家蚕丝素重链C末端序列分析、克隆及表达纯化
2015-04-06刘青松李珍珍刘莉娜王叶菁何华伟
刘青松 李 瑜 李珍珍 刘莉娜 王叶菁,2 何华伟,2,3,*
(1.西南大学家蚕基因组生物学国家重点实验室,2.生物技术学院,重庆 400716;3.中国科学院生物物理研究所生物大分子国家重点实验室,北京 100101)
家蚕丝素重链C末端序列分析、克隆及表达纯化
刘青松1,2,#李 瑜1,2,#李珍珍1,3刘莉娜1王叶菁1,2何华伟1,2,3,*
(1.西南大学家蚕基因组生物学国家重点实验室,2.生物技术学院,重庆 400716;3.中国科学院生物物理研究所生物大分子国家重点实验室,北京 100101)
蚕丝主要由丝素和丝胶蛋白组成,其中丝素包括丝素重链,丝素轻链和P25蛋白。丝素重链蛋白分子量大,体外表达困难,难以分离纯化,很难对其结构进行研究。本文通过对丝素重链基因的分析,以家蚕5龄3d后部丝腺cDNA为模板,克隆获得了丝素重链C末端碱基序列,并将其构建到pET-50b(+)表达载体上,转入到大肠杆菌中进行表达,通过镍柱亲和层析纯化获得了丝素重链C末端的融合蛋白,为进一步研究蚕丝蛋白的折叠和组装奠定了研究基础。
家蚕;丝素重链;C末端;克隆;表达纯化
家蚕丝是当今最引人瞩目的生物材料之一。蚕丝纤维的性能(如纤度、强度、弹性、导热性和吸湿性)与其理化性质密不可分,蚕丝纤维的理化性能与蚕丝蛋白的结构密切相关,但关于蚕丝蛋白结构与其纤维性能之间关系的研究却很少,这主要是由蚕丝蛋白的结构特点所决定。蚕丝蛋白主要由丝素(Fibroin)和丝胶组成,其中丝素占蚕丝蛋白总重的75%,它构成了蚕丝纤维的主要结构成分。丝素蛋白由丝素重链(Fibroin heavy chain,Fib-H)、丝素轻链(Fibroin light chain,Fib-L)和P25蛋白组成,其中Fib-H是丝素蛋白的主要结构组份[1-2]。丝素重链是一种纤维状蛋白,由N末端结构域、C末端结构域和中间大量的重复区域-非重复区域交错排列状结构组成,它决定了蚕丝纤维的物理和化学性能[3-4]。从天然的茧丝中分离纯化丝素重链蛋白相当困难,因此越来越多的研究者都致力于寻找一种能大量获取丝素重链蛋白的途径和方法,从而研究蚕丝蛋白的结构与性能之间的关系。
周丛照等[5-6]利用X-射线晶体衍射技术成功解析了Fib-H N末端(Fib-H NT)结构域的晶体结构,推测在蚕丝纤维的形成过程中,Fib-H NT可能具有两种功能:一是形成纳米球状结构,包裹丝素重链中的疏水重复区并增加整个蛋白的溶解性;二是Fib-H NT可以首先感知外界环境因素的改变,作为一种折叠启动子启动整个丝素重链蛋白的折叠,最终Fib-H NT以β折叠片的形式成为蚕丝纤维结构的一部分。He等[6]体外表达纯化了家蚕Fib-H N末端结构域,发现pH对丝素蛋白自组装行为具有重要影响。当pH值为6.0左右时,Fib-H NT由无规卷曲结构转变为β-折叠结构。当pH=4.7时,Fib-H NT呈双层反向平行β-折叠结构,每层由两个Fib-H NT分子相互作用。
丝素重链N末端对丝素蛋白构象的转变具有重要的作用,但是C末端在蚕丝纤维形成的过程中发挥什么样的功能当前仍不清楚。本文分析了Fib-HC末端序列的氨基酸组成和性质,预测了其二级结构。以后部丝腺cDNA为模板,克隆了Fib-HC末端碱基序列,并将其构建到pET-50b(+)表达载体,通过大肠杆菌成功实现了Fib-HC末端融合蛋白的表达,为深入研究Fib-H C末端结构域的结构和功能奠定了很好的研究基础。
1 材料与方法
1.1 材料与主要试剂
克隆用的菌株为Escherichiacoli(E.coli)DH5α,表达用的细胞为E.coliBL21(DE3),表达质粒pET-50b(+),均为本实验室保存。限制性内切酶,T4DNA连接酶和DNA Marker购自TaKaRa公司;DNA凝胶回收试剂盒,购自上海华舜公司;质粒提取试剂盒购自Axygen公司;氨苄青霉素(Amp)、硫酸卡纳霉素(Kana)均为上海生工提供。
1.2 Fib-HC碱基序列的克隆
取家蚕五龄三天后部丝腺,参照 TrizolRNA提取试剂盒的使用说明提取总RNA,参照反转录试剂盒说明,反转录合成cDNA。在NCBI上下载家蚕Fib-H基因的编码序列,利用primer premier 5.0软件根据Fib-H基因进行引物设计,加入BamHI和HindIII的酶切位点,分别以下划线指示。上游引物:5’-CGCGGATCCGTCAGTTACGGAGCTGGCAG-3’,下游引物:5’-CCCAAGCTTTTAGCAATTCACACAAGGCAG-3’,以后部丝腺cDNA为模板进行PCR扩增。扩增体系为:cDNA模板2μL,10 × reaction buffer 2.5μL,2.5mM MgCl22μL,2.5mM dNTPs 2μL,Taq DNA聚合酶 0.5μL,上下游引物各0.5μL,加去离子水补足25μL。反应条件为:94℃预变性4min,然后94℃变性30s、54℃退火30s、72℃延伸1min,最后72℃延伸5min。
1.3 融合蛋白的诱导表达
将测序验证正确的质粒转化E.coliBL21(DE3)表达菌株,挑取单克隆37℃培养过夜,然后接种到含有相应抗生素的LB液体培养基中,37℃培养至OD600达到0.6,加入IPTG至终浓度为0.2mM,于16℃诱导表达20 h。离心收集菌体,重悬后超声破碎,并用15%的SDS-PAGE检测蛋白表达。
1.4 融合蛋白的分离纯化和检测
将大量诱导的细菌培养液离心收集菌体,加入缓冲液悬浮,超声破碎释放融合蛋白,通过镍柱亲和层析对裂解液中的融合蛋白进行分离提纯。利用组氨酸标签抗体,进行Westernblotting鉴定目的蛋白的表达。
1.5 生物信息学分析
利用Protparam(http://web.expasy.org/protparam/)在线预测蛋白质的氨基酸组成、分子质量、等电点和疏水性,利用SignalP 4.1Server (http://www.cbs.dtu.dk/services/SignalP/)和TMHMM2.0 (http://www.cbs.dtu.dk/services/TMHMM/)分别预测信号肽和跨膜螺旋,利用PSIPRED (http://bioinf.cs.ucl.ac.uk/psipred/)预测蛋白质二级结构。
2 结 果
2.1 Fib-HC序列生物信息学分析
2.1.1 Fib-HC末端结构域的理化性质
Fib-HC编码的氨基酸序列总长为58个氨基酸,包含15种氨基酸(图1-A),其中丝氨酸含量最高(17.2%),其次为精氨酸(13.8%)、甘氨酸(12.1%)和丙氨酸(10.3%)。天冬氨酸、异亮氨酸和苯丙氨酸的含量最低,仅为1.7%。丝氨酸、甘氨酸和丙氨酸的含量相当高(36.2%),这与丝素重链中这些氨基酸的含量趋势基本一致。该蛋白质的理论等电点为10.59,这与精氨酸的含量高达13.8%,而其他酸性氨基酸含量较低密切相关。该蛋白的分子质量为6171.9Da。

图1 氨基酸组成分布(A)和二级结构预测(B)
2.1.2 Fib-HC末端的二级结构分析
二级结构预测显示Fib-H C末端两端都是由无规则卷曲结构组成,中间包含有一段短的α-螺旋、一段α-螺旋和一段短 β-折叠片段组成(图1-B),其中无规则卷曲结构含量占65.5%,这与新生的丝素重链蛋白总体的结构趋势基本一致。
2.1.3 Fib-H C疏水性和信号肽预测
从预测结果可以看出,丝素重链的C末端氨基酸残基之间存在一定的疏水性差异(图2-A),少部分位置的氨基酸残基具有疏水性,绝大部分氨基酸残基具有亲水性。总体而言,整个Fib-H的C末端结构域属于亲水性的蛋白。信号肽预测结果显示,C末端结构域中不存在信号肽(图2-B)。跨膜螺旋结构域预测结果表明,Fib-H的C末端不含有跨膜螺旋结构(图2-C)。
根据以上结果,推测C末端可能与新生丝素重链的分泌过程无关,但C末端的亲水性特征可能对丝素重链的折叠和组装具有重要意义。
2.2 Fib-HC末端基因克隆
根据Fib-HC末端的碱基序列设计引物 Fib-HC-F和Fib-HC-R,用家蚕后部丝腺 cDNA为模板进行PCR扩增,产物经琼脂糖凝胶电泳检测显示出一条约175bp的片段,大小与预期相符(图3)。PCR扩增获得的基因片段经切胶回收后连接到载体 pET-50b(+)上,重组质粒转化大肠杆菌 DH5α后,扩大培养,从菌液中提取重组质粒,进行双酶切鉴定和菌液PCR验证(图4)。双酶切鉴定和菌液PCR验证的结果均表明重组质粒构建成功。测序结果显示,克隆获得的序列与Pubmed上登录的序列一致,表明我们成功地获得了Fib-H C末端的碱基序列。
2.3 融合蛋白的表达纯化
将测序验证正确的融合蛋白表达质粒转化大肠杆菌感受态细胞BL21(DE3)后,在大肠杆菌中利用IPTG进行诱导表达。经过诱导条件的摸索,最终选用0.2mM IPTG、16℃、20 h的条件进行诱导表达。诱导表达结果如图5所示。
对融合蛋白进行大量诱导表达,利用镍柱亲和纯化的方法对目的蛋白进行了大量纯化,在80~500 mM的咪唑浓度梯度下洗脱获得了比较纯净的融合蛋白。结果如图6所示。
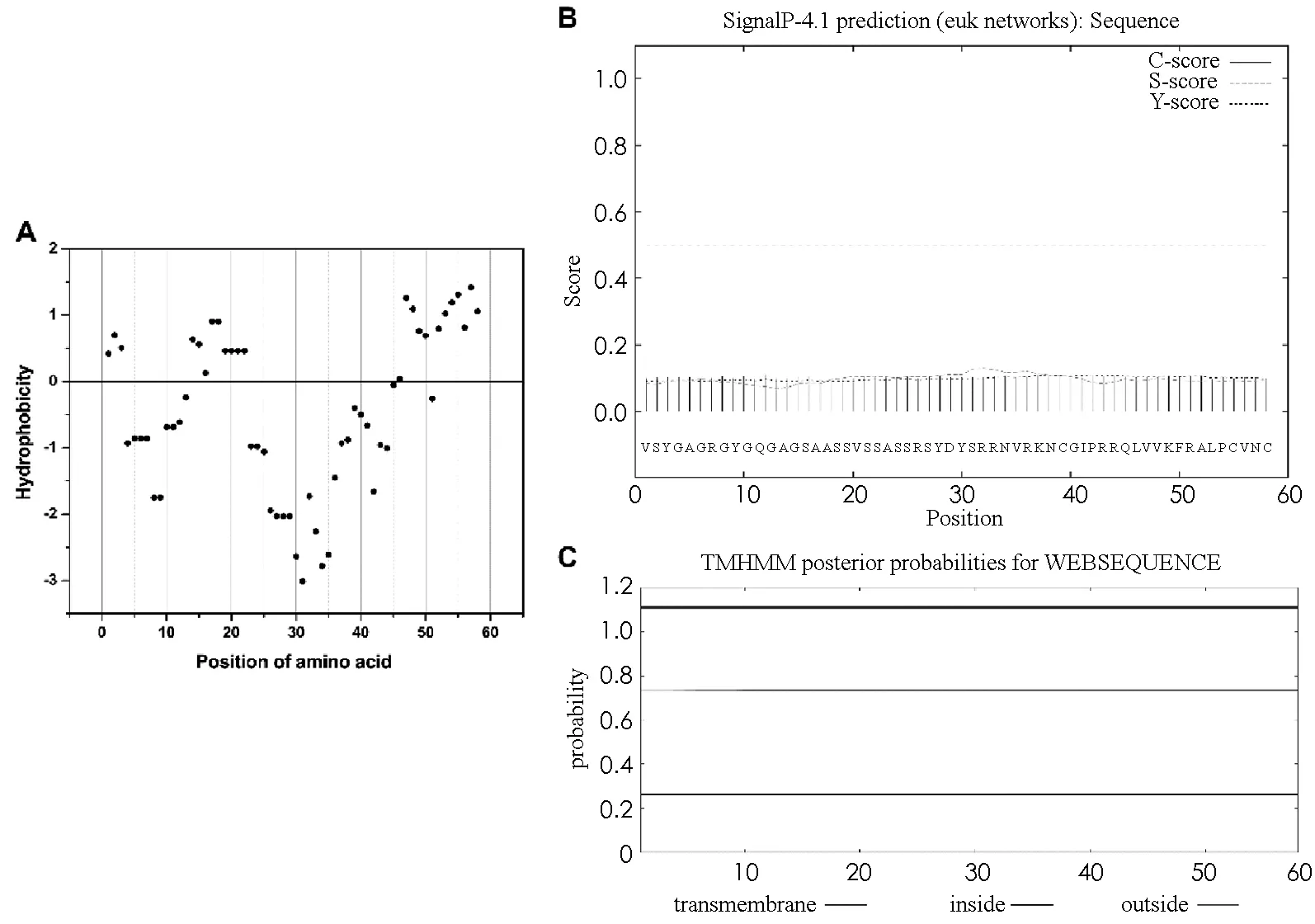
图2 Fib-H C末端氨基酸残基疏水性分析(A)、信号肽预测(B)和跨膜螺旋预测(C)
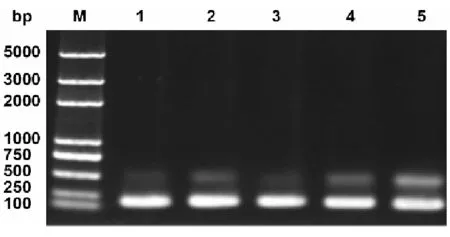
图3 目的基因PCR 扩增
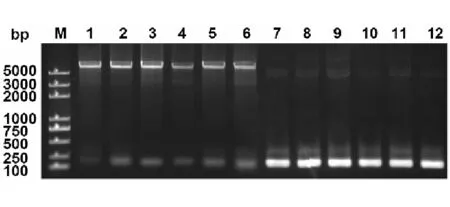
图4 双酶切检测和菌液PCR
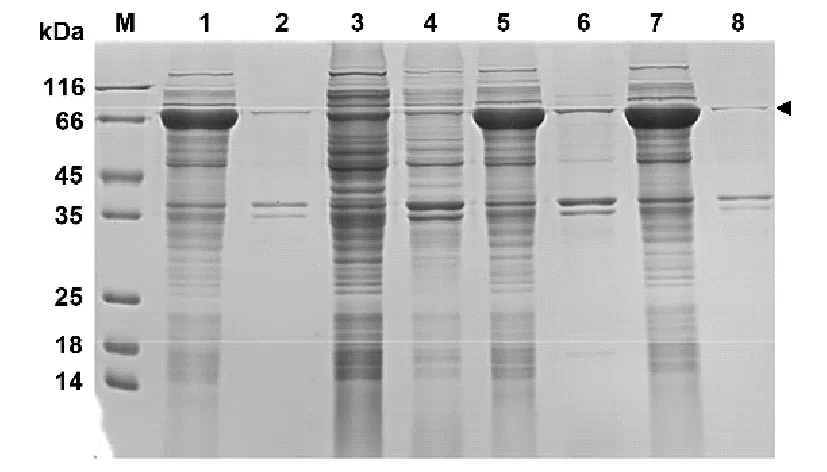
图5 融合蛋白表达检测结果

图6 融合蛋白纯化结果

图7 Westernblotting验证融合蛋白的表达
2.4 Westernblotting鉴定
为进一步验证融合蛋白在大肠杆菌中的表达,我们利用商业化的组氨酸蛋白标签抗体,按照Western blotting 的实验方法检测了蛋白的表达,结果如图7所示。
3 讨 论
丝素重链是蚕丝纤维的主要结构组分,丝素重链的结构决定了蚕丝纤维的物理和化学性能,因此研究丝素重链蛋白的结构和组装对于解析蚕丝纤维结构与性能之间的关系非常重要。之前的研究表明,Fib-H的N末端结构域随着pH值从中性到酸性的改变,可以从二聚体结构逐步发生寡聚化,进一步诱导了Fib-H的聚集和自组装。然而Fib-H的C末端结构域在Fib-H的折叠和组装过程中发挥什么样的作用当前并不清楚。
氨基酸序列分析表明,Fib-HC末端结构域具有一定的水溶性,含有约35%的α-Helix和β-sheet结构。为研究Fib-HC末端结构域的结构和功能,本文以家蚕5龄3d后部丝腺cDNA为模板,克隆获得了Fib-HC末端的碱基序列。由于该蛋白分子量相对较小,仅约6.2 kDa,难以表达纯化,因此将其构建到pET-50b(+)表达载体上,与NusA蛋白融合表达。融合蛋白在0.2 mM,16℃的诱导条件下,主要以可溶性蛋白的形式在上清中表达,经过镍柱亲和层析纯化,获得了较纯的目的蛋白。利用组氨酸蛋白标签抗体,经Western blotting检测,确证为His-NusA与Fib-H C的融合蛋白。为了提高目的蛋白的表达量,方便后期的蛋白纯化,我们采取了将His-NusA与Fib-H C融合表达纯化的策略,接下来还需要将His-NusA与Fib-H C分离并纯化获得Fib-H C,这是我们需要进一步面对和解决的问题。无论如何,该研究都为深入揭示Fib-H C末端结构域的结构和功能迈出了非常重要的一步。随着家蚕基因组框架图的绘制以及家蚕基因功能研究的不断发展[7],相信将来一定可以解析蚕丝纤维结构与性能之间的关系奥秘。
[1] 向仲怀. 蚕丝生物学(第一版)[M]. 北京:中国林业出社,2005.
[2] Inoue S,Tanaka K,Arisaka F,etal. Silk fibroin ofBombyxmoriis secreted,assembling a high molecular mass elementary unit consisting of H-chain,L-chain,and P25 with a 6:6:1 molar ratio[J]. Journal of Biological Chemistry,2000,275(51):40517-40528.
[3] Shao Z Z, Fritz Vollrath. Materials:Surprising strength of silkworm silk[J]. Nature,2002,418(6899):741-741.
[4] Zhou Z C, Li Z G. Fine organization ofBombyxmorifibroin heavy chain gene[J]. Nuc. AcidsRes,2000,28(4):2413-2419.
[5] Zhou C Z,Confalonieri F,Jacquet M,etal. Silk fibroin:structural implications of a remarkable amino acid sequence[J]. Proteins:Structure,Function,and Bioinformatics,2001,44(2):119-122.
[6] He Y X,Zhang N N,Li W F,etal. N-Terminal domain ofBombyxmorifibroin mediates the assembly of silk in response to pH decrease[J]. Journal of Molecular Biology,2012,418(3):197-207.
[7] Xia Q,Zhou Z,Lu C,etal. A draft sequence for the genome of the domesticated silkworm (Bombyxmori)[J]. Science,2004,306(5703):1937-1940.
Sequence Analysis, Cloning, Expression and Purification of Fibroin Heavy Chain C-terminal
LIU Qing-song1,2,#LI Yu1,2,#LI Zhen-zhen1,3LIU Li-na1WANG Ye-jing1,2HE Hua-wei1,2,3*
(1.Statekeylaboratoryofsilkwormgenomebiology;2.Collegeofbiotechnology,SouthwestUniversity,Chongqing400716,China;3.NationallaboratoryofBiomacromolecules,InstituteofBiophysics,Chineseacademyofsciences,Beijing100101,China)
Silk is mainly composed of fibroin and sericin proteins. Fibroin includes fibroin heavy chain, light chain and P25 protein. It is difficult to study the structure of fibroin heavy chain because it is hard to express and purify such a high molecular weight protein in vitro.. In this study, we analyzed the sequence offibroinheavychaingene and cloned its C-terminal nucleotide fragment by using the cDNA from the posterior silk gland of fifth instar 3d silkworm as a template. Then the fragment was subcloned into pET-50b(+) expression vector. Subsequently, the vector was transferred into E. coli and induced by IPTG to express the C-terminal fragment of fibroin heavy chain. The recombinant NusA-fused protein was purified by nickel affinity chromatography column. Our research will shed light on the folding and assembling of silk protein.
Bombyxmori;Fibroin heavy chain;C-terminal;Cloning;Expression and purification
*# 作者对此论文具有同等贡献基金项目:西南大学“国家级大学生创新创业训练计划”项目(201410635046),生物大分子国家重点实验室开放基金(2015kf08),中央高校基本科研业务费(SWU112111,XDJK2013A019,SWU112086,XDJK2013C049)。
何华伟,博士,教授。Email:hehuawei@swu.edu.cn
