基于Er∶YAlO/TiO的可见光催化降解室内甲醛
2015-04-05董山山董双石刘耀辉万立东
周 娴, 董山山, 董双石, 刘耀辉, 万立东
(吉林大学 地下水资源与环境教育部重点实验室, 吉林 长春 130021)
基于Er∶YAlO/TiO的可见光催化降解室内甲醛
周 娴, 董山山, 董双石*, 刘耀辉, 万立东
(吉林大学 地下水资源与环境教育部重点实验室, 吉林 长春 130021)
为使TiO2能够在可见光下发挥其于紫外激发的高光催化活性降解室内甲醛,采用水热处理法将TiO2与掺杂稀土离子Er3+的上转换发光剂Er3+∶YAlO3结合,制备具有可见光响应的Er3+∶YAlO3/TiO2光催化剂,并对其进行了表征分析。结果表明,TiO2以锐钛矿为主,且Er3+∶YAlO3可有效地将可见光上转换至可激发TiO2的紫外光。在箱式反应器中进行光催化降解气态甲醛,研究了甲醛初始浓度与催化剂用量对甲醛降解效率的影响。结果表明,该光催化反应的假一级反应速率常数(kapp)与甲醛初始浓度成正相关,而随催化剂用量的增加先升高后降低。当甲醛初始浓度为0.058 mg/m3、催化剂用量为0.122 4 g/L时,kapp最大为3.65×10-3min-1。该反应符合Langmuir-Hinshelwood模型,反应速率常数为5×10-8mg/(L·min)。
上转换发光剂; TiO2; 可见光催化; 甲醛
1 引 言
甲醛等有害气体会破坏室内空气质量,对人体脏器、神经系统和消化系统有很强的毒害作用[1]。室内甲醛气体的治理方法主要有物理法、生物法和化学法[2]。其中光催化法对污染物的降解具有效率高、反应条件温和的优点[3-4]。目前,大多数用于处理气态污染物的TiO2光催化技术是在紫外光的条件下进行,而不能在可见光下发生催化反应[5-6]。但日光中紫外线仅占不到5%,光能利用的效率很低。因此,有研究者采用溶胶-凝胶法在TiO2中掺杂紫外-可见上转换发光剂Er3+∶YAlO3与Er3+∶Y3Al5O12等来提高光能利用率。当材料受到可见光辐射时,上转换发光剂将可见光转换为紫外光,进而激发TiO2来提高其在可见光下的光催化活性。然而,上述研究仅局限于水中污染物的去除,在气态污染物降解方面还鲜见报道。
本文利用水热法[7-8]制备可见光响应光催化剂Er3+∶YAlO3/TiO2,以气态甲醛作为目标污染物,考察了甲醛初始浓度与催化剂用量对降解效率的影响。结果表明,该光催化反应的假一级反应速率常数与甲醛初始浓度成正相关,而随催化剂用量的增加先升高后降低。该反应符合Langmuir-Hinshelwood模型,反应速率常数为5×10-8mg/(L·min)。
2 实 验
2.1 Er3+∶YAlO3/TiO2的制备与表征
上转换发光剂Er3+∶YAlO3的制备参照文献[9]进行。采用水热合成法制备可见光响应光催化剂Er3+∶YAlO3/TiO2。以Ti(OC4H9)4作为Ti的前驱物,CH3COOH作为溶胶的媒质,C2H5OH作为分散媒质,Ti(OC4H9)4∶C2H5OH∶H2O∶CH3COOH的量比为1∶10∶2∶1,产物中TiO2与Er3+∶YAlO3的质量比为10∶1。将33.4 mL的 Ti-(OC4H9)4逐滴加入到28.7 mL的 C2H5OH溶液中,持续搅拌30 min,得到A溶液;将0.79 g 的Er3+∶YAlO3、5.68 mL 的CH3COOH、3.5 mL的蒸馏水加入到28.7 mL的C2H5OH中,持续搅拌30 min,得到B溶液。将B溶液逐滴加入到A 溶液中,室温下陈化24 h。取100 mL混合液全部移入容积为100 mL的聚四氟乙烯反应釜,130 ℃下热处理18 h,冷却后分别用无水乙醇和超纯水洗涤3次,80 ℃烘干,研磨即得到光催化剂Er3+∶YAlO3/ TiO2。将Er3+∶YAlO3/TiO2、蒸馏水及粘结剂聚乙烯醇以100∶3∶1的质量比混合搅拌,形成匀质浆液。在容器内底部两侧以相同层数的透明胶带确定涂布厚度,以轻薄匀质的不锈钢尺将浆液均匀涂布在反应器底部,自然干燥后形成均匀的光催化材料涂层。
采用D8 Advance型X射线衍射仪(Bruker AXS GmbH)分析光催化剂样品的物相,辐射源为Cu Kα射线,扫描角度范围为10°~90°,扫描步长为0.1°。采用LAMBDA35型紫外可见分光光度计(PerkinElmer)测试紫外-可见漫反射光谱(DRS),以硫酸钡作为标准反射率。荧光光谱(FS)分析采用Cary Eclipse型荧光分光光度计(VARIAN)。
2.2 反应装置搭建与运行
利用密闭式箱体反应器,在可见光源下模拟室内环境进行Er3+∶YAlO3/TiO2光催化降解甲醛气体(图1)。反应器为棱长0.6 m、有效容积216 L的全封闭有机玻璃箱,温度为(20±0.5) ℃,湿度为( 45±3)%,光源采用仅在可见区域发射的126 W LED灯。Er3+∶YAlO3/TiO2光催化剂均匀涂布在反应器内底。将一定量的37%~40% 的甲醛溶液和加热棒置于烧杯内,使其在反应器中充分挥发。采用小型吊扇使反应器内形成均相甲醛气体。将QC-1S型单路气体采样器(北京劳保所)与采样口连接并进行装置气密性检查,以5 mL浓度为1.0 g/L 的酚试剂作为吸收剂,采样间隔为30 min,单次采样体积为10 L,采样气流速率和时间分别为0.5 L/min和20 min。采用酚试剂分光光度法( GB/T 18204.26-2000)检测反应器内的甲醛浓度变化。
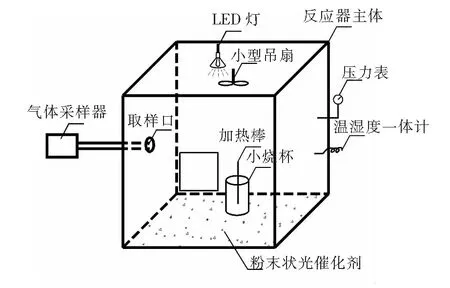
图1 反应器示意图
3 结果与讨论
3.1 Er3+∶YAlO3/TiO2表征
3.1.1 XRD分析
图2(a)为Er3+∶YAlO3的XRD图谱,谱中出现了YAlO3晶体衍射峰(图中●),说明YAlO3制备成功。图2(b)为不同热处理温度下的Er3+∶YAlO3/TiO2的XRD 图谱。可以看出,Er3+∶YAlO3/ TiO2经过不同温度的水热处理后,在2θ=25.4°处都可观察到明显的锐钛矿TiO2特征衍射峰,且随着水热温度由90 ℃上升到150 ℃,衍射峰逐渐变强,峰型变尖变窄;但当温度达到170 ℃后,衍射峰又变弱。这说明锐钛矿晶型结晶度的完整性随温度的升高而增强,但过高的温度不利于锐钛矿晶型的形成。在90~170 ℃的温度范围内未出现金红石相衍射峰,说明Er3+∶YAlO3/TiO2可在较宽焙烧范围内形成具有高光催化活性的锐钛矿型,而较高的温度有利于Er3+∶YAlO3/TiO2在载体表面的加热固定化。
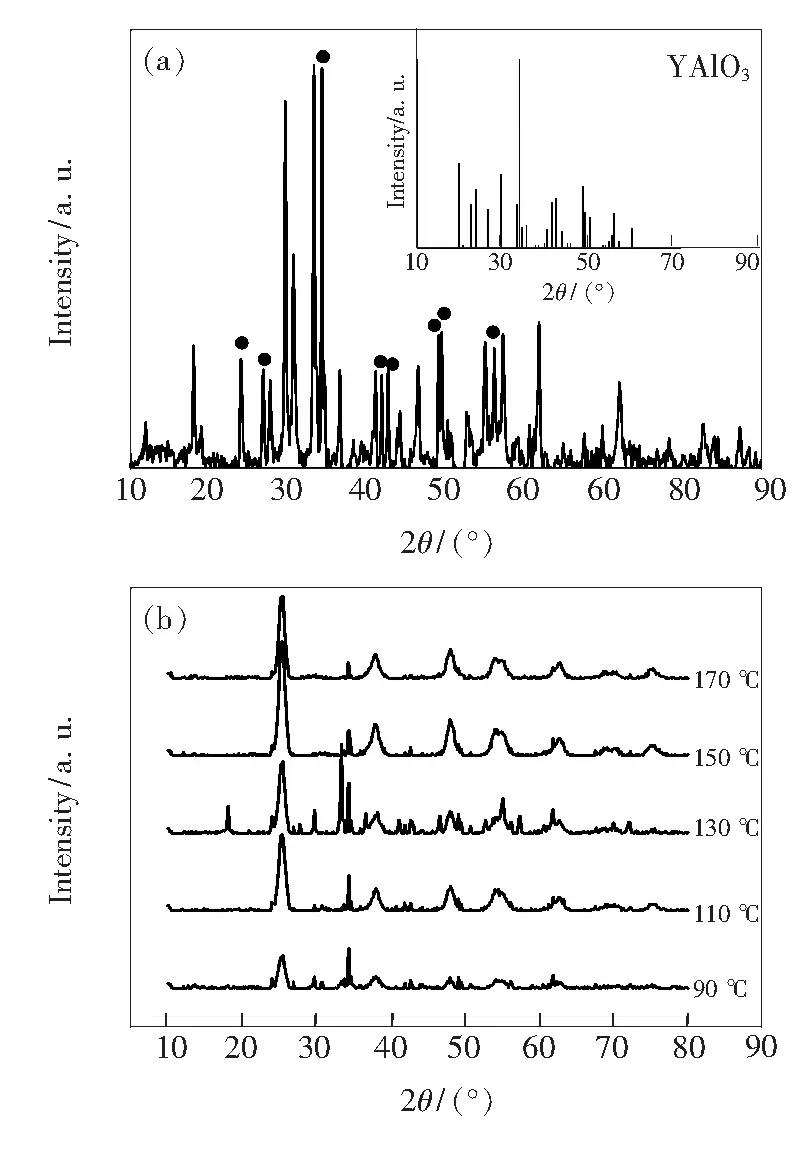
图2 Er3+∶YAlO3(a)与不同水热温度处理下的Er3+∶YAlO3/TiO2(b)的XRD图谱
Fig.2 XRD patterns of Er3+∶YAlO3(a) and Er3+∶YAlO3/TiO2at different hydrothermal treatment temperature (b)
3.1.2 UV-Vis 漫反射光谱
图3为TiO2、Er3+∶YAlO3/TiO2以及不同水热处理温度下的Er3+∶YAlO3/TiO2的DRS图谱。纯TiO2的特征吸收边为390 nm;Er3+∶YAlO3的特征吸收边为600 nm,具有明显的可见光吸收。水热处理温度为90,110,130,150,170 ℃的Er3+∶YAlO3/TiO2的吸收边分别为450,480,470,420,430 nm。水热温度的升高有利于材料吸收边界的红移,但温度过高又导致红移现象减弱。原因在于随着温度的升高,Er3+∶YAlO3/TiO2的晶体尺寸先增大后减小(表1),最大晶粒尺寸出现在110 ℃处;而带隙随晶粒尺寸的增大而减小[10],故带隙先减小后增大,引起材料的吸收边红移先增大后减小,吸收边在110 ℃处达到最大值480 nm。

图3 不同水热温度处理下的Er3+∶YAlO3/TiO2的DRS图谱
Fig.3 DRS patterns of Er3+∶YAlO3/TiO2at different hydrothermal treatment temperature
表1 不同温度焙烧的Er3+∶YAlO3/TiO2的平均粒径
Table 1 Average particle size of Er3+∶YAlO3/TiO2at different hydrothermal treatment temperature
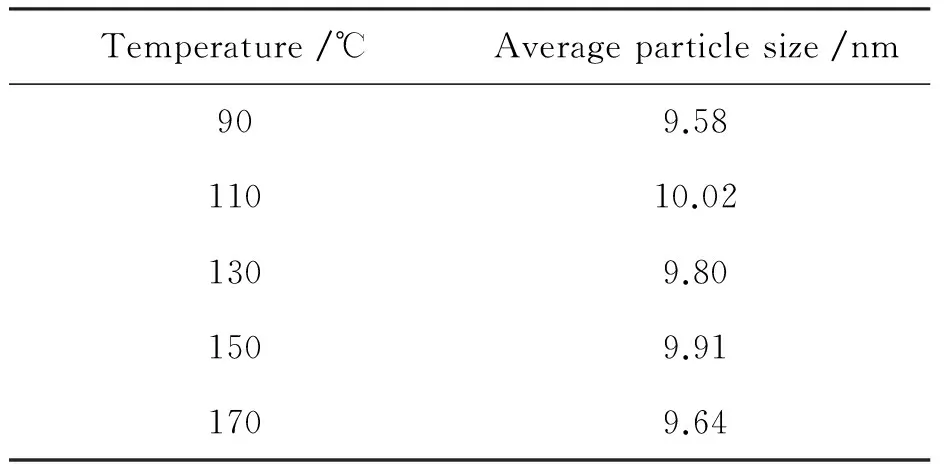
Temperature/℃Averageparticlesize/nm909.5811010.021309.801509.911709.64
3.1.3 荧光光谱
LED光源的两个特征波长为445 nm 和553 nm,我们采用上述激发波长测试Er3+∶YAlO3/TiO2(水热处理温度130 ℃)的荧光光谱,结果见图4。当激发波长为445 nm时,Er3+∶YAlO3在360 nm处的发射峰尖锐而Er3+∶YAlO3/TiO2的峰微弱;当激发波长为553 nm时,Er3+∶YAlO3在321,360,378 nm处的发射峰均尖锐而Er3+∶YAlO3/TiO2的峰微弱甚至消失。Er3+∶YAlO3在321 nm和360 nm处的发射光,其波长小于能够激发TiO2的387 nm,表明Er3+∶YAlO3发出的紫外光被TiO2吸收,进而有效激发TiO2产生光生电子-空穴对,能在可见光响应下进行光催化作用,这与DRS分析结果一致。

图4 553 nm(a)和445 nm(b) 激发下的Er3+∶YAlO3和Er3+∶YAlO3/TiO2的荧光光谱
Fig.4 Fluorescence Spectra of Er3+∶YAlO3and Er3+∶YAlO3/ TiO2under the excitation of 553 nm (a) and 445 nm (b)
3.2 初始浓度对甲醛光催化降解的影响
一般对于每个给定的初始浓度,甲醛的降解遵循一级动力学:
(1)
式中,C为甲醛浓度 (mg/L),kapp为假一级动力学反应常数 (min-1)。
图5为甲醛初始浓度为0.025,0.032,0.045,0.058 mg/m3时的甲醛降解效率与一级动力学拟合。图6为基于Langmuir-Hinshelwood(L-H)动力学模型的 1/r0-1/C0的线性拟合,用于分析初始甲醛浓度对反应速率的影响[11],拟合模型如下:
(2)
式中,r0为初始反应速率(mg·L-1·min-1),K为L-H反应速率常数(min-1),K′为Langmuir吸附常数 (L·mg-1)。

图5 (a) 甲醛初始浓度对可见光催化降解甲醛效率的影响;(b) 反应动力学的线性拟合。
Fig.5 (a) Effect of initial concentration on formaldehyde removal efficiency. (b) Linear plots of the reaction kinetics.
由图5可见,随着初始甲醛浓度由0.025 mg/m3增加到0.058 mg/m3,假一级动力学反应速率常数kapp由7.44×10-4min-1增加到3.35×10-3min-1,表明假一级动力学反应速率常数和光催化反应速率甲醛的初始浓度成正相关。当甲醛的初始浓度较低时,催化剂的催化作用主要受到甲醛从气相主体向催化剂表面的传质扩散的影响;随着甲醛初始浓度的增加,密闭反应器内的甲醛气体分压升高,从而使反应速率加快,降解速率和效率增大,甲醛浓度降低[12]。由图6可知,光催化降解甲醛的Langmuir-Hinshelwood反应速率常数为5×10-8mg/(L·min),Langmuir吸附常数为5.724×10-5L/mg。
3.3 催化剂使用量对甲醛光催化降解效率的影响
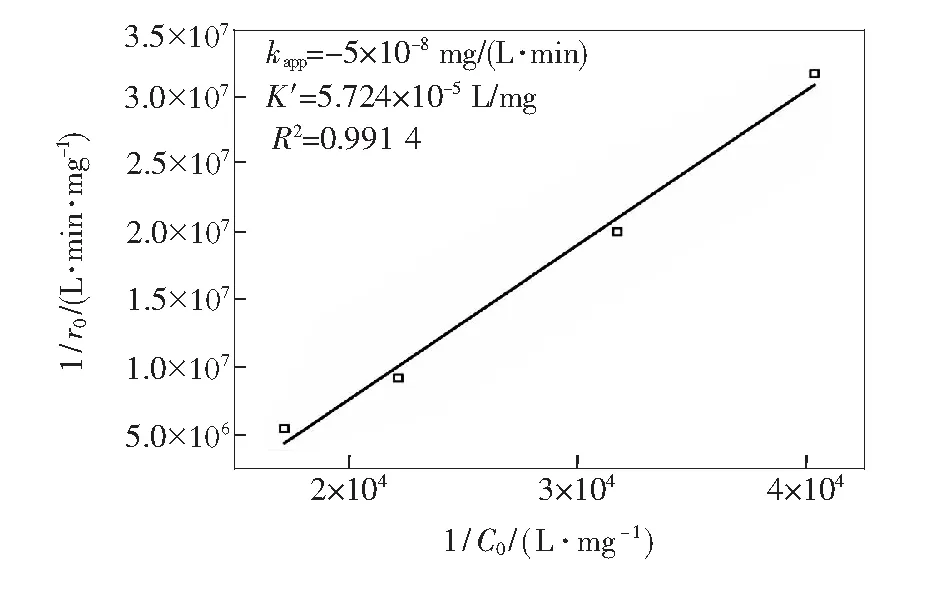
图6 基于Langmuir-Hinshelwood动力学模型的1/r0-1/C0的线性拟合
Fig.6 Linear plot of 1/r0vs. 1/C0based on Langmuir-Hinshelwood kinetic model
设置甲醛浓度为0.058 mg/m3,考察催化剂使用量对甲醛降解效率的影响。图7为Er3+∶YAlO3/TiO2不同相对投加量的可见光催化降解曲线与一级动力学拟合。当催化剂相对投加量由0.061 2 g/L增加到0.122 4 g/L时,假一级动力学反应速率常数kapp由2.88×10-3min-1增加到3.65×10-3min-1,达到最大;此后随着催化剂相对投加量的增大,kapp降低,到0.234 8 g/L时降低为9.51×10-4min-1。当催化剂相对投加量较小时,反应速率主要受控于活性位点。Er3+∶YAlO3/TiO2受到光照,产生强氧化性物质氧化甲醛,提高光催化氧化速率[13]。当Er3+∶YAlO3/TiO2相对投加量过大时,催化剂在载体表面堆积,堆积厚度的增加使载体上层的光催化剂阻碍下层光催化剂与甲醛和光的接触,影响光催化反应的进行[14]。

图7 (a) Er3+∶YAlO3/TiO2催化剂相对投加量对甲醛去除效率的影响;(b)反应动力学的线性拟合。
Fig.7 (a) Effect of relative dosage of Er3+∶YAlO3/TiO2catalyst on formaldehyde removal efficiency. (b) Linear plots of the reaction kinetics.
4 结 论
采用水热法制备了Er3+∶YAlO3/TiO2粉末状可见光催化剂。该催化剂中的Er3+∶YAlO3可将可见光上转换至321 nm与360 nm紫外光,进而激发锐钛矿型TiO2产生光催化作用降解甲醛。该光催化反应的假一级反应速率常数与甲醛初始浓度成正相关,而随催化剂用量的增加先升高后降低。当甲醛浓度为0.058 mg/m3、催化剂投加量为0.122 4 g/L时,假一级动力学反应速率常数达到最大。该光催化反应符合Langmuir-Hinshelwood模型,反应速率常数为5×10-8mg/(L·min)。本研究为可见光光催化降解室内甲醛气体的应用提供了依据。
[1] Gao L X, Lu Y J. Present status and improvement to find indoor purifier [J].J.HarbinInstituteTechnol.(哈尔滨工业大学学报), 2004, 36(2):199-201 (in Chinese).
[2] Niu S, Yan H. Novel silicone-based polymer containing active methylene designed for the removal of indoor formaldehyde [J].J.Hazard.Mater., 2015, 287:259-267.
[3] Daghrir R, Drogui P, Robert D. Modified TiO2for environmental photocatalytic applications: A review [J].Ind.Eng.Chem.Res., 2013, 52(10):3581-3599.
[4] Schneider J, Matsuoka M, Takeuchi M,etal. Understanding TiO2photocatalysis: Mechanisms and materials [J].Chem.Rev., 2014, 114(19):9919-9986.
[5] Hoang S, Berglund S P, Hahn N T,etal. Enhancing visible light photo-oxidation of water with TiO2nanowire arraysviacotreatment with H2and NH3: Synergistic effects between Ti3+and N [J].J.Am.Chem.Soc., 2012, 134(8):3659-3662.
[6] Pu Y C, Wang G, Chang K D,etal. Au nanostructure-decorated TiO2nanowires exhibiting photoactivity across entire UV-visible region for photoelectrochemical water splitting [J].NanoLett., 2013, 13(8):3817-3823.
[7] Macwan D P, Dave P N, Chaturvedi S. A review on nano-TiO2sol-gel type syntheses and its applications [J].J.Mater.Sci., 2011, 46(11):3669-3686.
[8] Andersson M, Österlund L, Ljungstroem S,etal. Preparation of nanosize anatase and rutile TiO2by hydrothermal treatment of microemulsions and their activity for photocatalytic wet oxidation of phenol [J].J.Phys.Chem. B, 2002, 106(41):10674-10679.
[9] Zhang J B, Wang Y L, Dong S S,etal. Preparation of immobilized visible light response photocatalyst Er3+∶YAlO3/TiO2-SAC and its photocatalytic activity [J].ActaEnergiaeSolaris(太阳能学报), 2012, 33(8):1259-1300 (in Chinese).
[10] Jasieniak J, Califano M, Watkins S E. Size-dependent valence and conduction band-edge energies of semiconductor nanocrystals [J].ACSNano, 2011, 5(7):5888-5902.
[11] Hou D, Feng L, Zhang J,etal. Preparation, characterization and performance of a novel visible light responsivespherical activated carbon-supported and Er3+∶YFeO3-doped TiO2photocatalyst [J].J.Hazard.Mater., 2012, 199:301-308.
[12] Badawy M I, Ghaly M Y, Ali M E M. Photocatalytic hydrogen production over nanostructured mesoporous titania from olive mill wastewater [J].Desalination, 2011, 267(2):250-255.
[13] Daskalaki V M, Kondarides D I. Efficient production of hydrogen by photo-induced reforming of glycerol at ambient conditions [J].Cata.Today, 2009, 144(1):75-80.
[14] Chowdhury P, Malekshoar G, Ray M B,etal. Sacrificial hydrogen generation from formaldehyde with Pt/TiO2photocatalyst in solar radiation [J].Ind.Eng.Chem.Res., 2013, 52(14):5023-5029.
Photocatalytic Degradation of Indoor Formaldehyde by Er3+∶YAlO3/TiO2Photocatalyst Under Visible Light Irradiation
ZHOU Xian, DONG Shan-shan, DONG Shuang-shi*, LIU Yao-hui, WAN Li-dong
(KeyLaboratoryofGroundwaterResourcesandEnvironment,MinistryofEducation,JilinUniversity,Changchun130021,China)*CorrespondingAuthor,E-mail:dongshuangshi@gmail.com
In order to develop the photocatalytic activity of TiO2under visible light as that under ultraviolet light to degrade indoor ormaldehyde pollution, a visible light response photocatalyst consisting of TiO2and upconversion luminescence agent Er3+∶YAlO3was prepared using hydrothermal treatment method. The photocatalyst was characterized by X-ray diffractometer (XRD) , UV-Vis diffuse reflectance spectrophotometer (DRS) and fluorescence spectrometer (FS) .The prepared TiO2is anatase-dominant. Er3+∶YAlO3can convert visible light to ultraviolet (UV) light to expand the absorption range of TiO2. The upconverted UV light can excite TiO2effectively to produce active materials with strong oxidation ability. The photocatalyst was applied to degrade gaseous formaldehyde in the sealed reactor, and the effect of initial formaldehyde concentration and photocatalyst dosage on the degradation efficiency of formaldehyde were investigated. The results show that the prepared photocatalyst can efficiently degrade the formaldehyde. The apparent first order reaction rate constant for gaseous formaldehyde degradation is positively correlated with the initial formaldehyde concentration, but increases first then decreases with the increasing of photocatalyst dosage from 0.061 2 g/L to 0.234 8 g/L. When the formaldehyde concentration is 0.058 mg/m3and the photocatalyst dosage is 0.122 4 g/L, the apparent first order reaction rate constant is the biggest of 3.65×10-3min-1. The degradation follows Langmuir-Hinshelwood model, and the reaction rate constant is 5×10-8mg/(L·min) .
upconversion luminescence agent; TiO2; visible light driven photocatalytic; formaldehyde

周娴(1992-),女,广西桂林人,硕士研究生,2014年于吉林大学获得学士学位,主要从事水处理高级氧化技术的研究。E-mail: 13596129763@163.com

董双石(1980-),男,辽宁鞍山人,副教授,2009年于哈尔滨工业大学获得博士学位,主要从事水处理高级氧化技术的研究。E-mail: dongshuangshi@gmail.com
2015-04-09;
2015-05-06
国家自然科学基金(50908096 ); 吉林省科技发展计划(20140101159JC)资助项目
1000-7032(2015)07-0769-06
O482.31; O654
A
10.3788/fgxb20153607.0769
