银杏GbSAD 基因对非生物胁迫的响应及原核表达1)
2015-04-03刘新亮蔡金峰王欢利曹福亮南方现代林业协同创新中心南京林业大学南京210037
刘新亮蔡金峰王欢利曹福亮( 南方现代林业协同创新中心( 南京林业大学) ,南京,210037)
植物硬脂酰-ACP 去饱和酶(Stearoyl-acyl carrier protein (ACP)desaturases,SADs,EC 1.14.99.6)是细胞核编码的、存在于细胞质体中的一类脱氢酶,广泛存在于植物细胞中,是植物中唯一已知的可溶性脱饱和酶家族[1-3]。Δ9硬脂酰-ACP 去饱和酶(SAD)是目前植物中研究最广泛的一种硬脂酰-ACP 脱饱和酶,催化硬脂酸脱氢形成第一个双键,从而使其去饱和形成单不饱和油酸(C18:1),完成十八碳不饱和脂肪酸合成的第一步去饱和反应,其功能已在多种植物中得到验证[4-7]。SAD 是脂肪酸代谢途径中的关键酶,也是调控膜脂与贮脂中饱和与不饱和脂肪酸比例的关键酶[8]。而不饱和脂肪酸参与植物体内多种代谢,特别与植物低温抗性有关,植物不饱和脂肪酸含量的增加可显著提高植物的低温适应性[9-10]。
银杏(Ginkgo biloba)的温度适应范围较广,在我国丹东市亦能正常生长(年平均气温8.5 ℃),具有较强的低温适应能力,是进行抗逆机理研究的理想树种[11]。银杏GbSAD 基因的全长cDNA 已得到克隆,编码一个包含412 个氨基酸残基的多肽序列,预测分子量为 47 kDa (Genbank 登录号:HQ694561)[12]。为探讨GbSAD 基因对激素介导的信号通路和高盐条件的响应机制,笔者悬浮培养了银杏愈伤组织细胞系,采用荧光定量PCR 分析GbSAD 基因在不同激素及盐胁迫条件下的表达模式,以期探讨其对激素介导信号通路的响应机制。另外,笔者成功地将GbSAD 构建到原核表达载体pET-32a(+)中,转化大肠杆菌(Escherichia coli)BL21(DE3)并诱导表达,以期为进一步研究GbSAD 酶学特性及其生物学功能奠定基础。
1 材料与方法
试材为人工授粉的同一母株上的一批种子,剥去骨质中种皮后,于超净台上70%酒精浸泡1 min,10%次氯酸钠消毒15 min。剖开种子取出子叶,切成大小均一的小块(约2 mm 长),接种于诱导培养基表面(MS+1.5 mg·L-1NAA+2 mg·L-16-BA)。每瓶接种5 块,培养条件为光照强度2 000 lx,温度25 ℃,每20 d 转接1 次。继代培养2 次后,将长势均匀一致的愈伤组织转接到装有100 mL MS 液体培养基(MS+1.5 mg·L-1NAA+2 mg·L-16-BA)的三角瓶中,每瓶愈伤组织接种量控制在3 ~4 g,25 ℃,100 r·min-1光照振荡培养。每7 d 继代一次,第2次转接正常培养48 h 后,开始进行胁迫处理,处理时间为0(对照)、3、6、12、24、48、72 h,每个处理取3瓶,纱布过滤后,液氮速冻-80 ℃保存。在前人研究的基础上,通过预试验将激素处理浓度分别设为100 μmol·L-1脱落酸(ABA)、100 μmol·L-1水杨酸(SA)、40 μmol·L-1乙烯利(ETH)、100 μmol·L-1茉 莉 酸 甲 酯(MeJA)、100 mmol · L-1氯 化 钠(NaCl)[13-16]。用于组织表达的根、茎、叶取自同一个2 年生银杏无性系,柱头及雄蕊于2014 年4 月采自南京林业大学实习林场。
1.1 GbSAD 基因荧光定量PCR
采用柱式植物总RNA 抽提纯化试剂盒(上海生工)分别提取银杏愈伤组织各处理总RNA,并提取各组织总RNA。参照Xu 等[17]选择GAPDH(Genbank 登录号:L26924)为内参基因,以各处理cDNA为模板检测GbSAD 基因的表达量,每个样品设3 个重复。Real-Time PCR 反应试剂由SYBR®Premix Ex TaqTMII 试剂盒(TAKARA)提供,在ABI PRISM 7500 Real-Time PCR 仪上进行定量扩增。采用2-ΔΔCt方法[18]分析试验结果,所用引物见表1。

表1 荧光定量PCR 引物及表达载体重组引物
1.2 GbSAD 蛋白序列分析及原核表达载体的构建
应用ORF Finder 进行在线ORF 分析并推导出GbSAD 氨基酸序列。在http:blast.ncbi.nlm.nih.gov/Blast 上进行序列比对和同源基因查询,应用DNAMAN V6.0 软件对序列一致性进行分析。设计GbSAD 基因全长引物GbSADU、GbSADD(表1),以上述叶片cDNA 为模板,通过PCR 扩增获得基因全长。根据GbSAD 基因全长序列及一步法定向克隆试剂盒(ClonExpressTMII One Step Cloning Kit,Vazyme)说明书设计表达载体引物GbSADS、GbSADA(表1),以得到的基因全长cDNA 为模板,PCR扩增获得含有载体同源序列的GbSAD 基因序列,与经过BamH I 酶切的线性化表达载体pET-32a(+)连接,获得重组表达载体pET32a-GbSAD。将连接产物转入DH5α 感受态细胞,挑取单菌落活化培养,选取菌液PCR 结果与产物大小一致的单菌落抽提质粒,通过PCR、EcoR V 和Xho I 双酶切筛选阳性克隆,并对阳性克隆测序验证。采用热激法将构建成功的pET32a-GbSAD 转化到大肠杆菌株系BL21(DE3)中进行蛋白诱导,将空载pET32a(+)转入BL21(DE3)作为阴性对照。
1.3 原核表达的SDS-PAGE 及Western Blot 分析
挑取测序正确的单克隆BL21(DE3)接种到2 mL LB(50 μg·mL-1Amp)培养基中,160 r/min 37 ℃培养6 h 后,取200 μl 加入20 mL LB(50 μg·mL-1Amp)培养基中,37 ℃160 r/min 培养至OD600为0.5~0.6 时,加入异丙基硫代半乳糖苷(IPTG,终浓度1 mmol·L-1)进行诱导表达,分别在37 ℃诱导2、6、24 h 后收集菌液。按照朱旭芬[19]的方法制备上清及沉淀(宿主菌BL21 细胞)样品。取上清和沉淀分别进行SDSPAGE 凝胶电泳(5%浓缩胶,12%分离胶),并用考马斯亮蓝R250 染色检测蛋白的表达情况,用Quantity One 软件分析表达蛋白分子量。SDS-PAGE 电泳后将蛋白从胶上转移到PVDF 膜(0.45 μm)上,单抗(TRUE-Tag Anti-His mAB,Vazyme)、二抗(HRP-conjugated Goat Anti-Mouse IgG(H+L),Vazyme)孵育标记,Enhanced ECL (Vazyme)反应1 min,拍照记录。
2 结果与分析
2.1 GbSAD 基因的表达
为研究银杏GbSAD 基因对各种非生物胁迫的应答,采用实时RT-PCR 分析了其在ABA、SA、Me-JA、ETH 以及NaCl 处理下的表达模式,设置相对表达量变化2 倍作为基因受到调控的阈值[20]。结果表明,GbSAD 基因受到多种非生物胁迫的调控(表2)。在ABA 处理条件下,该基因受诱导呈现先下降后上升的趋势,6 到12 h 时变化较明显,12 h 时表达量为6 h 时的2.1 倍,但与对照相比差异并未达到基因受调控的阀值。在SA 处理条件下,GbSAD 基因的相对表达量在诱导前期明显下降,至6 h 时达到最小值,明显低于对照,为对照的0.1 倍;随着诱导时间的延长,基因的相对表达量开始上升,24 h 时表达量为12 h 时的9.7 倍,且显著高于对照;诱导后期的表达量降低至对照水平。在外源MeJA 和ETH 处理条件下,GbSAD 的相对表达量变化趋势较为一致,但GbSAD被诱导的相对表达量未达到阈值,说明GbSAD 基因并没有受到这两个激素的诱导。NaCl 处理期间,GbSAD 的相对表达量呈现下降趋势,在6 h 时降到对照的0.45 倍,随着胁迫时间的延长,表达维持在较稳定的水平。GbSAD 基因的组织表达分析表明,GbSAD 在各个组织中均有表达,叶中表达量最高(1.01±0.24),其次是雌花(0.77±0.09),雄花为(0.12±0.01),根(0.08±0.01)和茎(0.08±0.03)中表达量最少。
2.2 GbSAD 蛋白序列
通过DNAMAN 软件将银杏GbSAD 基因编码的氨基酸序列与其他植物硬脂酰-ACP 去饱和酶序列进行比对,发现银杏GbSAD 氨基酸序列与其他被子植物的序列相似度较高,表明GbSAD 在进化上具有较高的保守性。GbSAD 与无油樟AtSAD 序列一致性最高,达到80.1%,与鳄梨、葡萄、巨桉、澳洲坚果、胡杨、茸毛烟草、乌桕、美国白蜡同样具有较高的同源性,分别为78.2%、79.0%、78.2%、78.2%、78.0%、77.4%、77.0%、76.2%(图1)。在银杏GbSAD 氨基酸序列中,包含两个保守多肽序列DETGASP 和DYADILE(图1 下划线标记的氨基酸)。

图1 GbSAD 与其他植物SAD 氨基酸同源序列比对

表2 GbSAD 基因在不同处理时间和非生物胁迫下表达量的变化
2.3 原核表达载体的构建及其表达
2.3.1 重组质粒pET32a-GbSAD 的构建及鉴定
以GbSAD 基因全长cDNA 为模板,用引物Gb-SADS 和GbSADA 进行扩增,得到大小约为1.2 kb的cDNA 编码区序列。电泳检测结果表明与预期大小相一致,且无特异扩增条带(图2)。利用Eco R V和Xho I 对重组子pET32a-GbSAD 双酶切检验,电泳结果如图2 所示,酶切产物与PCR 产物大小一致。将目的条带测序,序列比对结果正确,表明pET32a-GbSAD 原核表达载体已构建成功。

图2 GbSAD 基因PCR 结果和重组质粒pET32a-GbSAD 酶切检测
2.3.2 目的蛋白的SDS-PAGE 分析
重组质粒pET32a-GbSAD 转化BL21(DE3)后,用IPTG 诱导重组蛋白的表达,进行SDS-PAGE 电泳检测。结果表明,重组质粒pET32a-GbSAD 产生了一条约59 kDa 的条带,而未诱导的转化重组质粒和诱导的转化空载体均未出现这条蛋白带(图3)。37 ℃160 r/min 培养条件下,通过对比不同IPTG 诱导时间发现,目的蛋白的表达量在诱导2 h 后即可实现高效表达且其表达量随着时间的增加有下降趋势。
2.3.3 目的蛋白的可溶性及Western Blot 检测
经SDS-PAGE 分别电泳检测上清和沉淀发现,经1 mmol·L-1IPTG 诱导2 h 产生的目的蛋白在上清及宿主菌细胞中(沉淀)都有存在,表明GbSAD 经诱导形成了可溶性融合蛋白(图4-A)。目的蛋白的Western blot 检测结果表明,诱导产生的表达增强的59 KDa 蛋白质条带,表现出对His-6 抗原的阳性反应,说明银杏GbSAD 能够在BL21-pET32a(+)表达体系中表达出目的蛋白(图4-B)。
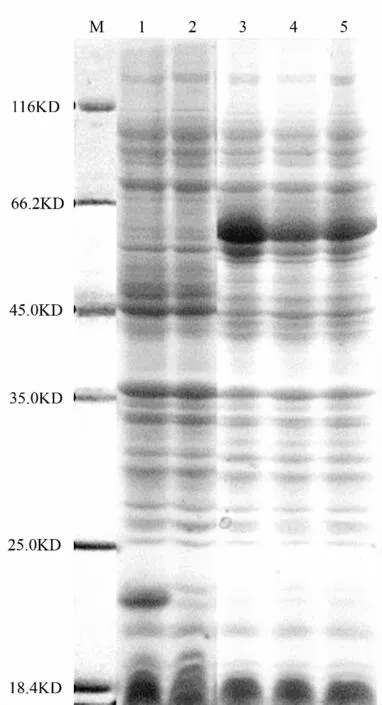
图3 银杏GbSAD 基因在大肠杆菌中的表达
3 结论与讨论
植物对低温胁迫的响应和适应是一个复杂的系统调控过程,全基因组分析的最新进展揭示这一过程是通过控制全体基因表达、蛋白质修饰和代谢组分实现的,涉及到一系列的生理生化反应[21-22]。植物的膜系统是一个动态平衡体系,外界温度的变化直接影响膜结构变化,细胞器膜结构的破坏是植物在低温胁迫中造成伤害的重要原因。生物膜对低温胁迫的相变温度主要是由膜脂的脂肪酸组成及其相对含量决定。SAD 是提高植物体内不饱和脂肪酸含量的关键酶,不饱和脂肪酸含量的增加可显著提高植物的低温适应性。Byfield 等[23]观察不同大豆品种种子萌发的过程时发现,低温明显提高了SAD基因的表达水平,而高温条件下,硬脂酸含量增加,SAD 基因的表达量显著减少。De Palma 等[24]在研究马铃薯的耐冷性时认为SAD 基因能够提高不饱和脂肪酸的含量,从而提高植株的耐冷性。因此,可以通过调控SAD 基因的表达水平来增加植物体内不饱和脂肪酸含量,从而增加植物对低温的适应能力[25]。除此之外,SAD 还有可能参与植物的衰老调节、抗真菌感染和机械损伤等调控过程[26-27]。低温能显著的提高SAD 基因的表达水平,这在银杏中GbSAD 基因也表现为同样的表达模式[12]。目前尚没有直接证明表明GbSAD 基因与银杏的抗寒性有关,其在非生物胁迫应答中的功能还不清楚。研究不同处理条件下GbSAD 的表达情况,对探讨其对激素和环境胁迫的应答机制具有重要意义。

图4 融合蛋白GbSAD 的可溶性检测及Western Blot 分析(诱导2 h)
植物通过激素传递的信号来调节自身的生长,是其适应外界环境变化的策略之一。植物对非生物胁迫的响应,从基因表达调控网络来看,可分为脱落酸(ABA)依赖型和非依赖型两大途径[28]。在植物中,由水杨酸(SA)、茉莉酸(MeJA)和乙烯利(ETH)介导的信号通路已被识别,这些信号通路主要由各种胁迫引起的防御反应诱导,旨在增加抗菌化合物的积累和防御相关基因的表达[29]。其中,SA 和JA介导的调控通路呈现出拮抗趋势,而JA 和ETH 介导的调控通路通常表现为协同作用[30]。有研究表明,在拟南芥突变株ssi2/fab2 中,SAD 基因功能的丧失降低了植株油酸(C18:1)含量,进而引起由SA和JA 介导的防御反应,油酸的减少诱导了SA 依赖型的逆境胁迫调控通路,抑制了JA 依赖型的调控通路[26]。本研究结果表明,GbSAD 的表达不受外源ABA 的诱导,属于ABA 非依赖型的逆境胁迫调控通路;而外源SA 明显的改变了GbSAD 基因的相对表达量,处理过程中相对表达量呈先下降后上升趋势,说明银杏GbSAD 基因可能参与了SA 介导的调控通路。在外源MeJA 和ETH 处理下,GbSAD 的表达水平并未发生明显变化。GbSAD 基因在高盐(NaCl)胁迫中后期,表现为低水平的表达模式,但是下降幅度并不大,这说明GbSAD 基因可能不受高盐胁迫诱导,其表达量的下降可能是盐胁迫下愈伤组织生长势减弱的原因。GbSAD 在各个组织中均有表达,其中叶中表达量最高,根和茎中表达量最低,这种显著的组织特异性说明该基因可能在特定的发育过程或生理活动中发挥作用。
由于银杏高效再生体系尚未建立,GbSAD 基因功能的研究只能通过异源表达进行间接研究。原核表达系统具有产量高、稳定性好、经济快捷等优点,为研究GbSAD 蛋白的表达和功能提供了一条有效的途径。在野生型大肠杆菌中并不存在脂肪酸去饱和酶,其不饱和脂肪酸的合成主要依赖厌氧途径。Cao 等[31]的研究实现了拟南芥SAD 基因在大肠杆菌(BL21)中的表达,并且在没有添加外源辅助因子的情况下,异源表达蛋白具有脂肪酸脱饱和活性,这为研究GbSAD 蛋白的功能提供了参考。本研究结果表明,GbSAD 蛋白能够与His 标签蛋白形成融合蛋白,在1 mmol·L-1IPTG 的诱导下,培养2 h 即能实现融合蛋白的高效表达。Wang 等[12]预测GbSAD蛋白为分泌蛋白,本试验在上清中检测到该目的蛋白,可推测该融合蛋白是以分泌蛋白的形式分泌至胞外。GbSAD 蛋白在诱导培养2 h 时即可高效表达,且2 h 后表达量明显降低,可能由于这种膜蛋白的大量表达对大肠杆菌有一定的毒害作用,限制了大肠杆菌的生长,进而影响了其表达量。另外,SDSPAGE 检测融合蛋白大小约59 kDa,略低于融合蛋白预测大小64 kDa(GbSAD 蛋白预测分子量47 kDa,载体自带标签序列预测蛋白分子量17 kDa),这可能与蛋白翻译后修饰及凝胶电泳所产生的误差有关。诱导时间、诱导剂浓度、诱导温度等因子都能影响外源基因在大肠杆菌中的表达,在试验中可进一步优化GbSAD 的原核表达体系,获取较高浓度和纯度的活性蛋白,为GbSAD 蛋白酶学特性的研究、抗体的制备及其功能的研究奠定基础。
[1] Chen G,Xing Z K,Pan W L,et al. Cloning of a novel stearoylacyl desaturase gene from white ash(Fraxinus americana)and evo lution analysis with those from other plants[J]. African Journal of Biotechnology,2013,79(10):18185-18193.
[2] Ramesh A M,Kesari V,Rangan L. Characterization of a stearoyl acyl carrier protein desaturase gene from potential biofuel plant,Pongamia pinnata L[J]. Gene,2014,542(2):113-121.
[3] Shilman F,Brand Y,Brand A,et al. Identification and molecular characterization of homeologous Δ9-stearoyl acyl carrier protein de saturase 3 genes from the allotetraploid peanut (Arachis hypogaea)[J]. Plant Molecular Biology Reporter,2011,29(1):232-241.
[4] Knutzon D S,Thompson G A,Radke S E,et al. Modification of brassica seed oil by antisense expression of a stearoyl-acyl carrier protein desaturase gene[J]. Proceedings of the National Academy of Sciences,1992,89(7):2624-2628.
[5] Liu Q,Singh S P,Green A G. High-stearic and high-oleic cotton seed oils produced by hairpin RNA-mediated post-transcriptional gene silencing[J]. Plant Physiology,2002,129(4):1732-1743.
[6] Zaborowska Z,Starzycki M,Femiak I,et al. Yellow lupine gene encoding stearoyl-ACP desaturase-organization,expression and po tential application[J]. Acta Biochimica Polonica,2002,49(1):29-42.
[7] Zhang P,Burton J W,Upchurch R G,et al. Mutations in a Δstearoyl-ACP-desaturase gene are associated with enhanced stearicacid levels in soybean seeds[J]. Crop Science,2008,48(6):2305-2313.
[8] 曹福亮,王欢利,郁万文,等.高等植物脂肪酸去饱和酶及编码基因研究进展[J].南京林业大学学报:自然科学版,2012,36(2):125-132.
[9] Kodama H,Horiguchi G,Nishiuchi T,et al. Fatty acid desatura tion during chilling acclimation is one of the factors involved in conferring low-temperature tolerance to young tobacco leaves[J]. Plant Physiology,1995,107(4):1177-1185.
[10] Tasseva G,Davy de Virville J,Cantrel C,et al. Changes in the endoplasmic reticulum lipid properties in response to low tempera ture in Brassica napus[J]. Plant Physiology & Biochemistry, 2004,42(10):811-822.
[11] 郁万文.银杏抗寒机理及种质资源抗寒性评定的初步研究[D].南京:南京林业大学,2008.
[12] Wang H,Cao F,Zhang W,et al. Cloning and expression of stearoyl-ACP desaturase and two oleate desaturases genes from Ginkgo biloba L.[J]. Plant Molecular Biology Reporter,2013,31(3):633-648.
[13] Chen Y,Lin F,Yang H,et al. Effect of varying NaCl doses on flavonoid production in suspension cells of Ginkgo biloba:rela tionship to chlorophyll fluorescence,ion homeostasis,antioxidant system and ultrastructure[J]. Acta Physiologiae Plantarum,2014,36(12):3173-3187.
[14] Cheng H,Li L,Cheng S,et al. Molecular cloning and function assay of a chalcone isomerase gene (GbCHI)from Ginkgo biloba[J]. Plant Cell Reports,2011,30(1):49-62.
[15] Liao Y L,Xu F,Huang X H,et al. Promoter analysis and tran scriptional profiling of Ginkgo biloba 3-Hydroxy-3-Methylglutaryl coenzyme a reductase (GbHMGR)gene in abiotic stress respon ses[J]. Notulae Botanicae Horti Agrobotanici Cluj-Napoca,2015,43(1):829-835.
[16] Kim S M,Kim Y B,Kuzuyama T,et al. Two copies of 4-(cytidine 5′-diphospho)-2-C-methyl-d-erythritol kinase (CMK)gene in Ginkgo biloba:molecular cloning and functional characterization[J]. Planta,2008,228(6):941-950.
[17] Xu F,Cheng H,Cai R,et al. Molecular cloning and function analysis of an anthocyanidin synthase gene from Ginkgo biloba,and its expression in abiotic stress responses[J]. Molecules Cells,2008,26(6):536-547.
[18] Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[19] 朱旭芬.基因工程实验指导[M].2 版.北京:高等教育出版社,2010.
[20] 高清松,张丹,徐亮,等.水稻ABC1 基因家族的鉴定及在非生物胁迫下的表达分析[J].中国水稻科学,2011,25(1):1-10.
[21] Gong X,Liu M,Zhang L,et al. Arabidopsis AtSUC2 and At-SUC4,encoding sucrose transporters,are required for abiotic stress tolerance in an ABA-dependent pathway[J]. Physiologia Plantarum,2015,153(1):119-136.
[22] Urano K,Kurihara Y,Seki M,et al.‘Omics’analyses of regulatory networks in plant abiotic stress responses[J]. Current Opinion In Plant Biology,2010,13(2):132-138.
[23] Byfield G E,Upchurch R G. Effect of temperature on delta-9 stearoyl-ACP and microsomal omega-6 desaturase gene expression and fatty acid content in developing soybean seeds[J]. Crop Science,2007,47(4):1698-1704.
[24] De Palma M,Grillo S,Massarelli I,et al. Regulation of desaturase gene expression,changes in membrane lipid composition and freezing tolerance in potato plants[J]. Molecular Breeding,2008,21(1):15-26.
[25] Luo T,Peng S M,Deng W Y,et al. Characterization of a new stearoyl-acyl carrier protein desaturase gene from Jatropha curcas[J]. Biotechnology Letters,2006,28(9):657-662.
[26] Kachroo A,Lapchyk L,Fukushige H,et al. Plastidial fatty acid signaling modulates salicylic acid-and jasmonin acid-mediated defense pathways in the Arabidopsis ssi2 mutant[J]. Plant Cell,2003,15(12):2952-2965.
[27] Madi L,Wang X,Kobiler I,et al. Stress on avocado fruits regulates Δ9-stearoyl ACP desaturase expression,fatty acid composition,antifungal diene level and resistance to Colletotrichum gloeosporioides attack[J]. Physiological Molecular Plant Pathology,2003,62(5):277-283.
[28] Yamaguchi Shinozaki K,Shinozaki K. Organization of cis-acting regulatory elements in osmotic-and cold-stress-responsive promoters[J]. Trends in Plant Science,2005,10(2):88-94.
[29] Bulgakov V,Tchernoded G,Mischenko N,et al. Effect of salicylic acid,methyl jasmonate,ethephon and cantharidin on anthraquinone production by Rubia cordifolia callus cultures transformed with the rolB and rolC genes[J]. Journal of Biotechnology,2002,97(3):213-221.
[30] Narusaka M,Yao N,Iuchi A,et al. Identification of Arabidopsis accession with resistance to Botrytis cinerea by natural variation analysis,and characterization of the resistance response[J]. Plant Biotechnology,2013,30(1):89-95.
[31] Cao Y,Xian M,Yang J,et al. Heterologous expression of stearoyl-acyl carrier protein desaturase (S-ACP-DES)from Arabidopsis thaliana in Escherichia coli[J]. Protein Expression Purification,2010,69(2):209-214.
