低剂量地西他滨增强T细胞对宫颈癌细胞杀伤活性研究
2015-04-01韩卫东孟元光
白 桦,李 祥,聂 晶,韩卫东,孟元光
解放军总医院,北京 1008531妇产科;2基础医学所分子生物室
低剂量地西他滨增强T细胞对宫颈癌细胞杀伤活性研究
白 桦1,李 祥2,聂 晶2,韩卫东2,孟元光1
解放军总医院,北京 1008531妇产科;2基础医学所分子生物室
目的研究低剂量地西他滨是否可增强T细胞对宫颈癌细胞杀伤活性,并探讨其可能的作用机制。方法CCK-8检测低剂量地西他滨对宫颈癌细胞增殖的影响,流式细胞仪检测低剂量地西他滨处理后宫颈癌细胞凋亡及周期的变化;CCK-8检测T细胞对低剂量地西他滨处理后宫颈癌细胞的杀伤作用,实时定量PCR法检测地西他滨处理后宫颈癌细胞癌/睾丸抗原(cancer testis antigen,CTA)及FasL的mRNA表达的变化。结果10 nmol/L地西他滨对宫颈癌细胞增殖、凋亡没有显著影响,100 nmol/L地西他滨一定程度上抑制细胞增殖。10 nmol/L地西他滨虽不直接抑制细胞增长,但使宫颈癌细胞对T细胞的杀伤效应更为敏感,以效靶比为10∶1时最显著。10 nmol/L地西他滨处理后宫颈癌细胞BORIS、NY-ESO-1、MAGE-A1/ A3/A4等CTA及FasL的mRNA水平显著上调(P<0.05)。结论低剂量地西他滨可抑制Hela及SiHa细胞的生长及存活,增强T细胞对Hela及SiHa细胞的杀伤能力,是一个潜在的免疫治疗辅助药物。
地西他滨;宫颈癌;癌睾丸抗原;免疫治疗
地西他滨(decitabine,DAC)是一种2′-脱氧胞苷类似物,是特异的DNA甲基化转移酶抑制剂[1],具有去甲基化的作用,能激活某些沉默基因表达[2]。研究表明,低剂量DAC具有长期的表观修饰“记忆”效应,通过该效应可直接抑制肿瘤细胞的生长[3]。DAC于2006年经美国FDA批准进入临床应用,主要用于治疗血液系统疾病骨髓增生异常综合征[4]。研究结果显示,DAC在实体瘤中有广泛的应用前景,如在肝癌、肺癌、结肠癌、卵巢癌中有化疗增敏作用[5-8]。宫颈癌的发生、发展与多个基因启动子区异常甲基化所导致的基因沉默有关[9],包括许多调控免疫相关的基因。而DNA甲基化在调控免疫相关基因如癌/睾丸抗原(cancer/ testis antigen,CTA)基因的表达中起着重要作用[10],而CTA的表达有助于提高肿瘤细胞的免疫原性[11],增强T细胞对肿瘤细胞的识别杀伤能力,为特异性免疫治疗提供可能。本实验通过研究低剂量地西他滨对宫颈癌细胞Hela及SiHa的凋亡、增殖及周期的影响,T细胞对地西他滨处理后Hela及SiHa细胞的杀伤作用以及Hela及SiHa细胞相关CTA表达的变化,探讨地西他滨促进T细胞杀伤Hela及SiHa细胞的作用机制,为地西他滨用于临床宫颈癌的免疫治疗提供实验依据。
材料和方法
1材料 人宫颈癌细胞株Hela及SiHa(本实验室保存);胎牛血清(Gibco)、1640培养液(Invitrogen)、MEM培养液(Invitrogen)、GT-T551培养液(Invitrogen);青链霉素(Gibco);CCK-8试剂盒(Dojindo);细胞凋亡检测试剂盒(BD);细胞周期检测试剂盒(BD);Trizol(Invitrogen);反转录试剂盒(TOYOBO);SYBR Green Master Mix (TOYOBO);地西他滨(中国西安杨森),淋巴细胞分离液(Ficoll),rIL-2、CD3(本实验室免疫室)。
2细胞培养及药物处理 宫颈癌Hela及SiHa细胞分别使用含10%胎牛血清(fetal bovine serum,FBS)及1%的100 U/ml青链霉素的1640、MEM培养液,于37℃、5% CO2条件下培养。选取对数生长期的细胞,接种于6孔板中,待贴壁后,用浓度分别为0 nmol/L、10 nmol/L、100 nmol/L的地西他滨处理72 h。T细胞的培养:取健康人外周血10 ml,用淋巴细胞分离液按常规方法分离外周血中单个核细胞,置于CD3抗体包被的培养瓶中,4 d后按0.1%加入rIL-2,隔天补加。
3CCK-8检测Hela及SiHa细胞的增殖 按前述方法药物处理72 h后,将细胞按照0.5×104/孔铺于96孔板中,每组3个平行孔,每天进行检测,将培养液去除,每孔加入100 μl含10% CCK-8的无血清培养基,在37℃、5% CO2条件下培养1.5 h,在酶联免疫检测仪上450 nm下测各孔吸光度(optical density,OD)值。
4流式细胞仪检测Hela及SiHa细胞的凋亡按Annexin V-PI凋亡试剂盒说明书操作。以适量无EDTA胰酶消化、分别收集地西他滨处理72 h后的Hela及SiHa细胞,磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤、重悬细胞,收集(1 ~ 5)× 105个细胞,2 000 r/min 5 min离心沉淀,加入500μl Binding buffer重悬细胞,向重悬液中加入5μl Annexin V-FITC染色,随后加入5μl碘化乙锭(propidium iodide,PI)染色,室温下避光孵育15 min,流式细胞仪检测凋亡率。
5流式细胞技术(PI、FITC双染法)检测Hela及SiHa细胞周期 分别胰酶消化、收集地西他滨处理72 h后的Hela及SiHa细胞.2 000 r/min离心5 min,并用PBS洗涤细胞,之后加入预冷70%乙醇于4℃固定过夜,第2天离心收集细胞,以1 ml的PBS洗细胞1次,加入500μl PBS(含50μg/ml碘化乙锭(PI),100μg/ml RNaseA),4℃避光孵育30 min后离心弃上清,最后在流式管中以标准程序于BD FACS Calibur流式细胞仪上检测。
6T细胞杀伤活性检测 按前述方法药物处理72 h后,将细胞按照0.5×104/孔铺于96孔板中,每组取3个平行孔,贴壁后将T细胞分别按不同效靶比1∶1、10∶1、50∶1加入,共培养24 h。将培养液去除,用PBS轻轻震荡洗去悬浮状态的T细胞,每孔加入100μl含10% CCK-8的无血清培养基,在37℃、5% CO2条件下培养2 h,在酶联免疫检测仪上450 nm下测各孔吸光度值。
7实时定量PCR检测Hela及SiHa细胞相关CTA的表达 Trizol抽提各个细胞总RNA。所提取RNA用紫外分光度计测得A260和A280,取1μg RNA用逆转录酶M-MLV和oligo-dT引物合成cDNA。采用SYBR qPCR Mix试剂进行实时定量PCR检测,相关引物序列见表1。
8统计学分析 所有实验均重复3次,结果采用SPSS18.0进行统计,组间比较采用t-test,结果以±s表示,P<0.05为差异有统计学意义。

表1 实时定量PCR相关引物序列Tab. 1 Primers used to perform qRT-PCR of CTA and FasL
结 果
1低剂量地西他滨抑制Hela及SiHa的增殖 与对照组相比,10 nmol/L及100 nmol/L DAC处理后的Hela及SiHa细胞增殖受到不同程度的抑制,选取对细胞毒性最小的10 nmol/L作为使用剂量。见图1。
2低剂量地西他滨促进Hela及SiHa细胞凋亡与对照组相比,DAC处理72 h后对宫颈癌Hela及SiHa细胞凋亡的影响无明显差异。见图2。
3低剂量地西他滨导致Hela及SiHa细胞G1/S期阻滞 与对照组相比,DAC处理72 h后,Hela及SiHa细胞G0/G1期比例增加,S期和G2/M期比例下降。见图3。
4低剂量地西他滨增强T细胞对Hela及SiHa细胞的杀伤活性 与对照组相比,DAC处理后的Hela及SiHa细胞被T细胞杀伤更显著,并随着效靶比增加作用逐渐增强。Hela细胞在效靶比为10∶1时差异最为显著,SiHa细胞随着效靶比增加差异逐渐明显。差异有统计学意义(P<0.05)。见图4。
5低剂量地西他滨上调Hela及SiHa细胞相关CTA及FasL的mRNA的表达 DAC处理72 h后,Hela及SiHa细胞中的BORIS、NY-ESO-1、MAGE-A1/A3/A4及FasL的mRNA的表达水平明显升高(P<0.05)。见图5。
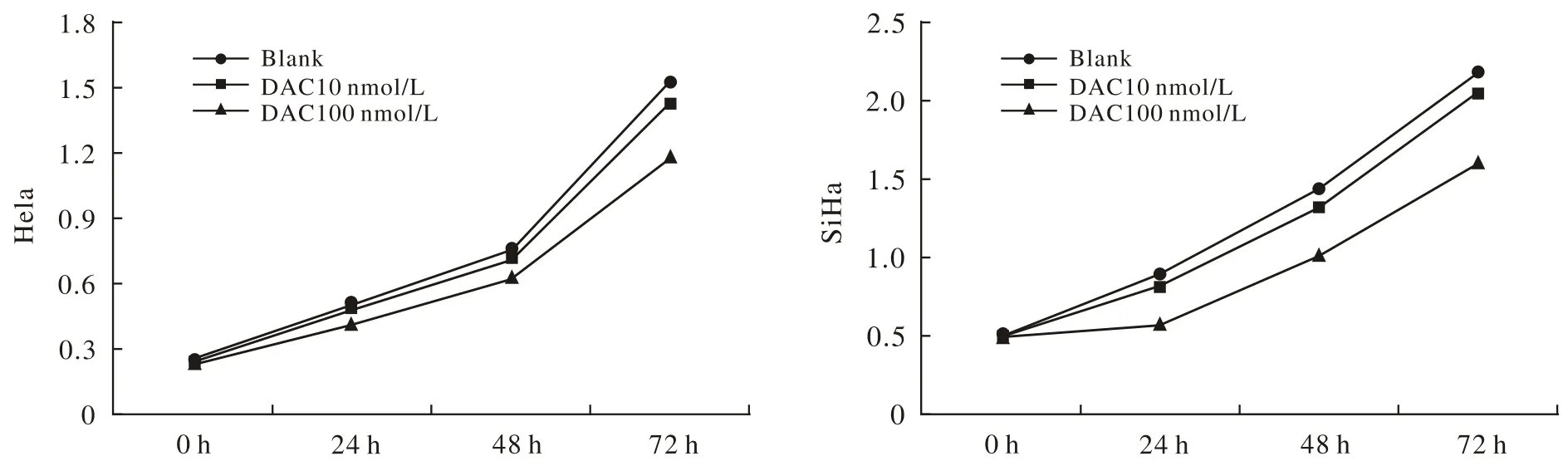
图 1 地西他滨抑制宫颈癌Hela,SiHa细胞增殖Fig. 1 DAC inhibiting the proliferation of Hela and SiHa cells (aP<0.05, vs blank)
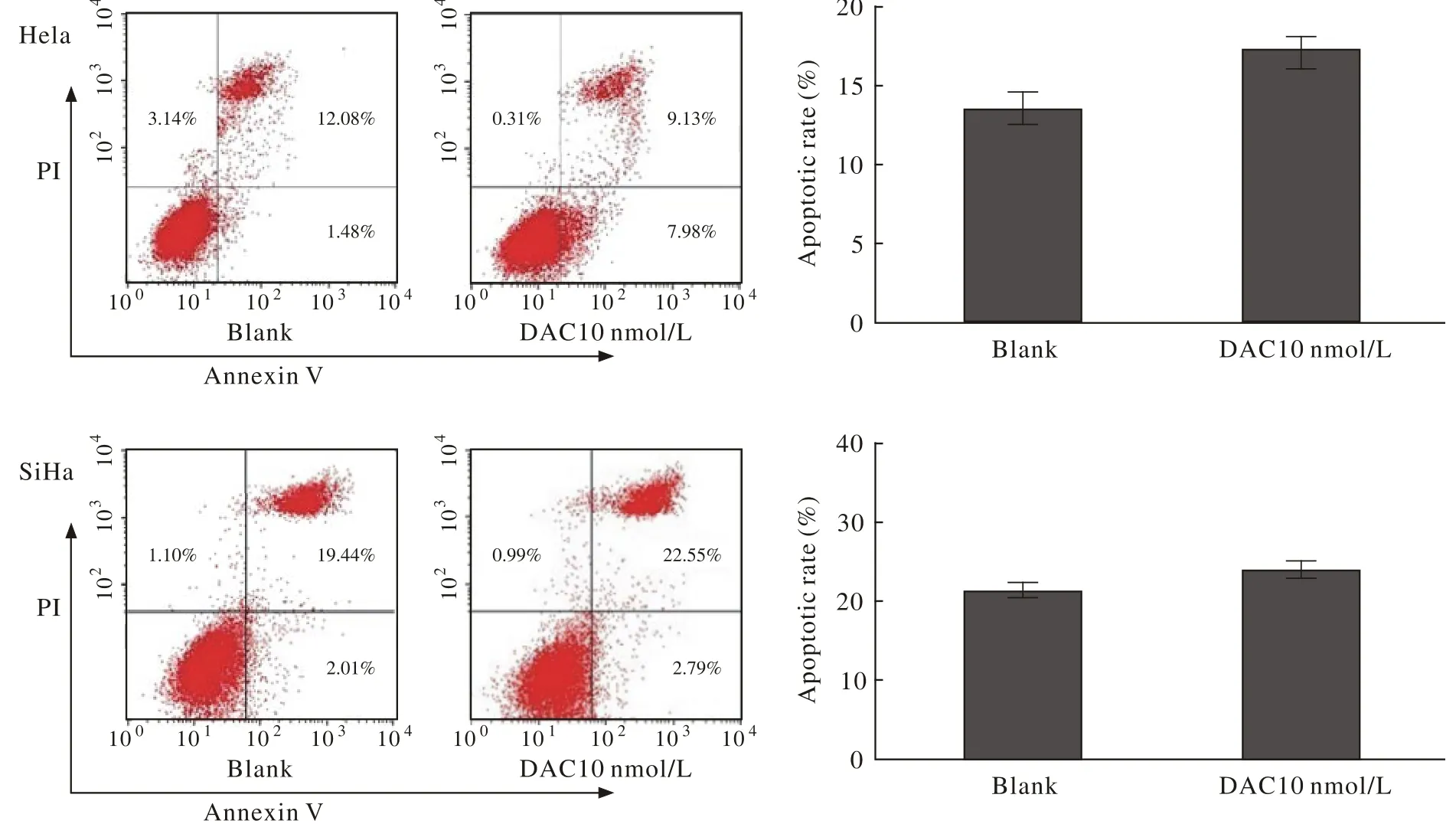
图 2 地西他滨增加宫颈癌Hela,SiHa细胞凋亡Fig. 2 DAC increasing Hela and SiHa cells apoptosis (aP<0.05, vs blank)
讨 论
肿瘤的发生、发展是免疫系统与癌细胞相互作用的动态过程,包括清除、平衡和逃逸3个阶段。免疫逃逸状态解除、细胞恢复免疫原性是肿瘤免疫治疗中的一个重大问题[12]。CTA是已知的几乎仅受到甲基化调控的肿瘤抗原[13-14]。恢复CTA的表达,可有效达到这个目的。目前,用于临床疫苗试验的癌睾丸抗原主要有针对NY-ESO-1及MAGEA3的免疫疫苗[15-16]。
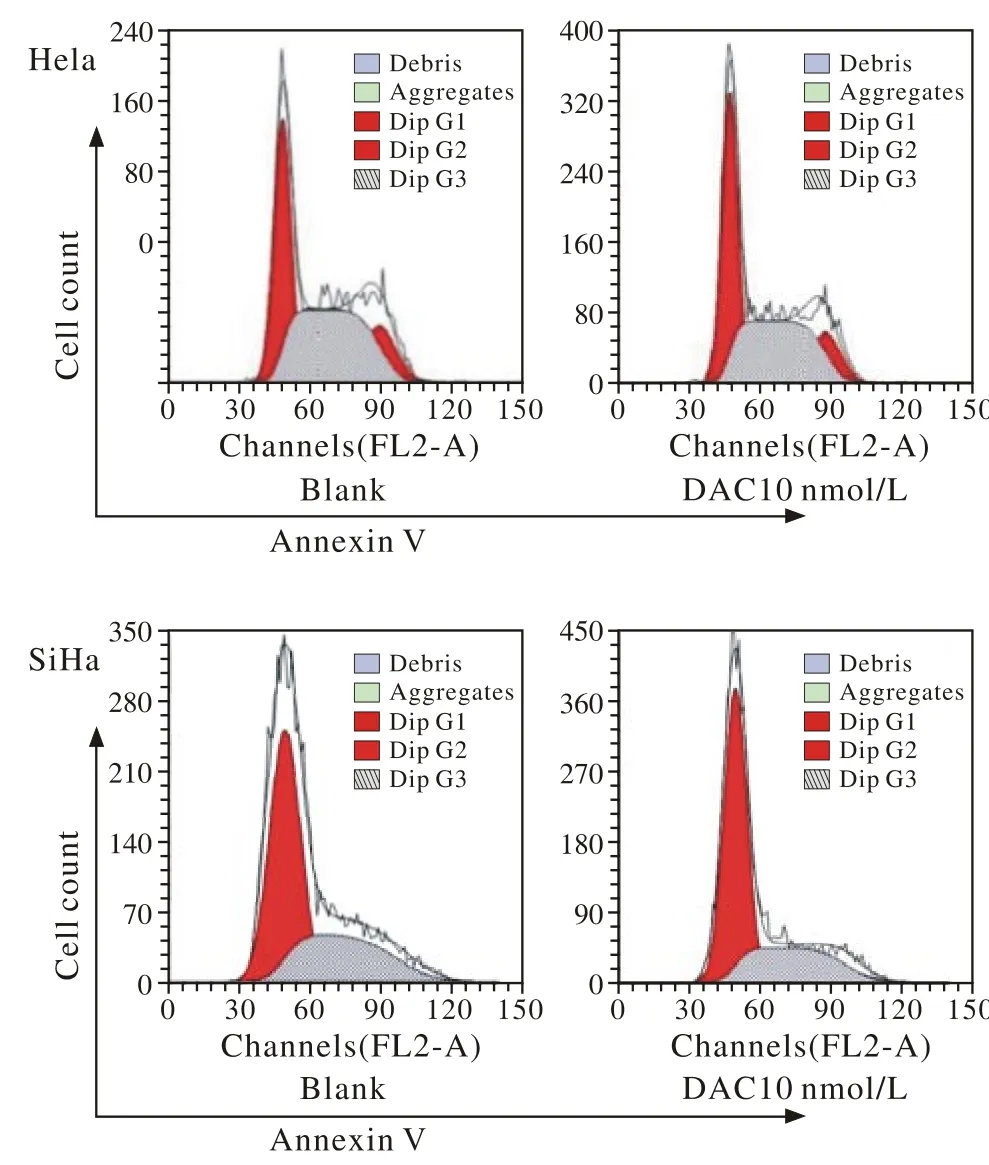
图 3 地西他滨造成宫颈癌Hela,SiHa细胞G1/S期阻滞Fig. 3 DAC promoting Hela and SiHa cells G1/S cycle arrest
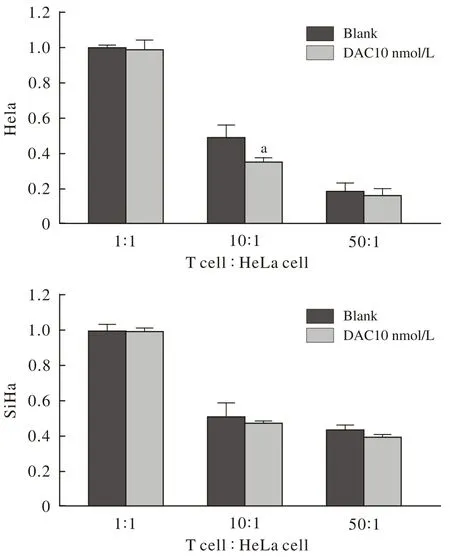
图 4 地西他滨增强T细胞对宫颈癌Hela, SiHa细胞杀伤活性Fig. 4 DAC enhancing T cell killing ability to Hela and SiHa cells (aP<0.05, vs blank)
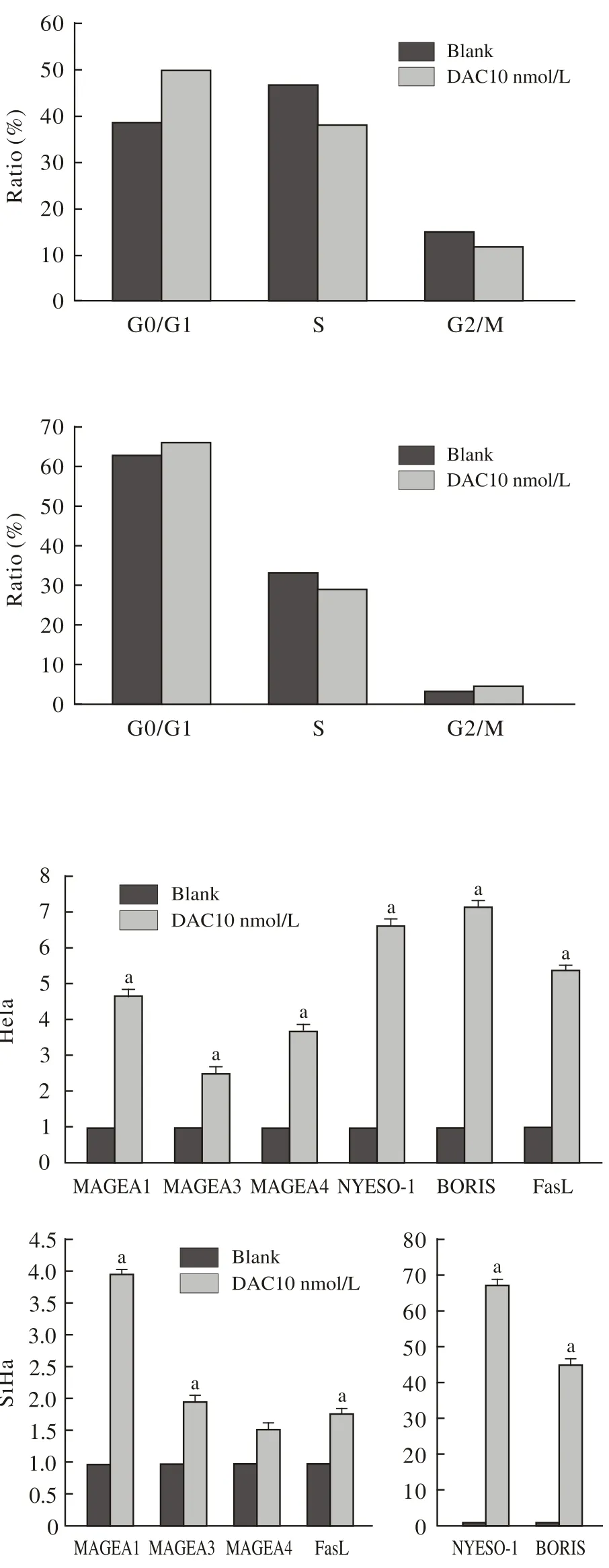
图 5 地西他滨增强宫颈癌细胞中的BORIS、NY-ESO-1、MAGEA1、 MAGEA3、 MAGEA4 及FasL 的mRNA的表达Fig. 5 DAC increasing the expression levels of BORIS, NY-ESO-1, MAGEA1, MAGEA3, MAGEA4 and FasL mRNAs of Hela and SiHa cells (aP<0.05, vs blank)
本研究显示,10 nmol/L地西他滨对宫颈癌细胞增殖和凋亡没有显著影响,100 nmol/L地西他滨一定程度上抑制细胞增殖。而10 nmol/L地西他滨虽不直接抑制细胞增长,但使宫颈癌细胞对T细胞的杀伤效应更为敏感,以效靶比为10∶1时最显著。为探讨地西他滨增强T细胞杀伤作用的可能机制,我们筛选发现,DAC不同程度地上调了癌睾丸抗原中BORIS、NY-ESO-1、MAGE-A1/A3/ A4的mRNA的表达,并且增强了细胞凋亡通路中FasL的表达[16],表明DAC处理后可能通过激活FasL通路促进细胞的凋亡,但是,DAC处理后上调的CTA之间有无互相促进表达升高的机制[17],DAC是否仅通过增加FasL的表达来调控宫颈癌的发生、发展[18],还有哪些通路参与其中都有待于进一步实验验证。
因此,通过系统合理地应用去甲基化药物DAC,提高CTA表达率,有助于提高肿瘤细胞的免疫原性,促进以T细胞对肿瘤细胞的识别和杀伤为主的生物免疫治疗。本研究为地西他滨用于临床宫颈癌的免疫治疗提供实验依据。
1 Shin DY, Sung Kang H, Kim GY, et al. Decitabine, a DNA methyltransferases inhibitor, induces cell cycle arrest at G2/M phase through p53-independent pathway in human cancer cells[J]. Biomed Pharmacother, 2013, 67(4):305-311.
2 Karahoca M, Momparler RL. Pharmacokinetic and pharmacodynamic analysis of 5-aza-2’-deoxycytidine (decitabine) in the design of its dose-schedule for cancer therapy[J]. Clin Epigenetics, 2013, 5(1):3.
3 Lemaire M, Chabot GG, Raynal NJ, et al. Importance of doseschedule of 5-aza-2’-deoxycytidine for epigenetic therapy of cancer[J]. BMC Cancer, 2008, 8:128.
4 Kantarjian H, Issa JP, Rosenfeld CS, et al. Decitabine improves patient outcomes in myelodysplastic syndromes: results of a phase III randomized study[J]. Cancer, 2006, 106(8):1794-1803.
5 Juergens RA, Wrangle J, Vendetti FP, et al. Combination epigenetic therapy has efficacy in patients with refractory advanced non-small cell lung cancer[J]. Cancer Discov, 2011, 1(7): 598-607.
6 Yang D, Torres CM, Bardhan K, et al. Decitabine and vorinostat cooperate to sensitize colon carcinoma cells to Fas ligand-induced apoptosis in vitro and tumor suppression in vivo[J]. J Immunol,2012, 188(9): 4441-4449.
7 Fang F, Balch C, Schilder J, et al. A phase 1 and pharmacodynamic study of decitabine in combination with carboplatin in patients with recurrent, platinum-resistant, epithelial ovarian cancer[J]. Cancer, 2010, 116(17):4043-4053.
8 Matei D, Fang F, Shen C, et al. Epigenetic resensitization to platinum in ovarian cancer[J]. Cancer Res, 2012, 72(9):2197-2205.
9 Sova P, Feng Q, Geiss G, et al. Discovery of novel methylation biomarkers in cervical carcinoma by global demethylation and microarray analysis[J]. Cancer Epidemiol Biomarkers Prev, 2006,15(1): 114-123.
10 Risinger JI, Chandramouli GV, Maxwell GL, et al. Global expression analysis of cancer/testis genes in uterine cancers reveals a high incidence of BORIS expression[J]. Clin Cancer Res, 2007, 13(6):1713-1719.
11 Kang Y, Hong JA, Chen GA, et al. Dynamic transcriptional regulatory complexes including BORIS, CTCF and Sp1 modulate NYESO-1 expression in lung cancer cells[J]. Oncogene, 2007, 26(30):4394-4403.
12 Mapara MY, Sykes M. Tolerance and cancer: mechanisms of tumor evasion and strategies for breaking tolerance[J]. J Clin Oncol,2004, 22(6): 1136-1151.
13 许涛,张小静,谢小薰.DNA甲基化对癌睾丸抗原基因表达的调控及其意义[J].生命的化学,2005,25(4):324-326.
14 Konkankit VV, Kim W, Koya RC, et al. Decitabine immunosensitizes human gliomas to NY-ESO-1 specific T lymphocyte targeting through the Fas/Fas ligand pathway[J]. J Transl Med, 2011, 9:192.
15 江华,姜永强.肿瘤-睾丸抗原研究进展[J].军事医学科学院院刊,2007,31(4):387-390.
16 Doumba PP, Nikolopoulou M, Gomatos IP, et al. Co-culture of primary human tumor hepatocytes from patients with hepatocellular carcinoma with autologous peripheral blood mononuclear cells: study of their in vitro immunological interactions[J]. BMC Gastroenterol,2013, 13:17.
17 Bhan S, Negi SS, Shao C, et al. BORIS binding to the promoters of cancer testis antigens, MAGEA2, MAGEA3, and MAGEA4, is associated with their transcriptional activation in lung cancer[J]. Clin Cancer Res, 2011, 17(13):4267-4276.
18 Siegel RM, Chan FK, Chun HJ, et al. The multifaceted role of Fas signaling in immune cell homeostasis and autoimmunity[J]. Nat Immunol, 2000, 1(6): 469-474.
Effect of T cell killing ability on low-dose decitabine treated cervical cancer cells
BAI Hua1, LI Xiang2, NIE Jing2, HAN Weidong2, MENG Yuanguang
1Department of Obstetrics and Gynecology;21Department of Molecular Biology, Institute of Basic Medicine Chinese PLA General Hospital, Beijing 100853, China
MENG Yuanguang. Email: meng6512@vip.sina.com
ObjectiveTo study the effect of T cell killing ability on low-dose decitabine (DAC) treated cervical cancer cells and explore its possible mechanism.MethodsCCK-8 was used to test the proliferation of low-dose DAC treated cervical cancer cells. Flow cytometry assay was used to test the apoptosis and cell cycle of low-dose DAC treated cervical cancer cells. CCK-8 was also used to test T cell killing ability of low-dose DAC treated cervical cancer cells. Real-Time PCR was used to test the expression of BORIS, NYESO-1, MAGEA1, MAGEA3, MAGEA4 and FasL on low-dose DAC treated cervical cancer cells.Results10 nmol/L of DAC showed no significant difference in the proliferation and apoptosis of cervical cancer cells, while 100 nmol/L of DAC inhibited the proliferation of cervical cancer cells. Though 10 nmol/L of DAC did not inhibit the proliferation of cervical cancer cells directly, it enhanced T cell killing ability to cervical cancer cells most significantly with the efficient targeting ratio of 10∶1. Also 10 nmol/L of DAC showed significant up-regulation in the mRNA expression of CTAs such as BORIS, NYESO-1, MAGEA1, MAGEA3 and MAGEA4, as well as FasL.ConclusionThese results suggest that low-dose DAC may work as a potential biological immunotherapy drug to inhibit cell viability and enhance T cell killing ability in cervical cancer cells.
decitabine; cervical cancer; cancer testis antigen; immunotherapy
R 737.33
A
2095-5227(2015)05-0497-05
10.3969/j.issn.2095-5227.2015.05.023< class="emphasis_bold">网络出版时间:
时间:2015-02-16 09:48网络出版地址:http://www.cnki.net/kcms/detail/11.3275.R.20150216.0948.002.html
2014-11-13
国家自然科学基金项目(81472838;81272867)
Supported by the National Natural Science Foundation of China(81472838; 81272867)
白桦,女,在读硕士,医师。研究方向:妇科肿瘤。Email: baihua.353@163.com
孟元光,男,主任医师,教授,博士生导师。Email: me ng6512@vip.sina.com
