利拉鲁肽对大鼠急性脊髓损伤后神经细胞自噬与运动功能恢复的作用
2015-04-01李昊天赵兴长王继权范仲凯
李昊天,赵兴长,孙 平,王继权,褚 鑫,吕 刚,范仲凯
辽宁医学院附属第一医院,辽宁锦州 121001
利拉鲁肽对大鼠急性脊髓损伤后神经细胞自噬与运动功能恢复的作用
李昊天,赵兴长,孙 平,王继权,褚 鑫,吕 刚,范仲凯
辽宁医学院附属第一医院,辽宁锦州 121001
目的探讨利拉鲁肽注射液(Liraglutide)对急性脊髓损伤(spinal cord injury,SCI)后神经细胞的保护作用及其可能机制。方法54只SD大鼠随机分成假手术组(Sham组)、脊髓损伤组(SCI组,损伤后立即腹腔注射0.9%氯化钠注射液50μg/kg)和治疗组(Liraglutide组,损伤后立即腹腔注射利拉鲁肽50μg/kg),每组18只,Allen法建立大鼠脊髓损伤模型,于损伤后3 d取脊髓组织,Western blot检测LC3-Ⅱ、Caspase-3表达,免疫荧光双标染色观察神经元自噬表达水平、神经细胞凋亡情况;于损伤后1 d、3 d、7 d分别进行Basso Beattle Bresnahan (BBB)运动评分。结果与Sham组相比,SCI组LC3-Ⅱ、Caspase-3表达、自噬阳性神经细胞数目、神经细胞凋亡数目均增多(P<0.01),BBB评分显著降低(P<0.01);Liraglutide组与SCI组相比,LC3-Ⅱ显著增多,Caspase-3表达降低(P<0.01);免疫荧光双标染色示自噬阳性细胞数目明显增多(P<0.01);神经元凋亡双标染色法示神经凋亡细胞数目明显减少(P<0.01);BBB评分在3 d与7 d时有显著提高(P<0.01)。结论利拉鲁肽增强大鼠脊髓损伤后神经细胞自噬,降低凋亡相关蛋白表达,减少神经细胞凋亡,促进大鼠运动功能恢复,对脊髓损伤具有保护作用。
脊髓损伤;利拉鲁肽;自噬;凋亡
脊髓损伤(spinal cord injury,SCI)后可导致继发性缺血、缺氧等一系列迟发性神经坏死,由此引发的细胞凋亡是脊髓神经元死亡的主要原因[1]。自噬是在营养缺乏或氧化应激时,细胞利用溶酶体降解自身受损的细胞器、大分子物质的过程,对维持细胞稳态具有重要意义[2]。近年来研究表明,SCI后细胞自噬水平显著提高,对细胞凋亡有复杂的作用与影响[3]。胰高血糖素样肽1(glucagon-like peptide-1,GLP-1)是主要由远端回肠等的L细胞分泌的一种肠促胰岛素,通过胰高血糖素样肽1受体(glucagon-like peptide-1 receptor,GLP-1R)产生作用[4]。利拉鲁肽是由丹麦诺和诺德公司研发的长效GLP-1类似物,2010年1月被美国食品与药物管理局(FDA)批准用于成年人2型糖尿病(type 2 diabetes mellitus,T2DM)的治疗。近年来,利拉鲁肽的胰腺外作用越来越被学者所重视。研究表明,利拉鲁肽通过抑制细胞凋亡对脑出血、脑缺血[5-6]、脑部慢性炎症[7]、阿尔茨海默病[4]等中枢神经系统疾患及胰腺细胞[8]、血管平滑肌细胞[9]的损伤有一定的保护作用,可以通过促进自噬抑制肝细胞和胰腺β细胞的凋亡[10-11]。目前,利拉鲁肽在SCI的作用尚未见相关报道。本研究通过利拉鲁肽对SCI大鼠模型进行干预,通过检测神经细胞自噬与凋亡及大鼠运动功能,研究利拉鲁肽对脊髓损伤后脊髓神经元的保护作用及其机制。
材料和方法
1材料和试剂 健康成年SD大鼠54只,雌雄不限,体质量(260±30) g,辽宁医学院实验动物中心提供。利拉鲁肽注射液(18 mg/支,丹麦诺和诺德公司,批号:CP51279);兔抗大鼠LC3、Caspase-3抗体,小鼠抗大鼠NeuN(美国Abcam生物技术公司);小鼠抗大鼠β-actin,山羊抗小鼠及山羊抗兔IgG二抗,FITC标记的驴抗小鼠IgG,Taxes标记的驴抗兔IgG(Santa Cruz);DAPI,RIPA(美国Sigma公司);增强型ECL试剂盒(Millipore);BCA蛋白浓度测定试剂盒(碧云天);TUNEL试剂盒(Roche)。
2动物分组 将大鼠随机分组为对照组(Sham组,n=18),脊髓损伤组(SCI组,n=18),利拉鲁肽组(Liraglutide组,n=18)。每组再分为3个亚组(n=6),第1组应用Western Blot法检测LC3Ⅱ、Caspase-3含量,第2组应用LC3/NeuN/DAPI/免疫荧光双标记法、TUNEL法检测神经细胞自噬及凋亡情况,第3组进行BBB运动评分。Sham组大鼠仅暴露脊髓,其他组制成脊髓损伤模型;根据以往学者对于利拉鲁肽在神经系统中的作用以及急性脊髓损伤病理过程的前期研究[1,5,13],我们制定如下给药方式:SCI组与Liraglutide组在打击后分别立即腹腔注射0.9%氯化钠注射液与利拉鲁肽(均为50μg/kg)。
3脊髓损伤模型制备 10%水合氯醛(3.0 ml/kg)腹腔麻醉大鼠,背部备皮消毒,于后背部T10棘突做正中切口,暴露T9、T10棘突及椎板,用咬骨钳咬除棘突和椎板以暴露脊髓。采用Allen′s法建立脊髓损伤模型[12-13]:击打器直径4.0 mm,质量20 g,打击高度为2.5 cm,致伤能量20 g×2.5 cm,以出现脊髓充血、双下肢、尾巴痉挛为造模成功,确保每只大鼠达到相同的损伤程度,模型的稳定性与可重复性良好。术后处理:将每只大鼠分笼饲养,食物和饮水不限,室温维持在(25±1)℃,保持干燥通风。术后定时协助大鼠排尿、排便。
4Western blot检测LC3、Caspase-3 SCI模型建立后统一于3 d时取脊髓组织。用RIPA裂解液裂解脊髓组织,提取总蛋白,用BCA法测蛋白浓度。制备15% SDS-PAGE进行恒压电泳,通过湿转移到PVDF膜上,封闭液室温封闭1 h,加入LC3、Caspase-3和β-actin抗体,4℃孵育过夜。洗涤后,分别加入HRP标记的山羊抗小鼠及山羊抗兔二抗,室温孵育1 h,用PBST洗涤,ECL化学发光试剂显影。
5神经元自噬免疫荧光双标记染色(LC3/NeuN/ DAPI染色) SCI模型建立后3 d取大鼠损伤脊髓组织,4%多聚甲醛固定1 d,30%蔗糖脱水2 d。在冷冻切片机中包埋后行连续横行切片(厚5μm)。加正常驴血清封闭1 h。LC3、NeuN两种一抗按1∶500稀释混合滴加到切片上,4℃孵育过夜。加入二抗FITC标记的驴抗小鼠IgG与Taxes标记的驴抗兔IgG的二抗混合物(1∶500稀释),室温孵育1 h,再用DAPI染色2 min。在避光条件下于荧光显微镜下观察。对于每段脊髓组织,以打击点为中心分别向头尾侧延伸2 mm,共取长度为4 mm的脊髓组织进行冷冻切片,每间隔0.5 mm取一张切片,每段脊髓组织取6张切片;对于每张切片在40×10倍视野下随机选取打击中心周边区不重叠的6个视野。计数绿色荧光的NeuN标记与红色的LC3标记共同定位的自噬阳性细胞数。
6神经元凋亡免疫荧光双标记染色(TUNEL/NeuN/ DAPI染色) 冷冻切片方法同5。加正常驴血清封闭1 h。NeuN一抗按1∶500稀释滴加到切片上,4℃孵育过夜。加入二抗FITC标记的驴抗小鼠IgG(1∶500稀释),室温孵育1 h,再按照TUNEL染色试剂盒说明进行操作。再用DAPI染色2 min。在避光条件下于荧光显微镜下观察。切片及选取方法同5。计数绿色荧光的NeuN标记与红色的凋亡小体标记共同定位的TUNEL阳性细胞数。
7行为学评分 根据文献报道的方法分别于伤后1 d、3 d和7 d进行BBB评分,研究利拉鲁肽对于大鼠SCI的运动恢复作用[14]:将动物置于宽阔活动场地自由活动5 min,观察其后肢运动情况,分别评分左右两侧肢体,取平均值为每只大鼠的功能得分。由不参与动物分组与治疗但熟悉评分标准的2位观察者同时独立进行评分,取平均值。
8统计学处理 应用SPSS13.0软件进行统计学分析。所得数据均以表示,各组均数间比较采用单因素方差分析,组间多重比较采用LSD-t检验,检验水准α=0.05。
结 果
1各组LC3-Ⅱ和Caspase-3蛋白表达 Sham组有极少量LC3-Ⅱ;与Sham组相比,SCI组与Liraglutide组LC3-Ⅱ表达量均增多(P<0.01);与SCI组相比,Liraglutide组LC3-Ⅱ表达显著增多(P<0.01)。Sham组Caspase-3有少量表达,而SCI组与Liraglutide组Caspase-3表达量均增加(P<0.01);与SCI组相比,Liraglutide组Caspase-3表达量显著降低(P<0.01)。见图1。
2各组神经元自噬水平比较 DAPI指示细胞核,绿色荧光的NeuN标记指示神经细胞,红色斑点荧光的LC3标记指示自噬相关蛋白LC3,绿色与红色荧光共同定位于的细胞为自噬阳性神经细胞。Sham组LC3阳性细胞数少,与Sham组相比,SCI组与Liraglutide组阳性细胞数增多(P<0.01);与SCI组相比,Liraglutide组阳性细胞数显著增多(P<0.01),提示自噬水平显著提高。见图2。
3各组神经元凋亡数量比较 蓝色荧光的DAPI指示细胞核,绿色荧光的NeuN标记指示神经细胞,红色荧光是TUNEL法指示凋亡小体,绿色与红色荧光共同定位于的细胞为凋亡神经细胞。与Sham组相比,SCI组与Liraglutide组神经细胞凋亡数量明显增多(P<0.01);与SCI组相比,Liraglutide组神经细胞凋亡数量明显降低(P<0.01)。见图3。
4行为学评分 Sham组在1 d、3 d、7 d的BBB评分分别为18.50±1.18、18.92±0.74、19.42±0.86。SCI组在1 d、3 d、7 d的BBB评分分别为0.91±0.80、1.50±0.44、3.16±0.82;与Sham组相比,SCI组在1 d、3 d及7 d的运动评分均显著降低(P<0.01);Liraglutid组在各个时间点BBB评分分别为1.08±0.66、3.75±0.69、6.17±0.61。与SCI组相比,Liraglutide组在3 d和7 d运动功能评分显著提高(P<0.01)。见图4。

图 1 Western blot检测各组LC3-Ⅱ和Caspase-3的表达 (aP<0.01,与Sham组比较;bP<0.01,与SCI组比较)Fig. 1 Western blot analysis of LC3-Ⅱ and Caspase-3 protein in different groups (aP<0.01, vs sham group;bP<0.01, vs SCI group)


图 2 各组自噬阳性细胞数(荧光显微镜, ×400;aP<0.01,与Sham组比较;bP<0.01,与SCI组比较)Fig. 2 Number of autophagy positive neurons in different groups (Fluorescence Microscope, ×400;aP<0.01, vs sham group;bP<0.01, vs SCI group)
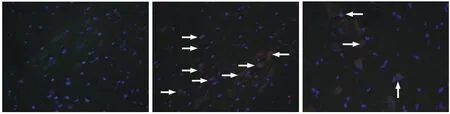
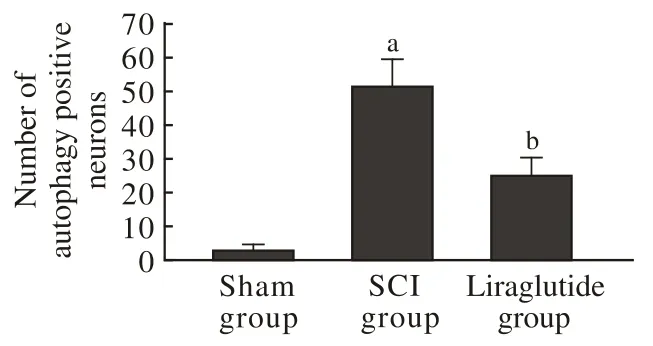
图 3 TUNEL检测各组中神经细胞凋亡情况 (荧光显微镜, ×400,aP<0.01,与Sham组比较;bP<0.01,与SCI组比较)Fig. 3 Neuronal apoptosis was identified by TUNEL staining in each group (Fluorescence microscope, ×200;aP<0.01, vs sham group;bP<0.01, vs SCI group)
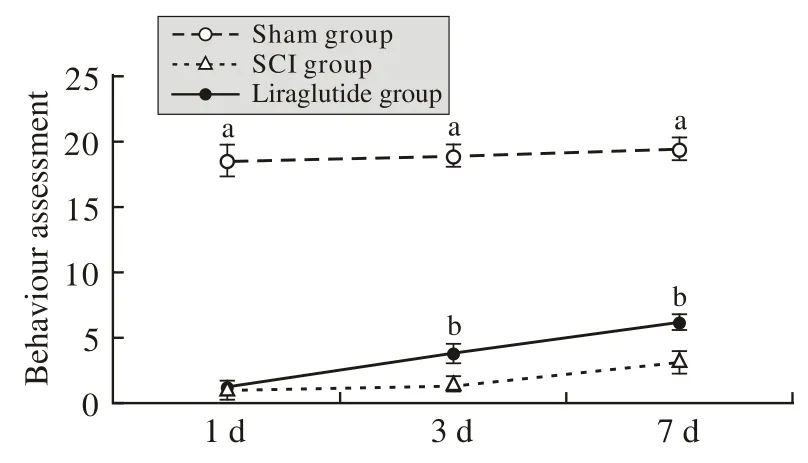
图 4 不同实验组行为学评分(aP<0.01,与Sham组比较;bP<0.01,与SCI组比较)Fig. 4 Behavioral assessment in different groups (aP<0.01, vs sham group;bP<0.01, vs SCI group)
讨 论
SCI后脊髓神经元的死亡主要由细胞凋亡所致[1,15]。近年来研究表明,自噬与细胞凋亡存在密切的关系[2-3]。自噬是真核细胞的一种高度保守的降解途径,将蛋白质、生物膜、线粒体、核糖体、内质网及过氧化物酶体等细胞器运送至溶酶体,形成自噬体后被降解为有生物活性的小分子,并重新利用,以维持细胞内环境稳定。在内环境变化(DNA、线粒体损伤)或应激等外界刺激(氧供减少、葡萄糖供应不足、氨基酸缺乏)的条件下可以诱导细胞自噬的发生。Sekiguchi等[16]研究发现,SCI后自噬相关蛋白LC3增高,同时通过雷帕霉素促进自噬可以抑制脊髓神经元凋亡。近来较多研究得出相符结论[3,17]。因此笔者认为通过促进SCI后神经细胞自噬,可能具有抗凋亡作用,为治疗脊髓损伤提供新的方法。
GLP-1的生理功能主要是调节胰岛素分泌及维持体内葡萄糖代谢,而近年来研究发现,GLP-1受体在啮齿类动物和心、人脑、脊髓等多种组织中广泛表达[18],其胰腺外作用也逐渐被学者所重视。利拉鲁肽为长效GLP-1类似物,弥补了外周循环中GLP-1的半衰期短暂的缺点(1 ~ 2 min),一些研究发现,利拉鲁肽对神经系统有一定的保护作用[4-11],但是利拉鲁肽在神经系统中的作用机制尚未阐明。
LC3-Ⅰ和LC3-Ⅱ蛋白是由哺乳动物中酵母Atg8基因的同源物编码的蛋白,参与自噬过程中自噬体的形成。当细胞发生自噬时,LC3-Ⅰ与磷脂酰乙醇胺结合,形成LC3-Ⅱ,进而定位于自噬体膜上,其含量的多少与自噬体数目成正比,因此LC3-Ⅱ常用来衡量细胞自噬水平[2]。根据先前学者对于利拉鲁肽在神经系统中的研究[5]以及急性脊髓损伤后的病理过程[1,13],本试验在建立SCI模型后对每只大鼠立即予以50μg/kg利拉鲁肽治疗,Western blot法显示,与Sham组、SCI组相比,Liraglutide组LC3-Ⅱ蛋白表达水平增高;进一步通过免疫荧光双标染色示Liraglutide组脊髓损伤区域LC3-Ⅱ较另外两组表达显著提高。这说明利拉鲁肽可以提高SCI后神经细胞的自噬水平。本研究结果与Sharma等[10]发现利拉鲁肽通过促进自噬减轻肝细胞脂肪性变、促进肝细胞存活的保护作用相符。同时,Zhou等[11]也指出利拉鲁肽可以通过促进自噬抑制胆固醇引发的胰腺细胞凋亡。因此,我们认为利拉鲁肽在SCI中的保护作用机制与促进细胞自噬有密切的关系。
SCI导致脊髓氧化应激、炎症反应、血脊髓屏障破坏、自由基释放、线粒体内质网功能受损等多方面改变,引起多种促凋亡因子释放,激活下游凋亡相关蛋白Caspase-3,最终导致细胞凋亡[19]。本研究通过Western blot法研究各组凋亡蛋白Caspase-3的表达,结果显示,与SCI组相比,Liraglutide组Caspase-3表达显著减少;进一步应用TUNEL/NeuN双标染色法发现Liraglutide组神经细胞凋亡数量明显小于SCI组。以上结果说明利拉鲁肽可以有效抑制SCI后神经细胞凋亡。以往研究也得出相符结论:Hou等[6]研究发现,利拉鲁肽可以减轻脑出血后的炎症反应与神经损害;Briyal等[5]指出,利拉鲁肽在脑缺血中可以抑制神经细胞凋亡,促进神经功能恢复。我们进一步通过在伤后不同时间进行BBB评分,结果示与SCI组相比,利拉鲁肽在伤后3 d与7 d可显著提高运动功能评分。综上,笔者认为利拉鲁肽可以通过促进自噬从而抑制SCI后神经细胞凋亡,减轻神经损伤。
研究表明,利拉鲁肽等GLP-1类似物在神经系统等胰腺外系统中的保护作用机制可能是多方面的。首先,Ogata等[8]与Dai等[9]指出利拉鲁肽可以通过抑制线粒体活性氧自由基生成、减轻氧化损伤、保护线粒体功能从而抑制人血管平滑肌细胞与胰腺B细胞的凋亡,说明其神经保护作用可能与保护线粒体功能有关;Parthsarathy和Hölscher[7]指出,利拉鲁肽可以减轻大鼠辐射后脑部慢性炎症,进而改善神经功能;此外,Xiong等[4]发现,利拉鲁肽在阿尔茨海默病小鼠模型中有促进记忆能力恢复、减轻退行性病变的作用。
综上所述,利拉鲁肽具有抑制神经细胞凋亡及促进脊髓功能恢复的作用,其可能机制为促进了SCI后神经细胞自噬。本研究为进一步研究及临床应用奠定基础,并印证了干预自噬可能成为未来治疗SCI的新方法。
1 Granger N, Franklin RJ, Jeffery ND. Cell therapy for spinal cord injuries: what is really going on?[J]. Neuroscientist, 2014, 20(6):623-638.
2 Levine B, Kroemer G. Autophagy in the pathogenesis of disease[J]. Cell, 2008, 132(1): 27-42.
3 Kanno H, Ozawa H, Sekiguchi A, et al. The role of mTOR signaling pathway in spinal cord injury[J]. Cell Cycle, 2012, 11(17):3175-3179.
4 Xiong H, Zheng C, Wang J, et al. The neuroprotection of liraglutide on Alzheimer-like learning and memory impairment by modulating the hyperphosphorylation of tau and neurofilament proteins and insulin signaling pathways in mice[J]. J Alzheimers Dis, 2013, 37(3):623-635.
5 Briyal S, Shah S, Gulati A. Neuroprotective and anti-apoptotic effects of liraglutide in the rat brain following focal cerebral ischemia[J]. Neuroscience, 2014, 281C: 269-281.
6 Hou J, Manaenko A, Hakon J, et al. Liraglutide, a long-acting GLP-1 mimetic, and its metabolite attenuate inflammation after intracerebral hemorrhage[J]. J Cereb Blood Flow Metab, 2012, 32(12):2201-2210.
7 Parthsarathy V, Hölscher C. The type 2 diabetes drug liraglutide reduces chronic inflammation induced by irradiation in the mouse brain[J]. Eur J Pharmacol, 2013, 700(1/3): 42-50.
8 Ogata M, Iwasaki N, Ide R, et al. GLP-1-related proteins attenuate the effects of mitochondrial membrane damage in pancreatic β cells[J]. Biochem Biophys Res Commun, 2014, 447(1):133-138.
9 Dai Y, Mercanti F, Dai D, et al. LOX-1, a bridge between GLP-1R and mitochondrial ROS Generation in human vascular smooth muscle cells[J]. Biochem Biophys Res Commun, 2013, 437(1): 62-66.
10 Sharma S, Mells JE, Fu PP, et al. GLP-1 analogs reduce hepatocyte steatosis and improve survival by enhancing the unfolded protein response and promoting macroautophagy[J]. PLoS One, 2011, 6(9):e25269.
11 Zhou J, Wu J, Zheng F, et al. Glucagon-like peptide-1 analogmediated protection against cholesterol-induced apoptosis via mammalian target of rapamycin activation in pancreatic βTC-6 cells[J/OL]. http://dx.doi.org/10.1111/1753-0407.12177.
12 Sonmez E, Kabatas S, Ozen O, et al. Minocycline treatment inhibits lipid peroxidation, preserves spinal cord ultrastructure, and improves functional outcome after traumatic spinal cord injury in the rat[J]. Spine (Phila Pa 1976), 2013, 38(15):1253-1259.
13 贾志强,王岩松,李刚,等.急性脊髓损伤后线粒体形态结构与线粒体膜电位的变化[J].解放军医学院学报,2014,35(9):939-941.
14 Basso DM, Beattie MS, Bresnahan JC. A sensitive and reliable locomotor rating scale for open field testing in rats[J]. J Neurotrauma, 1995, 12(1):1-21.
15 Wyndaele M, Wyndaele JJ. Incidence, prevalence and epidemiology of spinal cord injury: what learns a worldwide literature survey?[J]. Spinal Cord, 2006, 44(9):523-529.
16 Sekiguchi A, Kanno H, Ozawa H, et al. Rapamycin promotes autophagy and reduces neural tissue damage and locomotor impairment after spinal cord injury in mice[J]. J Neurotrauma,2012, 29(5): 946-956.
17 Yu DT, Li MF, Ni B, et al. Induction of neuronal mitophagy in acute spinal cord injury in rats[J]. Neurotox Res, 2013, 24(4): 512-522.
18 Holscher C. Incretin analogues that have been developed to treat type 2 diabetes hold promise as a novel treatment strategy for Alzheimer′s disease[J]. Recent Pat CNS Drug Discov, 2010, 5(2): 109-117.
19 Thompson CD, Zurko JC, Hanna BF, et al. The therapeutic role of interleukin-10 after spinal cord injury[J]. J Neurotrauma, 2013,30(15): 1311-1324.
Effect of Liraglutide on neuronal autophagy and movements recovery after spinal cord injury in rats
LI Haotian, ZHAO Xingzhang, SUN Ping, WANG Jiquan, CHU Xin, LYU Gang, FAN Zhongkai
First Affiliated Hospital of Liaoning Medical College, Jinzhou 121001, Liaoning Province, China
LYU Gang. Email: ganglv_jz@163.com; FAN Zhongkai. Email: flanzz@163.com
ObjectiveTo explore the neuroprotective effect and possible mechanism of Liraglutide in the rat model of spinal cord injury (SCI).MethodsFifty-four SD rats were randomly divided into three groups: sham operation group (n=18), spinal cord injury (SCI) group (immediately received 50μg/kg saline injection intraperitoneally after injury, n=18) and Liraglutide group (immediately received 50μg/kg Liraglutide injection intraperitoneally after injury, n=18). Spinal cord injury model was established using Allen's method. The rats were sacrificed and the spinal cord tissue were taken out 3 days after injury. Western blot was used to analyze the LC3-Ⅱ and caspase-3 expression. Immunofluorescent double labeling was used to detect the autophagy positive neurons and neuronal apoptosis. Finally, behavioral assessment with Basso Beattle Bresnahan locomotor rating scale (BBB) was done at 1 d, 3 d and 7 d after injury.ResultsCompared with sham group, the expression of LC3-Ⅱ, the level of caspase-3 and the number of autophagy positive neurons and neuronal apoptosis increased significantly in SCI group (P<0.01), while the BBB score decreased significantly (P<0.01). Furthermore, compared with SCI group, Western blot showed that the expression of LC3-Ⅱincreased while the level of caspase-3 decreased in Liraglutide group (P<0.01). Immunofluorescent double labeling showed that the number of autophagy positive neurons enhanced significantly (P<0.01) and the neuronal apoptosis in Liraglutide group reduced significantly compared with SCI group (P<0.01). Finally, behavioral assessment showed that animals in Liraglutide group achieved significant increase in BBB score on 3 d and 7 d (P<0.01).ConclusionLiraglutide promotes neuronal autophagy, decreases neuronal apoptosis and improves the locomotor function after SCI. Liraglutide may be a new candidate for clinical application in the treatment of SCI.
spinal cord injury; Liraglutide; autophagy; apoptosis
R 338
A
2095-5227(2015)05-0492-06
10.3969/j.issn.2095-5227.2015.05.022
时间:2015-02-13 10:07
http://www.cnki.net/kcms/detail/11.3275.R.20150213.1007.004.html
2014-12-01
国家自然科学基金项目(81272074);辽宁省高等学校优秀人才支持计划项目(LJQ2014091);辽宁医学院校长基金(AH2014012;XZJJ20130204)
Supported by the National Natural Science Foundation of China (81272074); Program for Liaoning Excellent Talents in University (2014091); Aohongboze Graduate Sci-tech Innovation Foundation, the President Fund of Liaoning Medical University(AH2014012; XZJJ20130204)
李昊天,男,在读硕士。研究方向:脊髓损伤。Email: lhtlacus@163.com
吕刚,男,主任医师,教授,博士生导师。Email: ganglv_jz@163.com;范仲凯,男,副教授,硕士生导师。Email: flanzz@163.com
