6-甲基-4-(4-甲氧酰基苯基)-5-甲氧羰基-3,4-二氢嘧啶-2-酮的合成及与牛血清白蛋白的相互作用
2015-04-01谢嘉霖彭化南叶红德
谢嘉霖,彭化南,2,叶红德
(1.上饶师范学院 化学化工学院,江西 上饶 334001;2.江西省普通高校应用有机化学重点实验室,江西 上饶 334001)
3,4-二氢嘧啶-2-酮类化合物因其具有广泛的生物活性,在农药和医药等方面备受关注。近年来,也有此类化合物作为钙通道阻滞剂、肾上腺素的拮抗剂和抗高血压药等方面的文献[1-4]报道。从海洋资源中已分离出许多含有二氢嘧啶酮结构单元的生物碱,它们具有潜在抑制HIVgp-120-CD4 病毒的作用[5-6]。由于嘧啶类化合物具有良好药物和生物活性,因此设计合成新型的嘧啶类衍生物并开展相应生物活性的研究引起了人们的重视。
血清白蛋白是血浆中含量最丰富的重要载体蛋白质,拥有维持渗透压平衡等多种生理功能[7]。牛血清白蛋白(BSA)与人血清白蛋白的结构相似,因此,牛血清白蛋白广泛作为模型蛋白用于研究[8]。本文以乙酰乙酸甲酯、尿素和对甲酰基苯甲酸甲酯为原料合成了6-甲基-4-(4-甲氧酰基苯基)-5-甲氧羰基-3,4-二氢嘧啶-2 酮(以下简称化合物)。采用荧光光谱法和紫外光谱法研究该化合物与牛血清白蛋白的相互作用,研究的结果为相关药物分子的设计和构效关系的研究提供理论参考。
1 实验部分
1.1 试剂与仪器
牛血清白蛋白、三羟甲基氨基甲烷均为生化试剂;对甲酰基苯甲酸甲酯、乙酰乙酸乙酯、尿素、对甲苯磺酸、无水乙醇、二甲亚砜、氯化钠、盐酸均为分析纯。
X-6 显微熔点测定仪;Bruker AM-400 核磁共振仪;Nicolet 6700 型FTIR 红外光谱仪;F-7000 型荧光光谱仪;TU-1901 双光束紫外-可见分光光度计;DKB-501A 型超级恒温水槽。
1.2 实验方法
1.2.1 溶液配制 用0.1 mol/L Tris-HCl 缓冲溶液(pH=7.4,内含0.1 mol/L NaCl 维持离子强度)为溶剂,配制成1.0 ×10-4mol/L 的BSA 溶液,溶液实验前配制,5 ℃保存。化合物用DMSO 为溶剂配制成2.0 ×10-4mol/L 的溶液。
1.2.2 6-甲基-4-(4-甲氧酰基苯基) -5-甲氧羰基-3,4-二氢嘧啶-2-酮的合成 在50 mL 圆底烧瓶中依次加入尿素0.9 g(15 mmol),对甲氧基苯甲酸甲酯1.64 g (10 mmol),乙 酰 乙 酸 甲 酯 1.16 g(10 mmol),对甲苯磺酸0.25 g,无水乙醇12 mL 为溶剂,在100 ℃下搅拌回流反应5 h,反应完毕后,冷却抽滤得到粗产物,用无水乙醇重结晶得到白色晶体,产率71.38%,m.p.210 ~223 ℃。IR (KBr),ν(cm-1):3 217,3 102,2 951,1 708,1 647,1 609,1 431,1 383,1 246,1 226,1 090。1H NMR (DMSOd6,400 MHz):9.28(s,1H,—NH),7.92(d,2H,J =7.0 Hz,Ar—H),7.82(s,1H,—NH),7.37(d,2H,J=7.0 Hz,Ar—H),5.21(s,1H,—CH),3.84(s,3H,—CH3),3.53 (s,3H,—CH3),2.25 (s,3H,—CH3)。HRMS calcd for [M + H]+C15H16N2O5:304.105 9,found 304.106。
合成路线见下式:

1.2.3 荧光光谱的测定 在10 mL 比色管中加入一定 量 的2.0 × 10-4mol/L 化 合 物 溶 液,用0.1 mol/L的Tris-HCl 缓冲溶液加至溶液体积约8 mL,再 加 入1.0 × 10-4mol/L 的 BSA 溶 液1.00 mL,用0.1 mol/L 的Tris-HCl 缓冲溶液定容,混匀,放入超级恒温水槽中,分别在298,303,308 K下反应10 min,然后扫描其荧光发射光谱(激发波长为280 nm)。同样方法测定298 K 下,△λ =15 nm和△λ=60 nm 的同步荧光光谱。
1.2.4 紫外光谱的测定 在室温下,分别测定纯化合物(1.0 ×10-5mol/L,DMOS 定容)、纯BSA(1.0×10-5mol/L,Tris-HCl 定容)和化合物∶BSA =1∶1(1.0 ×10-5mol/L,Tris-HCl 定容,反应10 min)在200 ~400 nm 范围内的紫外吸收光谱。
2 结果与讨论
2.1 BSA 的荧光猝灭光谱
牛血清白蛋白(BSA)中的色氨酸、酪氨酸和苯丙氨酸残基具有较强的内源荧光。当激发波长为280 nm 时,考察化合物对BSA 的荧光光谱的影响,见图1。

图1 化合物对BSA 的荧光光谱的影响(298 K)Fig.1 Fluorescence spectra of BSA influenced by different concentrations of compound(298 K)
由图1 可知,BSA 在340 nm 附近有很强的发射峰。在298 K 时,当BSA 浓度保持不变时,随着化合物浓度的逐渐增大,BSA 的荧光强度逐渐降低,但其发射峰的峰形和峰位没有变化,表明化合物与BSA 之间发生了相互作用,从而引起了BSA 的荧光猝灭。由于纯化合物在290 ~450 nm 间无荧光发射峰,故其对BSA 的荧光发射没有干扰。
温度为303 K 和308 K 时,化合物与BSA 的荧光光谱与298 K 时相似,最大荧光发射峰的峰形和峰位也都没有发生变化,表明在实验温度范围内,BSA 的构象没有发生变化。
2.2 BSA 荧光猝灭机理的推断
荧光猝灭可分为动态猝灭和静态猝灭,假设化合物对BSA 的猝灭为动态猝灭,则可按Stern-Volmer 方程处理[9]:
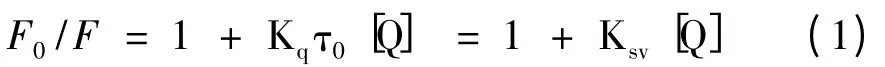
若以F0/F 对[Q]作图,可以得到不同温度下化合物对BSA 荧光猝灭的Stern-Volmer 图,见图2。
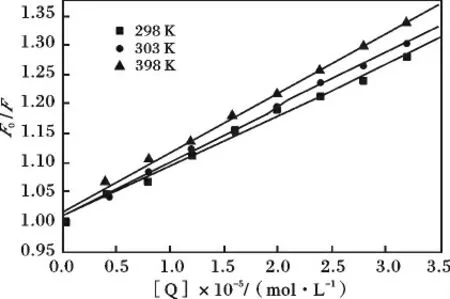
图2 不同温度下化合物对BSA 的Stern-Volmer 曲线Fig.2 Sterm-Volmer plots of BSA quenched by compound at different temperatures
由图2 可知,Stern-Volmer 曲线具有良好的线性关系。
生物大分子的荧光平均寿命一般约为10-8s,而各种猝灭剂对生物大分子的最大猝灭常数约为2×1010L/(mol·s)。由表1 可知,在298,303,308 K三种温度下,Kq均远远大于2 ×1010L/(mol·s),可以初步确定化合物对BSA 的荧光猝灭是由于形成了基态复合物而引起的静态猝灭。

表1 不同温度下化合物与BSA 作用的动态猝灭常数Table 1 Sterm-Volmer constant,quenching constant of compound and BSA at different temperatures
紫外光谱见图3。
由图3 可知,纯化合物和纯BSA 的紫外光谱与化合物+BSA(等物质的量混合)的紫外光谱有很大的差别,表明化合物与BSA 混合后形成了新的复合物。这可以进一步确定化合物对BSA 的荧光猝灭是由于形成了基态复合物而引起的静态猝灭。
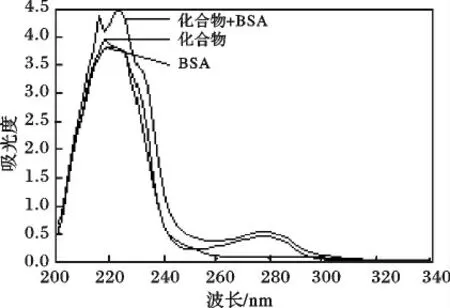
图3 化合物、BSA、化合物-BSA 体系的紫外吸收光谱Fig.3 UV absorption of compound,BSA and compound-BSA system
2.3 化合物与BSA 的结合常数(Ka)和结合位点数(n)
在静态猝灭中,BSA 的荧光强度与化合物的浓度符合下列关系:
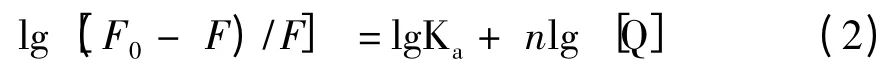
以lg [(F0-F)/F]对lg[Q]作图(图4),由直线的斜率和截距可以求出化合物与BSA 的结合常数(Ka)和结合位点数(n)[10]。

图4 化合物对BSA 荧光猝灭的双对数曲线Fig.4 Double-log plots of compound quenching effect on BSA fluorescence
Ka的数值反映了化合物与BSA 形成的基态复合物的稳定性。由表2 可知,Ka随着温度的升高而降低,表明化合物与BSA 形成的基态复合物的稳定性随着温度升高有所降低,即随着体系温度的升高化合物对BSA 的猝灭逐渐由静态猝灭为主转向动态猝灭为主。这与图2 中Stern-Volmer 曲线随温度的升高而升高和表1 中KSV随温度的升高而增大相吻合。
化合物与BSA 的结合点数(n)接近1,表明在实验温度范围内化合物与BSA 以接近1∶1(物质的量比)的比例形成基态复合物。
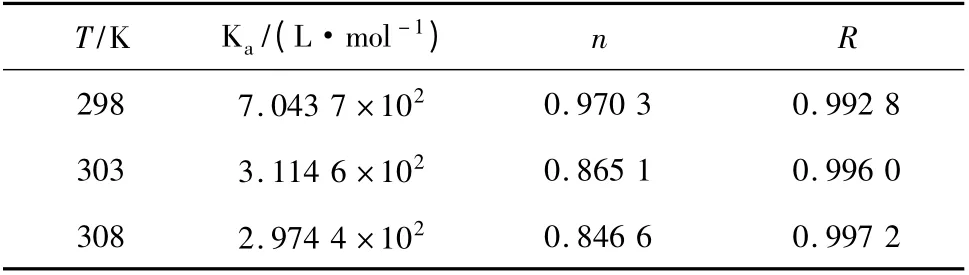
表2 不同温度下化合物与对BSA 作用的结合常数和结合位点数Table 2 Binding constants,number of binding sites for interaction of compound with BSA at different temperatures
2.4 化合物与BSA 的作用力类型
根据静态猝灭作用模型的Lineweaver-Burk 双倒数关系:
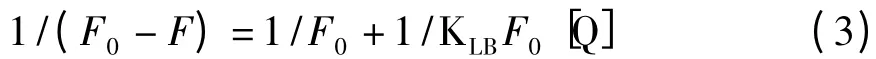
以(F0-F)-1对[Q]-1作图可以得Lineweaver-Burk 图(图5),由图中直线的斜率(KLBF0)-1和截距()可以求出KLB。
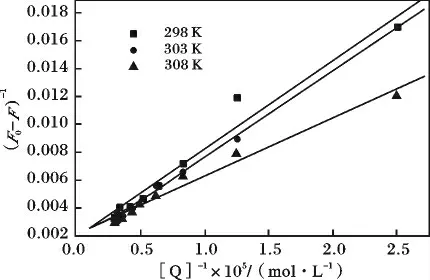
图5 (F0-F)-1与[Q]-1的关系图Fig.5 Relation curves of (F0-F)-1and[Q]-1
由于温度变化不大,ΔH 可以近似地认为是一个常数。通过公式:
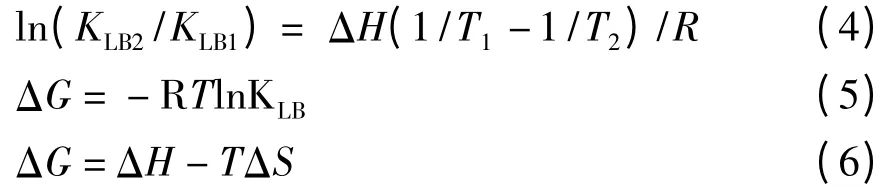
通过式(4)、(5)、(6)可以求出ΔH、ΔG 和ΔS见表3[11-12]。

表3 不同温度下化合物与BSA 的KLB和热力学参数Table 3 KLB and thermodynamic parameters of compound with BSA at different temperatures
由表3 可知,ΔH >0,ΔS >0,表明化合物与BSA的相互作用力主要是疏水作用力[13];ΔG <0,表明化合物与BSA 作用生成基态复合物的反应能自发进行。
2.5 化合物与BSA 的结合距离
给体-受体间能量转移效率E 与给体-受体间距离r 及能量转移距离R0存在如下关系:
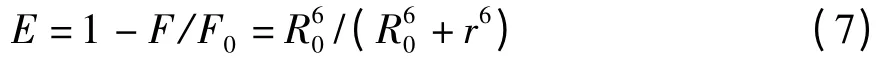
式(7)中的R0是转移效率为50%时的临界距离,可以通过下式来计算。
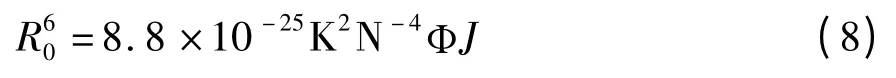
式(8)中,J 是给体的荧光发射光谱与受体的紫外吸收光谱重叠积分,可表示为:

本文实验条件下,受体和给体各项随机分布的取向因子的平均值K2= 2/3,Ф 取牛血清白蛋白(BSA)中色氨酸的量子产率0.118,N 取水和有机物折射指数的平均值1.336,J 可用矩形分割法来求得图6 中光谱重叠部分的面积,根据图6 求得化合物的重叠积分J =1.666 471 ×10-15cm3/(L·mol)。由公式(7)、(8)可以求得R0=1.82 nm,能量转移效率E =1.96 ×10-2,结合距离r =3.49 nm。r <7 nm说明化合物与BSA 分子之间发生了非辐射能量转移[14],化合物对BSA 的猝灭是通过能量转移机制使BSA 荧光发生静态猝灭。
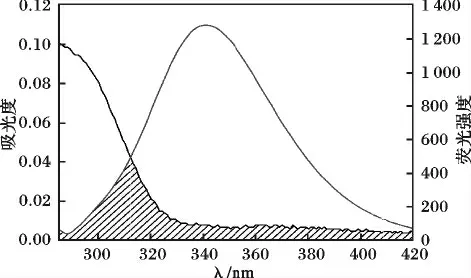
图6 化合物吸收光谱与BSA 荧光发射光谱的重叠图Fig.6 Spectral overlap between absorption spectrum of compound and fluorescence emission spectrum of BSA
2.6 化合物与BSA 构象的影响
在BSA 的同步荧光光谱中,Δλ =15 nm 时仅显示酪氨酸残基的荧光,Δλ =60 nm 时仅显示色氨酸残基的荧光。固定BSA 的浓度,逐步增加化合物的浓度,扫描Δλ=15 nm 和Δλ=60 nm 的同步荧光光谱(图7)。由图7 可知,当Δλ=15 nm 时,随着化合物浓度的增大,酪氨酸残基的最大荧光发射波长发生红移,表明酪氨酸残基所处的微环境发生了改变,疏水性降低。而Δλ=60 nm 时,随着化合物浓度的增大,色氨酸残基的最大荧光发射波长发生蓝移,表明色氨酸残基所处的微环境发生了改变,疏水性增强。
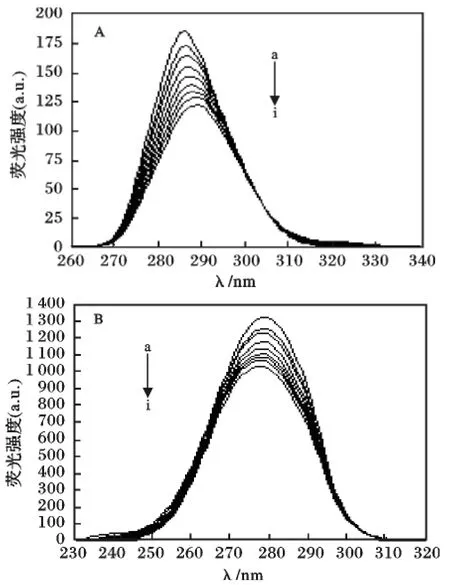
图7 BSA 的同步荧光光谱Fig.7 Synchronous fluorescence spectrum of BSA
3 结论
合成并表征了6-甲基-4-(4-甲氧酰基苯基)-5-甲氧羰基-3,4-二氢嘧啶-2-酮,利用荧光光谱法和紫外光谱法研究了该化合物与牛血清白蛋白(BSA)的相互作用。结果表明,化合物对BSA 的荧光猝灭为静态猝灭;化合物与BSA 的结合常数(Ka)和结合位点数(n)在298 K 时分别为7.043 7 ×102L/mol 和0.970 3,表明化合物与BSA 以接近1∶1(物质的量比)的比例生成基态复合物;热力学数据表明化合物与BSA 主要以疏水作用力相结合(ΔH >0,ΔS >0,ΔG <0);结合距离(r)为3.49 nm,表明化合物与BSA 分子之间发生了非辐射能量转移。
[1] 龚文朋,向诗银,徐玉林,等.H4SiW12O40/SiO2催化一锅法合成4-苯基-6-甲基-5-乙氧羰基-3,4-二氢嘧啶-2(H)-酮[J].精细化工,2014,31(2):225-228.
[2] 宋志国,王敏,宫红,等.邻甲基苯磺酸铜催化“一锅法”合成3,4-二氢嘧啶2-(1H)-酮[J].化学研究与应用,2009,21(11):1597-1600.
[3] Sedaghati B,Fassihi A,Arbabi S,et al.Synthesis and antimicrobial activity of novel derivatives of Biginelli pyrimidines[J].Med Chem Res,2012,21:3973-3983.
[4] Chitra S,Devanathan D,Pandiarajan K.Synthesis and in vitro microbiological evaluation of novel 4-aryl-5-isopropoxycarbonyl-6-methyl-3,4-dihydropyrimidin ones[J].Eur J Med Chem,2010,45:367-371.
[5] 李丽,刘庆俭,隋雪燕.C(5)-对甲基苯甲酰取代的3,4-二氢嘧啶(硫)酮类化合物的微波无溶剂合成[J].有机化学,2014,34(8):1669-1672.
[6] Tale B H,Rodge A H,Hatnapure G D,et al.The synthesis,anti-inflammatory and antimicrobial activity evaluation of novel thioanalogs of 3,4-dihydrothiopyri midin-2(1H)-one derivatives of N-aryl urea[J].Med Chem Res,2012,21:4252-4260.
[7] Li X R,Chen D J,Wang G K,et al.Investigation on the interaction between bovine serum albumin and 2,2-diphenyl-1-picrylhydrazyl[J].Journal of Luminescence,2014,156:255-261.
[8] Jayabharathi J,Thanikachalam V,Jayamoorthy K,et al.Binding interaction of 1-(4-methybenzyl)-2-p-tolyl-1Hbenzo[d]imidazole with bovine serum albumin[J].Spectrochimica Acta Part A,2012,93:180-184.
[9] 许金钩,王尊本.荧光分析法[M].3 版.北京:科学出版社,2006:67.
[10]张勇,张贵珠,王月梅.光谱法研究丝裂霉素、血清白蛋白以及金属离子间的相互作用[J].分析科学学报,2000,16(6):445-449.
[11]蒋建宏,李旭,肖圣雄,等.2-{[4-氨基-5-(3,4,5-三甲氧基-苄基)-嘧啶-2-亚胺基]-甲基}-6-甲氧基-苯酚与酵母细胞和牛血清白蛋白的相互作用[J].高等学校化学学报,2014,35(4):831-838.
[12]陈莉,孙绍发,宋功武.荧光光谱法研究一种噻吩并[2,3-d]嘧啶-4(3H)-酮衍生物与牛血清白蛋白的相互作用[J].分析科学学报,2012,28(2):207-211.
[13]林海彬,周朝晖,王庆华,等.三种钴乙醇酸配合物与牛血清白蛋白相互作用的荧光分析[J].无机化学学报,2014,30(7):1559-1566.
[14]杨树平,韩立军,潘燕,等.8-(3-或4-氟苯甲酰基)-7-羟基-4-甲基香豆素的合成、晶体结构、抑菌活性、抗氧化活性及其与牛血清白蛋白的相互作用[J].中国科学:化学,2013,43(7):858-868.
