丛枝菌根真菌对阿特拉津胁迫下芦苇生长及生理特性的影响
2015-03-31曹明竹齐珊珊栾恩骁赵昕悦
曹明竹, 王 立, 马 放, 董 静, 齐珊珊, 栾恩骁, 赵昕悦
(哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江哈尔滨 150090)
丛枝菌根真菌对阿特拉津胁迫下芦苇生长及生理特性的影响
曹明竹, 王 立, 马 放, 董 静, 齐珊珊, 栾恩骁, 赵昕悦
(哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江哈尔滨 150090)
[目的]定量考察农药胁迫条件下丛枝菌根真菌(AMF)对水生植被的保护作用。[方法]以芦苇为试验材料,研究在阿特拉津不同浓度胁迫下,接种AMF对芦苇生长和生理特性的影响。[结果]AMF可以与芦苇建立稳定的共生关系,接种AMF芦苇的各项生长指标以及根冠比均高于未接菌的对照,接菌处理的芦苇叶片中叶绿素含量以及根部过氧化物酶活性均高于未接菌的植株,而根部丙二醛含量则显著低于后者。接种AMF可在一定程度上缓解阿特拉津对芦苇生长和生理的胁迫,对生长胁迫的缓解随着阿特拉津浓度的增加呈现先增强后减弱的趋势,对叶绿素含量等生理指标胁迫的缓解超过326%。[结论]试验结果为湿地植被保护及修复提供了理论依据。
摩西球囊霉;芦苇;阿特拉津;生长特性;生理特性
我国是农业大国,农药流失现象异常严重,残留的农药伴随农田退水进入周边湿地系统,导致湿地系统农药超标严重。阿特拉津是一种广泛使用的除草剂,在保证粮食生产的同时,大量农药残留随着地表径流进入水体,对水生植被生长造成显著毒害作用,影响水生植被系统健康。
AMF是广泛存在于自然界的一种植物内生型真菌,可通过侵染植物根系与植物建立互惠互利的共生关系[1],促进宿主植物生长并提高其抗逆环境胁迫的能力。已有研究表明,AMF能够促进植物对营养元素的吸收[2-3],促进叶片叶绿素含量和植物光合作用的效率[4],同时可以提高宿主植物对干旱、低温、高温、高盐、重金属以及农药等外界不利生态环境的耐受能力[5-16]。上述研究多集中于土培农作物生长促进及产量提高方面,对自然条件下的原生植被,尤其是水生植物的研究较少。利用AMF的优良特性提高自然植被抵抗环境污染胁迫与冲击能力,是缓解自然水生植物系统因污染而产生的受损、退化等问题的有效途径。为定量考察农药胁迫条件下AMF对水生植被的保护作用,笔者以湿地优势植被——芦苇为宿主植物,构建AM真菌-芦苇共生体系,研究了阿特拉津胁迫下接种摩西球囊霉(Glomusmosseae,GM)对芦苇生长、生理特性的影响,旨在为湿地植被保护及修复提供理论依据。
1 材料与方法
1.1 材料 试验于2014年6~9月在哈尔滨工业大学城市水资源与水环境国家重点实验室综合试验区进行。供试芦苇种子产自吉林省吉林市。供试菌种为摩西球囊霉,采用营养液水培法进行培养,利用蛭石辅助根系固定。
1.2 试验设计 试验设接菌处理(+AM)和不接菌对照(-AM)。选取饱满一致的芦苇种子,分别播种于装有接种12 g菌剂(接菌处理)和接种12 g灭菌接种物(不接菌对照,保持营养物的一致)的营养液中。播种后60 d在营养液中施加阿特拉津,共设8个浓度:0、0.1、0.5、1.0、3.0、5.0、10.0、15.0 mg/L,每个浓度3次重复。
1.3 调查方法 第75天剪取幼苗叶片及根组织,测定叶片叶绿素含量、根部过氧化物酶(POD)活性、丙二醛(MDA)含量以及根系菌根侵染率,并对各处理植株株高、根长、地上部分鲜重和地下部分鲜重等生长指标进行测定。叶绿素含量的测定采用丙酮提取法[17];POD活性的测定采用分光光度法[18];MDA含量的测定采用分光光度法[19]。取30个根段采用酸性品红染色镜检,通过根段侵染率加权法计算菌根侵染率[20]。
侵染率(%)=∑(0%×相应根段数+10%×相应根段数+20%×相应根段数+···+100%×相应根段数)/总根段数
1.4 数据处理 试验数据采用SPSS 17.0软件进行分析,采用Duncan’s法进行多重比较。
2 结果与分析
2.1 AMF真菌-芦苇共生体系的构建及阿特拉津胁迫下菌剂侵染情况 侵染率是评价植物-菌根真菌共生体系成功与否的直接指标。阿特拉津是一种具有生物毒性的有机污染物,不仅对植物具有毒害作用,同时会威胁土壤微生物的生长。为考察阿特拉津胁迫下菌根共生体的稳定性,对不同浓度阿特拉津胁迫下菌剂侵染情况进行了定量比较分析(图1)。
自然条件下,AMF对芦苇的侵染率较低[21]。施加AMF菌剂,可以显著提高其侵染率,使AMF与芦苇根部形成良好的共生关系。不同浓度阿特拉津胁迫条件下,接菌处理均能够形成AMF-芦苇共生体系,侵染率最高达20.11%。施加不同浓度的阿特拉津会对侵染效果产生一定的影响,随着阿特拉津浓度的增加,菌根侵染率逐渐下降,但均保持在17%以上,可以证实AMF-芦苇共生体系在受到污染物毒害时具有一定的抗性。
2.2 阿特拉津胁迫下AMF对芦苇生长的影响 植物接种
菌根真菌后,最直观的效应就是能促进植株的生长,已有研究结果表明接种AMF对植物的生长均有不同程度的促进作用[22-23]。由表1和表2可以看出,接种AMF可以明显促进芦苇的生长,包括株高的生长和根的延伸,并增加植物各部位的生物量。阿特拉津各浓度下,菌根组植物的株高和根长分别较对照组提高了27.88%和45.50%,地下生物量和地上生物量分别增加了192.00%和221.00%。当阿特拉津浓度增加时,接菌处理与不接菌处理之间的差距呈现先减小后增大的趋势,说明当阿特拉津浓度较低时,菌根对芦苇的保护作用会随着环境胁迫的加剧而变得愈发明显;当阿特拉津浓度超过1.0 mg/L时,由于环境胁迫作用超过共生体系的承受范围,菌根的保护作用会因受到阿特拉津的毒害而损伤。阿特拉津同一浓度下,接菌处理的植株(+AM)的根冠比均比不接菌处理的植株(-AM)高。接种AMF提高了芦苇生长量,可能是菌根的形成扩大了芦苇根系在土壤中的吸收范围,从而使芦苇能够吸收更多的养分以供生长。
此外,各组处理中,接种AMF的植株重量根冠比均高于未接菌的对照。根冠比是描述植物生长状态的重要参数,当环境适宜时,根系吸收能力大于地上部分的消耗能力,植物就会加强地上部分的生长,根冠比就会降低;当植物受到污染胁迫作用,地上部分的蒸腾作用大于根系的吸收作用,地上部分的生长会受到限制,根系部分就会加强生长,根冠比就会增大。通常来讲,根冠比较低的植物往往叶片较小、茎秆较细、抗逆性较差,根冠比较高的植物,往往抗逆性更强。该试验中,+AM组根冠比始终高于-AM组,说明接菌使芦苇倾向于投资地下根系的扩展,有利于土壤营养和水分的吸收。随着浓度增加,根冠比数值降低,表明阿特拉津对根系的毒害作用是更直接的,较对地上器官的生长抑制更明显。
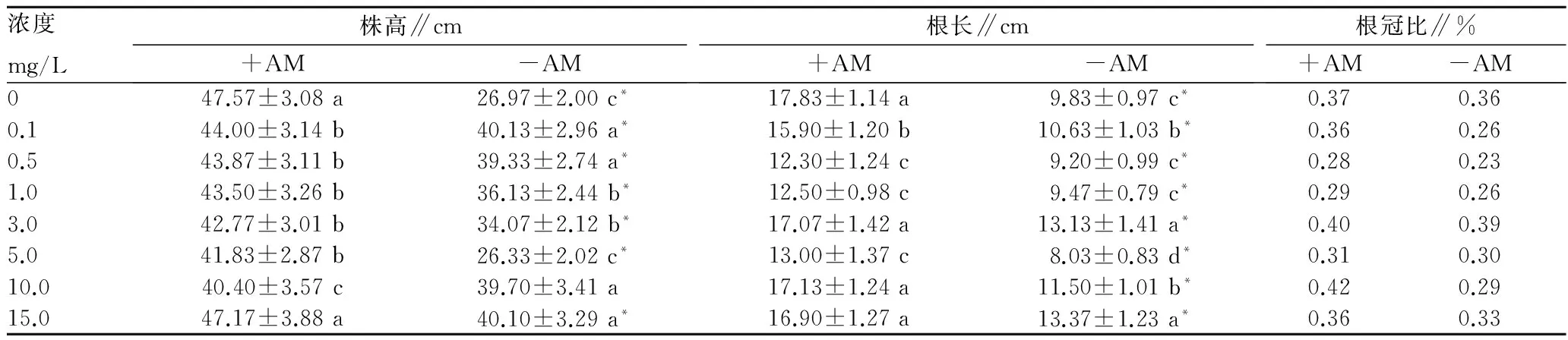
表1 不同浓度阿特拉津胁迫下接种AMF对芦苇空间扩展生长指标的影响
注:同列数据后不同小写字母表示不同浓度处理间差异显著;“*”表示与+AM相比差异显著。

表2 不同浓度阿特拉津胁迫下接种AMF对芦苇物质积累生长指标的影响
注:同列数据后不同小写字母表示不同浓度处理间差异显著;“*”表示与+AM相比差异显著。
2.3 阿特拉津胁迫下芦苇的生理响应
2.3.1 叶绿素含量的响应。植物依靠光合作用合成有机物质获得能量从而促进植株的生长发育。光合作用的主要色素是叶绿素,它是叶片进行光合作用时捕获光能的重要物质,其含量的高低反映了植株光合能力的大小。由图2可知,阿特拉津同一浓度下,施加AMF的芦苇叶片中叶绿素a、叶绿素b含量均高于未施加菌剂(-AM)组芦苇叶片,随着阿特拉津浓度的增加,芦苇叶片中的叶绿素a、叶绿素b含量整体呈现逐渐下降的趋势。
随着阿特拉津浓度的增加,总叶绿素含量呈现先快速下降后平缓再下降的趋势,表明在阿特拉津浓度较低时,植物对阿特拉津有一定的耐受性。施加AMF的芦苇其叶绿素含量下降幅度低于对照组(-AM),说明共生体系可以提高植物对药物毒害的抗性。阿特拉津同一浓度下,+AM组芦苇叶片中总叶绿素含量比-AM组高出55.60%,表明AMF可以促进芦苇叶片中叶绿体的形成和叶绿素合成速率的提高,进而提高菌根植株的光合能力,为植物的生长发育提供更多的碳水化合物,从而对植物的生长产生显著的促进作用。阿特拉津作为一种广谱性除草剂,主要通过抑制杂草的光合作用而导致其死亡,在芦苇上接种AMF可以缓解该种毒害作用达326%,增强了阿特拉津胁迫下芦苇的抗逆性。
2.3.2 抗逆生理指标的响应。阿特拉津浓度过大时,将对植物产生生长胁迫作用,激发植物体内与抗逆性相关的酶,测定与抗氧化相关的酶的活性可以反映植物的抗逆性和生长状况。植株抗逆性与防御系统活性密切相关,POD是植物在逆境条件下酶促防御系统的关键酶之一,其与超氧化物歧化酶(SOD)、过氧化氢酶(CAT)相互协调配合,清除过剩的自由基,使植物体内的自由基维持在一个较低的正常动态水平,控制细胞膜脂过氧化水平,减轻膜伤害,保证植物正常生理代谢[24-25]。植物体内POD活性与光合作用、呼吸作用等都有密切关系,是植物适应能力强弱的生理表征指数之一。大量研究表明POD活性与植物的抗逆性具有正相关关系[26]。由图3可知,当阿特拉津浓度为0时,芦苇根部POD活性很低;随着阿特拉津浓度的增加,植株根部POD活性呈现先增加后减少的趋势,在浓度为3.0 mg/L时达到最高,之后随着毒害作用超出植物承受限度,POD活性逐渐降低。阿特拉津同一浓度下,接种AMF的芦苇根部POD活性明显高于不接菌对照组,说明接种AMF能有效缓解外界污染胁迫对植物带来的伤害,提高植株的抗逆性。
植物在逆境条件下会产生大量的活性氧,活性氧很容易使植物细胞内膜发生过氧化作用或脱脂作用,而MDA则是细胞内膜脂过氧化或脱脂的产物,会严重地损伤细胞的生物膜,降低膜中不饱和脂肪酸的含量,使膜的流动性降低[27]。因此,生理学上通常利用MDA作为植物对逆境条件反应强弱的标志,一般来讲,抗性越强的植物其MDA含量越低。由图4可知,随着阿特拉津浓度的增加,MDA含量呈现先增加后降低的趋势,在低浓度胁迫下,植物表现出积极的抗逆响应,在阿特拉津浓度为0.5 mg/L时MDA含量最高,表明植物在该条件下呈现出最明显的抗逆以及应激反应,浓度为0.5~3.0 mg/L时植物呈现出损伤生理表征,浓度超过3.0 mg/L时植物受损过度出现死亡。阿特拉津同一浓度下,接种AMF的芦苇根部MDA含量比空白对照组平均低47.49%,其中阿特拉津浓度为0.5 mg/L时+AM组的MDA含量比-AM组低35.00%,说明接种AMF后植物的抗逆性明显增强,表明AMF可以在阿特拉津胁迫下增强芦苇的抗逆性,为利用AMF进行湿地生态系统的保护与污染湿地生态系统的重建提供了理论依据。
3 结论
丛枝菌根真菌与芦苇可以构建稳定的共生体系,在环境条件适宜时,其侵染率可达20%以上。当该共生体系受到阿特拉津污染胁迫时,侵染率有所下降,但仍可以保持较高的侵染率(17%以上),说明该共生体系一旦形成,是相对稳定的,在污染条件下具有一定的抗逆性。
在芦苇根部施加丛枝菌根真菌可以有效促进植株的生长,在受到污染胁迫时,共生体系可以通过增加地下根系的生长、扩大植物有效吸收面积来抵抗逆境对其的影响。
在共生体系受到阿特拉津胁迫时,通常首先表现出对逆境的应激反应,当污染超过该体系的抗逆承受能力时,植株会出现死亡的现象。不接菌时植物可在0~0.5 mg/L的阈值范围内进行有效的生理调节,接种丛枝菌根真菌时,植物可在0~3.0 mg/L阈值范围内进行生理调节,植株的抗逆生理指标通常在阿特拉津浓度为0.5~3.0 mg/L时达到最高,表示低于该浓度的阿特拉津存在时,共生体系可以有效发挥作用提高植物的抗逆性,超出该范围时,共生体系便无法承受,会导致植株受损甚至死亡,为农业生产中阿特拉津的安全施加量提供了依据。
[2] 贺学礼,刘媞,赵丽莉.接种丛枝菌根对不同施氮水平下黄芪生理特性和营养成分的影响[J].应用生态学报,2009,20(9):2118-2122.
[3] 吴强盛,邹英宁,夏仁学.水分胁迫下丛枝菌根真菌对红橘叶片活性氧代谢的影响[J].应用生态学报,2007(4):825-830.
[4] 贺忠群,贺超兴,任志雨,等.不同丛枝菌根真菌对番茄酶活性及光合作用的影响[J].北方园艺,2008(6):21-24.
[5] SMITH S E,READ D J.Mycorrhizal symbiosis[M].London:Academic Press,1997.
[6] AUGÉ R M.Water relations,drought and vesicular-arbuscularmycorrhizalsymbiosis[J].Mycorrhiza,2001,11:3-42.
[7] 宋会兴,彭远英,钟章成.干旱生境中接种丛枝菌根真菌对三叶鬼针草(BidenspilosaL.)光合特征的影响[J].生态学报,2008(8):3744-3751.
[8] ZHU X C,SONG F B,XU H W.Arbuscularmycorrhizae improves low tem-
perature stress in maize via alterations in host water status and photosynthesis[J].Plant and Soil,2010,331(1):129-137.
[9] 李思龙,张玉刚,陈丹明,等.丛枝菌根对高温胁迫下牡丹生理生化的影响[J].中国农学通报,2009,25(7):154-157.
[10] 贺忠群,贺超兴,张志斌,等.丛枝菌根真菌对番茄渗透调节物质含量的影响[J].园艺学报,2007,34(1):147-152.
[11] 张旭红,高艳玲,林爱军,等.重金属污染土壤接种丛枝菌根真菌对蚕豆毒性的影响[J].环境工程学报,2008,2(2):274-278.
[12] ANDERSEN C P,SUCOFF E I,DIXON R K.The influence of low soil temperature on the growth of vesicular-arbuscular mycorrhizalFraxinuspennsylvanica[J].Canadian Journal of Forest Research,1987,17(8):951-956.
[13] VOLKMAR K M,WOODBURY W.Effects of soil temperature and depth on colonization and root and shoot growth of barley inoculated with vesicular-arbuscularmycorrhizae indigenous to Canadian prairie soil[J].Canadian Journal of Botany,1989,67(6):1702-1707.
[14] 申鸿,陈保东,冯固,等.锌污染土壤接种丛枝菌根真菌对玉米苗期生长的影响[J].农业环境科学学报,2002,21(5):399-402.
[15] HAYMAN D S,TAVARES M.Plant growth responses to vesicular-arbuscular mycorrhiza[J].New Phytologist,1971,70(1):19-27.
[16] HETRICK B A,BLOOM J.The influence of temperature on colonization of winter wheat by vesicular-arbuscular mycorrhizal fungi[J].Mycologia,1984,76(5):953-956.
[17] 苏正淑,张宪政.几种测定植物叶绿素含量的方法比较[J].植物生理学报,1989(5):77-78.
[18] 陈育红.大豆种皮过氧化物酶活力的测定方法[J].农产品加工·创新版,2013(3):64-65.
[19] 郑世英,商学芳,王景平.可见分光光度法测定盐胁迫下玉米幼苗抗氧化酶活性及丙二醛含量[J].生物技术通报,2010(7):106-109.
[20] 盛萍萍,刘润进,李敏.丛枝菌根观察与侵染率测定方法的比较[J].菌物学报,2011,30(4):519-525.
[21] MA F,WU J,WANG L,et al.Characterization of the microbial community in the rhizosphere ofPhragmitesaustralis(cav.) trin ex.steudel growing in the Sun Island Wetland[J].Water Environment Research,2014,86(3):258-268.
[22] 王倡宪,秦岭,冯固,等.三种丛枝菌根真菌对黄瓜幼苗生长的影响[J].农业环境科学学报,2003,22(3):301-303.
[23] 贺忠群,贺超兴,张志斌,等.不同丛枝菌根真菌对番茄生长及相关生理因素的影响[J].沈阳农业大学学报,2006,37(3):308-312.
[24] LI X,YAN X,YU T.Effects of water stress on protective enzyme activities and lipid peroxidation inPhellodendronamurenseseedlings[J].Chinese Journal of Applied Ecology,2005,16:2353-2356.
[25] HE X L,ZHAO L L,LI Y P.Effects of AM fungi on the growth and protective enzymes of cotton under NaCl stress[J].Acta Ecologica Sinica,2005,25(1):188-193.
[26] JOSEPH L M,KOON T T,MAN W S.Antifungal effects of hydrogen peroxide and peroxidase on spore germination and mycelial growth ofPseudocercosporaspecies[J].Candian Journal of botany,1998,76:2119-2124.
[27] 张宪政.作物生理研究法[M].北京:农业出版社,1992.
Effects of Arbuscular Mycorrhizal Fungi on Growth and Physiology of Reeds under the Stress of Atrazine
CAO Ming-zhu,WANG Li,MA Fang et al
(State Key Laboratory of Urban Water Resource and Environment,Harbin Institute of Technology,Harbin,Heilongjiang 150090)
[Objective] The aim was to quantitatively observe the protection of arbuscular mycorrhizal fungi (AMF) to aquatic vegetation under pesticide stress.[Method] Using reeds as experimental material,effects of AMF on growth and physiology of reeds under different concentrations of atrazine were studied.[Result] The AMF and reeds could establish a stable symbiotic relationship,and the growth index and shoot ratio of inoculating AMF were higher than non-inoculating ones.Chlorophyll content in leaves and POD content of AMF groups were higher than control,while MDA content was obviously lower than control.AMF inoculation could alleviate atrazine reed growth and physiological stress in a certain extent,it could relieve stress on growth more than 100%,while relieving physiological stress such as chlorophyll content was over 326%.[Conclusion] The results provide reference for protection and repair of wetland vegetation.
Glumosmosseae; Reed; Atrazine; Growth index; Physiology index
国家自然科学基金项目(51179041);水体污染控制与治理科技重大专项(2012ZX07201003)。
曹明竹(1990- ),女,黑龙江哈尔滨人,硕士研究生,研究方向:生态学。
2015-04-20
S 432.4+4
A
0517-6611(2015)17-138-04
