钙-铀-碳酸络合物对红土吸附铀性能的影响
2015-03-30张志宾陈金和马慧杰曹小红刘云海东华理工大学核资源与环境省部共建国家重点实验室培育基地江西南昌33003江西农业工程职业学院江西樟树3300
刘 军,张志宾,陈金和,马慧杰,曹小红,刘云海(.东华理工大学核资源与环境省部共建国家重点实验室培育基地,江西南昌 33003;.江西农业工程职业学院,江西樟树 3300)
钙-铀-碳酸络合物对红土吸附铀性能的影响
刘 军1,张志宾1,陈金和2,马慧杰1,曹小红1,刘云海1
(1.东华理工大学核资源与环境省部共建国家重点实验室培育基地,江西南昌 330013;2.江西农业工程职业学院,江西樟树 331200)
摘要:采用静态实验法研究了钙-铀-碳酸络合物对红土吸附铀性能的影响。结果表明:溶液的pH值、总碳酸和钙离子浓度增大会抑制红土对铀的吸附,当pH=7.0,红土投加量为1g/L,钙离子、总碳酸根和初始铀浓度分别为0.4mmol/L、3.8mmol/L和50mg/L时,红土对铀的最大吸附容量约为4.20mg/g。铀在红土上的吸附形态为和利用铀-碳酸络合物总量c(UCO3)T可预测红土吸附铀的容量qe,c(U-CO3)T与qe呈非线性关系,其方程为该研究成果可为铀污染土壤的修复和治理提供技术和理论参考。
关键词:钙-铀-碳酸络合物;红土;铀;吸附容量;吸附形态
(20141BBG70001);江西省青年科学家培养对象计划资助项目(20122BCB23023);江西省优势科技创新团队计划资助项目(20142BCB24006)
铀作为铀矿开采和水冶设施运行中的主要放射性元素,会随着水等介质在岩土中迁移[1-2],对地下水及周边环境造成放射性污染。铀同位素的半衰期较长(234U,t1/2=2.48× 105a;235U,t1/2=7.13×108a;238U,t1/2=4.51× 109a),具有相当的生物/化学毒性[3],当人体中铀含量超过0.1mg/kg时,会对肾脏等器官造成化学损伤[4]。铀尾矿库的放射性核素在环境中横向迁移会污染周围土壤[5],所以,研究铀和土壤的相互作用,有利于掌握放射性核素在土壤中的迁移情况,为铀尾矿的管理及周边放射性污染的环境评估提供参考。
铀在土壤中的迁移速度受土壤成分/类型、环境pH值和铀离子形态影响[3,6-8]。pH<7的天然水体可溶解约100~1 000μmol/L碳酸盐类物质;pH>7时,pH值每增大1,水体中碳酸盐类物质浓度将扩大10倍[9]。因钙大量存在于水体中,使U(Ⅵ)在土壤孔隙水中的迁移形态以和Ca2UO2(CO3)3(aq)为主[10-11]。
红土主要分布在我国亚热带地区,是地带性土壤的代表,剖面呈红色或棕色[12],所含主要黏土矿物为高岭石[13],高岭石属页硅酸盐类黏土矿物,其固体表面存在不同化学成分的表面位点:Al/Si氧化物,锕系元素在≡AlOH表面结合较≡SiOH更牢固,因此红土对铀的吸附主要依靠铝氧化物位点[14-15]。
江西省红土面积为1 053.14万公顷(约1.05×107m2),占全省土壤总面积的70.69%[12],该地区分布有大量铀矿,是我国铀矿的主产区。本文通过研究钙-铀-碳酸络合物对红土吸附铀的影响,掌握铀在红土环境中的赋存状态,为修复铀污染土壤提供理论基础和科学依据。
1 实验
1.1 试剂与材料
乙酸(CH3COOH)、无水乙酸钠(CH3COONa)、碳酸氢钠(NaHCO3)、偶氮胂Ⅲ(C22H18As2N4O14S2)、2-4-二硝基酚(C6H4N2O5)均为分析纯,国药集团化学试剂有限公司。
铀标准溶液配制:用化学纯U3O8配制浓度为10g/L的铀标准溶液,不同浓度的铀溶液经稀释铀标准溶液获得。
1mol/L乙酸钠溶液配制:称取82.03g
无水乙酸钠定容到1 L的容量瓶中,用CH3COOH调节pH值为5。
红土预处理:主要目的是除去红土中碳酸
盐类物质,红土采自江西省中部地区。先将红土中的杂质去除,并过10目筛,称取10.0g加入到250mL 1mol/L的乙酸钠溶液中,振荡反应3d,更换新鲜乙酸钠溶液后再振荡3d,然后用去离子水洗涤红土3次后转移到透析袋中,将透析袋于1mmol/L的NaHCO3溶液中放置4h,再将透析袋于去离子水中放置1周,最
后自然风干,备用[10]。
1.2 仪器与设备
721E可见分光光度计,上海光谱仪器有限
公司;SHZ-82A型恒温振荡器,常州国华电器有限公司;pHS-3C型酸度计,上海仪电科学仪器股份有限公司;BSA224S电子天平,赛多利斯科学仪器(北京)有限公司;JS94H型微电泳仪,上海中晨数字技术设备有限公司;TG16-WS台式高速离心机,湘南湘仪实验室仪器开发有限公司。
1.3 吸附实验
准确称取0.100g预处理后的红土置于100mL一定浓度的铀溶液中,用0.5mol/L的HCl或NaOH调节pH值,恒温水浴振荡一段时间后离心,取上层清液,以偶氮胂Ⅲ为显色剂,使用分光光度计于650nm处测定溶液中铀的浓度。红土对铀的吸附容量qe由式(1)计算:

式中:qe为红土对铀的平衡吸附容量,mg/g;c0为溶液初始铀浓度,mg/L;ce为吸附平衡时溶液中铀的浓度,mg/L;V为溶液体积,L;m为吸附剂质量,g。
2 结果与讨论
2.1 pH值对铀吸附容量的影响
钙离子和总碳酸离子浓度分别为1mmol/L 和3.8mmol/L,铀初始浓度分别为10、20、30、40、50mg/L时,pH值对铀吸附容量的影响如图1所示。由图1可见,随着铀初始浓度的增大,红土对铀的吸附容量增加,铀初始浓度为50mg/L,pH值从5.0增大到5.5时,铀的吸附容量达最大值约17mg/g,继续增大pH值,铀吸附容量逐渐下降。利用中和沉淀法处理的铀矿山废水一般为中性或碱性[16-17],导致退役尾矿附近的红土孔隙水接近于中性,因此,本实验选用pH值为7.0。由图可见,pH=7.0、铀初始浓度为50mg/L时,铀的最大吸附容量约为2.51mg/g。

图1 不同铀初始浓度下pH值对吸附容量的影响Fig.1 Effect of pH on uranium adsorption capacity under different uranium initial concentrations
使用Visual Minteq软件模拟铀初始浓度0.2mmol/L、钙离子浓度1mmol/L、总碳酸浓度3.8mmol/L时,不同pH值下铀的形态分布,结果如图2所示。由图2可见,pH值大于3时,开始形成铀-碳酸络合物UO2CO3(aq);pH值大于5时,开始形成钙-铀-碳酸络合物CaUO2(CO3)2-3和Ca2UO2(CO3)3(aq);pH值大于7.0时,溶液中铀的形态基本上为钙-铀-碳酸络合物。
Fox等[1]认为钙-铀-碳酸络合物不会被水铁矿和石英吸附的原因在于和Ca2UO2(CO3)3(aq)中的钙原子已与碳酸根离子中的氧原子键合,钙-铀-碳酸络合物难以通过钙原子吸附到水铁矿和石英的表面。Stewart[10]等的研究表明,钙离子无法将吸附在天然沉积物表面的铀置换下来,进而证明钙或含钙络合物不参与沉积物表面位点的竞争吸附。因此,吸附在沉积物表面位点的铀络合形态为和UO2CO3(aq),具体反应如式(2)、(3)和(4)[9]所示。
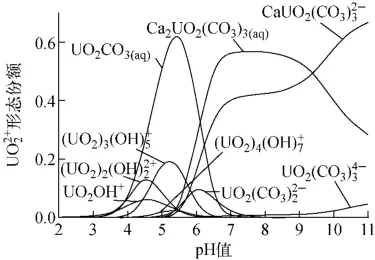
图2 在不同pH值时的形态分布Fig.2speciation distribution at different pH values
结合图1、2,pH=5.5时对铀的吸附容量最大,此时溶液中的铀-碳酸络合物含量最高,随着pH值的升高,溶液中总碳酸含量增加,有利于形成钙-铀-碳酸络合物,可被吸附的铀-碳酸络合物的含量减小,导致铀的吸附容量下降。
2.2 接触时间对铀吸附容量的影响
钙离子和总碳酸离子浓度分别为0.4mmol/L 和3.8mmol/L、铀初始浓度为50mg/L、pH=7.0时,接触时间对铀吸附容量的影响如图3所示。吸附初始阶段,由于红土表面传质阻力较小[18],红土对铀的吸附速度很快,随着接触时间的延长,吸附速度变缓,并于120min时达到饱和[19]。
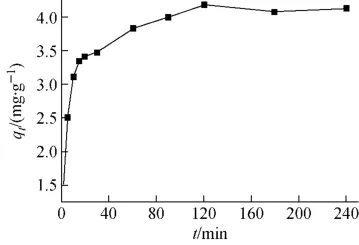
图3 接触时间对铀吸附容量的影响Fig.3 Effect of time on uranium adsorption capacity
采用准二级动力学模型分析红土吸附铀的动力学曲线,结果如图4所示。由图4可见,其准二级动力学拟合方程的线性相关系数达0.999,表明红土吸附铀的动力学模型符合准二级动力学模型,拟合得到平衡时的最大吸附容量qe,cal为4.20 mg/g,与实验值4.16 mg/g接近。

图4 红土吸附铀的准二级动力学拟合曲线Fig.4 Pseudo-second-order kinetic fitting curvefor adsorption of U(Ⅵ)on red soil
2.3 zeta电位测定
由式(2)、(3)可知,形成表面络合物会改变吸附剂表面电荷的大小。红土在不同溶液中的zeta电位如图5所示。吸附剂表面电荷由零电荷点PZC决定,其定义为吸附剂表面正负电荷量相等时对应的pH(pHPZC)值,溶液pH值小于pHPZC值时,吸附剂表面带正电,反之则带负电[20]。铀、钙离子和总碳酸浓度均为0mmol/L,红土的pHPZC值约为3.91,铀浓度为50mg/L,钙离子和总碳酸浓度分别为0mmol/L时,pHPZC值升高到4.33,zeta电位增大说明铀主要以阳离子形式被吸附。溶液中铀、钙离子和总碳酸浓度
分别为50mg/L、1mmol/L和3.8mmol/L时,pHPZC值下降到3.84,说明铀主要以阴离子形式被吸附[9]。由于实验选用的pH值为7.0,大于pHPZC值,此时吸附剂表面所带电荷为负,且溶液中含铀、钙离子、碳酸根离子,同时结合式(2)、(3)可进一步证明吸附在红土表面位点的铀络合形态为和UO2CO3(aq)。
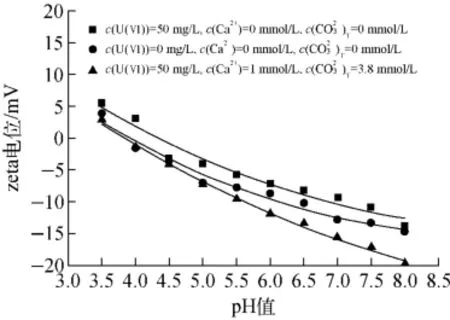
图5 不同pH值下的zeta电位Fig.5 zeta potential of red soil at different pH values
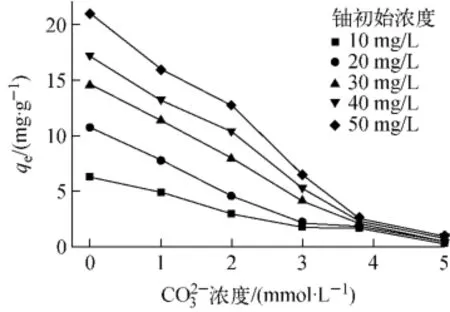
图6 碳酸根离子浓度对铀吸附容量的影响Fig.6 Effect ofconcentration on uranium adsorption capacity
2.4 碳酸根离子浓度对红土吸附铀性能的影响
水体中溶解的碳酸盐类物质的浓度在pH值为中性条件下可达约1mmol/L[9],碱性系统易于捕获二氧化碳[21],造成中性或碱性土壤孔隙水溶解的碳酸盐类物质增加。钙离子浓度为1mmol/L、铀初始浓度为10~50mg/L时,碳酸根离子浓度从0mmol/L增加到5mmol/L对红土吸附铀性能的影响如图6所示。由图6可见,铀初始浓度为50mg/L时,红土对铀的吸附量从20.99mg/g下降到0.95mg/g。
溶液pH值为7、铀初始浓度为0.2mmol/L、钙离子浓度为0.4mmol/L时,不同碳酸根离子浓度下的形态分布如图7所示。由图7可见,当总碳酸根离子浓度超过3.8mmol/L时,溶液中铀的形态基本为钙-铀-碳酸络合物。

图7 在不同碳酸根离子浓度时的形态分布Fig.7speciation distribution as a function ofconcentration
首先,随着总碳酸含量的增加,可被吸附的铀-碳酸络合物的含量减小,导致铀的吸附容量下降;其次,参与了红土表面位点的竞争吸附,具体反应如式(5)、(6)[9]所示:
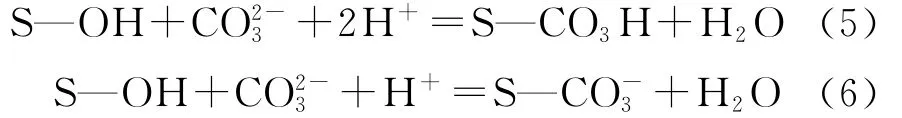
2.5 钙离子浓度对红土吸附铀性能的影响
南方红土钙含量约为1%(即每克南方红土钙含量约为0.25mmol),中和沉淀法处理铀矿山废水时常用生石灰(CaO)、石灰乳(Ca(OH)2)作中和剂[16],造成尾矿附近土壤孔隙水钙含量增加。实验选择钙离子浓度为0~1mmol/L。钙离子浓度对吸附容量的影响如图8所示。由图8可见,当总碳酸浓度为3.8mmol/L、铀初始浓度为50mg/L时,钙离子浓度从0mmol/L增加到1mmol/L,红土对铀的吸附容量从9.57mg/g下降到2.51mg/g。
溶液pH值为7、铀初始浓度为0.2mmol/L、总碳酸浓度为3.8mmol/L时,不同钙离子浓度下铀的形态分布如图9所示。由图9可见,钙离子浓度超过0.4mmol/L时,溶液中铀的
形态基本上为钙-铀-碳酸络合物。
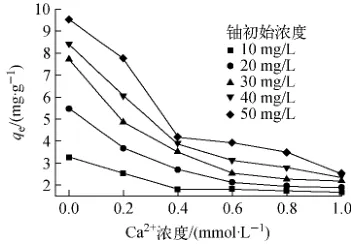
图8 钙离子浓度对铀吸附容量的影响Fig.8 Effect of Ca2+concentration on uranium adsorption capacity
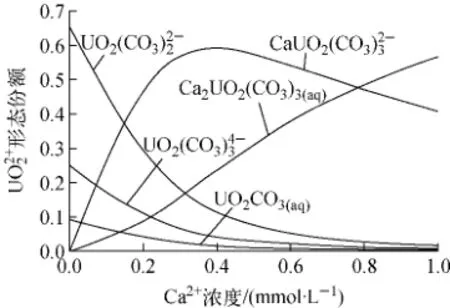
图9 在不同钙离子浓度下的形态分布Fig.9speciation distribution under different Ca ion concentrations
钙离子和红土表面位点竞争铀-碳酸络合物,导致铀的吸附容量下降。对比2.4节和2.5节红土对铀的吸附容量下降值可知,碳酸对红土吸附铀的抑制效果更明显。
2.6 利用铀-碳酸络合物总量预测红土对铀的吸附容量
能利用铀-碳酸络合物总量c(U-CO3)T预测铀吸附容量的原因在于钙-铀-碳酸络合物不参与吸附位点的竞争[10]。结合表1中各络合反应式及lg K值(数据源于Visual Minteq),可得到铀-碳酸络合物的电离方程式:
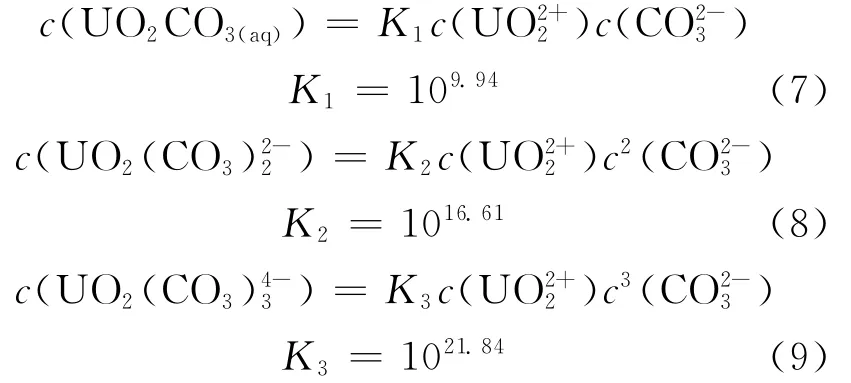

表1 各络合物的反应方程以及相关参数Table 1 Reaction equations and parameters
铀-碳酸络合物总量为:
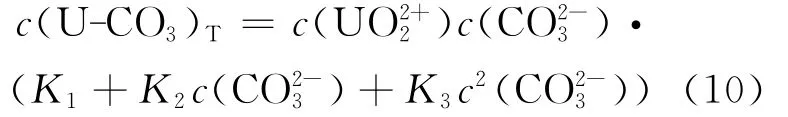
利用Visual Minteq提供的铀-碳酸络合物浓度值,得到c(U-CO3)T和qe的关系,结果如图10所示。由图10可见,总碳酸浓度为3.8mmol/L时,c(U-CO3)T与qe的关系式为:
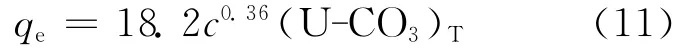

图10 c(U-CO3)T和qe的关系Fig.10 Relationship of c(U-CO3)Tand qe
将式(10)代入式(11),可得:
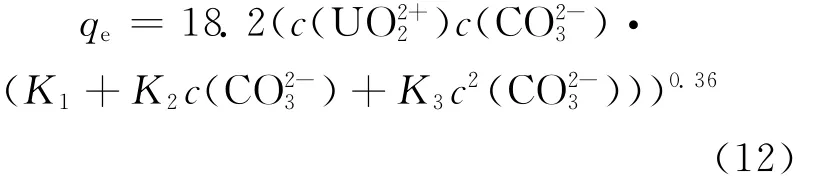
拟合度R2=0.835 8。
红土孔隙水的pH值接近中性或碱性条件下,利用式(12)可预测红土对铀的理论吸附容量。式(10)同时进一步证明,铀吸附容量随铀-碳酸络合物总量的降低而降低,与本文实验结果一致。
3 结论
1)pH值、总碳酸和钙离子浓度的增加会抑制红土吸附铀。pH值为7.0,红土投加量为1g/L,钙离子、总碳酸根和初始铀的浓度分别为0.4mmol/L、3.8mmol/L和50mg/L时,红土对铀的最大吸附容量约4.20mg/g。铀在红土上的吸附形态为和 UO2CO3(aq),钙-铀-碳酸络合物的形成会抑制红土对铀的吸附。
2)红土孔隙水的pH值接近中性或碱性时,利用c(U-CO3)T可预测红土对铀的理论吸附容量。铀吸附容量的拟合方程为qe=,根据c(U-CO3)T和qe的非线性关系,进而证实铀-碳酸络合物总量决定了铀的吸附容量。
参考文献:
[1] FOX P M,DAVIS J A,ZACHARA J M.The effect of calcium on aqueous uranium(Ⅵ)speciation and adsorption to ferrihydrite and quartz[J].Geochimica et Cosmochimica Acta,2006,70(6):1 379-1 387.
[2] QAFOKU N P,ZACHARA J M,LIU C,et al.Kinetic desorption and sorption of U(Ⅵ)during reactive transport in a contaminated Hanford sediment[J].Environmental Science &Technology,2005,39(9):3 157-3 165.
[3] LI X,WU J,LIAO J,et al.Adsorption and desorption of uranium(Ⅵ)in aerated zone soil[J].Journal of Environmental Radioactivity,2013,115(1):143-150.
[4] SAXENA S,PRASAD M,D'SOUZA S F.Radionuclide sorption onto low-cost mineral adsorbent [J].Industrial &Engineering Chemistry Research,2006,45(26):9 122-9 128.
[5] 杨巍,杨亚新,曹龙生,等.某铀尾矿库中放射性核素对环境的影响[J].东华理工大学学报:自然科学版,2011,34(2):155-159.YANG Wei,YANG Yaxin,CAO Longsheng,et al.Environmental impact of radionuclides from uranium tailings[J].Journal of East China Insti-
[6] ECHEVARRIA G,SHEPPARD M I,MOREL J L.Effect of pH on the sorption of uranium in soils[J].Journal of Environmental Radioactivity,2001,53(2):257-264.
[7] BEDNAR A J,MEDINA V F,ULMERSCHOLLE D S,et al.Effects of organic matter on the distribution of uranium in soil and plant matrices[J].Chemosphere,2007,70(2):237-247.
[8] TSERENPIL S,MASLOV O D,NOROV N,et al.Chemical and mineralogical composition of the Mongolian rural soils and their uranium sorption behavior[J].Journal of Environmental Radioactivity,2013,118(1):105-112.
[9] WAZNE M,KORFIATIS G P,MENG X.Carbonate effects on hexavalent uranium adsorption by iron oxyhydroxide[J].Environmental Science &Technology,2003,37(16):3 619-3 624.
[10]STEWART B D,MAYES M A,FENDORF S.Impact of uranyl-calcium-carbonato complexes on uranium(Ⅵ)adsorption to synthetic and natural sediments[J].Environmental Science &Technology,2010,44(3):928-934.
[11]DONG W,BALL W P,LIU C,et al.Influence of calcite and dissolved calcium on uranium(Ⅵ)sorption to a Hanford subsurface sediment[J].Environmental Science &Technology,2005,39 (20):7 949-7 955.
[12]魏林根,李建国,刘光荣,等.江西土壤环境质量与绿色食品可持续发展[J].江西农业学报,2008,20(1):159-162.WEI Lingen,LI Jianguo,LIU Guangrong,et al.Soil environmental quality and green food sustainable development in Jiangxi[J].Acta Agriculturae Jiangxi,2008,20(1):159-162(in Chinese).
[13]樊明辉,孙传敏.中国南方红土演化的矿物学特征[J].成都理工学院学报,1999,26(3):313-316.FAN Minghui,SUN Chuanmin.The mineralogical characters of red earth in Southern China[J].Journal of Chengdu University of Technology,1999,26(3):313-316(in Chinese).
[14]TERTRE E,BERGER G,SIMONI E,et al.Europium retention onto clay minerals from 25to 150℃:Experimental measurements,spectroscopic features and sorption modelling[J].Geochimica et Cosmochimica Acta,2006,70 (18):4 563-4 578.
[15]KREPELOVÁ A,BRENDLER V,SACHS S,et al.U(Ⅵ)-kaolinite surface complexation in absence and presence of humic acid studied by TRLFS[J].Environmental Science &Technology,2007,41(17):6 142-6 147.
[16]丁福龙.离子交换-石灰中和法处理本溪铀矿尾矿废水的研究[D].衡阳:南华大学,2011.
[17]邓锦勋,孟健,程威,等.某铀矿尾矿库废水处理工艺研究[J].铀矿冶,2011,30(2):100-103.DENG Jinxun,MENG Jian,CHENG Wei,et al.Waste water treatment technique for a uranium tailings pond[J].Uranium Ming and Metallurgy,2011,30(2):100-103(in Chinese).
[18]LIU Y,CAO X,HUA R,et al.Selective adsorption of uranyl ion on ion-imprinted chitosan/PVA cross-linked hydrogel[J].Hydrometallurgy,2010,104(2):150-155.
[19]熊国宣,黄海清,张志宾.多孔纳米钡铁氧体制备及其吸附铀的性能研究[J].原子能科学技术,2012,46(9):1 041-1 044.XIONG Guoxuan,HUANG Haiqing,ZHANG Zhibin.Preparation of porous nano barium ferrite and its adsorption properties on uranium[J].Atomic Energy Science and Technology,2012,46(9):1 041-1 044(in Chinese).
[20]SÁNCHEZ-GALVÁN G,RAMÍREZ-NU'ÑEZ P A.Cationic dye biosorption by salvinia minima:Equilibrium and kinetics[J].Water,Air,&Soil Pollution,2014,225(7):1-13.
[21]IMHOFF J F,SAHL H G,SOLIMAN G S H,et al.The wadi natrun:Chemical composition and microbial mass developments in alkaline brines of eutrophic desert lakes[J].Geomicrobiology Journal,1979,1(3):219-234.
Effect of Calcium-uranyl-carbonate Complex on Adsorption of Uranium on Red Soil
LIU Jun1,ZHANG Zhi-bin1,CHEN Jin-he2,MA Hui-jie1,CAO Xiao-hong1,LIU Yun-hai1
(1.State Key Laboratory Breeding Base of Nuclear Resources and Environment,East China Institute of Technology,Nanchang330013,China;
2.Jiangxi Agricultural Engineering College,Zhangshu331200,China)
Abstract:The effect of calcium-uranyl-carbonate complex on the adsorption of uranium on red soil was investigated through static adsorption experiment.The results indicate that the increases of pH and concentrations of dissolved carbonate and calcium ion can suppress U(Ⅵ)adsorption on red soil.When pH is 7.0,dosage of red soil is 1g/L and concentrations of calcium ion,dissolved carbonate and uranium are 0.4 mmol/L,3.8mmol/L and 50 mg/L respectively,the maximum adsorption capacity is about 4.20mg/g.The uranium is mainly adsorbed in the forms ofand UO2CO3(aq).The c(U-CO3)Tcan be used to predict uranium adsorption capacity of red soil.The c(U-CO3)Thas a nonlinear relationship with qe,and the equation is qe=book=1360,ebook=22The research results can provide technical or theoretical references for uranium contaminated red soil remediation.
Key words:calcium-uranyl-carbonate complex;red soil;uranium;adsorption capacity;adsorption form
作者简介:刘 军(1990—),男,四川绵阳人,硕士研究生,从事放射性核素吸附分离研究
基金项目:国家自然科学基金资助项目(21301028,21201033,11475044,41461070);江西省科技支撑计划资助项目
收稿日期:2014-04-15;修回日期:2014-09-19
doi:10.7538/yzk.2015.49.08.1359
文章编号:1000-6931(2015)08-1359-07
文献标志码:A
中图分类号:TL941.21;X591;O647.3
