酶法纯化玉米抗性淀粉工艺的研究
2015-03-27杨铭乾黄继红陶宜辰冯军伟苏雪锋李海月
杨铭乾,黄继红,2*,许 茜,陶宜辰,冯军伟,苏雪锋,王 文,李海月
(1.河南工业大学 生物工程学院,河南 郑州 450001;2.河南省食品工业科学研究所有限公司,河南 郑州 450000)
0 前言
抗性淀粉(Resistant Starch,RS),是一种非常重要的功能因子,在20 世纪八九十年代被发现[1],并定义为“健康人的小肠中不能被消化吸收的淀粉及其降解物的总称”[2],具有更优越于膳食纤维的生理功能和特性[3-4],如缓解糖尿病,控制体质量等[5-8].随着人们对抗性淀粉研究的逐渐深入,其特殊的生理功能和营养价值逐渐展现于人们眼前,近年来越来越受到营养界、医学界和食品界的好感和关注.
抗性淀粉RS3 是淀粉经过糊化之后凝沉而来的,现阶段公认的形成机理主要是直链淀粉分子之间回生形成双螺旋结构[9-10].目前抗性淀粉制备方法主要有高温压热法、微波辐射法、酶法(单酶法或双酶法)、酸法、挤压法或多法相结合,但普遍存在抗性淀粉含量偏低的问题.如余飞等[11]研究了普鲁兰酶处理条件对抗性淀粉增抗效应的规律,并用普鲁兰酶处理糊化后的蜡质玉米淀粉,在最优条件下制得的抗性淀粉含量大于10%.刘一洋[12]利用酸酶(普鲁兰酶)法制备大米抗性淀粉,其RS 含量为24.31%;李俊伟[13]利用挤压法制备大米抗性淀粉的含量为8.87%;吴享等[14]利用耐高温α-淀粉酶联合压热-冷却循环处理制备玉米抗性淀粉,其含量为17.94%.作者针对上述抗性淀粉制备中含量低的问题,对本实验室经压热和普鲁兰酶脱支得到的玉米抗性淀粉采用真菌α-淀粉酶进行纯化试验,研究了原抗性淀粉质量分数、酶添加量、酶解时间对纯化效果的影响;并通过响应面设计对其纯化工艺进行了优化,为制备高纯度抗性淀粉提供技术参考.
1 材料与方法
1.1 材料
玉米淀粉:成武大地玉米开发有限公司(含直链淀粉25%);真菌α-淀粉酶(20 000 U/g):山东隆大生物工程有限公司;抗性淀粉测定试剂盒:爱尔兰Megazyme 公司.
1.2 仪器与设备
PHS-3E 雷兹pH 计:上海精密科学仪器有限公司;SHA-C 数显水浴恒温振荡器:金坛华峰仪器有限公司;湘仪TDZ5-WSTDZ5-WS 多管架自动平衡离心机:河南湘仪实验室仪器开发有限公司;GZX-GF-MBS-Ⅰ型电热恒温鼓风干燥机:上海一恒科学仪器有限公司;FA12048 电子天平:上海精密科学仪器有限公司.
1.3 方法
1.3.1 抗性淀粉制备工艺
采用压热法与酶法相结合的方法制备玉米抗性淀粉,即将一定浓度的淀粉悬浮液经过压热而断链糊化之后,再加入普鲁兰酶进行脱支处理,然后经高温作用使直链淀粉最大程度地溶出,4 ℃放置结晶,24 h 之后干燥粉碎即得抗性淀粉,以AOAC Official Method 2002.2 测得所得样品抗性淀粉的含量为30.2%.
1.3.2 抗性淀粉纯化方法
在一定的条件下,用真菌α-淀粉酶对按1.3.1制得的玉米抗性淀粉进行酶解,以提高其抗性淀粉含量,酶解之后进行离心,并洗涤沉淀,置于60℃烘箱中进行干燥、粉碎得抗性淀粉,并对其进行含量测定和提纯率的计算,以综合评价其纯化效果.
1.3.3 单因素试验设计
预试验表明,酶法纯化玉米抗性淀粉过程中,原抗性淀粉乳的质量分数、真菌α-淀粉酶的添加量和酶解时间是影响玉米抗性淀粉纯化程度的主要因素,依次设计单因素和响应面试验进行纯化工艺条件的优化,并确定酶法纯化玉米抗性淀粉的最佳工艺条件.酶解温度和酶解pH 值根据所购买产品的最适条件进行,不需进行优化.
1.3.4 响应面试验设计
根据单因素试验结果,以原抗性淀粉乳的质量分数、真菌α-淀粉酶的添加量和酶解时间3 个因素为影响因素,利用Design-Expert 8.0.6 软件进行响应面试验设计,以获得酶法纯化玉米抗性淀粉的最佳工艺条件,其中各因素及水平见表1.
1.3.5 抗性淀粉含量的检测
依据AOAC Official Method 2002.2 测定.
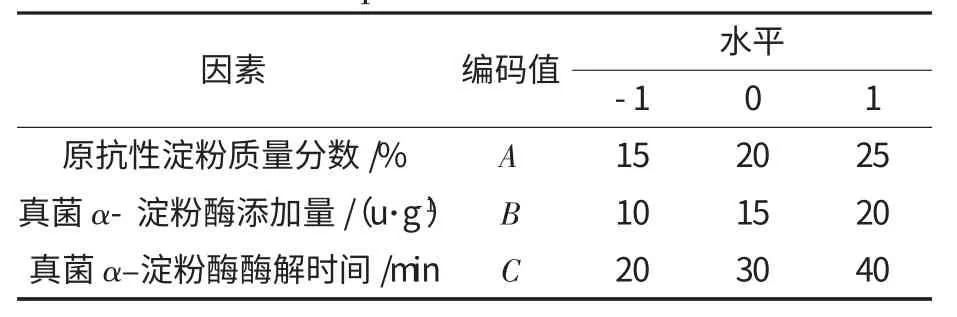
表1 响应面试验因素与水平Table 1 Factors and levels of response surface optimization test
1.3.6 抗性淀粉提纯率的计算

2 结果与分析
2.1 单因素试验
2.1.1 原抗性淀粉乳质量分数对纯化效果的影响
分别配制质量分数为15%、20%、25%、30%的原抗性淀粉乳,添加真菌α-淀粉酶10 u/g,在一定的条件下酶解20 min,酶解完毕之后进行离心洗涤及二次结晶,并于60 ℃下干燥,粉碎得纯化样品,按照AOAC 2002.02 方法测定其抗性淀粉含量,并计算其提纯率,结果如图1 所示,并对其进行单因素方差分析,如表2 所示.
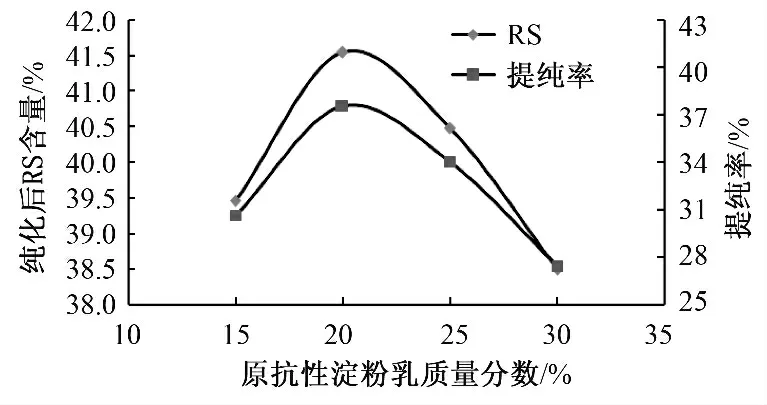
图1 原抗性淀粉乳质量分数对纯化效果的影响Fig.1 Effect of mass fraction of raw resistant starch on purification
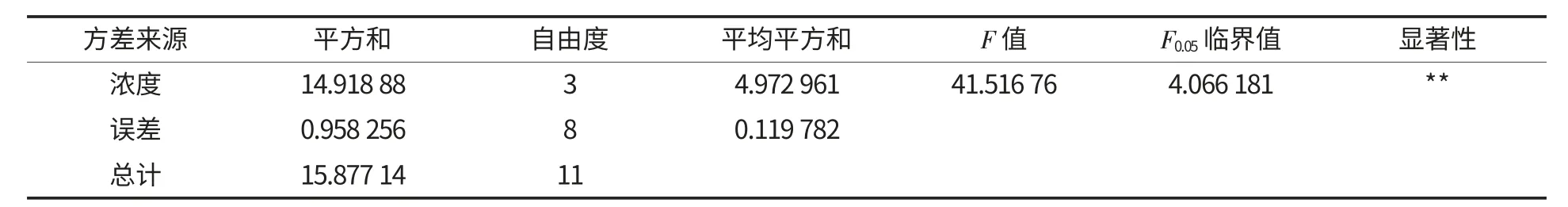
表2 原抗性淀粉乳质量分数的单因素方差分析Table 2 Single-factor ANOVA of raw resistant starch mass fraction
由图1 可知,随着原抗性淀粉乳浓度的增大,纯化后的抗性淀粉的含量呈现先增后减的变化趋势,在原抗性淀粉乳质量分数为20%左右时达到最大值,且在此时提纯率也达到最大值,可知适宜的底物(未转化的淀粉)浓度有利于酶解反应的高效进行,在一定的酶量下,当底物浓度较低时,酶量充足,则酶解作用强;而当底物浓度过高时,可能由于酶量不足或产生底物抑制,反而使得酶解作用逐渐减弱.由表2 可知,F=41.51676>>F0.05,表明该因素对纯化效果影响显著.
2.1.2 淀粉酶的添加量对纯化效果的影响
在其他酶解条件不变的情况下,选取真菌淀粉酶的添加量依次为1、5、10、15、20、25 u/g,进行纯化试验,采用AOAC Official Method 2002.2 法测定纯化后的抗性淀粉的含量,并计算其提纯率,结果如图2 所示,同时对测得的结果进行单因素方差分析,见表3.
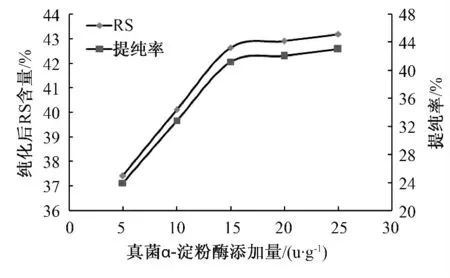
图2 真菌α-淀粉酶添加量对纯化效果的影响Fig.2 Effect of addition amount of fungal α-amylase on purification
由图2 可以看出,酶添加量也是影响抗性淀粉纯化程度的重要因素之一,在添加量小于15 u/g时,随着酶添加量的增大,抗性淀粉含量呈现增大趋势;当其大于15 u/g 时,抗性淀粉含量逐渐趋于恒定,其提纯率也同样如此.由此可知,在底物一定的前提下,当酶量较低时,产物的生成与酶添加量成正相关;当酶过量时,反应完全,产物恒定,因此选择酶添加量为15 u/g 为较佳条件.同时如表3 所示,F=276.660 2>>F0.05,表明酶添加量也显著影响其纯化效果.
2.1.3 酶解时间对纯化效果的影响
在其他酶解条件不变的情况下,改变酶解时间依次为10、20、30、40、50 min,进行纯化试验,采用AOAC Official Method 2002.2 法测定纯化后的抗性淀粉的含量,并计算其提纯率,结果如图3 所示,同时对测得的结果进行单因素方差分析,见表4.

表3 真菌α -淀粉酶添加量单因素方差分析Table 3 Single-factor ANOVA of addition amount of fungal α-amylase
由图3 可以看出,不同的酶解时间得到的酶解效果也有所区别,当酶解时间较短,即小于30 min时,纯化效果随着酶解时间的增长而增大;当酶解时间过长,即大于30 min 时,由于底物量固定,酶解完全,使得其结果逐渐趋于恒定.同时,如表4所示,F=103.839 5>>F0.05,可知酶解时间同样对该抗性淀粉的纯化效果影响显著.
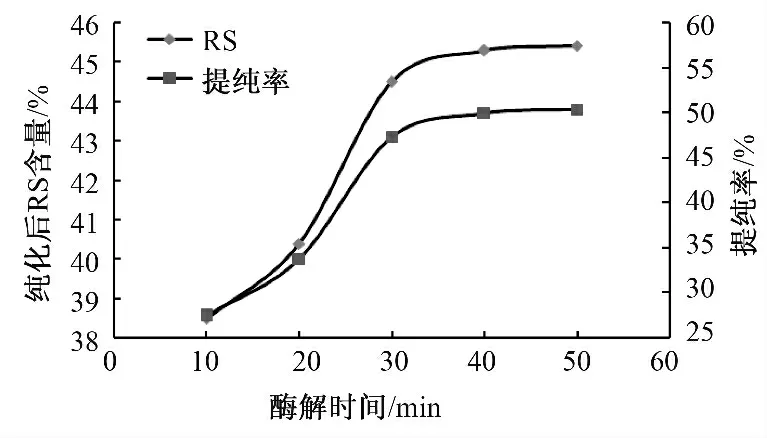
图3 真菌α-淀粉酶酶解时间对纯化效果的影响Fig.3 Effect of enzyme digestion time of fungal αamylase on purification
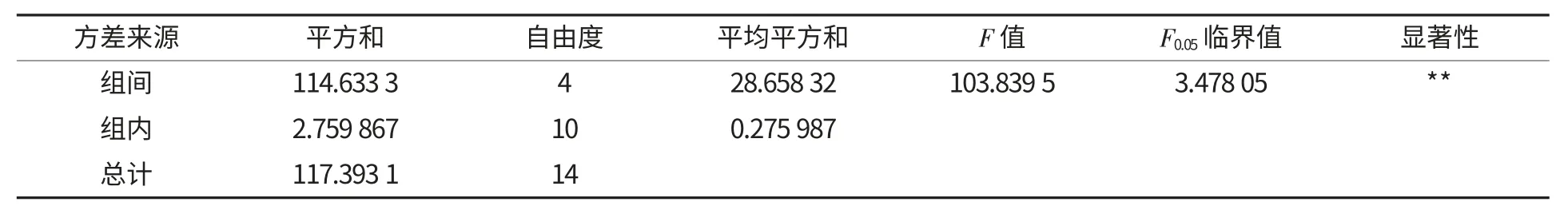
表4 真菌α-淀粉酶酶解时间单因素方差分析Table 4 Single-factor ANOVA of enzyme digestion time of fungal α-amylase
2.2 响应面试验
根据表1 设计3 因素3 水平响应面试验,试验结果见表5.
对表5 进行回归拟合,得到纯化后抗性淀粉含量的回归方程为:
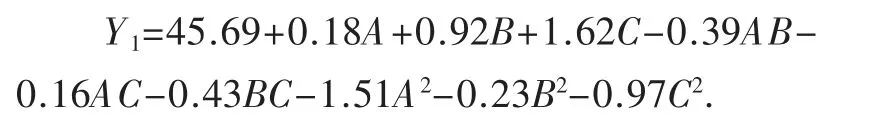
运用Design-Expert 8.0.6 软件对试验结果进行回归方差和显著性分析,其中纯化后抗性淀粉含量的分析如表6 所示.
由表6 可知,本试验所建立的二次多项式模型极为显著(p<0.000 1),失拟项不显著(p=0.337 4>0.005),因此该模型成立;回归方程的决定系数为0.978 1,校正决定系数为0.949 9,说明该模型能解释94.99%的响应值变化,拟合程度良好,可利用此模型进行分析和预测酶法纯化抗性淀粉的工艺优化.其中B、C、A2、C2都极为显著(p<0.01),表明在酶法纯化抗性淀粉工艺中,真菌α-淀粉酶的添加量、酶解时间、原抗性淀粉乳质量分数的二次方和酶解时间的二次方对纯化效果有显著影响.

表5 响应面试验设计与结果Table 5 The design and results of response surface optimization test
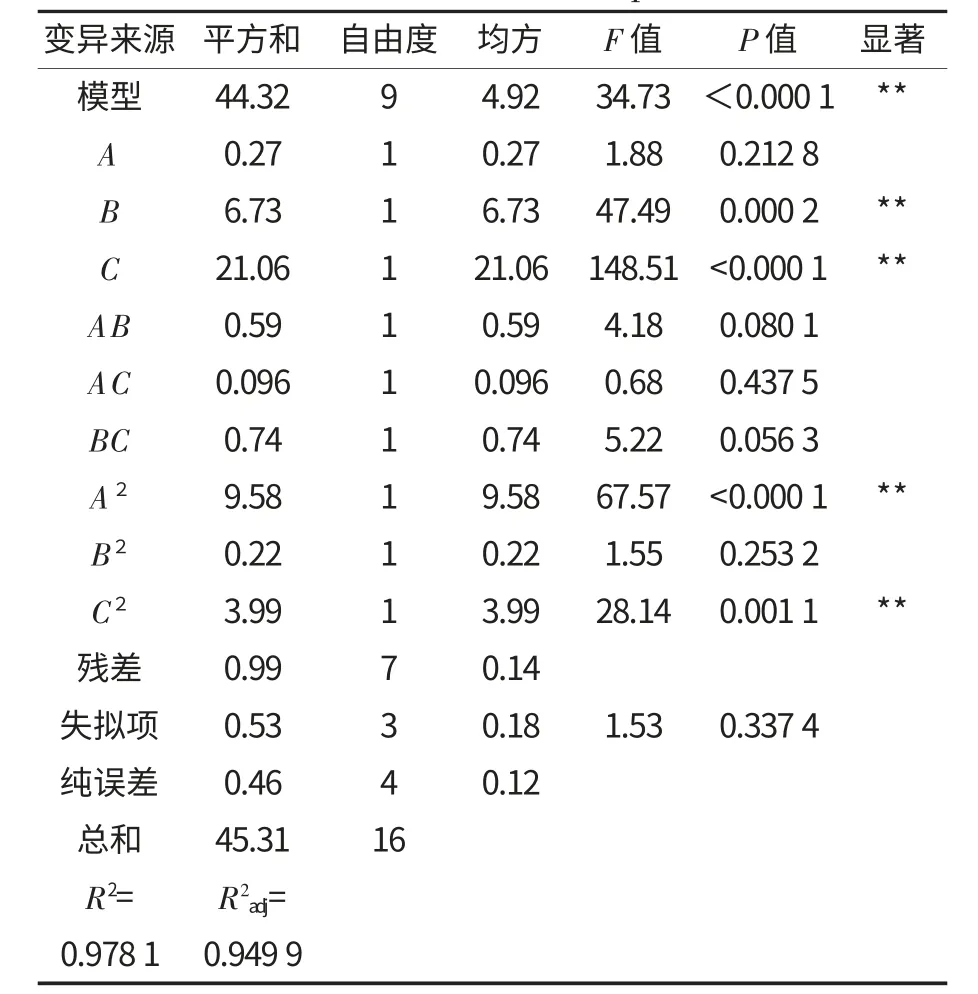
表6 纯化后抗性淀粉含量的回归方程分析Table 6 ANOVA of regression equation for the content of RS after purification
图4 为不同因子的响应曲面和等高线图,根据响应曲面和等高线所呈现的结果,可以看出因素B、C,即真菌α-淀粉酶的添加量和酶解时间对纯化后抗性淀粉的含量影响较大;依据纯化后抗性淀粉含量与提纯率的相关性可知,此两因素同样对提纯率有着显著影响,为影响纯化效果的重要因素,与回归方差分析结果一致.
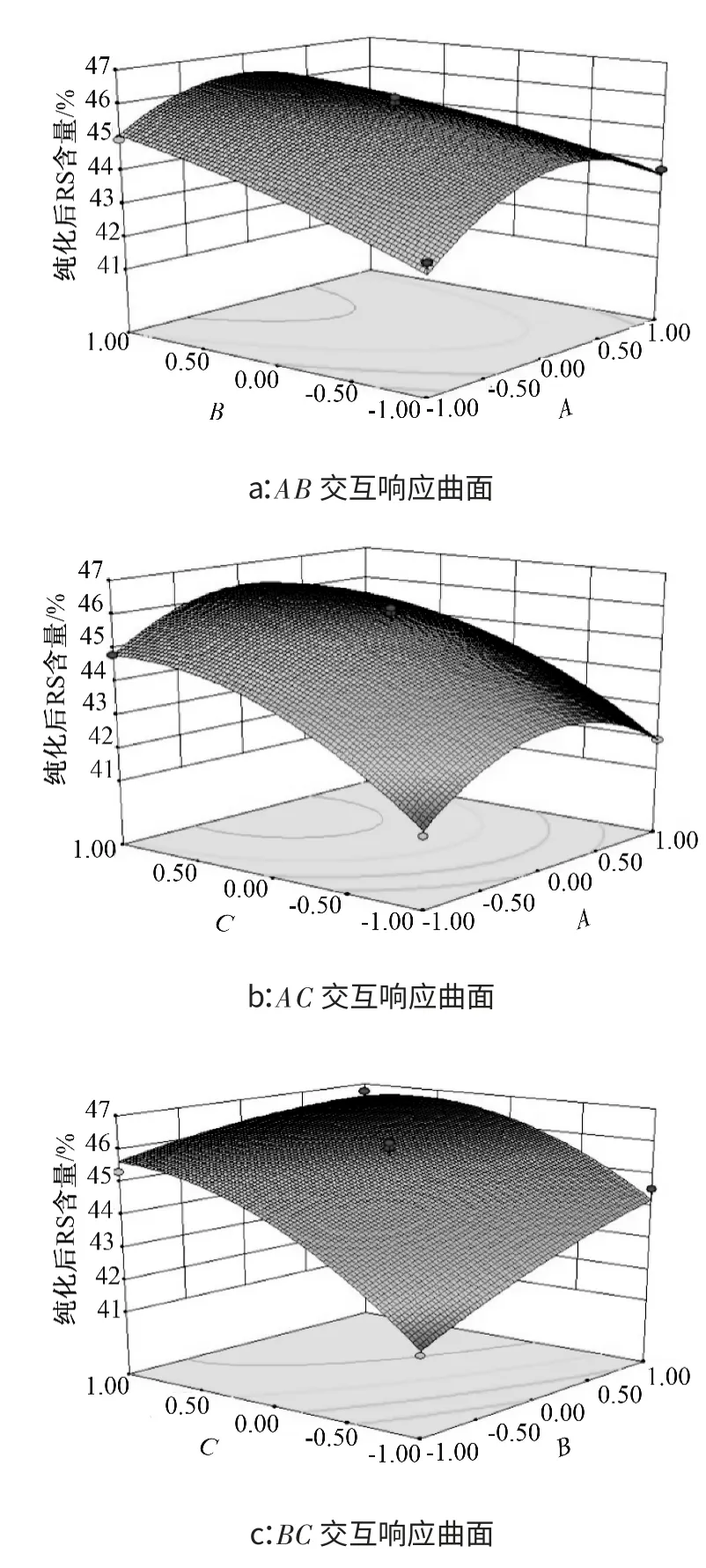
图4 响应面曲面与等高线Fig.4 Plots of response surface and contour
利用Design-Expert 8.0.6 软件对纯化后抗性淀粉含量的二次多项式模型进行分析,求得最佳纯化工艺条件为:原抗性淀粉乳质量分数19.51%,真菌α-淀粉酶添加量20 u/g,酶解时间36.21 min,纯化后抗性淀粉含量预测值为46.76%,提纯率为54.84%.但考虑到操作的方便性,工艺参数修正为原抗性淀粉乳质量分数20%,真菌α-淀粉酶添加量20 u/g,酶解时间36 min,并采用此最佳条件进行纯化试验,重复3 次,测得纯化后抗性淀粉含量平均为46.51%,此时提纯率为54.01%,证明了此最佳纯化条件的可靠性.
3 结论
酶法纯化工艺可有效提高玉米抗性淀粉的纯度,在其纯化过程中原抗性淀粉乳质量分数、真菌α-淀粉酶添加量和酶解时间均是主要的影响因素,应控制原抗性淀粉乳质量分数20%,真菌α-淀粉酶添加量20 u/g,酶解时间36 min,有利于抗性淀粉含量的显著增加.相比于原抗性淀粉,酶法纯化工艺在确保安全健康的基础上大大提高了其纯度,为制备高纯度抗性淀粉提供了基础方法,有利于抗性淀粉制备研究的继续进行.
[1]Englyst H N,Trowel H,Southgate Dat,et al.Dietary fibe and resistant starch[J].The American Journal of Clinical Nutrition,1987(46):873-874.
[2]余焕玲,曾凯.抗性淀粉研究方法[J].粮食与油脂,2001(9):32-34.
[3]Englyst H N,Andersen V,Cummings J H.Starch and non-starch polysaccharides in some cereal foods[J].Journal of the Science of Food and Agriculture,1983(34):1434-1440.
[4]Euresta.European flair -concerted action on resistant starch[C]//News letter IV,1993.
[5]Bodinham C L,Smith L,Wright J W,et al.Resistant starch and pullulan reduce postprandial glucose,insulin,and GLP -1,but have no effect on satiety in healthy humans[J].Journal of Agricultural and Food Chemistry,2012,60(48):11928-11934 .
[6]Klosterbuer A S,Thomas W,Slavin J L.Characterization of a novel resistant-starch and its effects on postprandial plasma -glucose and insulin responses[J].Cereal Chemistry,2010,87(4):257-262.
[7]Bodinham C L,Frost G S,Robertson M D.Acute ingestion of resistant starch reduces food intake in healthy adults[J].British Journal of Nutrition,2010,103(6):917-922.
[8]Zhou J,Martin R J,Tulley R T,et al.Failure to ferment dietary resistant starch in specific mouse models of obesity results in no body fat loss[J].Journal of Agricultural and Food Chemistry,2009,57(19):8844-8851.
[9]Zhang Huanxin,Jin Zhengyu.Preparation of products rich in resistant starch from maize starch by an enzymatic method[J].Carbohydrate Polymers,2011,86:1610-1614.
[10]罗志刚,高群玉.抗性淀粉制备研究[J].粮食与饲料工业,2006,3:19-21.
[11]余飞,邓丹雯,顾振宇,等.普鲁兰酶处理条件对淀粉增抗效应的规律研究[J].食品科技,2008(8):28-31.
[12]刘一洋.大米淀粉提取及抗性淀粉的制备及特性研究[D].长沙:湖南农业大学,2010.
[13]李俊伟.挤压法制备大米抗性淀粉的工艺及其性质研究[D].广州:暨南大学,2008.
[14]吴享,尹秀华,谢丽燕,等.酶法联合压热-冷却循环处理制备抗性淀粉[J].现代食品科技,2014,30(5):245-250.
