CdTe QDs/G14-3-14的制备及其在蛋白质荧光探针中的应用
2015-03-27邓淳钟亚平何瑜葛伊利宋功武
邓淳,钟亚平,何瑜,葛伊利,宋功武
(有机功能分子合成与应用教育部重点实验室(湖北大学),有机化工新材料湖北省协同创新中心(湖北大学),湖北 武汉 430062)
0 引言
蛋白质的检测在生物化学和免疫诊断等许多研究中都有着重要作用[1-2],因而高灵敏性和高选择性检测蛋白质的方法需要迫切.最常用测定蛋白质的方法有,凯氏定氮法、缩二脲的方法(Biuret),紫外吸收和考马斯亮蓝法(Bradford)等.和上述传统方法相比,荧光光度法由于操作简单,灵敏度高而有着很好的发展前景.纳米材料由于其显著的尺寸效应,因而有着和其相对应的单个分子或体相材料明显不同的理化性质,这使他们被广泛应用于纳米生物学研究[3-4],并且在各学科中表现出了潜在的应用价值[5-7]. CdTe纳米粒子是最常见的II-VI型的半导体材料,由于其在可见光范围内的发射波长可调因而被广泛研究[8].Gemini表面活性剂[9-11]是一个相对较新型的表面活性剂,由于具有较低的临界胶束浓度(CMCC)和较高的降低油/水界面张力等特点而优于同类传统表面活性剂,被广泛应用[12-14].由于量子点表面带有带负电的-COO-基团,可以和带正电的表面活性剂结合,从而发生相互作用.CdTe QDs/G14-3-14纳米材料作为有着高荧光效率和优良理化性质的荧光探针,成为检测蛋白质的新方法.
本实验将CdSe QDs用Gemini表面活性剂G14-3-14修饰,形成CdTe QDs/G14-3-14纳米材料.水相合成的纳米颗粒不仅解决了半导体纳米材料的水溶性问题,而且由于纳米粒子的表面包覆了一层巯基丙酸(HSCH2CH2COOH),借助于其外端的羧基可以和生物分子的胺基结合,形成酰胺键,从而达到标记生物分子的目的,因此可以高效地检测蛋白质.血清白蛋白是循环系统中最丰富的蛋白质,它具有多种生理和药理作用.牛血清白蛋白含有大量的氨基酸残基,并且结构与人血清白蛋白有着同源性,是研究最广泛的蛋白质之一,因此在这里我们以牛血清白蛋白作为蛋白质这一类生物分子的代表,表明我们的纳米材料能用于检测蛋白质.由于表面活性剂G14-3-14能与BSA发生疏水作用而结合,因而表面活性剂可以起到桥梁作用,使三者都产生相互作用,从而导致荧光的猝灭[15],高效地检测蛋白质.
1 实验部分
1.1 仪器与试剂 LS55型荧光分光光度计(美国Perkin-Elmer公司),TecnaiG20型透射电子显微镜(美国FEI公司),Spectrum one型傅里叶变换红外分光光度计(美国Perkin-Elmer公司),Lambda 35型紫外分光光度计(美国Perkin-Elmer公司),D/MAX-IIIC型X线衍射仪(日本理学).Gemini表面活性剂G14-3-14;牛血清白蛋白(BSA华美生物工程公司),原溶液浓度为5.0×10-6mol L-1;水溶性量子点为实验室制备.试剂均为分析纯,水为二次水.
1.2 实验方法
1.2.1 CdTe QDs的合成 合成方法采用改进后的方法[16-17].
1)将50.8 mg(0.4 mmol)锑粉和37.8 mg(1 mmol)NaBH4加入三颈烧瓶内,通入N2,注入10.0 mL超纯水,在氮气环境中室温下混合,直到得到透明的NaHTe溶液.
2)将0.8 mmol CdCl2溶液和1.02 mmol MPA溶液加入160 mL超纯水中混合均匀,用1.0 mol/L NaOH溶液调pH到11.9后将溶液转移到三颈烧瓶中,通入N2,得到Cd-MPA前驱体.
3)将所配制的Cd-MPA前驱体置于三颈瓶中,通入N2,注入新制的NaHSe溶液(0.08 mmol),在一个大气压下加热混合物到沸腾(100℃)并且冷凝回流,制备CdTe QDs溶液.将制备好的CdTe QDs用无水乙醇离心洗涤3次,干燥后备用.
1.2.2 纳米材料CdTe QDs/G14-3-14的合成 将CdTe QDs溶解后与一定量的Gemini表面活性剂G14-3-14混合搅拌,即得CdTe QDs/G14-3-14纳米材料.
1.2.3 纳米材料CdTe QDs/G14-3-14对BSA的检测 配置一系列不同比例的CdTe QDs和G14-3-14的混合溶液,加入适量的牛血清白蛋白溶液,固定激发波长350 nm,检测3次其发射光谱,以此得到的平均光谱的95%~105%为参照.配制比例不同的样品试样,检测其发射光谱,直至其发射光谱在上述参照范围内,记下该样品浓度,计算出蛋白质浓度.
2 结果与讨论
2.1 CdTe QDs的TEM图,XRD图和FT-拉曼光谱 我们通过透射电子显微镜(TEM)和X线粉末衍射(XRD)对产品的形貌和结构进行了表征.从TEM图可以看出CdTe QDs是球形晶体,并且尺寸均一,分散性好.X线衍射图谱中的(111),(220)和(311)显示CdTe QDs是典型的面心立方结构.由于MPA的巯基与Cd2+的共价结合,MPA分子中S—H振动峰(2 554 cm-1)消失了,而—CH2—特征峰(2 948 cm-1)仍然存在,确认了MPA和碲化镉核心之间的相互作用.
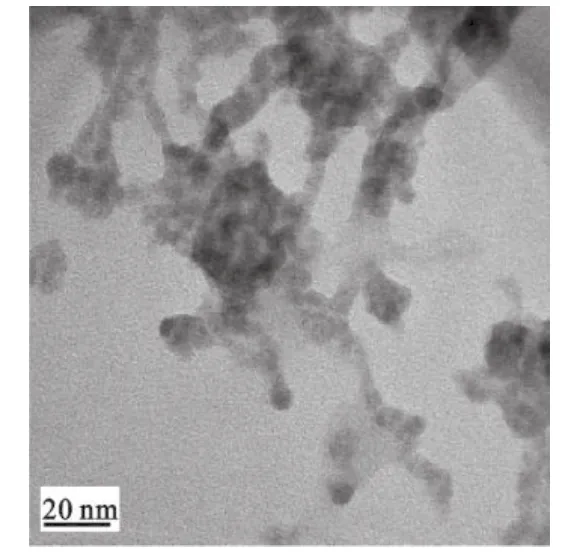
图1 CdTe QDs的TEM图
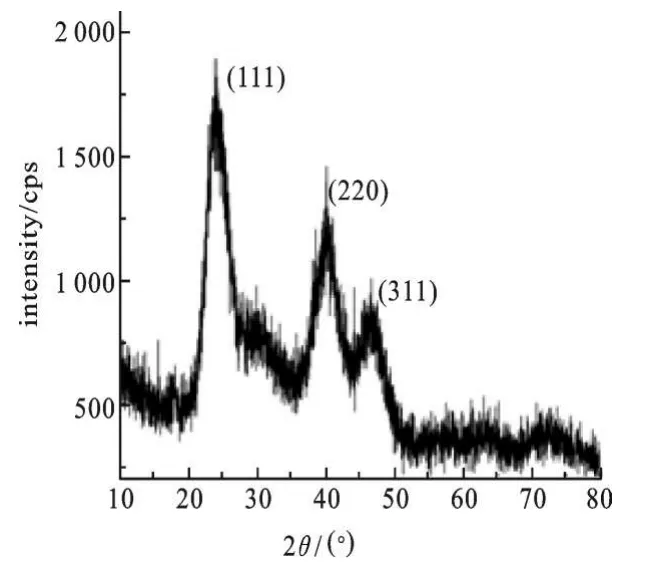
图2 CdTe QDs的XRD图
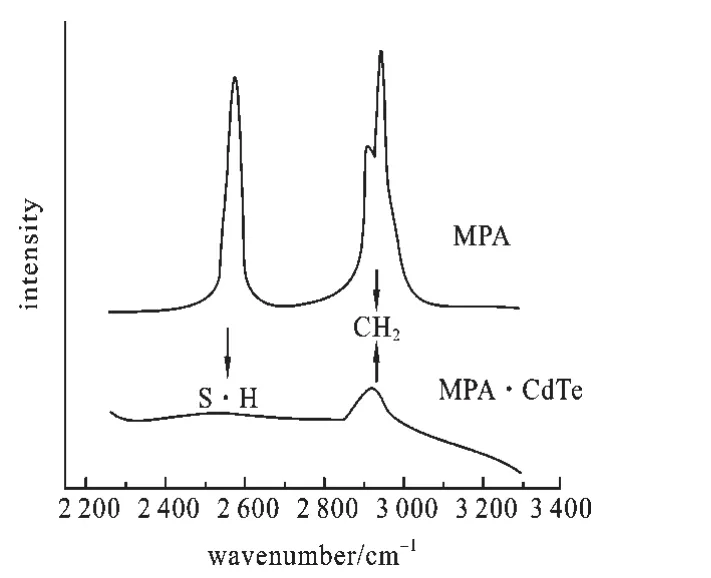
图3 MPA和MPA-CdTe的拉曼光谱
2.2 CdTe QDs的荧光光谱和紫外-可见吸收光谱 室温下加入NaHTe溶液后混合物变成金黄色,这表明晶核已经形成.从图4可以看出,随着反应的进行,CdTe QDs的尺寸和相应的荧光发射波长可以由加热时间控制.随着纳米颗粒的长大,荧光发射波长和紫外吸收波长均红移.分别加热1、5、10、20、30、45、60、90 min后,荧光发射峰分别在533、543、552、572、582、593、599、608 nm.CdTe QDs荧光发射峰位置从可见光区逐渐向近红外移动,所有样品在可见光区展示出尖锐的吸收峰并且随着颗粒尺寸的增大而变得平缓,这是由于量子禁断作用减弱的结果[16].
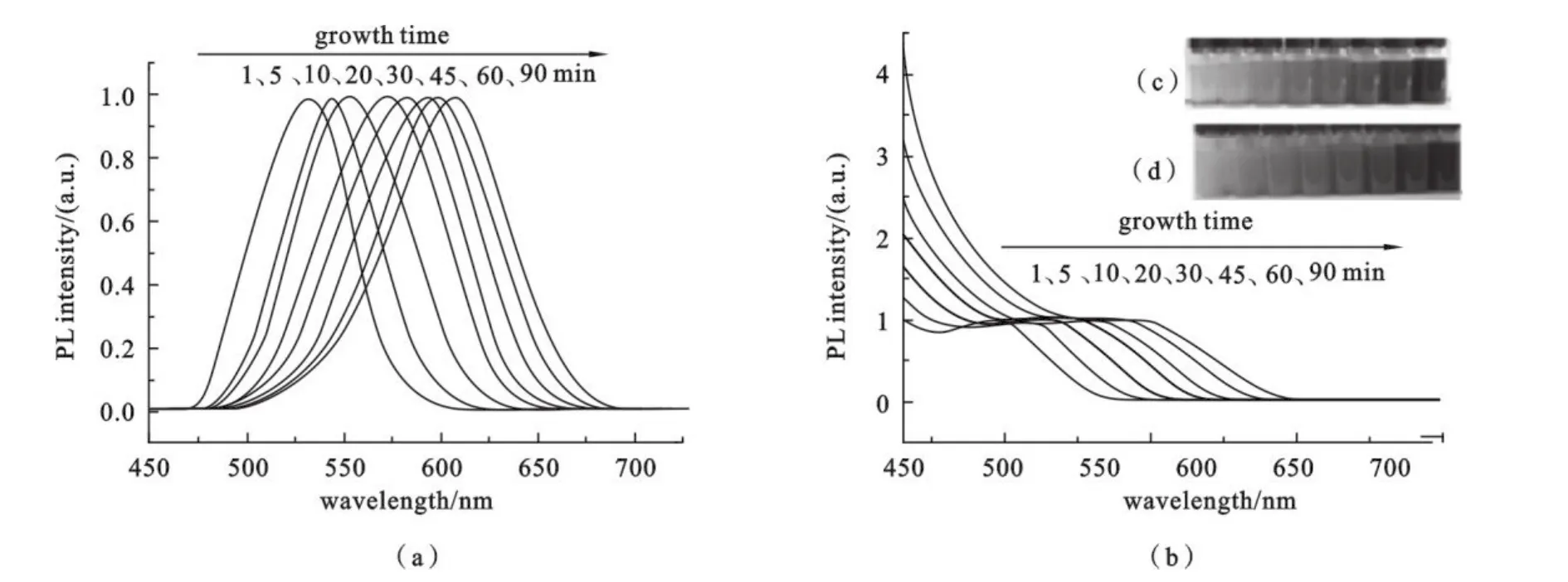
图4 不同反应时间合成的CdTe QDs(Cd、MPA、Te的摩尔比为1∶1.7∶0.05,pH=11.9)的荧光发射图谱(λex=350 nm)(a),紫外吸收图谱(b),在自然光照下(c)和紫外等光照下的颜色变化图(d)
2.3 纳米材料CdTe QDs/G14-3-14形成的机理与光谱表征 CdTe QDs的外面包覆了一层巯基丙酸(HSCH2CH2COOH),由于外端的羧基电离而使CdTe QDs带负电荷,所以CdTe QDs与G14-3-14分子之间存在着很强的静电吸引力(图5).由图6可知,随着体系中G14-3-14的增加,纳米材料CdTe QDs/G14-3-14的荧光强度明显降低,并伴随一定程度的红移,这表明二者产生了相互作用.当CdTe QDs和G14-3-14的摩尔比不断增大时,纳米材料的荧光强度是不断降低的,但是在1∶10到1∶100时,出现了一个平台,由此平台所示比例区间量子点对表面活性剂的摩尔比与纳米荧光材料的影响不大.所以,我们选择CdTe QDs和G14-3-14的摩尔比为1∶50为最佳比例,后面的实验均选用此比例的纳米荧光材料进行蛋白质检测.
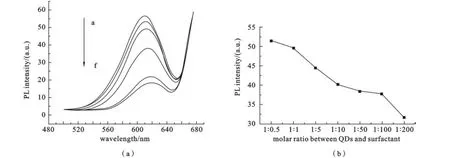
图6 CdTe QDs与G14-3-14反应的荧光图谱(a)CdTe QDs/G14-3-14体系的荧光发射图谱;(b)CdTe QDs与G14-3-14的比例对荧光强度的影响CCdTeQDs=1.2×10-8mol·L−1;λex=350 nm.CG14-3-14=1.0×10-4mol·L−1
2.4 纳米材料CdTe QDs/G14-3-14与BSA的相互作用 从图7可以看出,随着BSA浓度的增加,体系荧光猝灭并伴随红移,说明BSA与纳米材料发生了相互作用,并且猝灭十分明显,而且在实验所固定的波长范围内BSA与CdTe QDs之间也没有相互作用,证明只有修饰过的CdTe QDs才能和BSA作用,因此用这种纳米材料可以很好地进行蛋白质检测.
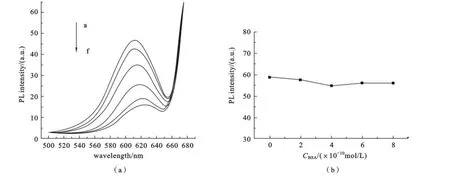
图7 (a)CdTe QDs-G14-3-14体系(CCdTeQDs=1.2×10-8mol·L−1;CG14-3-14=6.0×10-7mol·L−1;CBSA=4×10-8mol·L−1,a~f:0.0;0.2;0.4;0.6;1.0;1.2 mL)和(b)CdTe QDs与不同浓度的BSA相互作用的荧光图
由图8可以得知,无论是荧光材料本身(图8a),还是荧光材料对BSA进行检测时(图8b),时间对二者都没有影响.因此,我们可以认为,CdTe QDs/G14-3-14这种纳米荧光材料有着很好的抗光漂白性.
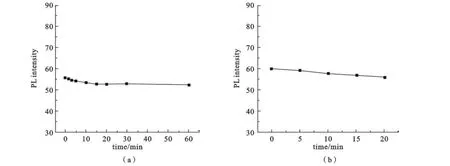
图8 (a)CdTe QDs/G14-3-14和(b)CdTe QDs/G14-3-14-BSA体系的荧光强度随时间变化图
由图9与表1可知,CdTe QDs/G14-3-14的摩尔比不同(1∶10~1∶100),BSA对它的荧光猝灭效果略有不同,图中所得的KSV值也比较接近,说明在该平台上选取任一比例合成的材料都可以很好地检测蛋白质,不因摩尔比不同而效果不同.由图10可以看出,G14-3-14没有紫外吸收,BSA的吸收峰在280 nm左右.CdTe QDs用表面活性剂修饰后紫外吸收峰强度增加,这可能是由于少数表面活性剂没有包裹量子点,而是形成了一些大的囊泡,从而引起光的散射所导致[18-19].加入BSA后CdTe QDs/G14-3-14的紫外吸收降低了,这表明蛋白质与纳米材料发生了相互作用.
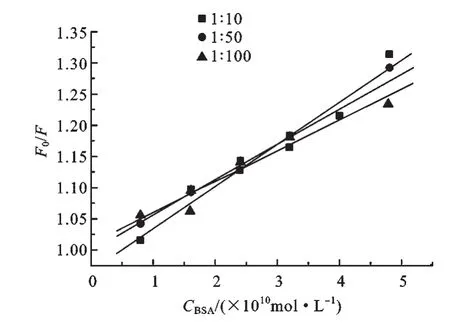
图9 不同的CdTe QDs与G14-3-14比例合成的CdTe QDs/G14-3-14与蛋白质相互作用的Stern-Volmer图
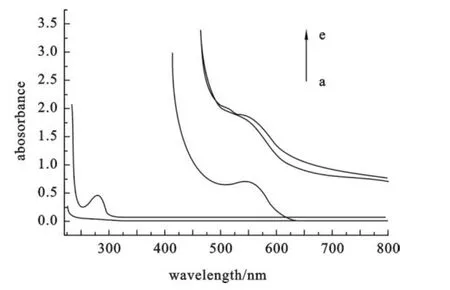
图10 不同体系的紫外吸收图谱(a~e:G14-3-14,BSA, CdTe QDs,CdTe QDs/G14-3-14-BSA,CdTe QDs/G14-3-14)
2.5 共存物质的干扰 在最佳检测条件下,对典型的共存物质进行了干扰测定.从表2可以看出,金属阳离子和生物分子对实验的影响均在允许的干扰范围之内,说明纳米粒子选择性好,抗干扰能力强.
2.6 工作曲线 在最优条件下,由ΔF对BSA的浓度作图,得到了工作曲线(RQDs/G14-3-14=1∶50).线性方程为ΔF=0.77+0.75C(μg·L-1),相关系数为R2= 0.99.如图11所示,BSA浓度的线性范围为0~42.24 μg·L-1.检出限LOD=0.18 μg·L-1.
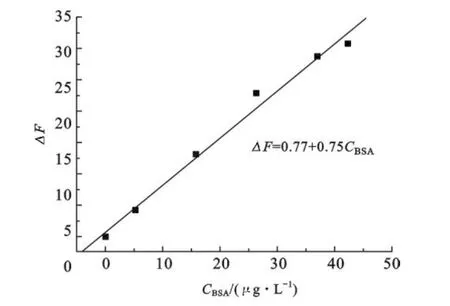
图11 CdTe QDs/G14-3-14对蛋白质检测的工作曲线BSA的浓度范围为0~42.24 μg·L-1

表1 CdTe QDs/G14-3-14(不同RQDs/G14-3-14)与BSA相互作用的猝灭常数
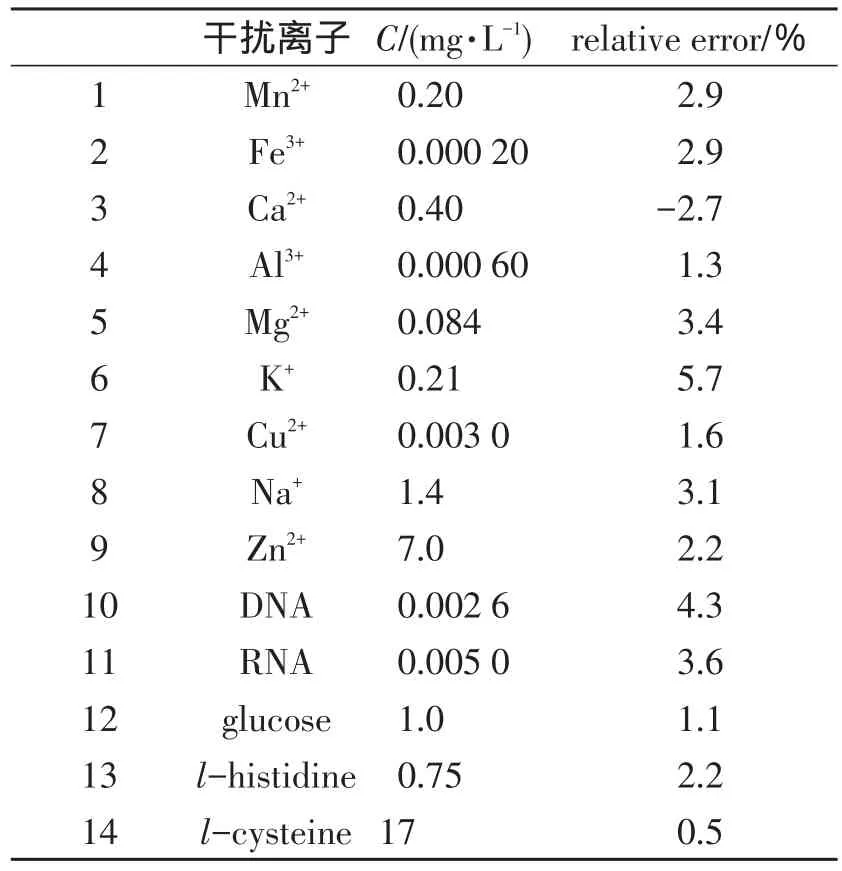
表2 不同的离子以及生物分子对体系的干扰(BSA:2.6 μg·L-1)
2.7 对实际样品中BSA含量的测定 为了研究这种荧光纳米材料的实用性,我们对新鲜尿液中BSA的含量进行了检测.表3显示了3组平行尿液稀释200倍的实际样品的检测分析结果.由此可以知,3组样品都达到了期望值,并且相对标准偏差(RSD)小于5%,这证明实验有很好的精密度;同时回收率在108%~110%之间,说明适合微量分析.这说明此种材料在蛋白质检测中具有较好的实用价值.

表3 实际样品测量结果
3 结论
本文中成功合成了CdTe QDs/G14-3-14纳米材料,这种纳米材料选择性好,可以作为蛋白质荧光探针.由实验结果可知,此种材料在蛋白质检测中具有较好的实用价值.本论文为Gemini表面活性剂修饰量子点作为荧光探针研究生物分子提供了参考.
[1]Patton W F.Detection technologies in proteome analysis[J].J Chromatogr B,2002,771:3-31.
[2]Sriyam S,SinchaikuL S,Tantipaiboonwong P,et al.Enhanced detectability in proteome studies[J].Journal of Chromatography.B,Analytical Technologies in the Biomedical and Life Sciences,2007,849(1/2):91-104.
[3]Molday R S,MacKenzie D.Immunospecific ferromagnetic iron-dextran reagents for the labeling and magnetic separation of cellsp[J].J Immunol Methods,1982,52:353-367.
[4]Bruchez M P,Moronne M,Gin P,et al Semiconductor nanocrystals as fluorescent biological labels[J].Science,1998,281:2013-2016.
[5]Marvin L F,Roberts A R,Fay L B.Matrix-assisted laser desorption/ionization time-of-flight mass spectrometry in clinical chemistry[J].Clin Chim Acta,2003,337:11-21.
[6]Pan C,Xu S,Zhou H,et al.Recent developments in methods and technology for analysis of biological samples by MALDITOF-MSAnal[J].Bioanal Chem,2007,387:193-204.
[7]Salata O V.Applications of nanoparticles in biology and medicine[J].J Nanobiotech,2004,2:1-6.
[8]Pan D C,Wang Q,Jiang S C,et al.Low-temperature systhesis of oil-soluble CdSe,CdS,and CdSe/CdS core-shell nanocrystals by using various water-soluble anion precursors[J].J Phys Chem C,2007,111:5661-5666.
[9]Menger F M,Littau C A.Gemini-surfactants:synthesis and properties[J].J Am Chem Soc,1991,113:1451-1452.
[10]Zana R,Talmon Y.Dependence of aggregate morphology on structure of dimeric surfactants[J].Nature,1993,362:228-230.
[11]Karaborni S,Esselink K,Hilbers P A J,et al.Simulating the Self-Assembly of Gemini(Dimeric)Surfactants[J]. Science,1994,266:254-256.
[12]Tardioli S,Bonincontro A,La Mesa C A.Interaction of bovine serum albumin with Gemini surfactants[J].Journal of Colloid and Interface Science,2010,347(1):96-101.
[13]Chen Z,Liu Guo-liang,Chen Mao-huai,et al.Determination of nanograms of proteins based on decreased resonance light scattering of zwitterionic Gemini surfactant[J].Analytical Biochemistry,2009,384(2):337-342.
[14]Zou Q C,Chen H,Yu H,et al.Synthesis of polycation with gemini structure and detection of DNA by resonance light scattering[J].Sensors and Actuators B:Chemical,2010,145:378-385.
[15]Lehres S.Solute perturbation of protein fluorescence:the quenching of the tyrpophyl fluorescence of model compounds and of lysozyme by zodide ion[J].Biochemistry,1971,10(17):3254-3258.
[16]Zhang H,Wang L,Xiong H,et al.Hydrothermal synthesis to high quality CdTe nanocrystals[J].Adv Mater,2003,15: 1712-1715.
[17]Gaponik N,Talapin D V,Rogach A L,et al.Thiol-capping of CdTe nanocrystals:an alternative to organometallic synthetic routes[J].Journal of Physical Chemistry B,2002,106(29):7177-7185.
[18]Yang P,Ando M,Murase N.Encapsulation of emitting CdTe QDs within silica beads to retain initial photoluminescence efficiency[J].J Colloid Interf Sci,2007,316:420-427.
[19]Zhelev Z,Ohba H,Bakalova R.Single quantum dot-micelles coated with silica shell as potentially non-cytotoxic fluorescent cell tracers[J].Journal of the American Chemical Society,2006,128(19):6324-6325.
