铅导致C2C12成肌细胞的氧化应激和凋亡损伤
2015-03-27王秋菊吴逍梁继超刘亚云陈勇
王秋菊,吴逍,梁继超,刘亚云,陈勇
(湖北大学生命科学学院,湖北省中药生物技术重点实验室,湖北 武汉 430062)
0 引言
铅在地球上分布广泛,是对人类最为严重的重金属污染物之一,随着现代化工业的发展,铅的应用越来越广泛,对人群的健康危害越来越大,如今铅污染已经成为一个全球性的公共卫生问题.铅是一种全身性的毒物,铅暴露能引起多系统的损害,包括神经、生殖、免疫、血液、肝、肾等[1-3].铅被吸收后以离子状态进入血液循环,最初主要以铅盐与血浆蛋白结合的形式分布于全身各组织,数周后绝大部分以不溶的磷酸盐形式沉积在骨骼系统和毛发,仅有5%左右的铅存留于肝脏、肾脏、脑、心脏、脾等软组织和血液内.然而,骨组织不能无限量地容纳铅,当骨铅含量达到饱和时,若继续与铅接触,则血液和肌肉组织中铅的浓度升高[4-6],会导致肌肉组织的毒性损伤.普遍认为,铅的毒作用机理是多方面的,根据近些年的研究报道,铅主要通过两方面发挥其毒性作用,一方面它与蛋白质有高度亲和力,可与蛋白质上的巯基或其他能结合二价离子的部位实行不可逆的共价结合;另一方面可模拟Ca2+作用,影响各种需Ca2+离子参与的功能的发挥,特别是细胞间信号的传导.随着铅毒性机理的不断深入,铅的氧化应激机理引起了人们的关注,氧化应激是指机体或细胞中的促氧化和抗氧化之间的平衡失调而倾向于前者,导致的机体或细胞受损的状态.Hashish[7]等发现,铅能够诱导尼罗非洲鲫鱼体内ROS的产生,导致氧化应激,发生一系列生理变化,包括血浆中钙、磷和镁水平的下降,肾脏中SOD、GSH酶活性的抑制,MDA水平的上升.赵南[8]等发现铅能诱导PC12细胞的凋亡.综上所述,虽然针对铅的细胞毒性研究很多,但是铅对C2C12成肌细胞造成的氧化应激和凋亡情况及机制不明,本研究的目的是探究其可能的毒性损伤和潜在机制.
1 材料与方法
1.1 材料与试剂 C2C12细胞株为中国北京协和医学院馈赠;β-actin,Bax和Bcl-2抗体购自美国Santa Cruz公司;噻唑蓝(MTT)和二甲亚砜(DMSO)购自美国Sigma公司;DMEM培养基和胎牛血清(FBS)购自美国Gibco公司;醋酸铅为分析纯购自天津科密欧化学试剂有限公司;ROS试剂盒,DNA ladder抽提试剂盒,Caspase-3试剂盒,抗小鼠二抗购自江苏碧云天生物技术研究所;LDH试剂盒和CAT试剂盒购自南京建成生物工程研究所.
1.2 主要仪器 HEAR Cell CO2培养箱购自德国Heraeus公司;XDS-1B倒置相差显微镜购自北京佳源兴业科技有限公司;BIO-RAD iMARKTM酶标仪,My CyclerTMThermal Cycler,BIO-RAD CFX ConnectTMReal-Time System购自BIO-RAD公司;5415R台式低温高速离心机购自eppendorf公司;DYC-40 A型垂直电泳槽,DYC-40 A电转仪,DYY-6C型水平电泳槽,DYY-6C型电泳仪购自北京市六一仪器厂.
1.3 实验方法
1.3.1 细胞培养 C2C12成肌细胞接种于75 mL玻璃培养瓶中,培养在含10%FBS、1%双抗(青霉素+链霉素)的DMEM培养基中,置于37℃、5%CO2细胞培养箱中孵育,待细胞汇合度达到90%,用0.25%胰蛋白酶进行消化传代.
1.3.2 醋酸铅对C2C12成肌细胞造成细胞毒性的检测 细胞的存活率通过MTT检测,将细胞接种于96孔板中,分别用不同浓度的醋酸铅(1,10,50,100,200,400 μmol/L)和空白对照组处理24 h和48 h后,每孔加入20 μL(5 mg/mL)MTT继续孵育4 h,终止反应后,每孔加入150 μL的DMSO,酶标仪490 nm处测各孔吸光值.此外,醋酸铅处理48 h后,收集培养基上清液,按照LDH试剂盒说明书操作,测得乳酸脱氢酶的释放量.
1.3.3 醋酸铅对C2C12成肌细胞造成的氧化应激损伤检测 包括ROS检测和CAT酶活力检测.ROS检测时,醋酸铅的染毒浓度设定为10,50,200 μmol/L和空白对照组,染毒时间为12 h;CAT酶活力检测时,浓度同上,染毒时间为48 h.后续具体操作步骤参照试剂盒所附说明书.
1.3.4 醋酸铅对C2C12成肌细胞凋亡的影响 包括DNA损伤检测、细胞周期检测、Bcl-2和Bax蛋白表达检测和Cas-3活性检测.DNA损伤检测中,醋酸铅的染毒浓度设定为10,50,100,200 μmol/L和空白对照组,染毒时间为48 h,后续具体步骤参照DNA Ladder抽提试剂盒使用说明书;细胞周期检测中,醋酸铅的染毒浓度设定为10,50,200 μmol/L和空白对照组,染毒时间为24 h和48 h,后续步骤参照Gabriel de Arriba等[9]进行的PI单染色操作;Bcl-2/Bax蛋白表达检测和Cas-3活性检测中,醋酸铅的染毒浓度都设定为10,50,200 μmol/L和空白对照组,染毒时间同为48 h,后续步骤分别参见蛋白印迹操作[10]和Cas-3试剂盒使用说明书.
1.3.5 统计分析 实验数据来自至少3次独立实验,所有数据均以平均数±标准差表示,统计学分析方法采用Student’s t检验(*p<0.05;**p<0.01).
2 结果
2.1 醋酸铅对C2C12细胞造成的细胞毒性 如图1所示,24 h和48 h的MTT结果同时说明,随着醋酸铅暴露剂量增大,细胞存活率逐渐下降,当醋酸铅浓度小于等于10 μmol/L时,细胞存活率有显著性差异(p<0.05);当醋酸铅浓度大于等于50 μmol/L时,细胞存活率有极显著性差异(p<0.01).根据本实验结果,我们选择了10,50,100 μmol/L作为醋酸铅的染毒剂量,以保证具有适当的细胞存活率(约50%~80%).为进一步反映细胞膜的损伤程度,本实验检测了LDH的释放量,与对照组比较,当醋酸铅浓度达到200 μmol/L时,有显著性差异(p<0.05).

图1 醋酸铅对细胞存活率和胞外LDH酶活的影响
2.2 醋酸铅对C2C12细胞造成的氧化应激损伤 如图2所示,细胞内ROS水平显著上调,与对照组相比,醋酸铅浓度为10 μmol/L时有显著差异(p<0.05),大于10 μmol/L时有极显著差异(p<0.01).而细胞内CAT酶活力则显著下调,50 μmol/L时有显著差异(p<0.05),大于50 μmol/L时有极显著差异(p<0.01).
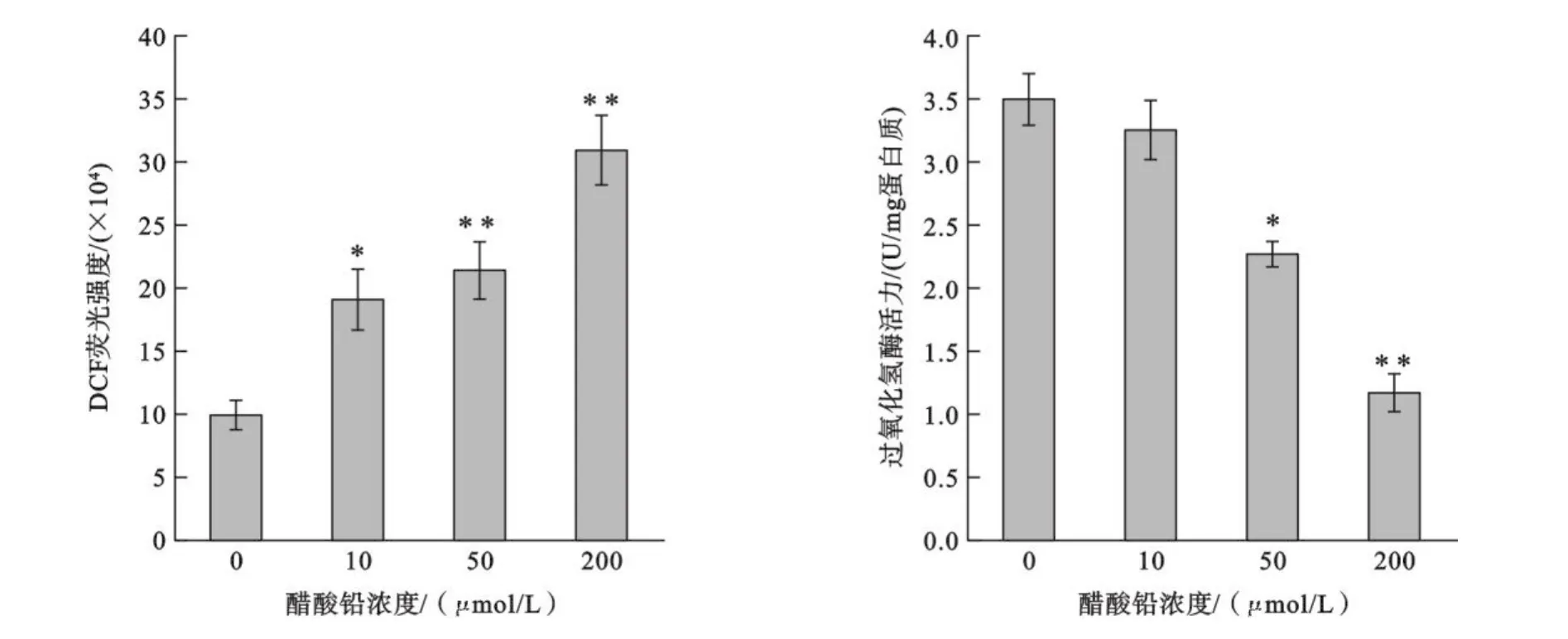
图2 醋酸铅对细胞内ROS水平和过氧化氢酶活力的影响
2.3 醋酸铅对C2C12细胞造成的凋亡损伤 醋酸铅对细胞周期进程的影响如图3所示,当处理时间为24 h时,处于G2/M期细胞比例分别为3.5%,4.8%,15.4%和12.9%,提示随着醋酸铅作用剂量的增加,细胞周期阻滞逐渐明显,而在S期的细胞数量有略微减少;当处理时间为48 h,高剂量组200 μmol/L处出现明显的凋亡峰.
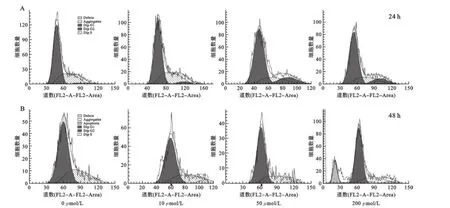
图3 醋酸铅对细胞周期的影响
DNA损伤后形成的片断化如图4所示,随着醋酸铅剂量的增加,醋酸铅处理组在对应的100~200 bp处荧光亮度在增加,提示基因组DNA链断裂形成的小片段逐渐增多,说明醋酸铅暴露诱导了细胞内基因组DNA的片段化.
蛋白印迹结果如图5所示,随着醋酸铅浓度的增大,抗凋亡蛋白Bcl-2表达量呈下降趋势,而促凋亡蛋白Bax表达量则呈上升趋势,同时Caspase-3酶活力上调,与对照组相比,在200 μmol/L时有显著性差异(p<0.05).

图4 DNA Ladder电泳

图5 醋酸铅对Bcl-2/Bax蛋白表达和Caspase-3酶活力的影响
3 讨论
铅是一种在细胞内不能被代谢转化降解的有毒重金属,目前的研究表明,重金属与DNA形成加合物而导致DNA的损伤可能是引发细胞凋亡的重要步骤,重金属还能使细胞中ROS升高,在直接导致DNA损伤的同时,启动相关的细胞凋亡信号通路,激活Caspase-3,同时还涉及一系列重要基因和蛋白的参与,包括Bcl-2和Bax等相关蛋白,从而促进凋亡的发生[11].吉珊珊[12]等发现纳米PbO2染毒后,铅可以广泛地分布于肝、肾、脑组织中,且随着染毒剂量的增加,体内铅含量随之增加,可使小鼠血液、肝脏、肾脏、脑组织的抗氧化功能受损,使机体出现氧化性损伤;雷义[13]等发现铅能导致HK-2细胞损伤,包括LDH释放的增加、细胞凋亡率和坏死率的增加、脂质过氧化的加快、细胞线粒体膜电位的降低.而铅除了对各个系统器官造成损害外,铅还严重影响骨骼肌的生长发育,铅对肌肉的损害主要是对成肌细胞的损害,小鼠C2C12成肌细胞被广泛用作细胞模型研究化学和药物引起的骨骼肌损伤[14-15],本研究应用体外培养的C2C12细胞从氧化应激和凋亡损伤的角度阐释铅对骨骼肌的损害作用.
LDH存在于细胞膜完整的胞质内,当胞膜受损后才迅速释放到胞外的介质中,因此LDH的释放可以反映胞膜的损伤程度,醋酸铅处理24 h和48 h的实验结果显示醋酸铅呈剂量依赖模式抑制C2C12成肌细胞的存活率,且显著增加细胞内LDH的释放量.
活性氧(reactive oxygen species,ROS)是生物体有氧代谢产生的一类活性含氧分子的总称,包括超氧阴离子(O2-),羟自由基(OH-),以及过氧化氢(H2O2),这些活性分子均有较强的氧化特性[16-18],实验结果显示,在醋酸铅处理C2C12成肌细胞12 h后,细胞内ROS显著上调,同时CAT酶活力显著下降.铅导致ROS在胞内的积累,同时抑制细胞内的抗氧化酶,例如超氧化物歧化酶(SOD),过氧化氢酶(CAT),这些酶都是肝细胞和骨骼肌细胞在代谢中的重要酶,最后造成氧化应激损伤[19].细胞内ROS的升高一方面导致CAT的损耗,一方面可以直接导致DNA损伤,同时还可能启动相关的凋亡信号通路[20].
结果显示,醋酸铅处理C2C12成肌细胞48 h后,促进胞内DNA片断化,导致细胞周期阻滞在G2/M期,且当醋酸铅浓度为200 μmol/L时,出现明显的凋亡峰.蛋白印迹结果显示,铅暴露抑制抗凋亡蛋白Bcl-2的表达,同时诱导促凋亡蛋白Bax的表达,提示Bcl-2和Bax参与了醋酸铅导致的C2C12细胞凋亡. Caspase家族在介导细胞凋亡的过程中起着非常重要的作用,其中Caspase-3为关键的执行分子,在凋亡的早期被激活[21-22].醋酸铅处理细胞48 h后,Caspase-3酶活力显著增加.
综上所述,本实验研究表明,铅能够破坏细胞膜的完整性,通过增加C2C12胞内ROS水平,降低胞内CAT酶活力引起细胞氧化应激损伤,同时与DNA形成加合物导致其片断化,再进一步激活凋亡相关的酶Caspase-3活力和影响凋亡相关蛋白Bcl-2/Bax表达,造成细胞凋亡.提示ROS启动的、Caspase-3介导的细胞凋亡可能是铅诱导的C2C12细胞损伤的主要途径.
[1]Needleman H.Lead poisoning[J].Annu Rev Med,2004,55:209-222.
[2]Anjum M R,Sainath S B,Suneetha Y,et al.Lead acetate induced reproductive and paternal mediated developmental toxicity in rats[J].Ecotoxicol Environ Saf,2011,74:793-799.
[3]Liu C M,Ma J Q,Sun Y Z.Protective role of puerarin on lead-induced alterations of the hepatic glutathione antioxidant system and hyperlipidemia in rat[J].Food Chem Toxicol,2011,49:3119-3127.
[4]Ni Z,Hou S,Barton C H,et al.Lead exposure raises superoxide and hydrogen peroxide in human endothelial and vascular smooth muscle cells[J].Kidney Int,2004,66:2329-2336.
[5]马雨水.铅对SD乳鼠成骨细胞毒性机理的研究[D].江苏:扬州大学,2009.
[6]Scinicariello F,Buser M C,Mevissen M,et al.Blood lead level association withlower bodyweight in NHANES 1999–2006[J].Toxico Appl Pharmacol,2013,273:516-523.
[7]Hashish E A,Elqaml S A,El-Murr A,et al.Nephroprotective and antioxidant significance of selenium and α-tocopherol on lead acetate-induced toxicity of Nile Tilapia(Oreochromis niloticus)[J].Fish Physiol Biochem,2015.
[8]赵南,唐旭东,周克元.醋酸铅对PC12细胞凋亡和caspase-3活性的影响[J].中国工业医学杂志,2004,17:286-288.
[9]Gabriel D A,Miryam C,Selma B,et al.Cyclosporine A-induced apoptosis in renal tubular cells is related to oxidative damage and mitochondrial fission[J].Toxicol Lett,2013,218:30-38.
[10]Su J K,Young J L,Eun K L,et al.Silver nanoparticles-mediated G2/M cycle arrest of renal epithelial cells is associated with NRF2-GSH signaling[J].Toxicol Lett,2012,211:334-341.
[11]刘欣梅,项黎新,邵健忠,等.重金属诱导细胞凋亡的分子机制[J].细胞生物学杂志,2006,26:235-240.
[12]吉姗姗.纳米二氧化铅对小鼠急性损害作用的研究[D].河北:河北医科大学,2010.
[13]雷义.铅诱导的HK-2细胞氧化应激及线粒体损伤的实验研究[D].衡阳:华南大学,2007.
[14]Steffens A A,Hong G M,Bain L J.Sodium arsenite delays the differentiation of C2C12 mouse myoblast cells and alters methylation patterns on the transcription factor myogenin[J].Toxicol Appl Pharmacol,2011,250:154-161.
[15]O'Flaherty E J.Physiologically based models for bone-seeking elements V:lead absorption and disposition in childhood[J]. Toxicol Appl Pharmacol,1995,131:297-308.
[16]Hsu P C,Guo Y L.Antioxidant nutrients and lead toxicity[J].Toxicol,2002,180:33-44.
[17]Chen X,Wang K Y,Wang Z Q,et al.Effects of lead and cadmium co-exposure on bone mineral density in a Chinese population[J].Bone,2014,63:76-80.
[18]洪玮,付欣,周问渠,等.醋酸铅对体外培养大鼠肾小管上皮细胞的毒性损伤[J].激光生物学报,2011,20:315-318.
[19]刘欣梅,项黎新,邵健忠,等.重金属诱导凋亡的分子机制[J].细胞生物学杂志,2004,26:235-240.
[20]Liu G,Li Z F,Wang J Q,et al.Puerarin protects against lead-induced cytotoxicity in cultured primary rat proximal tubular cells[J].Hum Exp Toxicol,2014,33:1071-1080.
[21]Chander K,Vaibhav K,Ahmed M E,et al.Quercetin mitigates lead acetate-induced behavioral and histological alterations via suppression of oxidative stress,Hsp-70,Bak and up regulation of Bcl-2[J].Food Chem Toxicol,2014,68:297-306.
[22]Xu J,Ji L D,Xu L H.Lead-induced apoptosis in PC 12cells:involvement of p53,Bcl-2family and caspase-3[J].Toxicol Lett,2006,166:160-167.
