鸭源新城疫病毒NP基因在昆虫细胞中的表达及抗原性检测
2015-03-26王安平朱善元王永娟左伟勇洪伟鸣
王安平, 朱善元, 王永娟, 吴 双, 左伟勇, 洪伟鸣
(江苏农牧科技职业学院江苏省兽用生物制药高技术研究重点实验室,江苏 泰州 225300)
新城疫病毒(NDV)是副粘病毒科副粘病毒亚科禽腮腺炎病毒属的成员,能导致禽类严重的呼吸系统和神经系统疾病,主要特征是呼吸困难、高热、下痢、神经机能紊乱以及黏膜和浆膜出血。以前认为新城疫病毒不会引起水禽致病,自从1997年,王永坤等[1]报道了从病鹅体内分离到了NDV强毒株,从而打破NDV对水禽不致病之说。近年来,鸭、鹅等水禽感染NDV并发病的病例越来越多,也越来越严重,给中国水禽养殖业带来了很大的损失[2-4]。
新城疫病毒是单股负链,不分节段的RNA病毒,基因组编码6种结构蛋白质,分别为核衣壳蛋白质(NP)、磷酸化蛋白质(P)、膜蛋白质(M)、融合蛋白质(F)、血凝素-神经氨酸酶蛋白质(HN)和大分子蛋白质(L)[5-6]。NP蛋白质是NDV核衣壳的主要蛋白质成分,其 N端结合RNA,高度保守,C端含有磷酸化位点和抗原决定簇位点。本研究利用 Bac-to-Bac杆状病毒系统,构建含鸭新城疫病毒NP基因的重组杆状病毒,并在昆虫细胞中表达重组NP蛋白质,为鸭新城疫病毒病的基础研究奠定基础。
1 材料与方法
1.1 毒株、菌株和载体
鸭源新城疫病毒、鸭新城疫阳性血清由福建省农业科学院惠赠;Sf9细胞、大肠杆菌DH5α感受态细胞由江苏省兽用生物制药高技术研究重点实验室保存;杆状病毒Bac-to-Bac表达系统(包括转座质粒pFastBac1、E.coli DH10Bac受体菌)购自Invitrogen公司。
1.2 工具酶和试剂
pfu DNA Polymerase、限制性内切酶EcoRⅠ、PstⅠ及T4 DNA连接酶购自Fermentas公司,Wizard DNA Clean-up System购自美国Promega公司,昆虫细胞培养基Sf-900ⅡSFM(Serum free medium)购自GBICO公司,转染试剂CellfectinⅡReagent购自Invitrogen公司,HRP标记的羊抗鸭IgG、荧光素标记的羊抗鸭IgG均购自美国KPL公司,其他试剂均为国产分析纯级。
1.3 引物的设计与合成
参考GenBank中登录的鸭新城疫病毒NP基因序列设计1对引物,为了便于基因的克隆及表达载体构建等后继工作,在NP基因引物的上、下游5′端分别添加了EcoRⅠ和PstⅠ酶切位点。通用引物M13F/ M13R参照Bac-to-Bac杆状病毒表达系统设计,引物均由上海英潍捷基生物技术有限公司合成。NP基因引物序列为:P1:5′-GCG GAATTCACCATGTCGTCTGTTTTCGACGA-3′(下划线为EcoRⅠ酶切位点),P2: 5′-TAA CTCGAGTCAGTACCCCCAGTCAGTGTC-3′(下划线为PstⅠ酶切位点)。通用引物序列为:P1:5′-GTTTTCCCAGTCACGAC-3′,P2:5′-CAGGAAACAGCTATGAC-3′。
1.4 病毒的扩增与总RNA的提取
取10倍稀释的原代病毒0.2 ml接种于10日龄SPF鸡胚尿囊腔,于37℃孵化箱孵化。选择24~72 h内死亡的鸡胚,置于4℃过夜,收集尿囊液。按Trizol法抽提尿囊液总RNA,操作参照说明书。
1.5 NP基因的扩增
根据Invitrogen公司的RT-PCR试剂盒操作说明进行操作,反应程序设定为:25℃10 min,42℃90 min,70℃10 min。PCR反应条件为:95℃预变性3 min;95℃30 s,54℃30 s,72℃1 min,30个循环;72℃10 min。PCR产物经0.8%琼脂糖凝胶电泳分析。
1.6 重组转座载体pFastBac-NP的构建
回收的NP基因经EcoRⅠ、PstⅠ酶切后,与经同样酶切的pFastBac1连接,在含100 μg/ml氨苄青霉素的LB琼脂平板上37℃培养过夜后,挑取单菌落,提取质粒电泳筛选,并进行酶切鉴定。酶切鉴定正确后送由上海英潍捷基生物技术有限公司测序,鉴定正确的克隆命名为pFastBac-NP。
1.7 重组杆状病毒穿梭载体的构建
参考 Invitrogen公司的 Bac-to-Bac Baculovirus Expression System使用说明,将阳性重组质粒pFast-Bac-NP转化DH10Bac感受态细胞,用含四环素(10 μg/ml)、卡那霉素(50 μg/ml)、庆大霉素(7 μg/ml)、IPTG(40 μg/ml)、X-gal(100 μg/ml)的LB琼脂平板筛选阳性菌落,挑取白色菌落,提取质粒,用通用引物M13F/M13R进行PCR鉴定,扩增条件如下:95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸2 min,30个循环;72℃延伸10 min。产物用0.8%琼脂糖凝胶电泳检测,获得的阳性重组转座子命名为rBacmid-NP。
1.8 重组杆状病毒rBac-NP的制备
将rBacmid-NP参照CellfectinⅡ Reagent转染试剂说明书转染处于对数生长期的Sf9昆虫细胞。转染后每12 h观察细胞生长状态,直至细胞出现明显的病变,72 h后收集培养基上清液,500 g离心5 min,将上清液转移至新的无菌管中,此即为P1代重组杆状病毒rBac-NP,4℃保存备用。
1.9 Western blot分析
将P1代rBac-NP按感染复数(MOI)为0.1感染对数生长期Sf9细胞,直至细胞出现明显病变(感染后约48~72 h),收集上清液即为P2代重组病毒,按此方法将病毒传至P3代。将P3代rBac-NP分别按MOI为1、5、10接种24孔板中Sf9细胞,分别在感染后24 h、48 h、72 h收集细胞沉淀,PBS洗涤1次后,于沉淀中加入100 μl 1×Loading buffer煮沸3 min后,取15 μl进行SDS-PAGE分析,以未接种病毒的细胞沉淀作为阴性对照。样品电泳结束后转印PVDF膜,以全病毒鸭抗血清作为一抗,以HRP标记的羊抗鸭IgG作为二抗,按常规方法进行Western blot。
1.10 间接免疫荧光试验
将P3代rBac-NP分别按MOI为1、5、10接种24孔板中Sf9细胞,在感染后48 h弃去上清液,PBS洗涤2次后,常规程序进行细胞免疫荧光,以全病毒鸭抗血清为一抗,以荧光素标记的羊抗鸭IgG为二抗。同时以未接种病毒的细胞作为阴性对照。
2 结果与分析
2.1 NP基因的扩增
NP基因PCR产物经0.8%的琼脂糖凝胶电泳,可见大约1 500 bp的条带(图1),与预期结果相符。
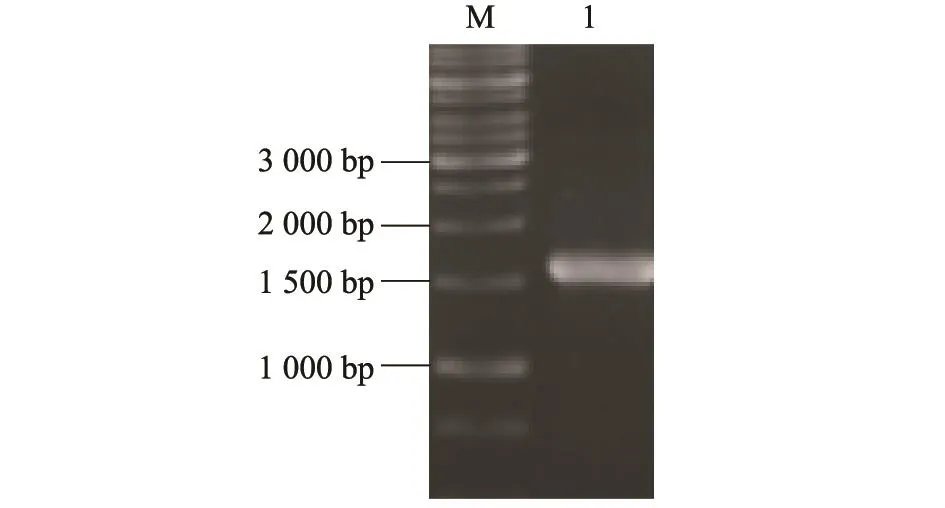
图1 目的基因的PCR扩增结果Fig.1 Amplification of target genes by PCR
2.2 重组转座载体pFastBac-NP的构建与鉴定
疑似重组质粒经EcoRⅠ和PstⅠ双酶切后出现约1 600 bp和4 800 bp两条带(图2),与预期相符,且DNA测序证明NP基因克隆正确且无突变。
2.3 重组杆状病毒穿梭载体的鉴定
以提取的疑似含有NP基因的重组杆粒DNA为模板,分别以NPP1/NPP2、M13P1/M13P2为引物进行PCR鉴定,产物经0.8%琼脂糖凝胶电泳后分别在约1 600 bp和4 800 bp处可见特异性条带,与预期片段大小相符(图3),而空载体对照组未出现特异条带,表明NP基因转座成功,获得的重组杆粒正确。
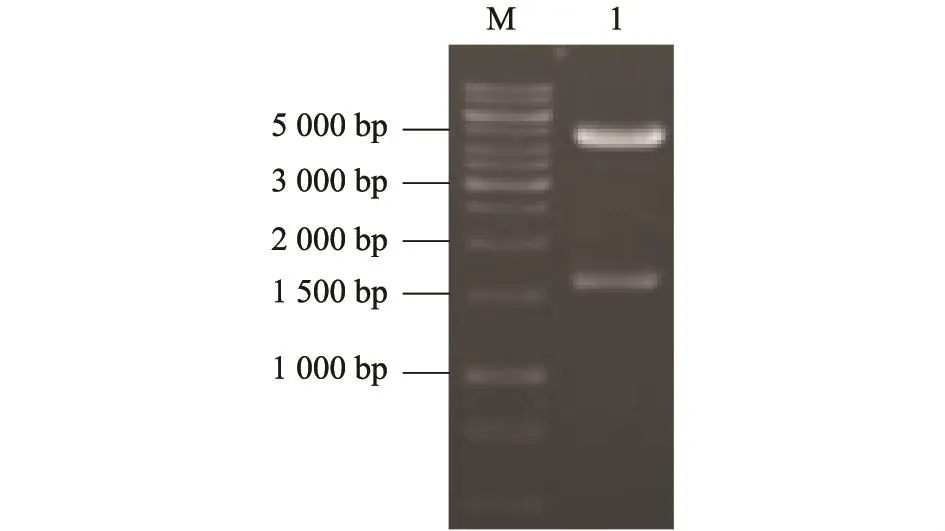
图2 重组质粒pFastBac-NP的酶切鉴定Fig.2 Identification of recombinant plasmid by restriction endonucleases digestion
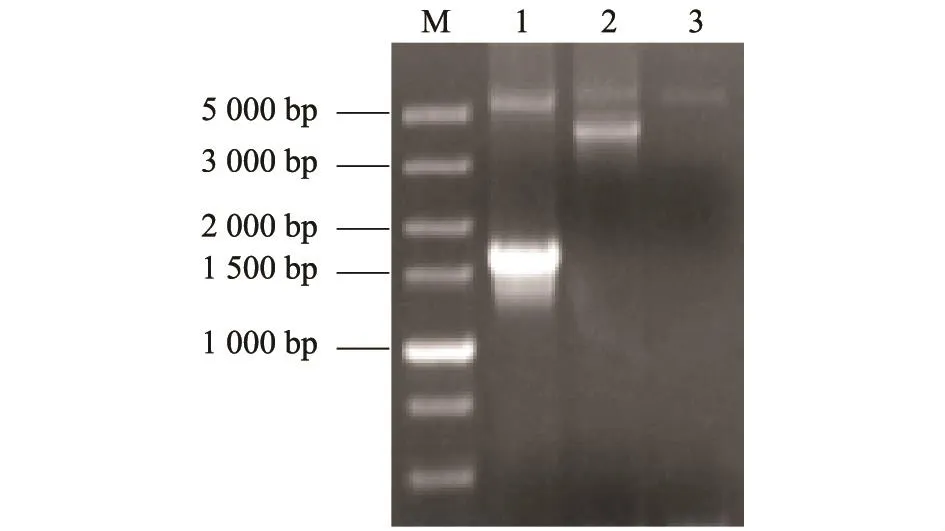
图3 重组转座子的PCR鉴定Fig.3 Identification of recombinant plasmid by PCR
2.4 重组杆状病毒的收获及感染细胞的病变
rBacmid-NP转染对数生长期昆虫细胞 Sf9, 5 d后可见细胞变大,细胞生长停止,细胞内出现颗粒,有些细胞肿大而破碎等明显的细胞病变现象,而未转染组的细胞未出现此现象。
2.5 F基因在昆虫细胞中的表达
2.5.1 Western blot鉴定 P3代 rBac-NP感染24孔板中对数生长期的 Sf9细胞,细胞沉淀经SDS-PAGE电泳后,采用鸭抗全病毒血清为一抗进行Western blot检测,结果在约53 000处出现特异条带(图4),分子量与目的蛋白质相同,而正常Sf9细胞未出现相应条带,说明重组蛋白质在昆虫细胞中获得了成功表达,且具备良好的反应原性。

图4 重组蛋白质的Western blot鉴定Fig.4 Western blot identification of recombinant protein
2.5.2 间接免疫荧光试验 P3代rBac-NP感染24孔板中对数生长期的Sf9细胞,以鸭抗全病毒血清为一抗进行间接免疫荧光分析,结果显示在感染rBac-NP的Sf9细胞中观察到了特异性荧光,而在对照孔细胞中未出现荧光(图5)。
3 讨论
自1997年以来在江苏、山东等地相继报道了鹅副粘病毒病以后,鸭源NDV也相继从发病鸭群中分离到,近些年鸭、鹅等水禽感染NDV并发病的病例越来越多,给中国的水禽养殖业带来了较大的损失。目前,疫苗接种仍然是预防和控制该病的主要手段和方法。NP蛋白质是NDV的核衣壳蛋白质,与病毒基因组RNA结合形成螺旋堆成的卷曲状结构[7]。不同毒株间NP基因的保守性很高,NP蛋白质在病毒粒子中是最丰富的蛋白质,具有天然的免疫原性,但不具有免疫保护作用,常用于监测疫苗接种程序和新城疫诊断中[8]。本试验利用鸭源新城疫病毒福建强毒株为研究对象,利用分子克隆技术克隆出NP基因片段,将其克隆入Bac-to-Bac杆状病毒载体中并且获得了成功表达。
Bac-to-Bac杆状病毒表达系统是一种比较成熟的真核表达系统,具有阳性重组率高、操作简便、成本低等优点,尤其是该系统可以获得大量的、免疫原性较好的、与天然蛋白质功能相似的可溶性重组蛋白质,因此被广泛应用于药物开发、重要药用蛋白质及疫苗研究等多个领域[9-11]。
本研究利用Bac-to-Bac杆状病毒表达系统在昆虫细胞中表达鸭源新城疫病毒NP基因。首先将NP基因克隆入杆状病毒转移载体pFastBac1中,转化感受态细胞DH10Bac,经抗性基因和蓝白斑筛选随机挑取白色菌落,分别以NP基因上、下游引物和M13上、下游引物进行PCR鉴定,以蓝色菌落为阴性对照,结果证实白色菌落为重组成功的阳性转座子。提取其DNA,脂质体介导下转染Sf9昆虫细胞,72 h后细胞出现典型病变。Westertn blot分析重组蛋白质表达产物,有一条约53 000的特异性条带,与理论值相符,且重组蛋白质与鸭抗全病毒血清也呈现了良好的反应原性,说明本系统表达的重组NP蛋白质可用于鸭源新城疫病毒的诊断和检测。
[1] 王永坤,田慧芳,周继宏,等.鹅副粘病毒病的研究[J].中国家禽,1998,20(4):3-5.
[2] 李世江,赵忠民,刘红娟,等.鸭副粘病毒病的诊治[J].中国动物保健,2003,53(7):51.
[3] 何永强,洪 健,吴旧生,等.致麻鸭产蛋下降的副粘病毒的分离和鉴定[J].中国兽医学报,2005,25(3):238-240.
[4] 张耀成,朱汉华.鸭副粘病毒与鸭疫里默氏杆菌混合感染的诊治[J].禽病防制,2005,22(5):28.
[5] 于 洋,封 振,何孔旺,等.新城疫病毒毒力分子机制研究进展[J].江苏农业学报,2013,29(2):435-439.
[6] 吴 双,王永娟,左伟勇,等.新城疫病毒LaSota疫苗株的准种遗传变异分析[J].江苏农业科学,2014,42(3):161-163.
[7] KHO C L,TAN W,YUSOFF K.Production of the nucleocapsid protein of newcastle disease virus in Escherichia coli and its assembly of into ring-like and nucleocapsid-like particles[J].Journal of Microbiology,2001,39(4):293-299.
[8] MAKKAY A M,KRELL P J,NAGY E.Antibody detection-based differential elisa for NDV-infected or vaccinated chickens versus NDV HN-subunit vaccinated chickens[J].Veterinary Microbiology,1999,66(3):209-222.
[9] HU Y C.Baculovirus as a highly efficient expression vector in insect and mammalian cells[J].Acta Pharmacol Sin,2005,26 (4):405-416.
[10]MARANGA L,CRUZ P E,AUNINS J G,et al.Production of core and virus-like particles with baculovirus infected insect cells[J].Adv Biochem Eng Biotechno,2002,74:183-206.
[11] ZHANG T,XU Y,QIAO L,et al.Trivalent human papillomavirus(HPV)VLP vaccine covering HPV type 58 can elicit high level of humoral immunity but also induce immune interference among componenttypes[J].Vaccine,2010,28(19): 3479-3487.
