基于“二维特征鉴别法”的巴西草药GENGIBRE真伪鉴别
2015-03-26徐文英马恺悦冯孟鑫顾选李妍芃赵百孝刘春生马长华韩丽
徐文英 马恺悦 冯孟鑫 顾选 李妍芃 赵百孝 刘春生 马长华 韩丽
干姜为姜科植物Zingiber offcinale Rosc.的干燥根茎[1],收载于2010年版《中华人民共和国药典》(一部),在中国及巴西均是药食两用的常用药材,具有温中散寒,回阳通脉,温肺化饮等功效,可用于脘腹冷痛,呕吐泄泻,肢冷脉微,寒饮喘咳。根据《葡汉词典》[2],巴西草药GENGIBRE在葡萄牙语中意为姜,在国外作为调味品及辛香料被广泛使用,与中国干姜的食用价值非常类似。为扩大中国干姜的药用资源,本文拟从基因鉴别与化学成分鉴别相结合的角度对巴西草药GENGIBRE进行真伪鉴别及品种鉴定。
DNA条形码技术是目前中药真伪鉴别及准确物种鉴定可靠的技术和方法,本研究拟对以巴西草药GENGIBRE的ITS序列进行DNA测序,作为基因鉴别结果。此外,中药干姜中所含 6-姜辣素(6-Gingerol)为其辛辣物质,具有强心、降血压、降血糖、降血脂、抗氧化、抗炎止痛等广泛的药理作用,其含量直接影响干姜的品质和药效。因此,选用6-姜辣素为指标对两者进行化学成分鉴别。通过巴西草药GENGIBRE与中国干姜中6-姜辣素的含量差异,结合两者的DNA条形码匹配度结果,为巴西草药GENGIBRE的品质鉴定及扩大中国干姜的药用资源提供理论依据[3-11]。
1 材料与仪器
1.1 材料
药材:巴西草药GENGIBRE 3份(巴西隆城市场,样品的凭证标本保存于北京中医药大学标本室)、中国干姜(北京市花家地南里同仁堂药店,经北京中医药大学刘春生教授鉴定为姜科植物姜Zingiber officinale Rosc.的干燥根茎)、6-姜辣素(中国药品生物制品鉴定所,批号:111833-201102);试剂:乙腈(色谱纯,Fisher)、甲醇(色谱纯,Fisher)、娃哈哈纯净水、液氮。
1.2 仪器
植物DNA提取试剂盒(北京博迈德生物有限公司,批号:69691125)、TProfessiona型PCR扩增仪(德国 Biometra公司,批号:20092237)、ContigExpress软件。
岛津LC-20AT液相色谱仪(日本岛津公司)、水浴锅、粉碎机(型号:FW-100,北京中兴伟业仪器有限公司)、电子天平sartorius AG BS110S(北京赛多利斯仪器系统有限公司)、XBrige C18色谱柱(150 mm ×4.6 mm,5 μm,美国 Waters公司)、FW400A高速万能粉碎机(北京科伟永兴仪器有限公司)、Sartorius BS110S分析天平、KQ-400KDE型高功率数控超声波清洗器(昆山市超声仪器有限公司)。
2 方法与结果
采用DNA条形码技术和HPLC技术对巴西草药GENGIBRE进行真伪鉴别分析。即先根据样品的遗传信息确定其基源,结合指标性成分的含量高低或存在与否,相互印证得出结论。
2.1 DNA条形码分析
2.1.1 DNA提取 样品经乙醇消毒后,取每份样品加液氮研磨成细粉,用博迈德DNA提取试剂盒提取,按照说明书提取总DNA,取5μL 1%的琼脂糖凝胶进行电泳。
2.1.2 ITS序列的扩增 采用扩增ITS序列的通用引物,ITS上游引物 P1:5'-AGAAGTCGTAACAAGGTTTCCGTAGG-3';ITS下游引物P4:5'-TCCTCCGCTTATTGATATGC-3'。扩增反应在PCR扩增仪上进行,50μL反应体系中含模板2.5μL,Tap Mix酶25μL,引物 P1 2.5 μL,引物 P4 2.5 μL。扩增程序为:94℃预变性5分钟;94℃变性50秒;55℃退火50秒;72℃延伸1分钟;35个循环,最后72℃延伸10分钟。
2.1.3 测序 PCR产物在紫外灯下从1%的琼脂糖凝胶上进行切胶,由上海生工生物工程有限公司测序部测序。各样品均采用正向和反向测序,以保证测序的准确性。PCR产物电泳结果如图1所示,PCR产物电泳在750 bp左右出现单一、清晰且明亮的条带。3份样品的测序峰图良好,测序结果一致,截取ITS片段后选择一条序列用于后续分析。
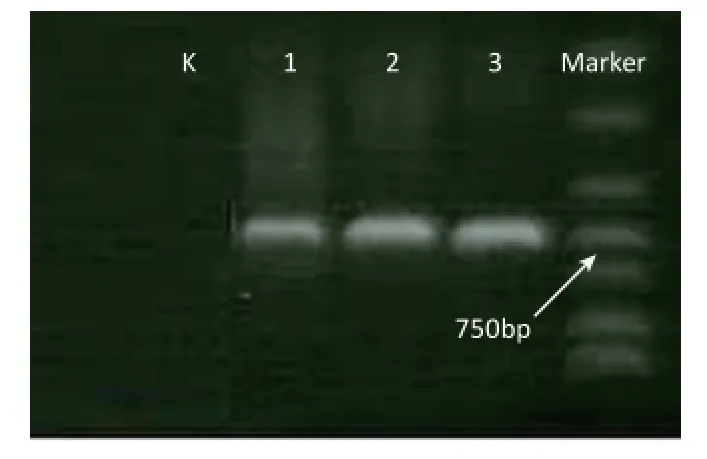
图1 PCR产物电泳结果
2.1.4 序列分析 利用contig1软件对测序获得的正、反向序列进行拼接,根据BLAST所获相似度最高物种的ITS序列边界,截取待鉴定物种的ITS序列,对截取后待鉴定样品的ITS序列进行检索,综合考虑Score值、Coverage值、evalue值,初步确定相似度最高的物种为待鉴定样品的基原。结果如图2所示。图2表明,样品与芸香科吴茱萸植物相似度最高,相似度范围为97% ~99%,因此初步鉴定该样品来自芸香科吴茱萸Tetradium ruticarpum。
2.2 HPLC 法分析
2.2.1 对照品及供试品溶液的制备 对照品溶液制备:取 6-姜辣素对照品,精密称定,配制成0.1014 mg/mL的对照品溶液,使用前0.45μm微孔滤膜过滤,即得。
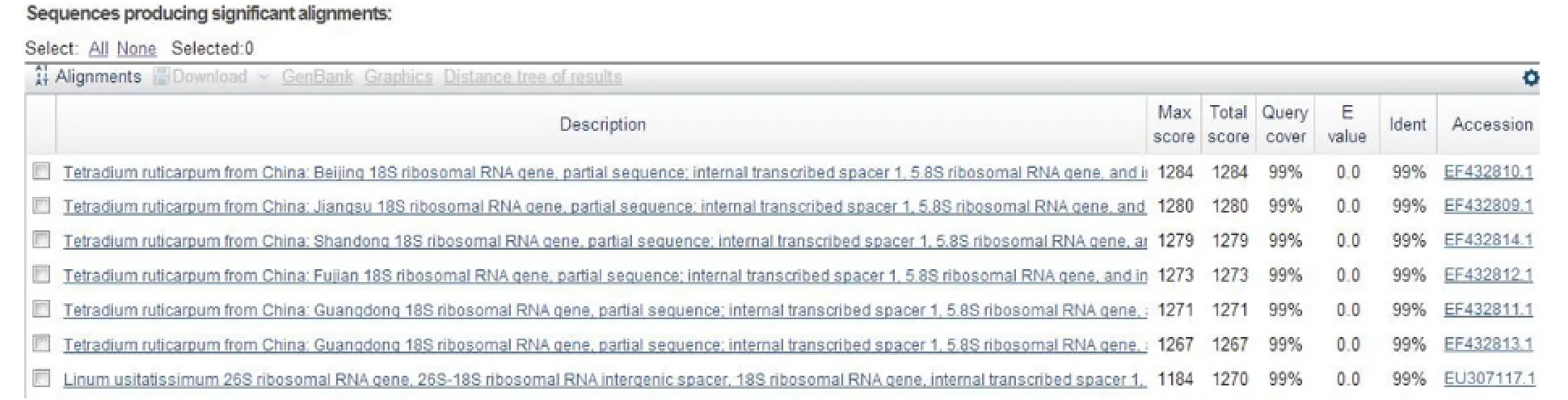
图2 巴西样品GENGIBRE的ITS序列BLAST结果
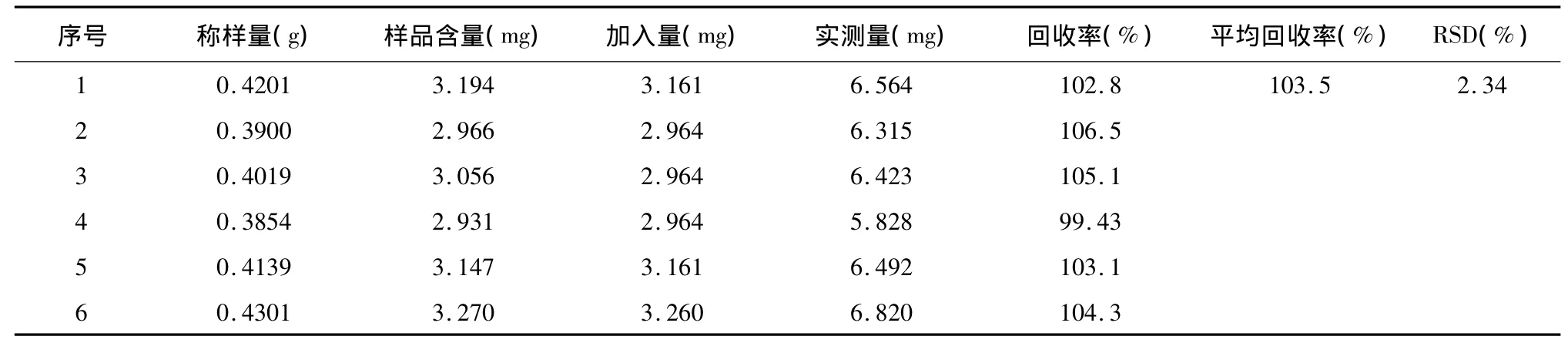
表1 中国干姜6-姜辣素的加样回收率结果

图3 对照品溶液及各供试品溶液的HPLC图谱
供试品溶液制备:取各样品粉末0.8 g(粉碎机粉碎,过80目筛),置50 mL锥形瓶中,准确移取甲醇25 mL加入,准确称量,水浴加热回流30分钟,放冷至常温,甲醇补重,摇匀,过滤,续滤液0.45μm微孔滤膜过滤,即得。
2.2.2 色谱条件 色谱柱:XBrige C18色谱柱(150 mm ×4.6 mm,5 μm,美国 Waters公司),流动相:0 ~20 分钟:乙腈 -水(45:55),流速:1.0 mL/分钟,进样量:10μL,柱温:30℃,检测波长:280 nm。
2.2.3 专属性考察 按”2.2.1”项下方法制备对照品溶液及各供试品溶液,分别精密吸取对照品及各样品供试溶液10μL,按上述色谱条件进样分析,各色谱图见图3。如图所示,测定方法专属性好,待测成分与其他成分分离度大于1.5,且其他成分对待测成分测定无干扰。
2.2.4 线性关系考察 精密吸取”2.2.1”项下对照品溶液 1 μL、5 μL、10 μL、20 μL、30 μL、40 μL,按”2.2.2”项下色谱条件进行测定,记录峰面积。线性方程为 Y=737357X -34852,R2为0.9999,结果表明6-姜辣素在0.1014~4.056μg质量范围内线性关系良好。
2.2.5 精密度考察 精密称定中国干姜样品0.8 g,按“2.2.1”项下方法制备供试品溶液,按“2.2.2”项下色谱条件进行测定,连续进样6次,每次进样10μL,记录峰面积。结果显示,RSD为0.45%,表明本法精密度良好。
2.2.6 稳定性考察 精密称定中国干姜样品0.8 g,按“2.2.1”项下方法制备供试品溶液,分别于室温放置0小时、2小时、4小时、6小时、8小时,按”2.2.2”项下色谱条件进行测定,记录峰面积。结果显示,RSD为1.07%,表明本法稳定性良好。
2.2.7 重现性考察 精密称定中国干姜样品0.8 g,一式 6 份,按“2.2.1”项下方法制备供试品溶液,按“2.2.2”项下色谱条件进行测定,记录峰面积,计算RSD值。结果显示,RSD为1.05%,表明本法重复性良好。
2.2.8 加样回收率实验 取6份中国干姜样品,每份约0.4 g,精密称定,分别精密加入一定量的6-姜辣素标准溶液,按“2.2.1”项下方法制备供试品溶液,按“2.2.2”项下色谱条件进行测定,记录峰面积,计算回收率与RSD,6-姜辣素的平均回收率为103.5%,RSD为2.34%,表明本法含量测定结果良好。结果见表1。
2.3 6-姜辣素的含量测定结果
分别取巴西草药GENGIBRE、中国干姜约0.8g,精密称定,一式3份,按“2.2.1”项下方法制备供试品溶液,并按”2.2.2”项下色谱条件进行测定,记录峰面积,计算待测成分含量,巴西草药、中国干姜中6-姜辣素含量分别为0.112%和0.759%。结果见表2。

表2 巴西草药GENGIBRE、中国干姜中6-姜辣素的含量(n=3)
3 讨论
本实验采用“二维特征鉴别法”,对未知巴西草药GENGIBRE进行以中国干姜为标准的定向真伪鉴别。其一借助中药DNA条形码技术,对样本进行基原判别;其二利用HPLC技术对样品与定向鉴别品种中指标性成分进行含量测定。最终将所得判别结果与含量测定结果进行相互比对,综合评判样品真伪。由DNA条形码技术结果可知巴西草药GENGIBRE与芸香科植物吴茱萸相似度最高,相似度范围在97%~99%,因此初步鉴定该样品来自芸香科吴茱萸Tetradium ruticarpum。由HPLC法测定干姜中活性成分6-姜辣素含量结果可知,两者均含有6-姜辣素,含量分别为0.112%和0.761%。巴西样品GENGIBRE中6-姜辣素含量远远低于2010年版《中华人民共和国药典》(一部)规定标准0.60%,而中国干姜样品品质良好。综合两者结果可知,仅从化学成分角度进行真伪鉴别易出现假阳性,而仅从基因角度鉴别无法得知样品品质。因此,本实验利用两种方法结合比较,从而对未知样品进行“真伪优劣”的全面鉴别。
另外,本实验对巴西药草GENGIBRE中6-姜辣素含量测定时出现假阳性结果,可能是由于吴茱萸的炮制方法中包含姜制法。因此,在进行干姜的真伪鉴别时,若干姜样品粉末中掺杂姜制吴茱萸粉末,则仅依据HPLC图谱中6-姜辣素峰的有无无法判定未知样品是否为干姜,还需要额外的判别指标进行印证。本文采用的“二维特征鉴别法”为中药的质量控制、资源普查、新品种选育等方面的研究提供了新的思路,具有非常重要的现实意义。
[1] 国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:14.
[2] 陈用仪.葡汉词典[M].北京:商务印书馆,2010.
[3] 陈洁艳,黄芳,羊超菠,等.高效液相色谱法测定生姜中的有效成分6-姜辣素[J].科技创新导报,2015,(5):146.
[4] 张宏武,安培坤.生姜炮制品种及其临床应用刍议[J].西部中医药,2015,28(4):24-26.
[5] 龙全江,徐雪琴.干姜化学成分、药理作用及加工炮制研究文献分析[J].现代中药研究与实践,2015,29(1):82-83.
[6] 邓仙梅,吴燕妮,王淑美,等.正交试验优选干姜中姜辣素的提取工艺[J].中医学报,2015,30(1):83-85.
[7] Maranon JA,de los Santos L,Lozano C,et al.HPLC-DAD selective method for ginger root powder and extracts nauseastop as standarized not mutagenic ginger extract[J].Planta Medica,2014,80(10):832-832.
[8] Yudthavorasit Soparat,Wongravee Kanet,Leepipatpiboon Natchanun.Characteristic fingerprint based on gingerol derivative analysis for discrimination of ginger(Zingiber officinale)according to geographical origin using HPLC-DAD combined with chemometrics[J].Food Chemistry,2014(158):101-111.
[9] 白英鸽,梁光义,高源,等.HPLC法测定比较人参四逆汤传统汤剂、复方颗粒剂和配方颗粒剂中6-姜辣素含量[J].贵阳中医学院学报,2014,36(3):1-5.
[10] 陈艳,周冬翠,张梅.三种方法提取生姜有效部位群并测定6-姜辣素含量[J].中国药师,2015,17(7):1099-11002.
[11] 刘雯,刘佳乐,黄亮,等.HPLC法测定生姜提取液中6-姜酚含量的研究[J].广东化工,2014,41(17):169-170.
