不同品种小麦抗氧化系统对水分胁迫的响应
2015-03-26时振振李胜马绍英王雅梅苏李维唐斌赵生琴苏利荣
时振振,李胜,2*,马绍英,王雅梅,苏李维,唐斌,赵生琴,苏利荣
(1.甘肃农业大学生命科学技术学院,甘肃 兰州730070;2.甘肃省干旱生境作物学重点实验室,甘肃 兰州730070;3.甘肃农业大学农学院,甘肃 兰州730070)
干旱是农作物生长发育,完成生命周期中经常遭受的一种逆境胁迫现象,对植物的生理代谢和产量产生重大的影响,是制约农业生产的主要逆境因子之一。据统计,世界上有1/3的可耕作土地处于水分胁迫状态[1]。我国是个水资源短缺的国家,其中干旱、半干旱的土地面积约占总国土面积的52.5%[2],而西北地区又是我国主要的干旱和半干旱地区,因此,干旱现已成为阻碍西北农业发展的主要因素。
植物的抗旱性主要通过渗透调节物质的增加、细胞膜脂成分的改变、自由基的产生和清除等综合因素作用的结果[3]。小麦(Triticumaestivum)生理生化特征变化被认为是其抗旱性的内在原因,其中可溶性糖含量、脯氨酸含量、质膜透性、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性和过氧化氢酶(CAT)活性等是与抗旱性密切相关的重要生理指标[4-5]。有研究表明,水分能显著影响小麦可溶性糖、脯氨酸以及MDA的含量,在干旱胁迫下可溶性糖和脯氨酸含量明显增加[6-8],且由于干旱胁迫促进了细胞内自由基的代谢而产生大量活性氧,当活性氧的积累超过伤害阈值时,会引起细胞膜脂过氧化反应从而产生MDA,导致MDA含量升高并对细胞膜系统造成伤害,从而损害植物的生长[9-10]。在干旱胁迫下能有效地清除植物体内活性氧的抗氧化防御系统主要包括过氧化物酶、超氧化物歧化酶和过氧化氢酶等,其能降低膜脂过氧化水平,从而使膜受伤害的程度减轻[11]。大量研究表明,小麦在水分胁迫下以上抗氧化酶的活性呈上升的趋势[12-14]。因此,人工模拟条件下的水分胁迫成为研究小麦抗旱机理的主要途径之一。尽管前人对小麦的抗旱性研究较多,但对不同品种小麦以上抗旱指标的综合研究以及小麦不同部位对抗旱性的响应的研究鲜有报道。本文拟通过不同水分胁迫程度、不同胁迫时长以及复水等处理,探讨水分胁迫及复水对旱地小麦品种“西旱2号”和水地小麦品种“永良4号”中抗旱指标的影响,以期为两小麦在干旱和半干旱地区的种植及水分管理提供理论参考,并通过对小麦叶、鞘和茎中抗旱指标变化的研究以确定分析小麦抗旱性的最佳部位。
1 材料与方法
1.1 材料与处理
试验于2013年在甘肃农业大学校内试验基地进行。选用小麦品种西旱2号(旱地品种,抗旱性强,用字母A表示)和永良4号(水地品种,抗旱性弱,用字母B表示)为试验材料。小麦品种由甘肃农业大学农学院提供。采用塑料水桶盆栽种植,桶直径30cm,高26cm。土壤为砂壤土,0~20cm土壤含有机质13.6g/kg、全氮0.9 g/kg、水解氮64mg/kg,速效磷13.0mg/kg,速效钾125mg/kg,缓效钾1.5g/kg。施水前土壤基础养分状况:肥料(硫酸钾0.3g/kg,尿素0.3g/kg,过磷酸钙0.75g/kg)与选用土壤混匀后直接施入桶中。每桶装过筛土12 kg,每桶4穴,每穴3粒,每处理15桶,常规栽培管理。共设5个土壤水分处理:T1:生育期充足供水(CK),土壤含水量维持在田间持水量的70%~75%;T2:开花前轻度水分胁迫(土壤含水量为田间持水量的55%~60%),灌浆期复水;T3:开花前轻度水分胁迫(土壤含水量为田间持水量的55%~60%),直到成熟;T4:开花前中度水分胁迫(土壤含水量为田间持水量的45%~50%),灌浆期复水;T5:开花前中度水分胁迫(土壤含水量为田间持水量的45%~50%),直到成熟。试验所用种子预先在实验室进行催芽处理,将种子放在铺有湿润滤纸的培养皿中,用湿纱布覆盖,并保持滤纸和纱布的湿润。待大部分种子露白后,挑选发芽一致的种子于4月初播种。从播种到拔节期前,所有盆栽小麦均充分供水,自孕穗期开始控水,至灌浆期土壤含水量达到处理所需要求为止。控水采用称重法,每处理选10盆进行称重,取平均值。苗期每5d称重一次,由于后期需水量增大,改为3d称重一次,每天生长量忽略不计。
每处理选择生长一致的主茎,并标记。选择灌浆期一致的小麦作为实验材料,在灌浆期(0d)及以后乳熟期(7d)、蜡熟期(14和21d)、完熟期(28d)分别取样一次,每处理每次取样20个小麦主茎,然后迅速将样品分解为叶、鞘、茎3部分,经液氮速冻后置于-60℃冰箱中,用于各指标的测定。以上处理均重复3次。
1.2 测定指标与方法
游离脯氨酸(proline,Pro)含量的测定采用茚三酮显色法[15];可溶性糖含量的测定根据蒽酮比色法[15];丙二醛(malondialdehyde,MDA)含量的测定采用硫代巴比妥酸法[15];超氧化物歧化酶(superoxide dismutase,SOD)活性的测定采用氮蓝四唑还原法[15];过氧化氢酶(catalase,CAT)活性的测定采用钼酸铵比色法[15];过氧化物酶(superoxidase,POD)活性的测定采用愈创木酚法[15]。
1.3 数据分析
采用Excel 2003和SPSS 11.5软件进行统计、处理及分析试验数据。
2 结果与分析
2.1 水分胁迫及复水对小麦植株脯氨酸含量的影响
脯氨酸作为植物在逆境条件下增强抗性的一种重要渗透调节物质,在逆境胁迫时其含量会增加。如图1和图2所示,脯氨酸的含量随水分胁迫程度和时间的增加而增加,复水后其含量呈下降趋势。叶和鞘中脯氨酸含量在水分胁迫和复水过程中的变化幅度相似且较茎中变化幅度大,表明水分胁迫下,就脯氨酸含量变化而言,叶和鞘较茎敏感。在不同程度水分胁迫下,西旱2号处理组AT3和AT5叶中脯氨酸含量较对照组AT1分别高87.4%和79.0%,与之相应的永良4号处理组BT3和BT5分别较对照组BT1高39.5%和64.8%,鞘和茎表现出与叶相同的变化趋势。从复水开始直到复水后第14天,叶、鞘和茎的脯氨酸含量一直呈下降趋势,在复水后第14天,轻度胁迫下西旱2号和永良4号叶中脯氨酸含量达到最低,与复水第0天相比分别降低了49.9%和25.5%,且西旱2号低于对照,而永良4号则恢复到对照水平。在复水14d以后,西旱2号脯氨酸含量维持在正常水平而永良4号则略高于正常水平。中度水分胁迫后,脯氨酸含量随复水时间的延长呈下降趋势且高于对照组。鞘和茎在复水处理中表现出与叶相似的趋势。
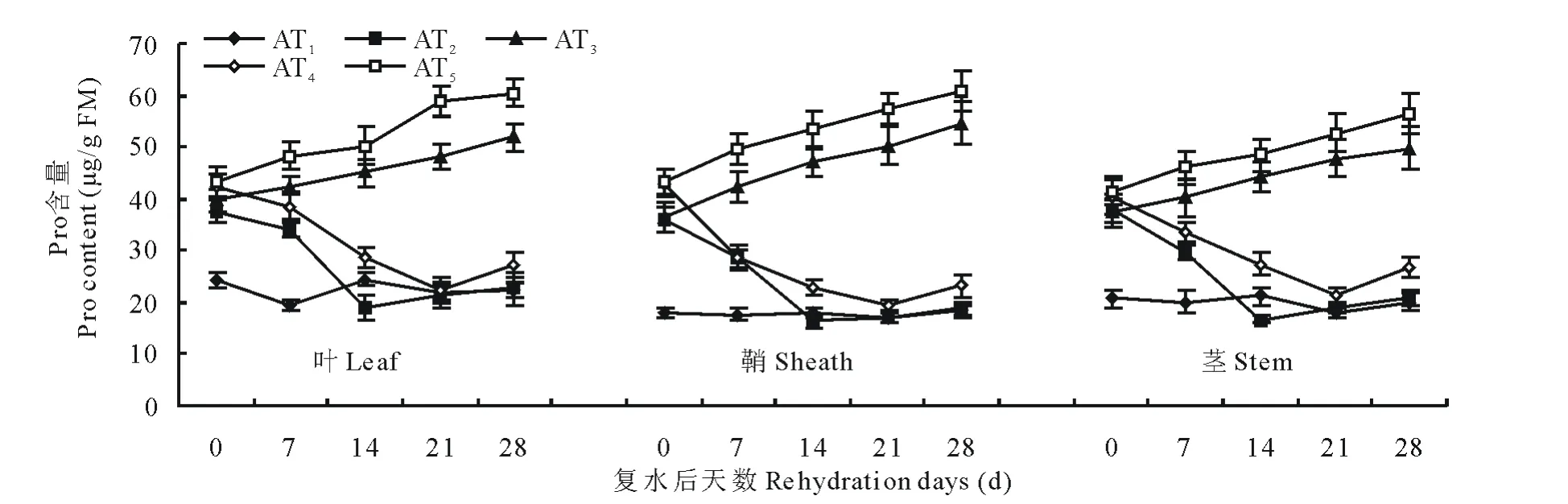
图1 西旱2号水分胁迫及复水后对脯氨酸含量的影响Fig.1 The effect of water stress and rehydration on Pro content in Xihan 2
2.2 水分胁迫及复水对小麦植株可溶性糖含量的影响
供试材料经水分胁迫和复水后可溶性糖含量变化如图3和图4所示。随水分胁迫程度和时间的增加,小麦植株中可溶性糖含量呈持续增加的趋势;复水后,可溶性糖含量呈先升后降的趋势,且其变化幅度叶大于鞘,鞘和茎则表现相似。说明水分胁迫下,3种器官对可溶性糖含量变化的敏感性为叶>鞘≈茎。在轻度水分胁迫下,复水后第7天可溶性糖含量低于对照组并达到超补偿效应,其中西旱2号和永良4号叶中可溶性糖含量分别较对照组降低了15.7%和11.2%;中度水分胁迫下,复水后可溶性糖含量均高于对照组,未达到补偿效应。鞘和茎中可溶性糖含量的变化趋势和叶相似。
图2 永良4号水分胁迫及复水后对脯氨酸含量的影响Fig.2 The effect of water stress and rehydration on Pro content in Yongliang 4
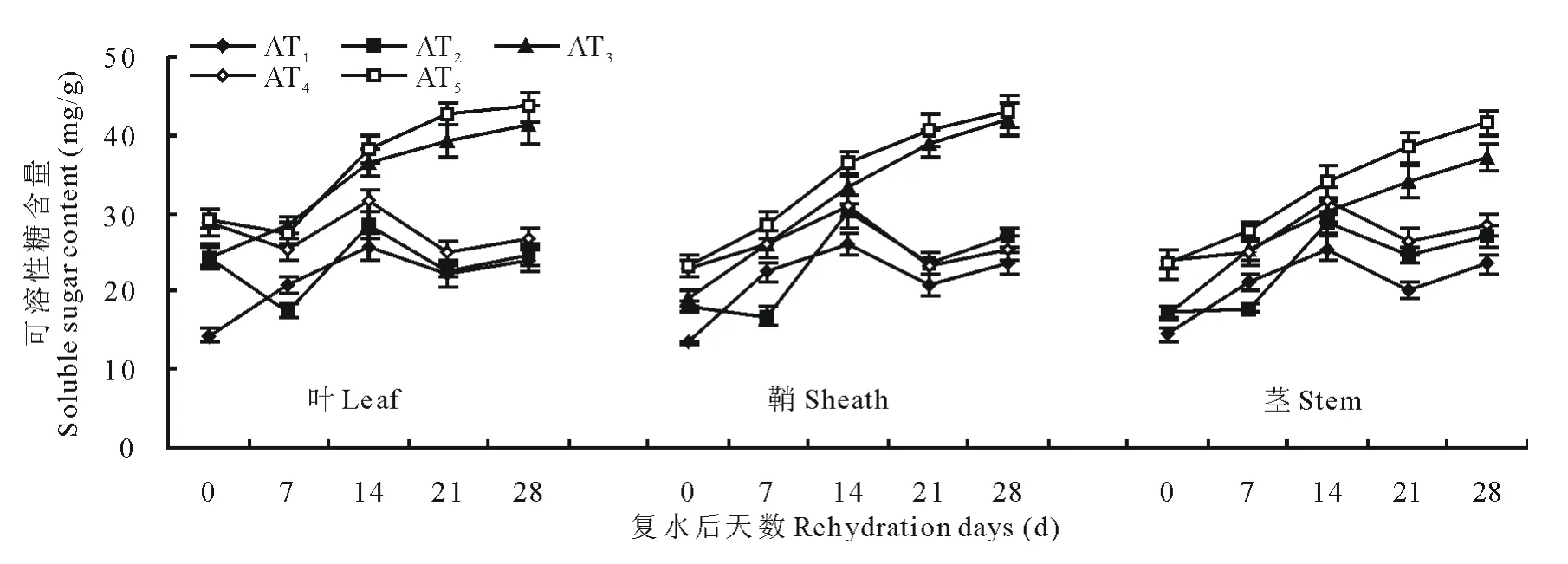
图3 西旱2号水分胁迫及复水后对可溶性糖含量的影响Fig.3 The effect of water stress and rehydration on soluble sugar content in Xihan 2

图4 永良4号水分胁迫及复水后对可溶性糖含量的影响Fig.4 The effect of water stress and rehydration on soluble sugar content in Yongliang 4
2.3 水分胁迫及复水对不同小麦品种不同器官MDA含量的影响
由图5和图6可知,在水分胁迫和复水作用下,小麦中丙二醛含量变化趋势和脯氨酸类似。不同的是,在水分胁迫下对丙二醛含量变化表现最敏感的是叶,鞘次之,茎最不敏感。由图5可知,中度水分胁迫始终比轻度水分胁迫下的MDA含量高,中度水分胁迫和轻度水分胁迫下叶中MDA含量在14d时分别是对照组的2.02和1.80倍。同样水分胁迫条件下,永良4号中MDA含量均高于西旱2号,说明永良4号细胞膜受损程度要大于西旱2号。轻度水分胁迫下进行复水,西旱2号中MDA含量在复水第14天及以后均达到对照水平,而中度水分胁迫下进行复水MDA含量则均高于对照组。永良4号中MDA含量变化与西旱2号相似,如图6所示,但轻度水分胁迫下进行复水,MDA含量恢复到对照水平的时间为复水后第21天。
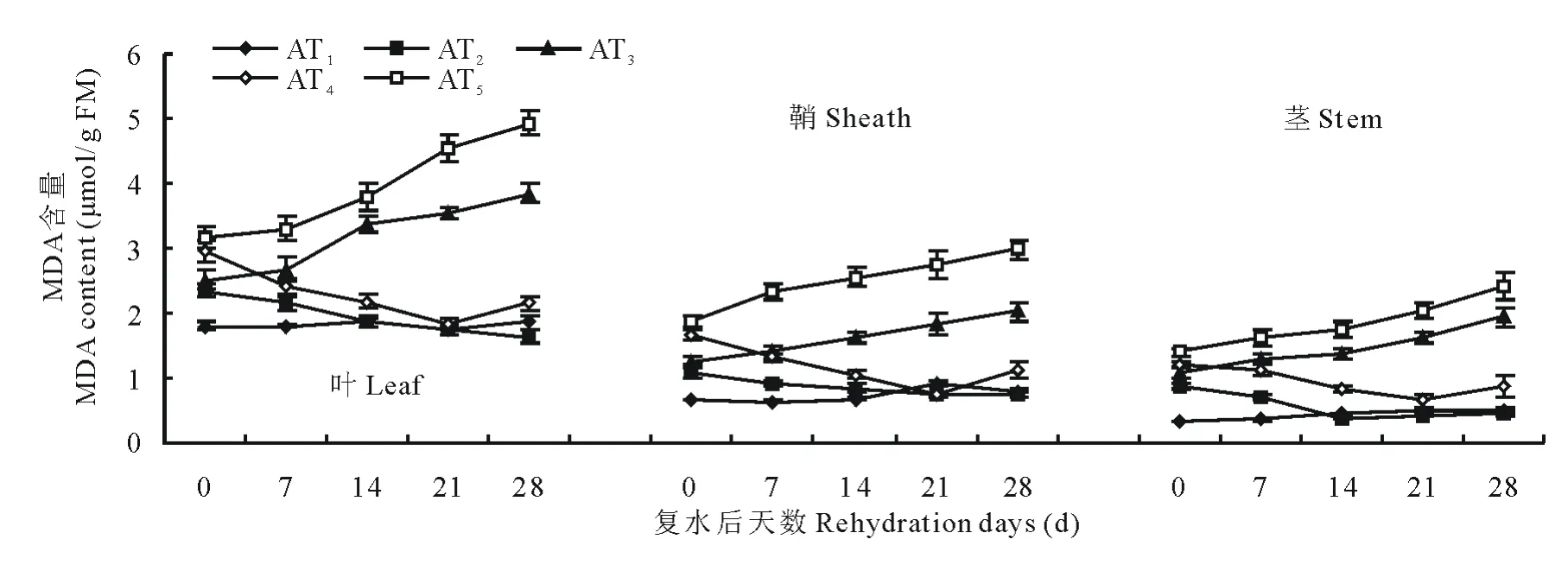
图5 西旱2号水分胁迫及复水后对MDA含量的影响Fig.5 The effect of water stress and rehydration on MDA content in Xihan 2
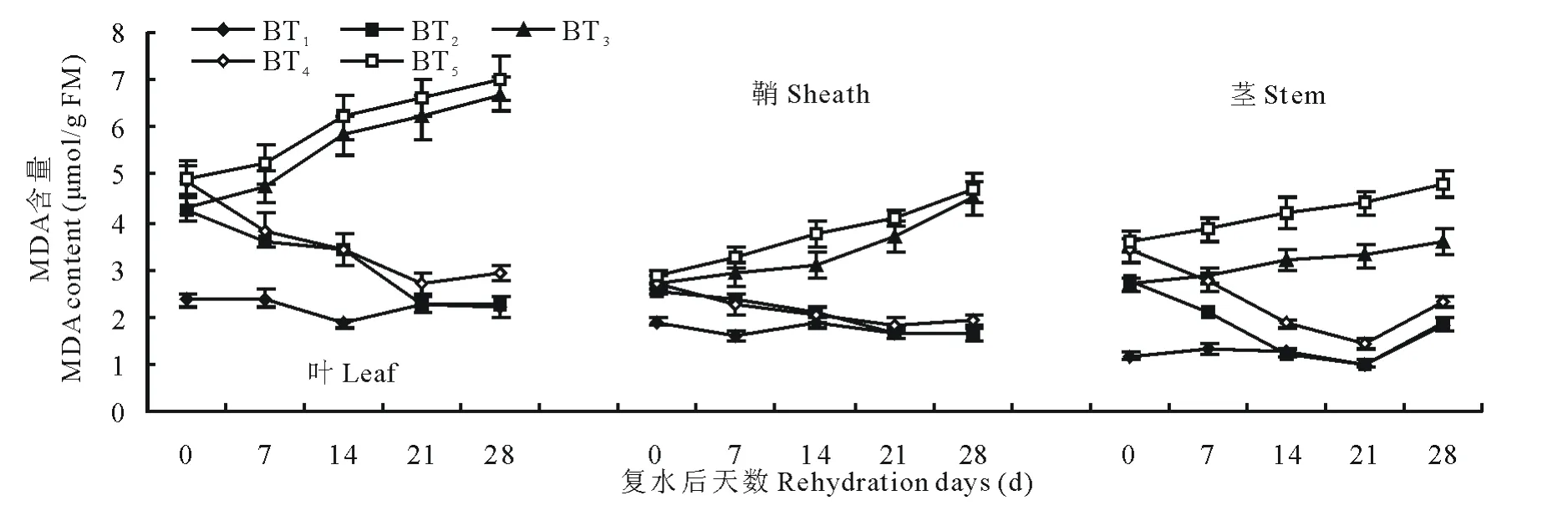
图6 永良4号水分胁迫及复水后对MDA含量的影响Fig.6 The effect of water stress and rehydration on MDA content in Yongliang 4
2.4 水分胁迫及复水对小麦植株抗氧化酶系统的影响
水分胁迫及复水对小麦植株抗氧化酶系统的影响如表1至表6所示,轻度水分胁迫下,小麦叶、鞘和茎中SOD,POD和CAT活性均有不同程度的上升。以处理第14天的叶为例,西旱2号和永良4号在轻度水分胁迫下,与对照相比,CAT活性分别增加了85.3%和75.0%,POD活性分别增加了47.0%和40.5%,SOD活性分别增加了78.7%和67.0%,西旱2号中抗氧化酶活性增加幅度均大于永良4号。但中度水分胁迫下,3种酶的活性呈先升高后降低的趋势,且从处理第14天开始酶活性持续下降,原因可能是持续的中度水分胁迫破坏了细胞内部结构进而导致酶失活。轻度和中度水分胁迫下进行复水,3种酶的活性均呈先降后升的趋势。轻度水分胁迫下进行复水,西旱2号和永良4号在复水第14天时叶中CAT的活性与复水第0天相比,分别下降了87.1%和68.8%。3种酶的活性在复水第14天时均降到最低,且轻度水分胁迫处理组的酶活性低于对照水平,达到超补偿效应,随后则恢复到对照水平,而中度水分胁迫处理组则始终高于对照组,没有达到补偿效应。从以上分析可知,3种抗氧化酶活性在水分胁迫下增加及复水后下降的幅度依次表现为叶>鞘>茎,说明对水分胁迫下抗氧化酶活性的敏感性叶大于鞘,茎的敏感性最弱。
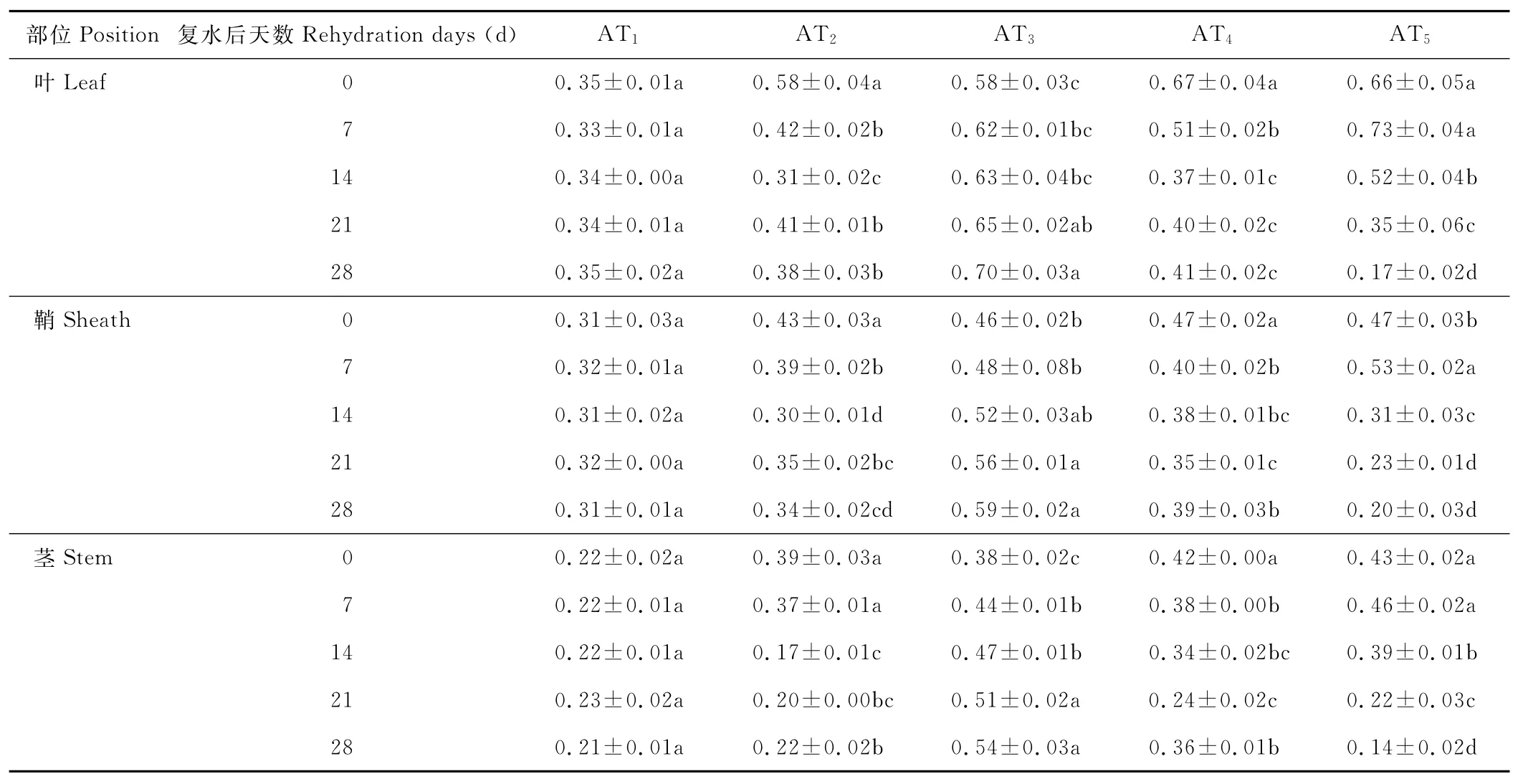
表1 西旱2号水分胁迫及复水后对CAT活性的影响Table 1 The effect of water stress and rehydration on CAT activity in Xihan 2 U/(g·min)
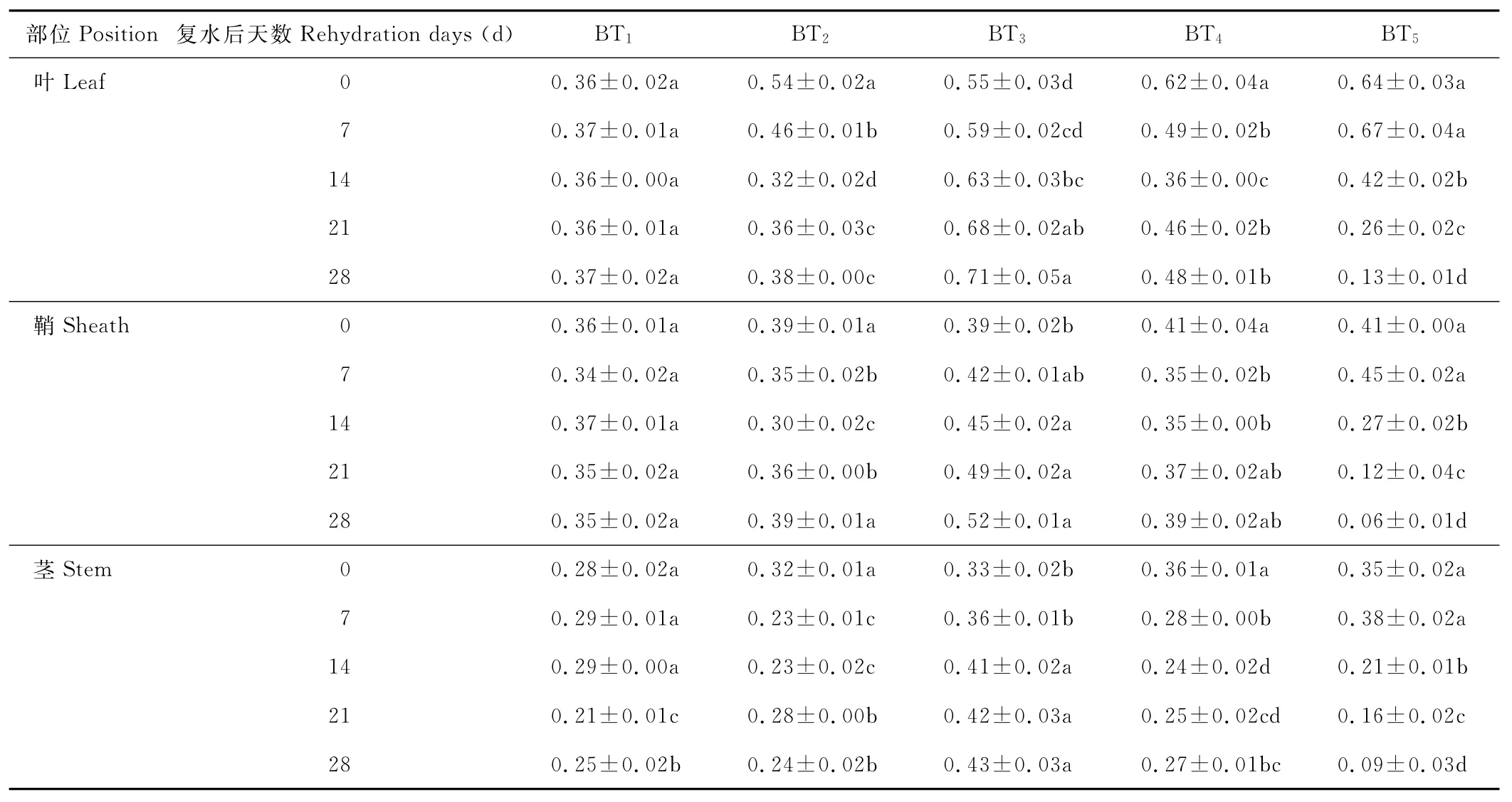
表2 永良4号水分胁迫及复水后对CAT活性的影响Table 2 The effect of water stress and rehydration on CAT activity in Yongliang 4 U/(g·min)
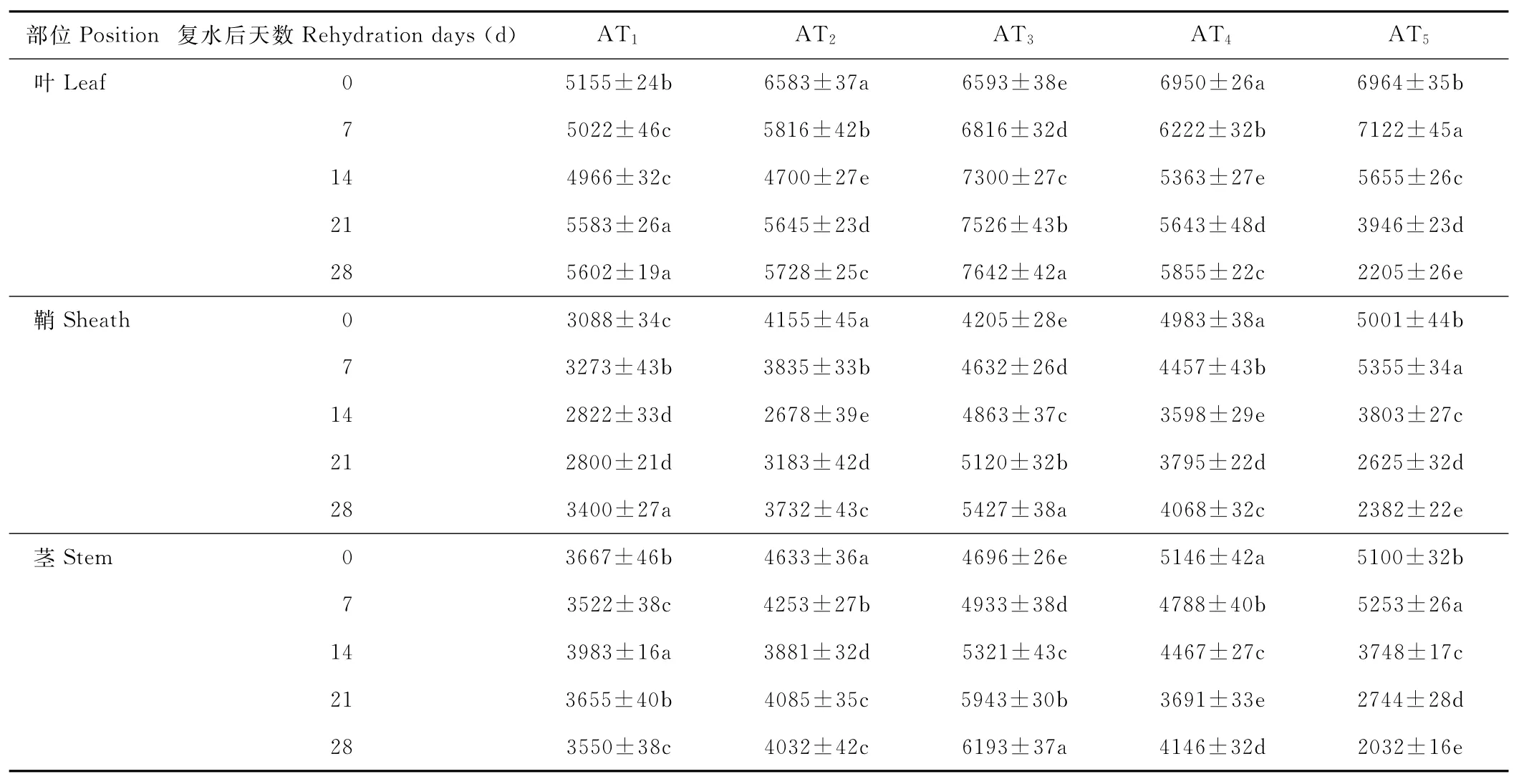
表3 西旱2号水分胁迫及复水后对POD活性的影响Table 3 The effect of water stress and rehydration on POD activity in Xihan 2 U/(g·min)
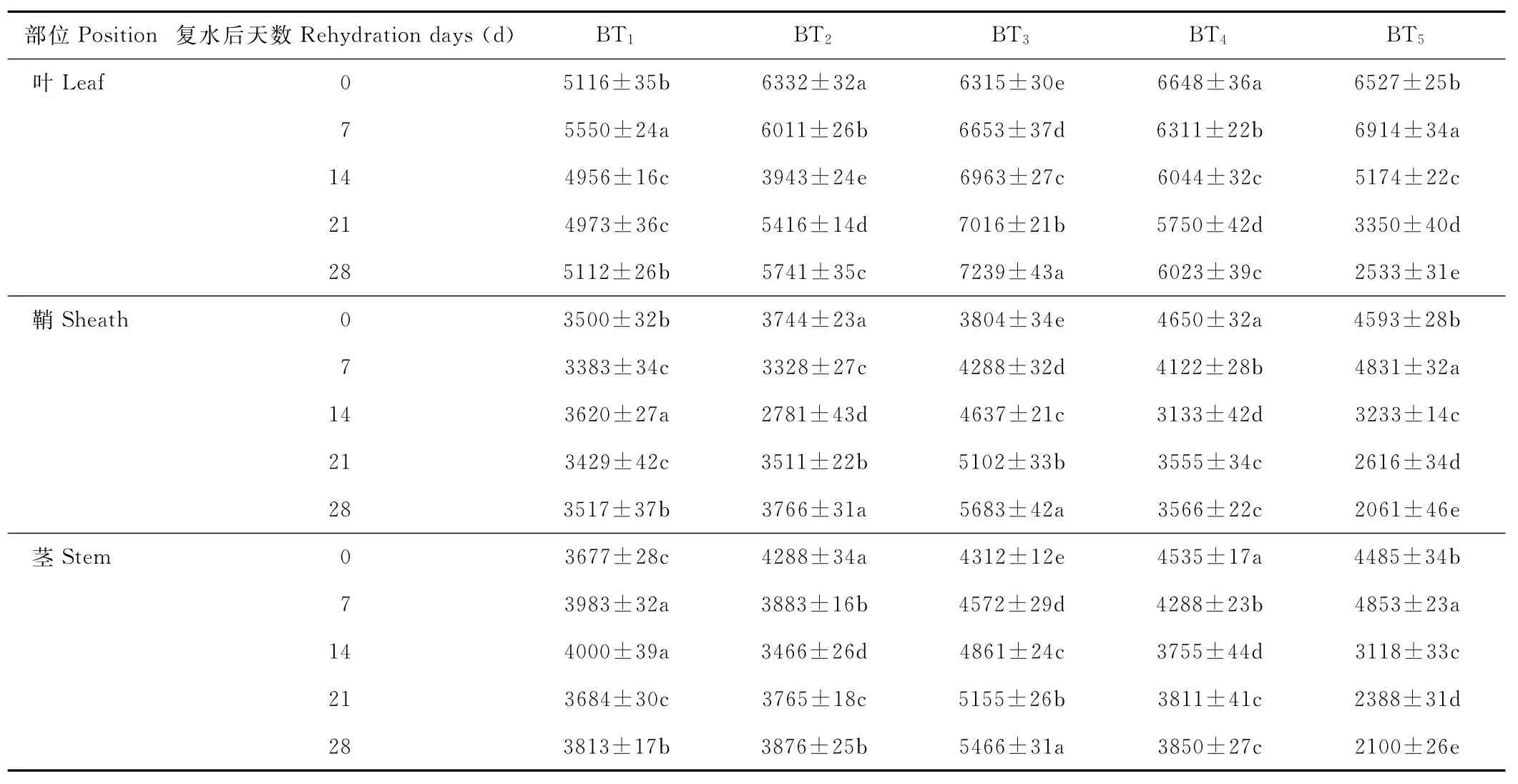
表4 永良4号水分胁迫及复水后对POD活性的影响Table 4 The effect of water stress and rehydration on POD activity in Yongliang 4 U/(g·min)
3 讨论
渗透调节是植物抗旱的一种重要生理机制,与植物的抗旱性有密切的关系[16-17]。脯氨酸和可溶性糖作为植物体内重要的渗透调节物质,是植物应对逆境胁迫的重要物质基础[18]。杨书运等[19]研究表明,干旱胁迫下可溶性糖和脯氨酸含量增加幅度较大的小麦品种抗旱性强。本研究结果显示,脯氨酸和可溶性糖含量随水分胁迫程度和时间的增加而显著增加,这与赵文才等[20]的研究结果一致,并且旱地小麦品种西旱2号中两物质增加的幅度大于水地品种永良4号。在复水处理试验中,西旱2号中可溶性糖和脯氨酸含量下降程度大于永良4号,并且轻度水分胁迫下,西旱2号在复水第14天时脯氨酸含量达到超补偿效应。以上分析表明,在干旱胁迫下可溶性糖和脯氨酸起着重要作用,并且旱地小麦品种西旱2号脯氨酸和可溶性糖的积累量大于水地小麦品种永良4号,而复水后恢复效应要好于永良4号。
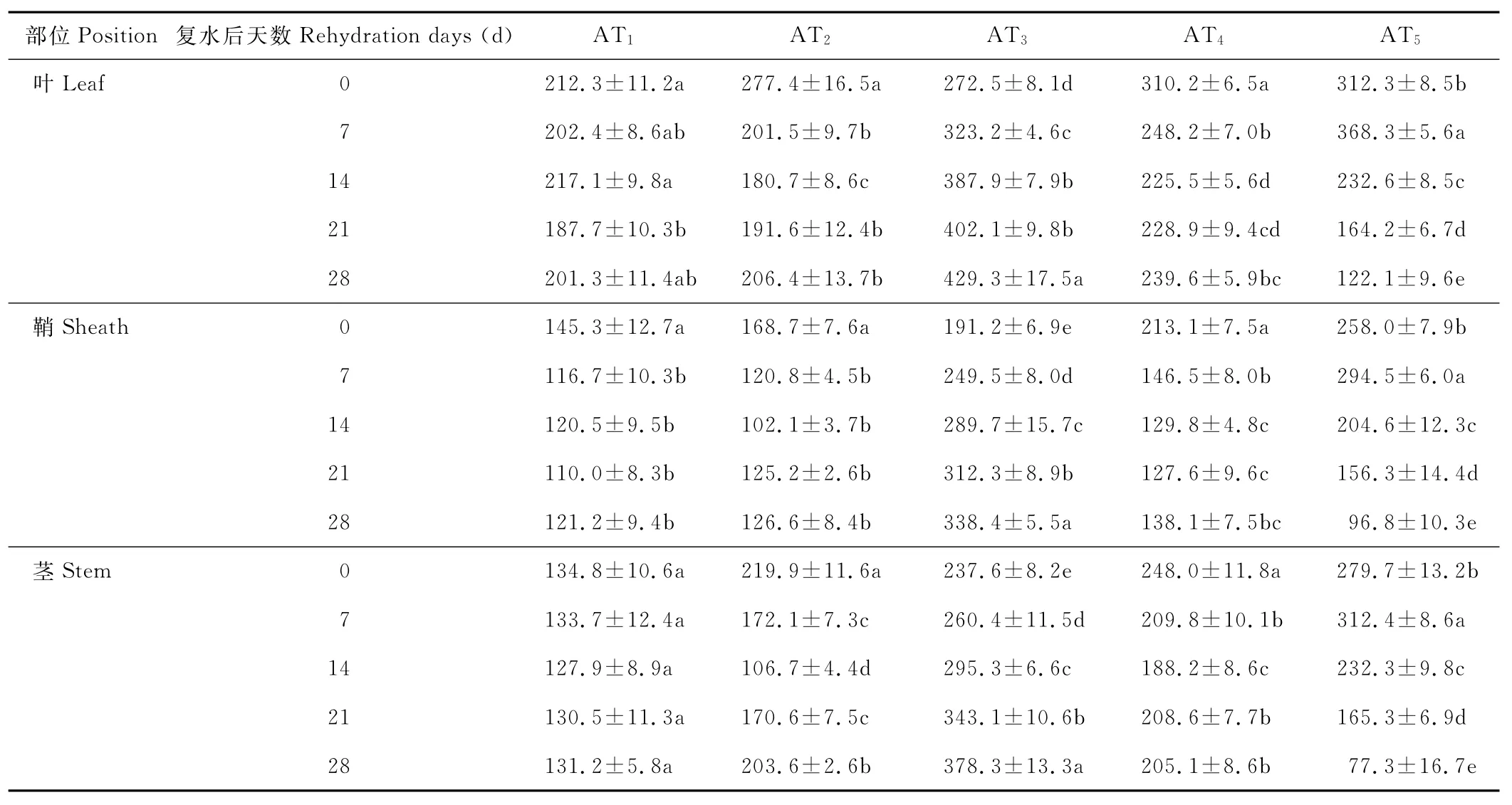
表5 西旱2号水分胁迫及复水后对SOD含量的影响Table 5 The effect of water stress and rehydration on SOD content in Xihan 2 U/g
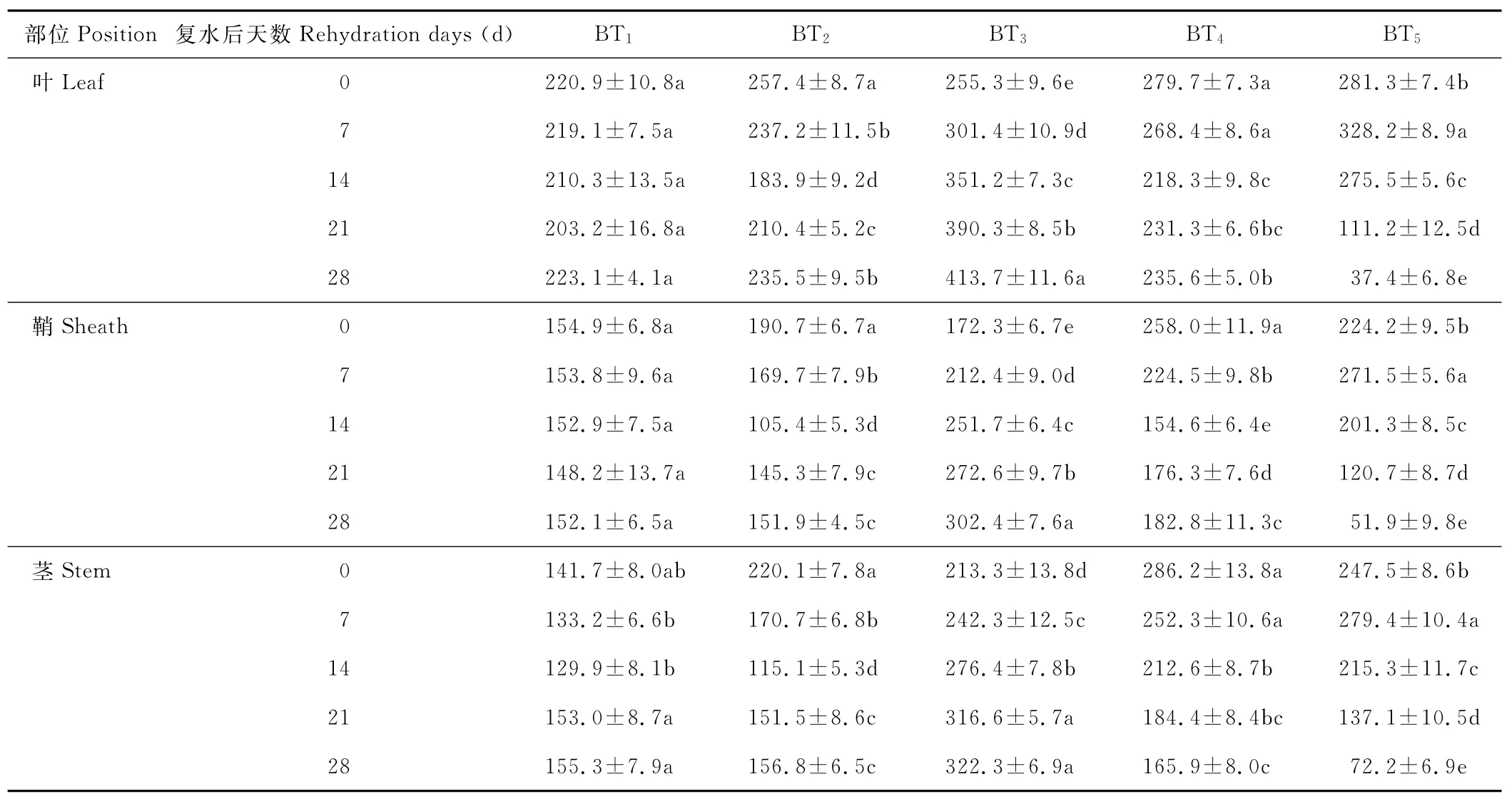
表6 永良4号水分胁迫及复水后对SOD含量的影响Table 6 The effect of water stress and rehydration on SOD content in Yongliang 4 U/g
植物在逆境胁迫过程中,细胞内代谢平衡的失调导致活性氧大量积累,并生成膜脂过氧化物和以MDA为代表的小分子降解物,因此,MDA成为衡量植物抗旱性强弱的一个重要指标[21]。植物体内活性氧的清除主要依赖于活性氧清除酶系统,CAT、SOD和POD是活性氧清除酶系统中重要的保护酶,其活性的变化能反映细胞清除活性氧的能力[22]。本实验结果表明,在水分胁迫条件下,MDA含量增加,且抗旱小麦品种西旱2号增加幅度要小于永良4号。3种活性氧清除酶的活性在轻度水分胁迫下均随时间的延长而增加,且西旱2号增加幅度要大于永良4号,而中度水分胁迫下,其活性呈先升后降的趋势。这是因为在CAT、SOD和POD的协同作用下对体内活性氧具有一定的防御作用,从而降低活性氧对细胞膜系统的伤害。这种防御作用与干旱程度有关,小麦在适度干旱条件下抗氧化物酶活性上升,而长时间的干旱使其活性下降,这与王宝山和赵思齐[23]的研究结果一致。以上分析表明,在干旱胁迫条件下,旱地小麦品种抗氧化物酶活性明显高于水地小麦品种,因此,旱地小麦品种西旱2号具有更强的抗旱性。
对小麦抗旱性的研究主要集中在叶片中生理指标的变化[24-25],而干旱胁迫下对小麦叶鞘和茎的研究主要包括生物量[26]、植物激素的动态变化规律[27]以及光合作用等方面[28],对渗透调节物质和抗氧化酶系统的研究鲜有报道。本试验研究结果显示,干旱胁迫下叶和鞘对脯氨酸含量变化的敏感性要高于茎,而在可溶性糖和MDA含量以及CAT、SOD和POD活性变化方面,叶表现最敏感,鞘次之,茎最不敏感。因此,在小麦的抗旱性研究中叶片为最佳的试验材料,但是,鞘和茎中抗旱指标的变化在一定程度上也反映了植物的抗旱性,故可以通过对小麦叶、鞘和茎中生理生化指标变化的综合分析,更全面地去探究小麦的抗旱机理。
综上所述,小麦对水分胁迫的响应可以通过细胞内多种生理生化指标的变化来反映,不同的小麦品种其抗旱性存在明显的差异,旱地小麦品种西旱2号抗旱性明显强于水地品种永良4号。在水分胁迫下,西旱2号不但具有较强的活性氧清除能力,而且能通过增加渗透调节物质的含量来保持较高的渗透调节能力。因此,西旱2号的抗旱性要高于永良4号。叶片为小麦反映抗旱指标的最佳器官,叶鞘和茎在抗旱性分析中起到重要的补充作用。
[1] Dai J J,Wang Y T.Agricultural Mitigation Guide[M].Beijing:Chinese Agricultural Press,1994.
[2] Li X Q,Jin S H.Effects of drought stress on gas exchange and chlorophyll fluorescence characteristics inEremochloaophiuroides.Chinese Agricultural Science Bulletin,2010,26(8):170-174.
[3] Ji Y,Zhang X Q,Peng Y,etal.Effects of drought stress on lipid peroxidation,osmotic adjustment and activities of protective enzymes in the roots and leaves of orchardgrass.Acta Prataculturae Sinica,2014,23(3):144-151.
[4] Hall A E.Physiological Ecology of Crops in Relation to Light,Water and Temperature[M].New York:McGrawHill Publishing Company,1990:191-233.
[5] Zhang C J,Ji T H,Yang Z G,etal.Study on resistance drought identify method and evaluation index of wheatⅠidentify method and evaluation index.Chinese Agricultural Science Bulletin,2007,23(9):226-230.
[6] Li D Q,Guo Q F,Zhang Y Q,etal.Studies on the physiological characteristics of drought resistance in winter wheat.Acta Agronomica Sinica,1993,19(2):125-132.
[7] Jiang D,Yu Z W,Li Y Q,etal.Changes of soluble sugar contents in leaf,stem and grain in winter wheat and its relationship with grain starch accumulation.Journal of Triticeae Crops,2001,21(3):38-41.
[8] Zhang J,Liu H,Li X P,etal.Effect of drought on leaf physiological parameters and yield of wheat at booting stage.Agricultural Research in the Arid Areas,2014,32(3):1-8.
[9] Huang C B,Zeng F J,Lei J Q.Comparison of drought resistance among threeCalligonumin the Southern Fringe of the Taklamakan Desert.Acta Prataculturae Sinica,2014,23(3):136-143.
[10] DaCosta M,Huang B R.Changes in antioxidant enzyme activities and lipid peroxidation for Bentgrass species in response to drought stress.Journal of the American Society for Horticultural Science,2007,132:319-326.
[11] Sairam R K,Vasanthan B,Arora A.Calcium regulates gladiolus flower senescence by influencing antioxidative enzymes activity.Acta Physiologiae Plantarum,2011,33(5):1897-1904.
[12] Zhang X H,Huang C L,Shen Y Y,etal.Research progress in plant drought resistant gene engineering.Biotechnology Information,2001,(4):21-25.
[13] Wang J L,Zhang X Z,Su Z J,etal.Physiological responses and mechanisms of wheat to drought resistance.Acta Tritical Crops,1994,(5):44-46.
[14] Fei M H.Effect of water stress on seeding growth and antioxidant ability of wheat.Journal of Jilin Normal University(Natural Science Edition),2011,(1):43-44.
[15] Gao J F.Plant Physiology Experimental Guidance[M].Beijing:Higher Education Press,2006.
[16] Chandra B R,Safiullah P M,Blum A,etal.Comparison of measurement methods of osmotic adjustment in rice cultivars.Crop Science,1999,39:150-158.
[17] Hsiao T C,O’Toole J C,Yambao E B,etal.Influence of osmotic adjustment on leaf rolling and tissue death in rice.Plant Physiology,1984,75(2):338-341.
[18] Zhang M S,Peng Z H,Xie B,etal.Relationship between water loss rate of cutting leaves and osmotic regulators under water stress and drought resistance in sweet potato.Scientia Agricultura Sinica,2004,37(1):152-156.
[19] Yang S Y,Yan P,Mei X Y.The impact on soluble sugar and proline contents under different water stress.Chinese Agricultural Science Bulletin,2007,(12):229-233.
[20] Zhao W C,Li H,Zhao H J,etal.Effects of exogenous polyamine osmotica regulation in wheat seedling leaves under drought stress.Chinese Agricultural Science Bulletin,2009,25(9):148-151.
[21] Xiong J Y,Zhang Z M,Bai T,etal.Comprehensive evaluation of drought resistance of wheat mutant lines derived from ultra-high-pressure mutagenesis.Acta Agriculturae Boreali-Occidentalis Sinica,2014,(6):81-87.
[22] Wang Y,Di X Y,Ma J P,etal.Drought resistance of seedlings of eight provenances of Chinese pine.Bulletin of Soil and Water Conservation,2009,29(4):46-50.
[23] Wang B S,Zhao S Q.Effect of drought on lipid peroxidation and defensive enzymes in the wheat seedlings.Journal of Shandong Normal University(Natural Science),1987,(1):29-30.
[24] Ma Z P,Li M F,Yang D L,etal.Relationship between grain filling and accumulation and remobilization of water soluble carbohydrates in leaf and stem of winter wheat during the grain filling in different water conditions.Acta Prataculturae Sinica,2014,23(4):68-78.
[25] Song X Y,Wu S,Zhang H S,etal.Effect of soil water stress on physiological characteristics in different winter wheat cultivars.Acta Agriculturae Boreali-Sinica,2014,29(2):174-180.
[26] Wang W L,Lin Z P,Zhang X Y,etal.On the effect of soil drought during the period from the end of flowering to ripening on the grain filling and matter translocation in the wheat plant.Acta Phytophysiologia Sinica,1982,8(1):67-80.
[27] Zhang W,Gao W,Cao Z,etal.Immunolocalization and quantitation of ABA and IAA in the organs of wheat(TriticumaestivumL.)under drought stress.Scientia Agricultura Sinica,2014,47(15):2940-2948.
[28] Wei A L,Wang Z M,Chen B,etal.Effect of soil drought on electron transport rate and photophosphorylation level of different green organs in wheat.Acta Agronomica Sinica,2004,30(5):487-490.
参考文献:
[1] 代久江,王咏涛.农业减灾指南[M].北京:中国农业出版社,1994.
[2] 李雪芹,金松恒.干旱胁迫对假俭草气体交换和叶绿素荧光特性的影响.中国农学通报,2010,26(8):170-174.
[3] 季杨,张新全,彭燕,等.干旱胁迫对鸭茅根、叶保护酶活性、渗透物质含量及膜质过氧化作用的影响.草业学报,2014,23(3):144-151.
[5] 张灿军,冀天会,杨子光,等.小麦抗旱性鉴定方法及评价指标研究Ⅰ.鉴定方法及评价指标.中国农学通报,2007,23(9):116-230.
[6] 李德全,郭清福,张以勤,等.冬小麦抗旱生理特性的研究.作物学报,1993,19(2):125-132.
[7] 姜东,于振文,李永庆,等.冬小麦叶茎粒可溶性糖含量变化及其与籽粒淀粉积累的关系.麦类作物学报,2001,21(3):38-41.
[8] 张军,刘红,李晓萍,等.干旱对小麦孕穗期叶片生理特性及产量的影响.干旱地区农业研究,2014,3(3):1-8.
[9] 黄彩变,曾凡江,雷加强.塔克拉玛干沙漠南缘3个沙拐枣种的抗旱特性比较.草业学报,2014,23(3):136-143.
[12] 张秀海,黄丛林,沈元月,等.植物抗旱基因工程研究进展.生物技术通报,2001,(4):21-25.
[13] 王金铃,张宪政,苏正椒,等.小麦对干旱的生理反应及抗性生理.国外农学-麦类作物,1994,(5):44-46.
[14] 费明慧.水分胁迫对小麦幼苗生长及抗氧化能力影响.吉林师范大学学报(自然科学版),2011,(1):43-44.
[15] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[18] 张明生,彭忠华,谢波,等.甘薯离体叶片失水速率及渗透调节物质与品种抗旱性的关系.中国农业科学,2004,37(1):152-156.
[19] 杨书运,严平,梅雪英.水分胁迫对冬小麦抗性物质可溶性糖与脯氨酸的影响.中国农学通报,2007,23(12):229-233.
[20] 赵文才,李慧,赵会杰,等.外源腐胺对干旱胁迫下小麦叶片渗透调节的影响.中国农学通报,2009,25(9):148-151.
[21] 熊建云,张正茂,白婷,等.超高压诱变小麦突变株系的抗旱综合评价.西北农业学报,2014,(6):81-87.
[22] 王琰,狄晓艳,马建平,等.8个油松种源抗旱性的比较研究.水土保持通报,2009,29(4):47-50.
[23] 王宝山,赵思齐.干旱对小麦幼苗膜脂过氧化及保护酶的影响.山东师范大学学报(自然科学版),1987,(1):29-30.
[24] 马召朋,栗孟飞,杨德龙,等.不同水分条件下冬小麦灌浆期茎叶可溶性碳水化合物积累转运与籽粒灌浆的关系.草业学报,2014,23(4):68-78.
[25] 宋新颖,邬爽,张洪生,等.土壤水分胁迫对不同品种冬小麦生理特性的影响.华北农学报,2014,29(2):174-180.
[26] 王万里,林芝萍,张秀英,等.灌浆-成熟期间土壤干旱对小麦籽粒充实和物质运转的影响.植物生理学报,1982,(1):67-81.
[27] 张炜,高巍,曹振,等.干旱胁迫下小麦(TriticumaestivumL.)幼苗中ABA和IAA的免疫定位及定量分析.中国农业科学,2014,(15):40-48.
[28] 魏爱丽,王志敏,陈斌,等.土壤干旱对小麦绿色器官光合电子传递和光合磷酸化活力的影响.作物学报,2004,30(5):487-490.
