不同生境小花山桃草自然种群表型变异与协变
2015-01-02刘龙昌杜改改司卫杰王菲罗海军周正军
刘龙昌,杜改改,司卫杰,王菲,罗海军,周正军
(1.河南科技大学林学院,河南 洛阳471003;2.中国林业科学研究院林业研究所,北京100091)
外来种入侵不仅导致生物多样性的减少或丧失,威胁区域生态安全,而且会对经济造成严重影响[1]。探明入侵种的入侵机制对有效控制其扩散和减少对入侵地造成的危害具有重要意义。
表型可塑性和遗传分化是植物适应异质生境的两种不同策略,但二者并不矛盾和排斥,均有利于外来植物适应入侵地的新生境[2-3]。入侵物种往往比非入侵种具有更高的表型可塑性[4-5],表型可塑性通过改变植物的形态、生长、生物量分配和生理特性等来获取资源,从而占据多样的生境,增强其入侵能力[6-7]。对于遗传多样性低的外来植物(如自花授粉植物或克隆植物)来说,表型可塑性是其成功入侵和扩张过程的关键因素[2]。植物进入新生境后,在新环境压力胁迫下遗传物质会发生快速适应性变化,通过进化适应产生表型变异以适应新环境。由于表型特征是自然选择的直接承受者,所以表型进化比基因进化要快得多。许多研究表明,入侵植物能通过遗传分化以适应不同的选择压力,即对不同环境做出局域适应[8-9]。区域性梯度变化的温度、降水和光周期等常引起植物的适应性进化[10-11],生境因子如土壤水分、肥力等也是引起植物适应性进化的重要原因[12-13]。
由于生理以及遗传发育的相关性,植物在经历不同环境的自然选择时,表型性状间存在着表型协变(表型整合)和权衡关系。选择作用可使不同的表型性状具有不同式样和不同程度的可塑性,一个性状在不同环境下的稳定性可能正是由于其他性状具有可塑性的结果[14]。
小花山桃草(Gauraparviflora)是柳叶菜科山桃草属一年生或越年生自花授粉植物,原产北美中东部。因其具有适应性广、繁殖能力强等特点,近几年在我国呈快速扩散蔓延态势,成为我国危害性较大的外来入侵植物之一[15-16],在一些地区已发展成恶性杂草[17]。小花山桃草在义马市北露天矿不同排矸年限的矸石山均有分布。不同排矸年限矸石山在土壤水分、养分条件等方面差异很大[18],这为研究不同生境下小花山桃草种群表型性状变异规律提供了良好条件。我们以分布于该矸石山的自然种群为对象,在小花山桃草果实成熟期,对16个表型性状进行了观测,分析不同种群植株表型性状在种群内、种群间的变化特点及其环境依赖性,以期为探明小花山桃草表型变异规律和机制提供线索。
1 材料与方法
1.1 研究区域概况
研究区位于河南省义马市北露天矿煤矸石山(北纬34°41′-34°46′,东经111°57′-111°59′),属暖温带大陆性季风气候,年平均气温12.4℃,极端最高气温41℃,极端最低气温-18.5℃;无霜期平均215d;平均日照时数2257.4h;平均降雨量为666.9mm,最多为1013.6mm,最少为456.1mm;降水多集中于7-9月份,占全年降水量的60%;多年年平均蒸发量2052mm。
1.2 取样方法
根据矸石山堆积形成的时间和立地条件,在全面调查的基础上,选取相距1km以上且生境差异明显的5个种群为研究对象[18],各种群的生境特征见表1。于2012年7月小花山桃草果实成熟期,在小花山桃草集中连片分布处设置20m×20m的样地,再在每个样地中沿对角线间隔5m布设5m×5m的样方,每个样地设3个样方。在每样方中随机取10株生长正常的健康植株,用铁锨将植株连根挖出,清理干净后装入纸袋带回实验室,在80℃的烘箱中干燥处理72h。
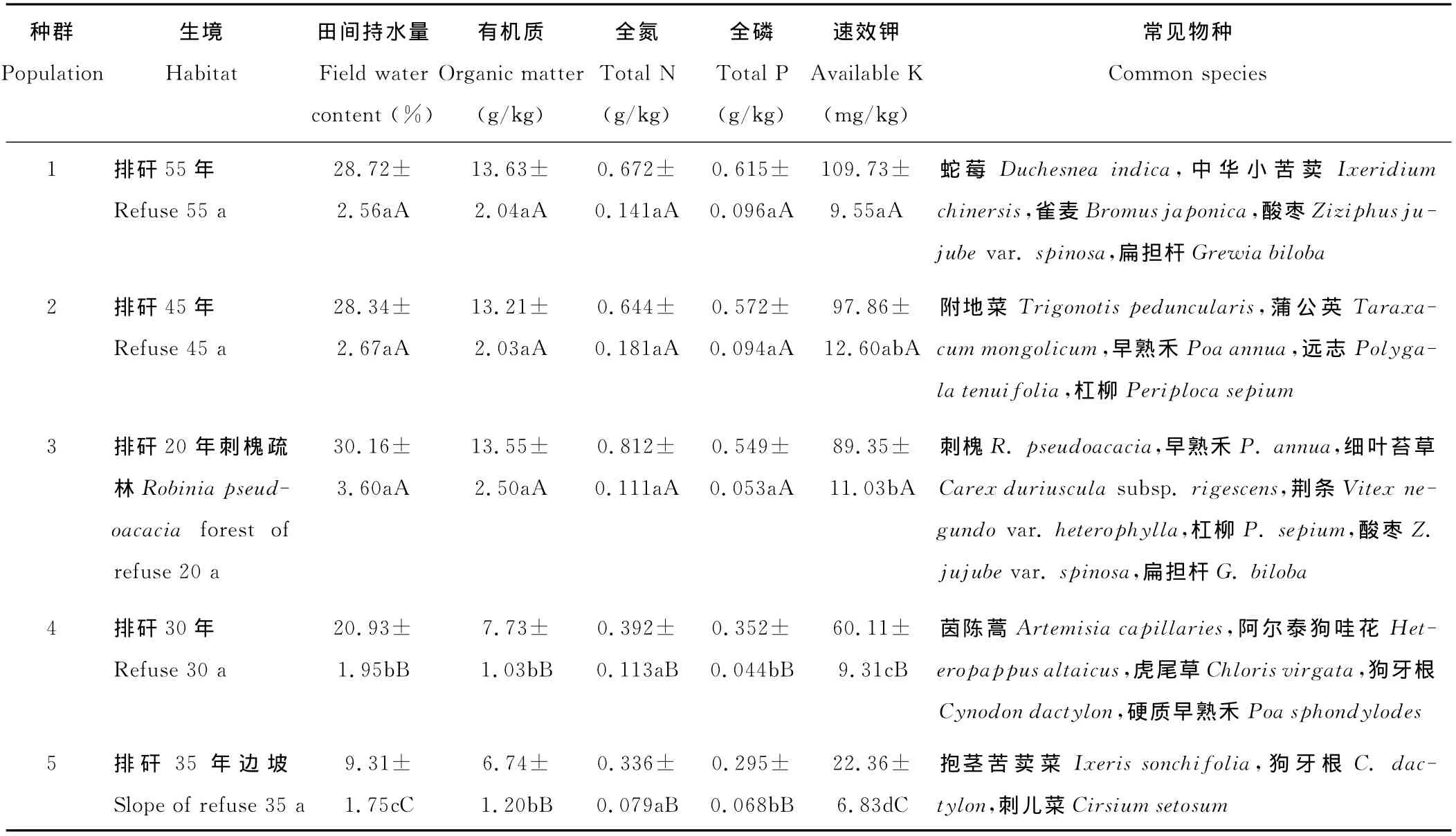
表1 小花山桃草5个种群的生境概况Table 1 Information of G.parviflorain five sample site
1.3 性状选取和观测方法
性状选取时兼顾地上和地下部分、营养和繁殖性状,共选取16个表型性状:株高、节间距、茎粗、叶长、叶宽、主根长、分枝数(植株分枝数)、主根重、茎重、叶重、果长、果宽、单果种子数、单株果数、单果重和比叶面积。叶面积用扫描仪和数字化方法获得,以叶片面积除以叶片质量得到比叶面积(SLA,cm2/g);株高和主根长度用直尺测量,其他指标测量均用游标卡尺测量;用万分之一天平测量单果重、主根重、茎重和叶重,单果重采用单株果实总重与单株果实数目的比值来计算;每株随机选取10个果实,剥取种子,统计种子数,其平均值为单果种子数。
1.4 土壤因子测定
选取对植物生长发育影响显著、反映土壤水分和养分状况的土壤因子,包括田间持水量,有机质、全氮、全磷和速效钾含量。在每个样方中心取1处土壤样点,挖取0~30cm土层的混合土壤样品(具体做法为,用土钻分别采集0~10cm,10~20cm和20~30cm土壤样品,组成混合样品),带回实验室进行分析。其中,田间持水量和有机质含量参考刘龙昌等[18]的研究结果;全氮测定采用凯氏定氮法,全磷测定采用酸溶-钼锑抗比色法,速效钾测定采用醋酸铵溶-火焰光度法[19],测定结果见表1。
1.5 数据分析
计算各表型性状种群内和种群间的平均数、标准差和变异系数,表型性状的变异系数反映了种群内表型性状的变异水平[20]。
用巢氏方差分析法将表型性状变异分解为种群间变异和种群内变异,以探究种群间表型变异特征,各部分方差分量百分比说明了变异来源[21]。用表型分化系数(Vst)反映群体间表型分化情况,公式为,其中为群体间的方差分量,为群体内的方差分量[22-23]。
用主成分分析法研究种群间不同性状的协变情况。若多个性状在第一主成分(或第二主成分)特征向量中的特征值大于0.5且符号相同,则说明这些性状的协变性较大。种群间协变性状相同且协变数目越多,表明性状的分化程度越低,性状具有相似的整合格局[24]。
采用分层聚类法探讨5个种群间表型性状的整体相似性[24],相似系数计算采用欧氏距离法,分析前数据进行标准化变换;对各表型性状和生境土壤因子进行相关性分析,以探究生境因子对表型性状的影响。所有统计和分析在SPSS 18.0、SAS 6.0和 Excel 2003统计软件上进行。
2 结果与分析
2.1 种群内和种群间表型变异特征
变异系数的大小可间接反映群体的表型多样性丰富程度,变异系数大说明该群体的性状变异幅度高,表型多样性丰富;反之则说明该群体的性状变异幅度低,表型多样性低[25]。由表型性状变异系数(表2)可知,不同种群各性状平均变异系数由大到小依次为:种群2>种群5>种群1>种群3>种群4,平均变异系数最大的是拍矸时间45年的种群(种群2),为0.386,最小的是拍矸30年的种群(种群4),为0.338。平均变异系数<0.2的性状有果长、果宽和比叶面积,说明这3个性状最稳定。平均变异系数>0.4的性状有:叶宽、主根重、茎重、叶重和单株果数,其中叶重和单株果数变异系数最大(>0.8),说明它们最不稳定。
单果种子数和单果重在种群内和种群间的差异均不显著(P>0.05),其他性状在种群间的差异均达极显著水平(表3),说明各种群生长状况差异较大。其中节间距、茎粗、叶长、叶宽、主根长、主根重、茎重、叶重、果宽、单株果数和比叶面积变化较大(F值大于10),叶宽和节间距在种群间的变化最大(F值大于50)。
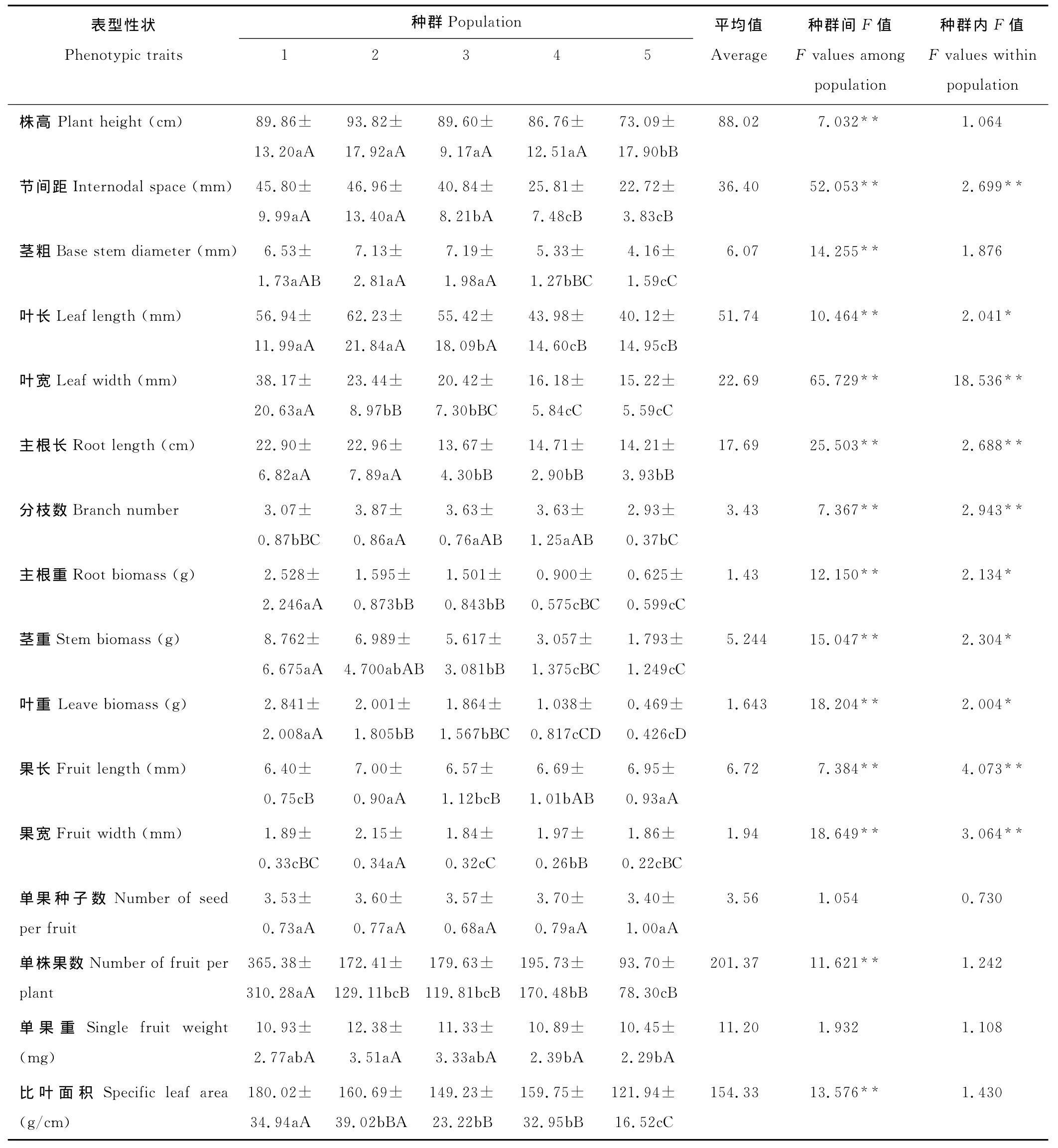
表3 不同生境小花山桃草种群各性状单因素方差分析(平均值±标准偏差)Table 3 One Way ANOVA of phenotypic traits variance between G.parviflora populations from different habitat(mean±SE)
在16个表型性状中,株高、茎粗、单果种子数、单株果数、单果重和比叶面积6个性状在种群内的差异均不显著;叶长、主根重、茎重和叶重4个性状差异显著(P<0.05);节间距、叶宽、主根长、分枝数、果长和果宽6个性状差异极显著(P<0.01),其中叶宽的变化最大。
2.2 种群内和种群间表型分化
16个表型性状的Vst变异范围为26.85%~96.98%,平均为73.03%(表4),说明种群间变异是表型变异的主要来源,也表明不同排矸年限环境(即生境)对小花山桃草各种群表型变化有决定性影响。
果长、分枝数和叶宽的表型分化系数较低(<50%),尤其是果长仅为26.85%,说明果长、分枝数和叶宽3个性状在种群内有较大的变异,受种群内微环境变化的影响强烈。株高、节间距、茎粗、主根长、叶重、单果种子数、单株果数和比叶面积8个性状的表型分化系数达80%以上,种群间变异大于种群内变异,表明这些性状受种群内微环境的影响较小,受不同生境水肥状况影响较大。
2.3 不同生境种群表型整合格局
不同生境下5个种群的株高、茎粗、叶长、叶宽、主根重、茎重、叶重和单株果数8个性状的第一主成分特征向量值均大于0.5,表明这些性状的变化具有明显的协同性(表5);种群2和种群3的节间距、种群1的主根长以及种群2和种群4的分枝数的第一主成分特征值大于0.5。在其他种群中,这3个性状的第一主成分特征值虽然小于0.5,但仍可达到0.34~0.47,同样表现出大体相同的协同变化趋势。
单果重、果长、果宽3个果实性状以及比叶面积与生长性状(包括株高、节间距、茎粗、叶长、叶宽、主根长、主根重、分枝数、茎重和叶重)之间的协变性较弱。尽管这4个性状在第二主成分中有较大的特征向量,但它们之间以及它们与生长性状之间的协变性较低,协变方向也不一致。
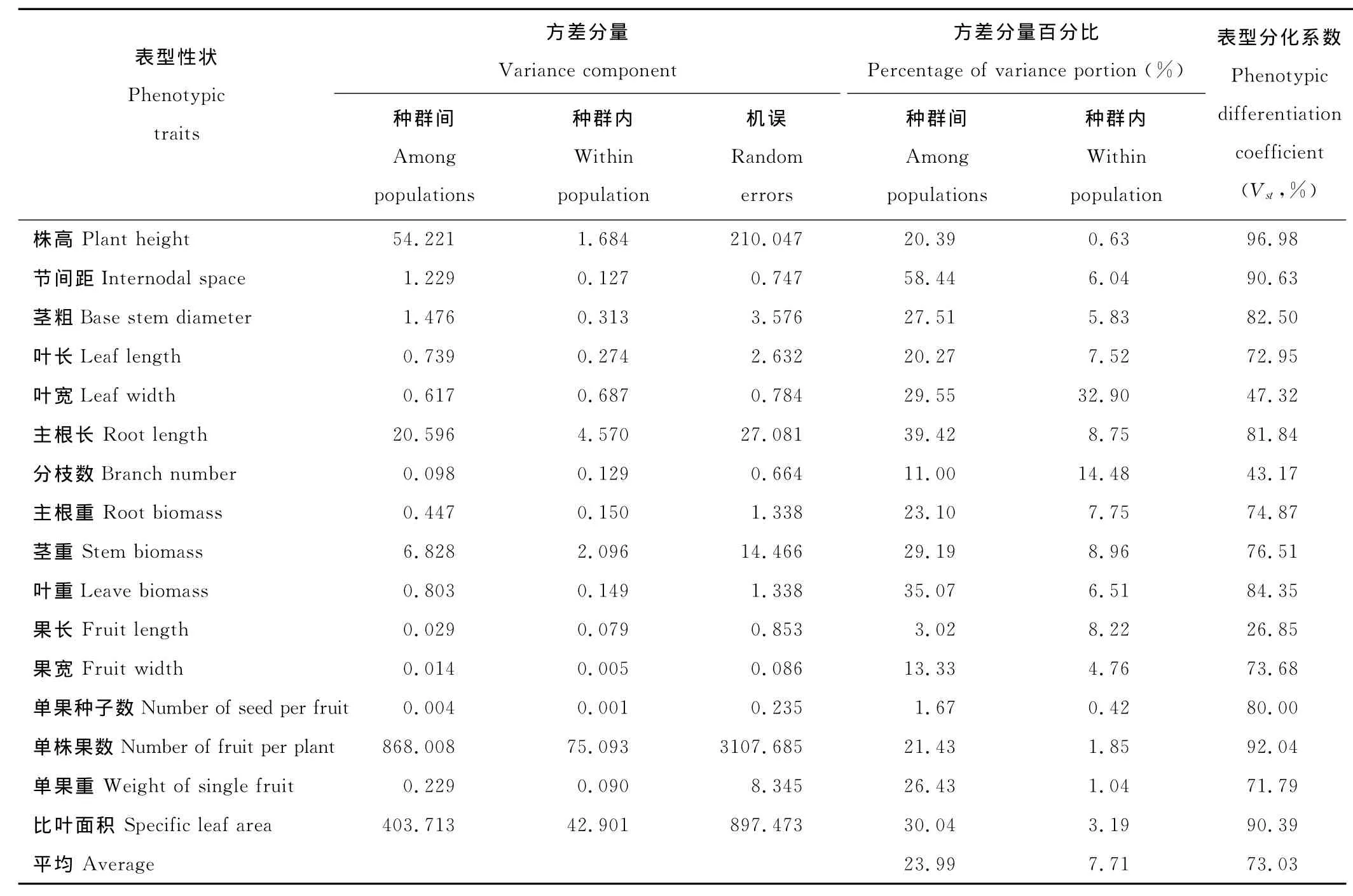
表4 不同生境下小花山桃草表型性状的方差分量与居群间表型分化系数Table 4 The percentage of variance components and differentiation coefficients of phenotypic traits(Vst)within and among population of G.parviflorain different habitat
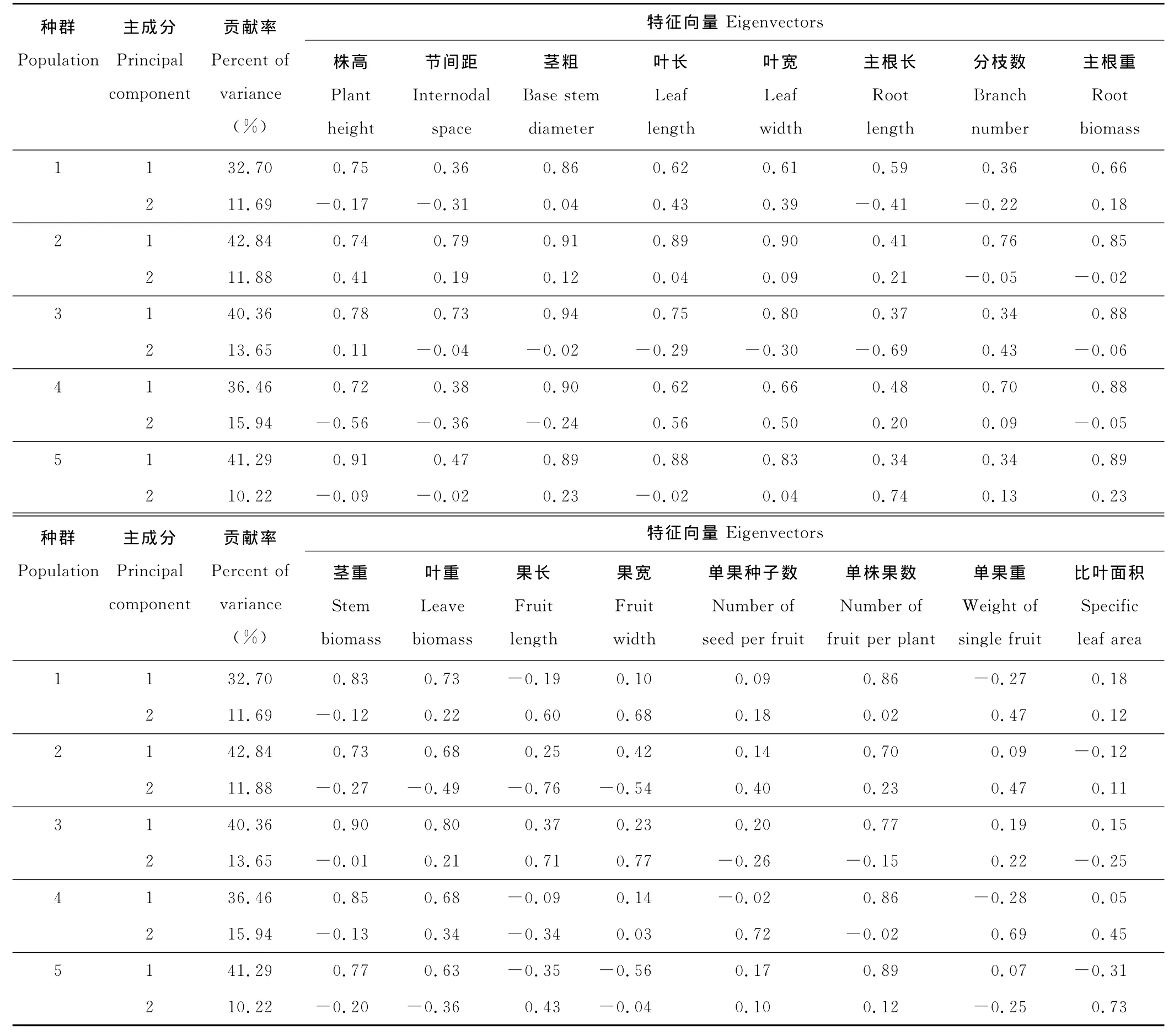
表5 不同生境下小花山桃草种群16个表型性状主成分分析Table 5 Principal component analysis of sixteen phenotypic traits of G.parviflorain different habitat
2.4 小花山桃草表型性状与生境因子的相关性
小花山桃草各性状与生境因子的相关关系分析见表6,10个生长性状中有9个(包括株高、节间距、茎粗、叶长、叶宽、主根长、主根重、茎重和叶重)与各生境因子存在显著或极显著的正相关关系;4个果实性状中有3个(包括果宽、单果重和单果种子数)与生境因子相关性低。这表明相对于生长性状,果实性状较为稳定,不易受环境影响。果实长度与各生境因子存在显著负相关关系,在贫瘠干旱的环境条件下,小花山桃草的果实更细长一些,果实中的种子数也少一些。分枝数与土壤含水量和全氮量呈显著正相关,与其他生境因子无显著相关关系,说明分枝数主要受土壤含水量和全氮含量的制约。
2.5 小花山桃草种群间表型相似性的聚类分析
采用欧式距离法对不同生境的5个种群进行聚类分析(图1)。结果表明,在阈值为10时可把5个种群分为2组。种群1、种群2和种群3被分为一组,结合表3可知,这3个种群在株高、节间距、茎粗、叶长、茎重、单果重6个表型性状上比较相似。而种群4和种群5在节间距、茎粗、叶长、叶宽、主根重、茎重、叶重和单果重等表型性状上较为相似,均明显低于前3个种群,因此单独聚为一类。
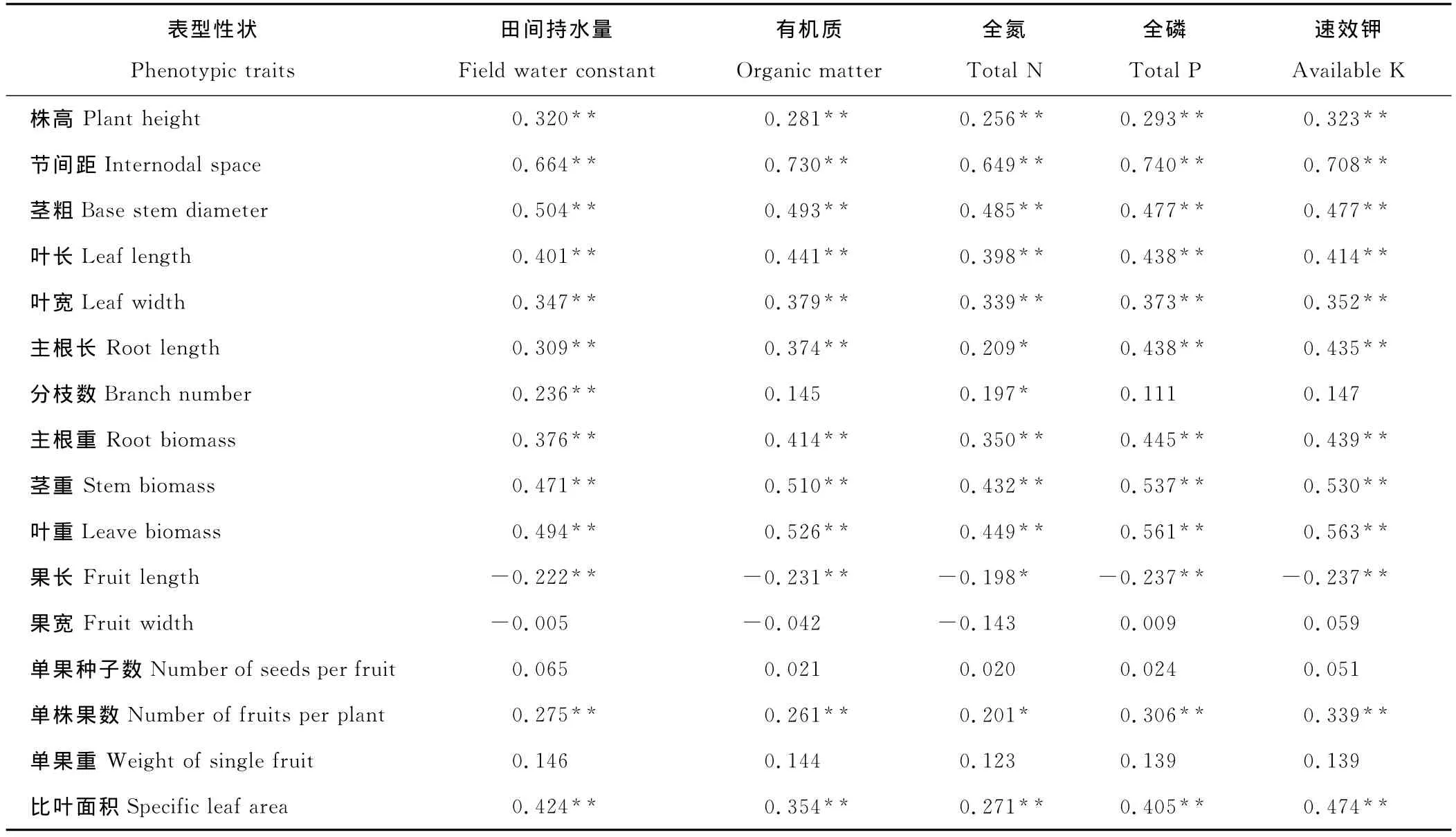
表6 小花山桃草表型性状与生境因子之间的相关系数Table 6 Correlation coefficient between phenotypic traits and habitat factors of G.parviflora
结合各种群的生境条件(表1)可知,生境条件较好的3个种群聚在一个分支,生境条件较差的2个种群聚在另一分支。由此不难看出,小花山桃草表型特征受种群间环境条件(水、肥)的强烈影响。
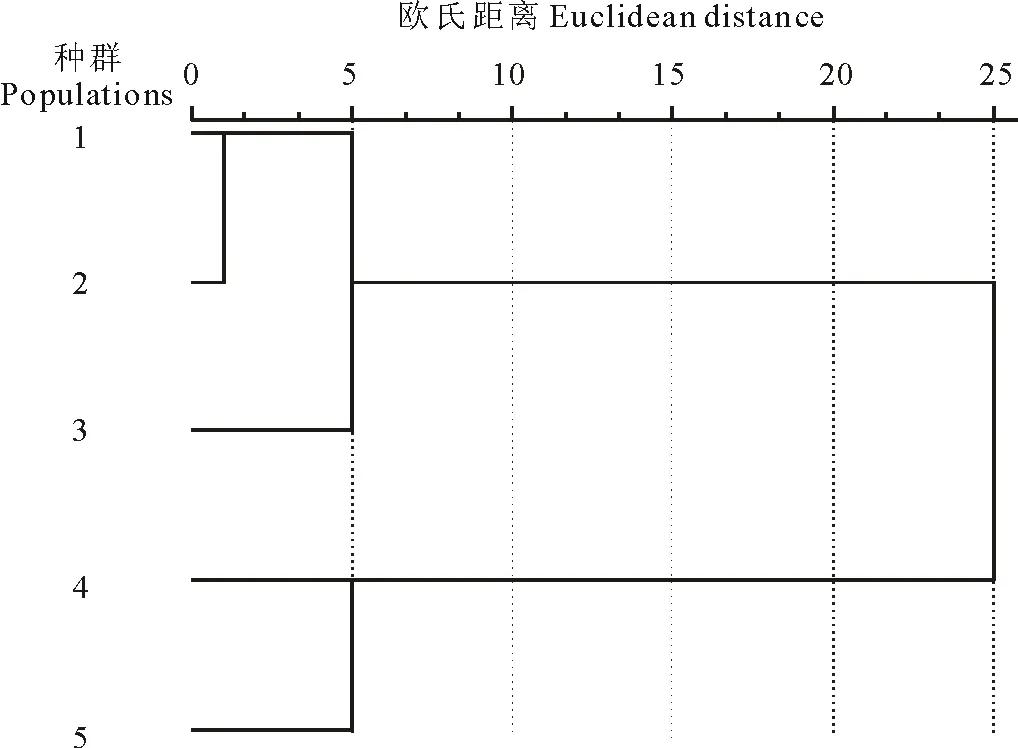
图1 基于小尺度环境下小花山桃草5个种群16个表型性状的聚类图Fig.1 Hierarchical cluster based on sixteen phenotypic traits of five G.parviflora populations in different habitat
3 讨论
表型多样性作为遗传多样性与环境多样性的综合体现,是了解生物遗传变异的重要线索,也是生物多样性的重要内容[26]。植物表型性状的变异幅度越大,表型多样性越丰富[27]。本研究显示,小花山桃草5个群体16个表型性状的平均变异系数为36.30%(繁殖性状的平均变异系数为31.42%)。明显高于大多数非入侵植物的变异系数,如滇北球花报春(Primuladenticulatassp.Sinodenticulata)的7.08%、野扁桃(Amygdalusledebouriana)的18.66%、野生芒(Miscanthussinensis)的 27.35%[28-30]。也显著高于一些入侵植物的变异系数,如刺萼龙葵(Solanumrostratum)的13.60%、剑叶金鸡菊(Coreopsislanceolata)的8.24%(繁殖性状)[13,31]。但低于有些入侵植物的变异系数,如银胶菊(Parthenium hysterophorus)的54.86%、喜旱莲子草(Alternantheraphiloxeroides)的59.83%[12,32]。表明小花山桃草的表型多样性较为丰富,暗示它对异质生境有较为广泛的适应能力[33-34]。
一般来说,营养性状对不同生境的反应比繁殖性状更为敏感,更容易发生变异。所以,营养性状的变异系数常高于繁殖性状的变异系数[35]。本研究结果也支持这一结论,小花山桃草种群营养性状的变异系数(平均为40.52%)明显高于繁殖性状的变异系数(平均为31.42%)。繁殖性状相对稳定有助于保持子代与母代间遗传物质的稳定,而较高的营养性状变异有利于植物适应多变的环境。
表型性状的变化对环境具有明显的依赖性,不同性状对自然选择的反应不同[24]。本研究结果表明,在观测的16个表型性状中,有11个性状在种群间表现出明显的差异,包括株高、节间距、茎粗、叶长、主根长、主根重、茎重、叶重、果宽、单株果数和比叶面积,它们的表型分化系数均在71%以上。尤其是株高、茎粗、单株果数和比叶面积4个性状在种群内的差异不显著,而在种群间的差异均达到极显著水平,表型分化系数均在82%以上,表明种群间主要生境因子的差异是上述表型性状变化的决定因素;节间距、叶长、叶宽、主根长、分枝数、主根重、茎重、叶重、果长和果宽在种群内和种群间均表现出明显的差异,尤其是节间距、叶宽、主根长、分枝数、果长和果宽6个性状在种群内的差异均达极显著水平,表明这些性状受种群内微环境的影响较大。同时,研究还发现,果长、分枝数和叶宽3个性状对梯度生境因子和微环境条件均比较敏感,种群间和种群内的方差分量比较接近,这应该是其表型分化系数较低的主要原因。
功能性状株高、比叶面积和单株果数在种群间表现出极高的变异性,表型分化系数均在90%以上,且与各生境因子呈显著正相关,这说明它们易受梯度生境因子影响。在充足的水分和良好的养分条件下,小花山桃草通过生长空间和叶面积的扩大捕获更多的光能,积累更多的营养物质,生产更多的果实和种子,从而实现 “表现最大化”[2]。
植株的分枝数常与土壤含水量呈正相关关系[36],本研究进一步证实了这一点。分枝数的这种可塑性变异具有生态适应意义。在水分条件充足时,植物通过增加分枝数和冠幅,扩大生长空间,积累更多营养,以实现生理功能的最大化。在水分不足时,通过减少分枝数和冠幅,减小枝叶构件间的竞争作用和水分散失[37-38],以保证基本生理功能的维持。
从理论上说,同时具有丰富遗传变异和高度表型可塑性的植物能够更有效地适应复杂多变的环境[2]。许多外来植物的成功入侵是其表型可塑性和局域适应共同作用的结果[39]。在一个范围很小的样地内,植株间的遗传变异往往很低(自花授粉和克隆植物尤为如此),所以种群内植株间表型性状的差异可能主要是表型可塑性的结果[23]。而生境的异质性使得各种群承受了不同的选择压力,如果这种选择压力大于遗传漂变和基因流的作用,则处于不同生境的种群可能在形态、生理和物候等表型性状上产生分化,出现局部适应现象[40]。本研究表明,小花山桃草种群间表型变异很高,种群间表型性状分化远大于种群内的变异(平均表型分化系数为73.03%)。同时,其多数表型性状(16个表型性状中有10个)在种群内也有较高的变异。这暗示小花山桃草可能同时具有较高的表型可塑性和较强的适应进化能力。为进一步明确这一问题,进一步开展不同尺度环境下表型变异规律和同质生物园对比研究十分必要。
植物能够通过生理整合调控其表型可塑性[41]。表型性状间的协同性越高,植物体的整体功能就会越高效[42]。本研究表明,不同生境下小花山桃草种群的株高、茎粗、叶长、叶宽、茎重、叶重、主根重和单株果数具有一致的整合格局。说明小花山桃草地上部分(株高、茎重和叶重等)与地下部分(主根重)之间、植株生物量(茎重、叶重和主根重)与繁殖输出(单株果数)之间具有生理功能上的权衡性。由于单株果数和单果种子数是决定植物相对适合度高低的重要因素,所以茎重、叶重、主根重与单株果数的协同变化具有适应意义[24]。
[1]Mack R N,Simberloff D,Lonsdale W M,etal.Biotic invasions:causes,epidemiology,global consequences,and control.Ecological Applications,2000,10(3):689-710.
[2]Geng Y P,Zhang W J,Li B,etal.Phenotypic plasticity and invasiveness of alien plants.Biodiversity Science,2004,12(4):447-455.
[3]Qin R M,Zheng Y L,Valiente-Banuet A,etal.The evolution of increased competitive ability,innate competitive advantages,and novel biochemical weapons act in concert for a tropical invader.New Phytologist,2013,197(3):979-988.
[4]Feng Y L,Fu G L,Zheng Y L.Specific leaf area relates to the differences in leaf construction cost,photosynthesis,nitrogen allocation,and use efficiencies between invasive and noninvasive alien congeners.Planta,2008,228(3):383-390.
[5]Zhao X J,Liu W Y,Zhou M.Lack of local adaptation of invasive crofton weed(Ageratinaadenophora)in different climatic areas of Yunnan Province,China.Journal of Plant Ecology,2013,6(4):316-322.
[6]Liu J,Li J M,Yu H,etal.The relationship between functional traits and invasiveness of alien plants.Biodiversity Science,2010,18(6):569-576.
[7]Huang W,Carrillo J,Ding J Q,etal.Invader partitions ecological and evolutionary responses to above-and belowground herbivory.Ecology,2012,93(11):2343-2352.
[8]Dlugosch K M,Parker I M.Invading populations of an ornamental shrub show rapid life history evolution despite genetic bottlenecks.Ecology Letters,2008,11(7):701-709.
[9]Gao L X,Geng Y P,Li B,etal.Genome-wide DNA methylation alterations ofAlternantheraphiloxeroidesin natural and manipulated habitats:Implications for epigenetic regulation of rapid responses to environmental fluctuation and phenotypic variation.Plant Cell Environment,2010,33(11):1820-1827.
[10]Maron J L,Elmendorf S C,VilàM.Contrasting plant physiological adaptation to climate in the native and introduced range ofHypericumperforatum.Evolution,2007,61(8):1912-1924.
[11]Zhen Y,Ungerer M C.Clinal variation in freezing tolerance among natural accessions ofArabidopsisthaliana.New Phytologist,2008,177(2):419-427.
[12]Pan X Y,Geng Y P,Zhang W J,etal.Cover shift and morphological plasticity of invasiveAlternantheraphiloxeroidesalong a riparian zone in South China.Chinese Journal of Plant Ecology,2006,30(5):835-843.
[13]Chen T Y,Liu Z H,Lou A R.Phenotypic variation in populations ofSolanumrostratumin different distribution areas in China.Chinese Journal of Plant Ecology,2013,37(4):344-353.
[14]Klingenberg C P.Morphological integration and developmental modularity.Annual Review of Ecology,Evolution,and Systematics,2008,39:115-132.
[15]Du W B,Ye Y Z,Peng S L.Study on the seasonal growing dynamics and invasive characteristics ofGauraparviflora.Acta Ecologica Sinica,2003,23(8):1679-1684.
[16]Liu L C,Xu L,Feng P,etal.Seed dormancy and germination characteristics ofGauraparviflora,an exotic weed species in China.Acta Ecologica Sinica,2014,34(24):7338-7349.
[17]Wan F H,Liu Q R,Xie M,etal.Gauraparviflora.Biological Invasions:Color Illustrations of Invasive Alien Plants in China[M].Beijing:Science Press,2012:202-203.
[18]Liu L C,Song M Y,Xu G R,etal.Land suitability evaluation of vegetation restoration of coal-gangue pile in Yima Area.Journal of Fujian College of Forestry,2012,32(1):70-75.
[19]Bao S D.Soil and Agricultural Chemistry Analysis(3th edition)[M].Beijing:China Agriculture Press,2000:14-38.
[20]Wang D,Pang C H,Gao Y H,etal.Phenotypic diversity ofAcerginnala(Aceraceae)populations at different altitude.Acta Botanica Yunnanica,2010,32(2):117-125.
[21]Zhang H Q,An L J,Zhu Y G.Geographical variation of morphology characters for natural populations ofPinuskoraiensis.Acta Ecologica Sinica,1999,19(6):932-938.
[22]Ge S,Wang M X,Chen Y W.An analysis of population genetic structure of masson pine by isozyme technique.Scientia Silvae Sinice,1988,24(4):399-409.
[23]Hedrick P W.A standardized genetic differentiation measure.Evolution,2005,59(8):1633-1638.
[24]Li L,Liu T,Liu B,etal.Phenotypic variation and covariation among natural populations ofArabidopsisthalianain North Xinjiang.Biodiversity Science,2010,18(5):497-508.
[25]Dunn C P.Keeping taxonomy based in morphology.Trends in Ecology and Evolution,2003,18(6):270-271.
[26]Guo N,Yang S H,Ge W Y,etal.Phenotypic diversity of natural populations ofRosalaxaRetz.in Tianshan Mountains of Xinjiang.Acta Horticulturae Sinica,2011,38(3):495-502.
[27]Zhang C X,Ming J,Liu C,etal.Phenotypic variation of natural populations inLiliumregaleWilson.Acta Horticulturae Sinica,2008,35(8):1183-1188.
[28]Zhang R L,Jia Y,Zhang Q X.Phenotypic variation of natural populations ofPrimuladenticulatassp.sinodenticulata.Biodiversity Science,2008,16(4):362-368.
[29]Zeng B,Luo S P,Li J,etal.Morphological variations in natural populations ofAmygdalusledebouriana.Biodiversity Science,2008,16(5):484-491.
[30]Nie G,Zhang X Q,Huang L K,etal.Phenotypic variation of wildMiscanthussinensispopulations from southwestern China.Acta Prataculturae Sinica,2013,22(5):52-61.
[31]Zeng J J,Xiao Y A,Sun M.Reproductive traits associated with invasiveness inCoreopsislanceolata.Chinese Journal of Plant Ecology,2010,34(8):966-972.
[32]Pu G Z,Tang S C,Pan Y M,etal.Phenotypic plasticity and modular biomass of invasivePartheniumhysterophorusin dif-ferent habitats in south China.Guihaia,2010,30(5):641-646.
[33]Du N,Zhang X R,Wang W,etal.Foliar phenotypic plasticity of a warm-temperate shrub,Vitexnegundovar.heterophylla,to different light environments in the field.Acta Ecologica Sinica,2011,31(20):6049-6059.
[34]Richter S,Kipfer T,Wohlgemuth T,etal.Phenotypic plasticity facilitates resistance to climate change in a highly variable environment.Oecologia,2012,169(1):269-279.
[35]Xing Y,Zhao X,Dong K H,etal.A study on morphological variation of different populations ofLespedezadavurica.Acta Prataculturae Sinica,2008,17(4):26-31.
[36]Xu G F,Shen S C,Zhang F D,etal.Effect of soil-water conditions on survival rate and morphological plasticity of clonal plantMikaniamicranthaH.B.Kunth.Scientia Agricultura Sinica,2013,46(15):3134-3141.
[37]Luo Y Z,Li G.The effect of water stress on growth and biomass ofMedicagosativacv.Xinjiangdaye.Acta Prataculturae Sinica,2014,23(4):213-219.
[38]Zhou Z H,Li Z,Jiao J,etal.Analysis of clonal growth patterns and branching architecture ofNitrariatangutorumclonal ramet in the Southern margin area of the Tengger Desert.Acta Prataculturae Sinica,2014,23(1):12-21.
[39]Zhang C L,Li Y P,Feng Y L,etal.Roles of phenotypic plasticity and local adaptation inEupatoriumadenophoruminvasions in different altitude habitats.Acta Ecologica Sinica,2009,29(4):1940-1946.
[40]Kawecki T J,Ebert D.Conceptual issues in local adaptation.Ecology Letters,2004,7(12):1225-1241.
[41]Luo D,Qian Y Q,Liu J X,etal.Phenotypic responses of a clonal plant(Buchloedactyloides)to nutrient heterogeneity.Acta Prataculturae Sinica,2014,23(3):104-109.
[42]Marcus B T,Cynthia W.Plasticity and environment-specific covariances:an investigation of floral-vegetative and within flower correlations.Evolution,2007,61(12):2913-2924.
参考文献:
[2]耿宇鹏,张文驹,李博,等.表型可塑性与外来植物的入侵能力.生物多样性,2004,12(4):447-455.
[6]刘建,李钧敏,余华,等.植物功能性状与外来植物入侵.生物多样性,2010,18(6):569-576.
[12]潘晓云,耿宇鹏,张文驹,等.喜旱莲子草沿河岸带不同生境的盖度变化及形态可塑性.植物生态学报,2006,30(5):835-843.
[13]陈天翌,刘增辉,娄安如.刺萼龙葵种群在中国不同分布地区的表型变异.植物生态学报,2013,37(4):344-353.
[15]杜卫兵,叶永忠,彭少麟.小花山桃草季节生长动态及入侵特性.生态学报,2003,23(8):1679-1684.
[16]刘龙昌,徐蕾,冯佩,等.外来杂草小花山桃草种子休眠萌发特性研究.生态学报,2014,34(24):7338-7349.
[17]万方浩,刘全儒,谢明,等.小花山桃草.生物入侵:中国外来入侵植物图鉴[M].北京:科学出版社,2012:202-203.
[18]刘龙昌,宋蒙亚,徐国瑞,等.义马煤矿矸石山植被恢复土地适宜性评价.福建林学院学报,2012,32(1):70-75.
[19]鲍士旦.土壤农化分析(第三版)[M].北京:中国农业出版社,2000:14-38.
[20]王丹,庞春华,高亚卉,等.茶条槭不同海拔种群的表型多样性.云南植物研究,2010,32(2):117-125.
[21]张恒庆,安利佳,祖元刚.天然红松种群形态特征地理变异的研究.生态学报,1999,19(6):932-938.
[22]葛颂,王明庥,陈岳武.用同工酶研究马尾松群体的遗传结构.林业科学,1988,24(4):399-409.
[24]李磊,刘彤,刘斌,等.新疆北部拟南芥自然居群表型变异与协变.生物多样性,2010,18(5):497-508.
[26]郭宁,杨树华,葛维亚,等.新疆天山山脉地区疏花蔷薇天然居群表型多样性分析.园艺学报,2011,38(3):495-502.
[27]张彩霞,明军,刘春,等.岷江百合天然群体的表型多样性.园艺学报,2008,35(8):1183-1188.
[28]张睿鹂,贾茵,张启翔.滇北球花报春天然群体表型变异研究.生物多样性,2008,16(4):362-368.
[29]曾斌,罗淑萍,李疆,等.新疆野扁桃天然居群形态变异的研究.生物多样性,2008,16(5):484-491.
[30]聂刚,张新全,黄琳凯,等.中国西南区野生芒居群表型变异研究.草业学报,2013,22(5):52-61.
[31]曾建军,肖宜安,孙敏.入侵植物剑叶金鸡菊的繁殖特征及其与入侵性之间的关系.植物生态学报,2010,34(8):966-972.
[32]蒲高忠,唐赛春,潘玉梅,等.入侵植物银胶菊在不同生境下表型可塑性和构件生物量.广西植物,2010,30(5):641-646.
[33]杜宁,张秀茹,王炜,等.荆条叶性状对野外不同光环境的表型可塑性.生态学报,2011,31(20):6049-6059.
[35]邢毅,赵祥,董宽虎,等.不同居群达乌里胡枝子形态变异研究.草业学报,2008,17(4):26-31.
[36]徐高峰,申时才,张付斗,等.土壤水分对薇甘菊不同繁殖体单位存活能力和植株表型可塑性影响.中国农业科学,2013,46(15):3134-3141.
[37]罗永忠,李广.土壤水分胁迫对新疆大叶苜蓿的生长及生物量的影响.草业学报,2014,23(4):213-219.
[38]周资行,李真,焦健,等.腾格里沙漠南缘唐古特白刺克隆分株生长格局及枝系构型分析.草业学报,2014,23(1):12-21.
[39]张常隆,李扬苹,冯玉龙,等.表型可塑性和局域适应在紫茎泽兰入侵不同海拔生境中的作用.生态学报,2009,29(4):1940-1946.
[41]罗栋,钱永强,刘俊祥,等.克隆植物野牛草对异质营养的表型可塑性响应.草业学报,2014,23(3):104-109.
