固相合成锂离子电池正极材料LiMn1−xFexPO4/C的结构与电化学性能
2015-03-25唐仁衡肖志平卢安贤
苑 硕,唐仁衡,王 英,肖志平,卢安贤
(1.中南大学 材料科学与工程学院,长沙410083;2.广东省工业技术研究院(广州有色金属研究院),广州510651)
锂离子电池具有工作电压高、比能量高、自放电率低和无记忆效应等优点,广泛应用于现代通讯、信息技术、空间技术和现代国防等高科技领域[1]。在锂离子电池正极材料中,橄榄石型结构磷酸盐系列材料(LiMnPO4、LiCoPO4、LiNiPO4与LiFePO4)因成本低、环境友好、循环寿命长和热稳定性高,在动力能源领域有极大的市场前景[2−5];而在这4种磷酸盐材料中,LiCoPO4性能较好,但钴资源匮乏且对环境有污染;LiNiPO4由于没有相匹配的电解液,限制了其实际使用。LiFePO4与LiMnPO4具有资源较丰富、循环性能好、安全、无污染等优点,与Fe3+/Fe2+相对于Li+/Li的电极电势3.4 V相比,LiMnPO4材料中Mn3+/Mn2+相对于Li+/Li的电极电势为4.1 V,且正好位于现有电解液体系的稳定电化学窗口,因此该材料具有潜在的高能密度的优点[6]。
然而,LiMnPO4材料具有极低的本征电子导电率和锂离子扩散系数,具有绝缘体的特征,从而导致难以合成能够实行可逆充放电的LiMnPO4,严重限制了其发展与应用[7−8]。为了提高LiMnPO4的电化学性能,目前一般采用降低颗粒粒度[9]、对材料进行金属离子掺杂[10]、碳包覆改性[11]等方法。LiMnPO4的主要制备方法有液相法,如溶胶凝胶法[12]、水热法[13]和高温固相合成法[14−15]等,最有效的合成方法是通过液相法合成纳米级LiMnPO4。如2009年Deyu WANG[16]采用水热法并加入多元醇合成高性能、纳米结构的LiMnPO4,其可逆容量在0.05、0.1、1C倍率下分别为145、141和113(mA·h)/g。但液相法合成过程复杂,操作困难,难以应用到实际工业生产中。而固相法合成过程简单易操作,产品不需要进行后期处理。本文作者以葡萄糖为碳源,通过对LiH2PO4、MnCO3、FeC2O4与葡萄糖等反应物进行湿法球磨与高温煅烧,对LiMnPO4进行铁离子掺杂和碳包覆改性,合成能进行可逆充放电的LiMn1−xFexPO4/C复合材料,并对铁离子掺杂量对材料晶体结构、微观形貌与电性能的影响进行研究,从而制备出电性能更加良好的LiMnPO4材料。
1 实验
1.1 LiMn1−xFexPO4/C的制备
所用原料为LiH2PO4,纯度99.9%,上海晶纯生化科技股份有限公司生产;MnCO3,分析纯,天津市福晨化学试剂厂生产;FeC2O4,纯度99.5%,沈阳市北丰化学试剂厂生产;葡萄糖,分析纯,广州化学试剂厂生产。首先按LiMn1−xFexPO4(x=0、0.05、0.10、0.15、0.20)的化学组成称量LiH2PO4、MnCO3和FeC2O4,混合均匀,然后加入占反应物总质量40%的葡萄糖作碳源,置于行星式球磨机中,加入少量乙醇,在转速为250 r/min条件下球磨2 h。取出后,在氮气保护下于真空热处理炉中在750℃温度下煅烧10 h,随炉冷却至室温,得到LiMn1−xFexPO4粉末。
1.2 电池组装
将制得的LiMn1−xFexPO4、导电剂乙炔黑、粉结剂聚偏氟乙烯(PVDF)按照8:1:1的质量比进行称量,将正极活性物质与乙炔黑混合并研磨均匀,同时将PVDF溶解在适量分散剂甲基二吡咯烷酮(NMP)中,然后将混合均匀的正极活性物质与乙炔黑放入已溶解PVDF的NMP中,在磁力搅拌机上搅拌均匀,制成一定粘度的浆料,均匀地涂在已称好质量的正极集电体铝箔上,控制涂抹质量在4 mg左右。再将铝箔在真空干燥箱中60℃干燥4 h,取出后用压片机压实,放入真空干燥箱,在120℃条件下真空干燥12 h,取出后迅速称取质量,放入真空手套箱中,作为电池的正极。
电池的组装过程必须在真空手套箱中进行,组装前控制真空手套箱中的氧含量低于2×10−7,水含量低于2×10−6。以金属锂片为负极,用LiPF6及溶剂EC和DMC配制电解液(电解液中LiPF6的浓度为1 mol/L,EC与DMC的体积比为1:1),以美国CELGARD公司的PP/PE/PP作隔膜,采用反装法组装成2032型纽扣电池。反装的顺序为负极壳、弹簧片、垫片、负极、隔膜、正极、正极壳,滴加适量电解液后,将电池封口,静置24 h后进行电化学性能测试。
1.3 表征与测试
1.3.1 晶体结构与形貌分析
采用日本岛津RINI-1100型X射线衍射仪对合成的LiMn1−xFexPO4粉末材料进行晶体结构分析。以Cu靶Kα线为辐射源,使用Ni滤波片,波长λ=1.540 6 nm,工作电压40 kV,工作电流30 mA,测试角度10°~90°,步长0.02°/步,扫描速度为每步0.2 s。通过对比所得样品的衍射图谱与标准卡片图谱,观察有无杂相及样品的结晶程度。
在已清洗干净的试样台上粘上一层导电胶,在导电胶上轻轻洒上一薄层LiMn1−xFexPO4粉末,再进行喷金处理,然后采用日本电子株式会社的JSM-6380LA型电子扫描电镜观察粉末的颗粒大小、形状及分布情况。
1.3.3 电池的充放电性能测试
采用型号为LAND-CT2001A的电池充放电测试系统,在室温下以0.05C倍率充放电,在2~4.5 V电压范围内对组装的电池进行充放电测试。
1.3.4 交流阻抗测试
本实验采用美国阿美特克有限公司生产的电化学工作站(型号为PARSTAT2273)对组装的电池进行交流阻抗测试,微扰设置为5 mV,频率范围为10 m~100 kHz。
2 结果与讨论
2.1 晶体结构

图1 LiMn1−xFexPO4/C粉末的XRD谱Fig.1 XRD patterns of LiMn1−xFexPO4/C powders
图1所示为LiMn1−xFexPO4/C粉末的XRD谱。由图可看出,所有粉末样品的衍射峰位置和数目均与LiMnPO4标准图谱(卡片号PDF74-0375)衍射峰一致,没有杂质峰出现,表明合成的LiMn1−xFexPO4/C粉末结构均为橄榄石结构,铁的掺入没有改变磷酸锰锂的结构。并且所有样品的衍射峰尖锐,表明材料具有较好的结晶度。此外,虽在合成样品中添加了一定比例的葡萄糖做碳源,但XRD谱中没有检测到碳的存在,说明碳以无定形形态存在。
2.2 微观形貌
图2所示为LiMn1−xFexPO4/C的SEM形貌。由图可看出,粉末存在一定程度的团聚,但团聚颗粒疏松,无紧密烧结块状物。与未掺杂的LiMnPO4/C材料相比,铁离子掺杂的材料颗粒较均匀细小,最大颗粒尺寸不超过2μm。颗粒尺寸减小可缩短锂离子在晶格间的扩散距离,使锂离子的嵌入和脱出容易进行,有利于提高材料的电化学性能。从图中可看出,铁离子掺杂量对LiMn1−xFexPO4/C的形貌影响不大。

2.3 电化学性能
图3所示为0.05C倍率下LiMn1−xFexPO4/C(x=0、0.05、0.10、0.15、0.20)的首次充放电曲线。其中a、b、c、d、e为5组样品的首次放电曲线,a′、b′、c′、d′、e′为5组样品的首次充电曲线。对比各样品的首次充放电曲线可看出,LiMn0.9Fe0.1PO4/C具有明显的充放电平台,首次放电比容量达到110.1(mA·h)/g,而未掺杂的LiMnPO4/C的首次放电比容量仅为35(mA·h)/g。由此可说明Fe的掺入大大改善了LiMnPO4的导电性,使其电性能明显提高。另外,从图3还发现,LiMn0.85Fe0.15PO4/C和LiMn0.8Fe0.2PO4/C的充放电比容量较高,但有2个充放电平台,这是由于铁的掺杂量过高,生成了一部分LiFePO4。LiFePO4相对于Li+/Li的电极电势为3.4 V,而LiMnPO4相对于Li+/Li的电极电势为4.1 V,因此低的电压平台属于Fe2+/Fe3+转化,高的电压平台属于Mn2+/Mn3+转化,低电压平台上Fe2+/Fe3+转化受到Mn2+/Mn3+转化的影响,电极电势有所提高。电池在低电压平台上的放电比容量不属于LiMnPO4的放电比容量,因此LiMn0.9Fe0.1PO4/C具有最高的首次放电比容量。

图3 0.05C倍率下LiMn1−xFexPO4/C的首次充放电曲线Fig.3 The first charge and discharge curves of LiMn1−xFexPO4/C(x=0,0.05,0.10,0.15,0.20)at 0.05C

图4 0.05C倍率下LiMn1−xFexPO4/C的循环性能Fig.4 The cycling performance of LiMn1−xFexPO4/C at 0.05C a,b,c,d,e—x=0,0.05,0.10,0.15,0.20
图4所示为LiMn1−xFexPO4/C(x=0、0.05、0.10、0.15、0.20)在0.05C充放电倍率下的循环性能。经过50次循环后,LiMn0.9Fe0.1PO4/C材料的放电比容量由最初的110.1(mA·h)/g衰减到约80(mA·h)/g,容量保持率为72.73%。相比之下,LiMnPO4/C,LiMn0.95Fe0.05-PO4/C,LiMn0.85Fe0.15PO4/C和LiMn0.8Fe0.2PO4/C的放电比容量均有不同程度的降低。由此说明随循环的不断进行,锂离子的反复嵌入和脱出引起材料结构膨胀和收缩,对材料造成一定的破坏,导致锂离子扩散通道被堵塞。因此,要提高材料的循环性能,必须提高材料结构的稳定性。
图5所示为LiMn0.9Fe0.1PO4/C在0.05C和0.20C充放电倍率下的循环性能曲线。由图可见LiMn0.9-Fe0.1PO4/C在0.2C充放电倍率下的放电比容量与0.05倍率下的放电比容量相比有很大程度的降低,首次放电比容量从110.1(mA·h)/g降到约40(mA·h)/g,这表明大倍率放电对材料的结构影响很大。原因是材料本身具有的较好的锂离子扩散通道和晶体结构在较大倍率下充放电时遭到破坏,晶体结构发生坍塌,一部分锂离子通道被堵塞,导致锂离子的扩散速度急剧减小,因此材料在充放电性能受到很大影响。
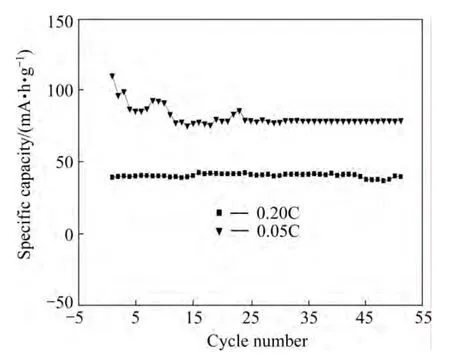
图5 0.05C和0.20C倍率下LiMn0.9Fe0.1PO4/C的循环性能Fig.5 The cycling performance of LiMn0.9Fe0.1PO4/C at 0.05C and 0.20C

图6 LiMnPO4/C和LiMn0.9Fe0.1PO4/C的交流阻抗曲线Fig.6 Electronic impedance spectrum(EIS)curves of LiMnPO4/C and LiMn0.9Fe0.1PO4/C
图6所示为LiMnPO4/C和LiMn0.9Fe0.1PO4/C的交流阻抗曲线。在频率范围较宽时,不同样品由于电荷传递的弛豫过程和扩散弛豫过程的快慢不同,呈现不同的交流阻抗曲线。从图6可看出,LiMnPO4/C与LiMn0.9Fe0.1PO4/C的交流阻都是主要由高频区的半圆弧和低频区的斜线组成,其中半圆表征电极表面的电荷转移阻抗,直线部分对应Li+扩散,为Li+进入电极材料体相引起的Warburg阻抗。LiMn0.9Fe0.1PO4/C材料的半圆明显比LiMnPO4/C材料的半圆小,LiMnPO4/C和LiMn0.9Fe0.1PO4/C的电荷转移阻抗Rct分别为520 Ω和150Ω,说明铁离子掺杂改性使LiMn0.9Fe0.1PO4/C材料的电荷转移阻抗明显降低,从而促进电池内部的电荷传递,减小电池极化,提高材料的电化学性能。这是因为电极表面反应的动力学过程是离子和电子共同作用的结果,铁离子改性使颗粒细化,增大了锂离子的扩散速率,并有效改善颗粒表面之间的电接触,从而提高材料的离子导电性和电子导电性,直接影响电极动力学过程。
3 结论
1)用葡萄糖为碳源,采用高温固相法实现对LiMnPO4的铁离子掺杂和碳包覆改性,得到锂离子电池正极材料LiMn1−xFexPO4/C(x=0、0.05、0.10、0.15、0.20),该材料为单一橄榄石型结构。
2)在0.05C倍率下对LiMn1−xFexPO4/C进行可逆充放电,其中LiMn0.9Fe0.1PO4/C的首次放电比容量达到110(mA·h)/g,但循环容量有一定的衰减,倍率性能也较差,经过30次循环后,放电比容量约80(mA·h)/g,综合电化学性能有待提高。
3)LiMn0.9Fe0.1PO4/C具有较小的阻抗值,意味着铁离子掺杂以及碳包覆的改性有利于锂离子的扩散,从而提高磷酸锰锂的电化学活性。
[1]YAMADA A,HOSOYA M,CHUANG S C,et al.Olivine-type cathodes:Achievements and problems[J].Journal of Power Sources,2003,119/121:232−238.
[2]CHOI D,WANG D,BAE I T,et al.LiMnPO4nanoplate grown via LiMnPO4nanoplate grown via solid-state reaction in molten hydrocarbon for Li-Ion battery cathode[J].Nano Letters,2010,10(8):2799−2805.
[3]KONAROVA M,TANIGUCHI I.Preparation of carbon coated LiFePO4by a combination of spray pyrolysis with planetary ball-milling followed by heat treatment and their electrochemical properties[J].Powder Technology,2009,191(1/2):111−116.
[4]PADHI A K,NANJUNDASWAMY K S,GOODENOUGH J B.Phospho-olivines as positive-electrode materials for rechargeable lithium batteries[J].Journal of the Electrochemical Society,1997,144(4):1188−1193.
[5]KANG B,CEDER G.Battery materials for ultrafast charging and discharging[J].Nature,2009,458(7235):190−193.
[6]LEE J W,PARK M S,ANASS B,et al.Electrochemical lithiation and delithiation of LiMnPO4:Effect of cationsubstitution[J].Electrochimica Acta,2010,55(13):4162−4169.
[7]DELACOURT C,LAFFONT L,BOUCHET R,et al.Toward understanding of electrical limitations(electronic,ionic)in LiMPO4(M = Fe,Mn)electrode materials[J].Journal of the Electrochemical Society,2005,152(5):913−917.
[8]YONEMURA M,YAMADA A,TAKEI Y,et al.comparative kinetic study of olivine LixMPO4(M=Fe,Mn)[J].Journal of The Electrochemical Society,2004,151(9):1352−1356.
[9]DELACOURT C,POIZOT P,MORCRETTE M,et al.One-step low-temperature route for the preparation of electrochemically active LiMnPO4powders[J].Chemistry of Materials.2004,16(1):93−99.
[10]WANG D,OU Y C,DRÉZEN T,et al.Improving the electrochemical activity of LiMnPO4via Mn-sitesubstitution[J].Journal of the Electrochemical Society,2010,157(2):225−229.
[11]MIZUNO Y,KOTOBUKI M,MUNAKATA H,et al.Effect of carbon source on electrochemical performance of carbon coated LiMnPO4cathode[J].Journal of the Ceramic Society of Japan,2009,117(1371):1225−1228.
[12]PIANA M,CUSHING B L,GOODENOUGH J B,et al.A new promising sol-gel synthesis of phospho-olivines as environmentally friendly cathode materials for Li-ion cells[J].Solid State Ionics,2004,175(1/4):233−237.
[13]WANG Y,YANG Y,YANG Y,et al.Enhanced electrochemical performance of unique morphological LiMnPO4/C cathode material prepared by solvothermal method[J].Solid State Communications,2010,150(1):81−85.
[14]MINAKSHI M,SINGH P,THURGATE S,et al.Redox behavior and surface characterization of LiFePO4in lithium hydroxide electrolyte[J].Journal of Power Sources,2006,158(1):646−649.
[15]彭忠东,胡国荣,刘业翔.稀土掺杂合成离子电池正极材料LiMnO4技术[J].粉末冶金材料科学与工程,2005,10(1):45−49.PENG Zhong-dong,HU Guo-rong,LIU Ye-xiang.Synthesis of rare earth doping cathode materials LiMn2O4used for lithium ion batteries[J].Materials Science and Engineering of Powder Metallurgy,2005,10(1):45−49.
[16]WANG D Y,BUQA H,CROUZET M.High-performance,nano-structured LiMnPO4synthesized via a polyolmethod[J].Journal of Power Sources,2009,189(1):624−628.
