新型温度敏感型栓塞剂用于原发性肝癌动脉栓塞的初步临床试验
2015-03-25杨仁杰王晓东朱林忠徐海峰郭建海
曹 广, 杨仁杰, 朱 旭, 陈 辉, 王晓东, 朱林忠, 徐海峰, 高 嵩,刘 鹏, 郭建海
原发性肝细胞癌(HCC)是全球性常见的恶性肿瘤,在我国尤其高发,位居所有恶性肿瘤的第3位[1]。 经皮肝动脉化疗栓塞术(TACE)是目前不可切除性HCC治疗主要手段之一。目前国内最常用的HCC TACE治疗栓塞剂主要有碘油、明胶海绵颗粒,PVA颗粒、微球,海藻酸钠颗粒等,国际最新流行载药微球DC-Bead[2],放射性微球钇90等。 碘油作为最经典的栓塞剂目前在实际临床中最为常用,各家具体做法不一,具体化疗混合药物的方案也略 有 不 同[3-4]。
近年来,一种新型温度敏感型栓塞剂尝试应用介入血管内栓塞治疗,已经过大量体内外动物实验[5-10]。我们进一步改进了此类型温敏栓塞剂配方,加入使其可在X线显影特性的碘油成分,以适当比例混合,同时又保留其原有的温敏凝结特性,其化学名称为聚N-正丙基丙烯酰胺-co-N-异丙基丙烯酰胺(POLY-N-propylacrylamide-co-N-Isopropyl acrylamide,P-NIP-co-NNP)。 该栓塞剂已于 2011年9月19日通过了国家食品药品监督管理局济南医疗器械质量监督检验中心检验(编号:Y2009030511),该聚合物已经过严格的I期安全性试验,具有水溶性,不需要有机溶剂,无毒、非黏附性、X线下可视等独特的优点。
2012年1—12月,我们组织开展了以温敏栓塞剂为基础的肝动脉栓塞治疗晚期不可切除的HCC患者的前瞻性、单臂、开放性、单中心期临床研究,此研究已经所在单位伦理委员会审查并通过,入组10例患者,现将初步结果报道如下。
1 材料与方法
本临床试验为单中心,前瞻,开放的临床试验,试验对象定为HCC患者,实施血管内栓塞治疗,栓塞剂不掺加化疗药物。本试验在北京大学肿瘤医院介入科进行,不设对照组。10例为巴塞罗那肝癌分期(BCLC)B期或C期患者。
1.1 入组标准
①HCC患者,临床有乙型或丙型病毒性肝尖病史,有肝硬化背景,甲胎蛋白(AFP)大于200μg/L。若AFP血清学阴性患者,则需要经过病理学穿刺活检证实;②患者本人同意参加本试验并签署知情同意书;③不适合其他治疗法;④BCLC分期B或C,肝功能Child-Pugh分级为A级或B级的患者;⑤门静脉主干无癌栓侵犯或阻塞;造影显示可见门脉向肝血流方向;⑥肿瘤的体积小于全肝的60%;⑦患者ECOG评分0或1分,预期生存期3个月以上;⑧女性患者妊娠试验必须是阴性。
1.2 方法
1.2.1 治疗方法 设备为美国GE公司Innova4100血管造影机。采用超选择TACE操作技术,首先进行肝动脉造影,分析肝动脉/门脉血流动力学改变,了解肿瘤血供情况,采用超选择同轴导管技术,将微导管送至肿瘤供血动脉,根据手术需要使用小容量的注射器(2.5 ml)推注适量温敏型液体栓塞剂栓塞肿瘤血管,同时评价靶肿瘤的栓塞情况及栓塞剂的使用情况。
1.2.2 评价标准
1.2.2.1 安全性评价,不良反应:记录患者在观察期间的所有不良反应及程度。介入治疗前、后均进行血常规、肝肾功能和心电图等检查。术后(3~5周内)全面复查和评价病情1次,同时监测血清AFP变化。检测有无其他脏器如肺、脑的异位栓塞情况出现,主要根据临床症状评估,必要时行影像学检查。参照美国国家肿瘤研究所发布的治疗不良反应分级标准(National Cancer Institute Common Toxicity Criteria,version 3.0)[11]记录患者所有不良反应。
1.2.2.2 疗效评价:①主要评价,由专门制定从事介入诊疗工作8年以上高年资医师操作,评定操作过程中安全性,靶血管栓塞的即刻成功率;误栓率;导管堵塞率。②次要评价,术后(30±7)d肿瘤动脉的栓塞情况;术后(30±7)d 实体瘤 mRECIST[12-13]疗效评价,检测AFP变化。
1.3 统计方法
使用SPSS 19.0统计软件,对所有入组患者用Kaplan-Meier法统计肝脏局部病灶的无进展生存期(PFS,progress free survival)和累计总生存期(OS,overall survival)
2 结果
2.1 患者一般情况
本次试验总计入组10例患者,男9例,女1例,栓塞可评估靶病灶23处。年龄为45~74岁,中位值62.5岁。获得穿刺病理学诊断5例;根据影像学、乙肝或丙肝病史、肝硬化背景、AFP大于200μg/L等临床诊断5例。BCLC分期B期5例,C期5例;ECOG评分0~1分者8例,2分者2例;肝功能Child-Pugh分级A级7例,B级3例;肝内病灶数1处3例,2、3处5例,4处2例;有无肝内外转移各5例;门脉分支有癌栓者6例。随访时间共计2年,术后第1年生存率50%,随访截止2014年2月,10例患者9例已死亡,1例存活。
2.2 安全性评估
术中及术后无一例患者出现异常栓塞剂相关严重并发症,无患者出现异位栓塞(肺、脑栓塞)相关临床表现。
所有患者术后1个月内出现不同程度的栓塞后综合征表现,不良反应包括:疼痛,发热,肝功能异常,胃肠道反应,腹水等。反应程度多在1、2级以内,在经过一般支持对症治疗后均得到缓解。无一例患者在术后3个月内死亡。见表1。
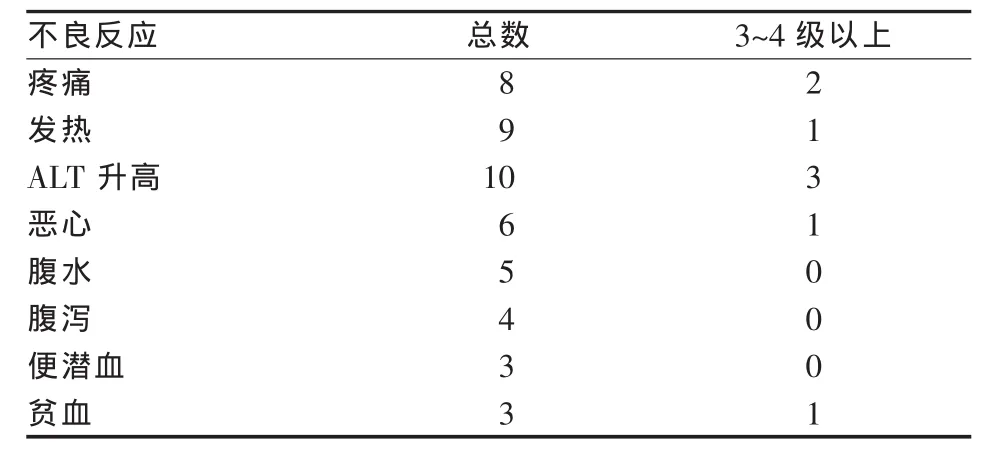
表1 术中、术后不良反应一览 例
2.3 疗效评价
2.3.1 术中造影情况 操作过程中注意初始温度控制,正常室温25℃以下存放该栓塞剂均为纯液态状态。栓塞操作由高年资介入医师完成,尽量超选择至肿瘤靶血管分支,注射过程中应注意速度控制。理想栓塞终点为肿瘤供血动脉分支血流停止或明显减慢,同时尽量保护肝动脉主干及其他正常段分支血流通畅,造影复查肿瘤供血分支区域可呈“干枝修剪后”征象,未再显示明显靶瘤体染色。所有10例患者手术均获成功,无一例术中出现栓塞剂堵塞导管情况。(见图1)。
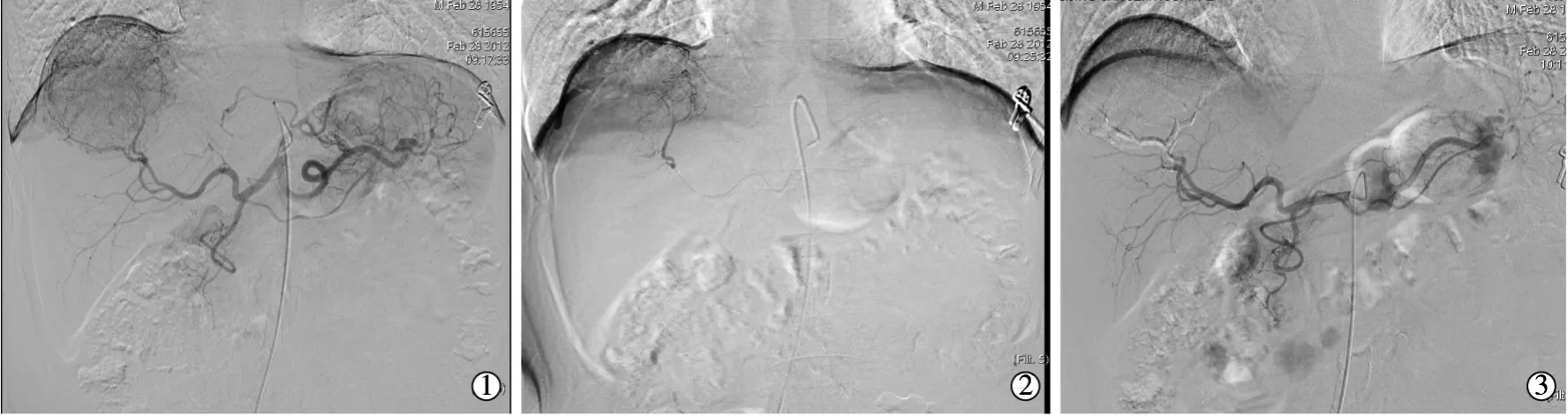
图1 术中造影所见
2.3.2 术后3~5周内CT复查结果 获得完全缓解(CR)1 例,部分缓解(PR)3 例,稳定(SD)5 例,进展1例,客观缓解率(CR+PR)为 40%,疾病控制率(DCR=CR+PR+SD)90%。常见的不良反应为疼痛,发烧,肝功能损伤,少量腹水,腹泻等。
2.3.3 PFS和 OS 肝内靶病灶 PFS为 18.4(95%CI:14.15~22.65)周,累积 mOS 为 46.2(95%CI:38.18~54.22)周。 (见图 2)
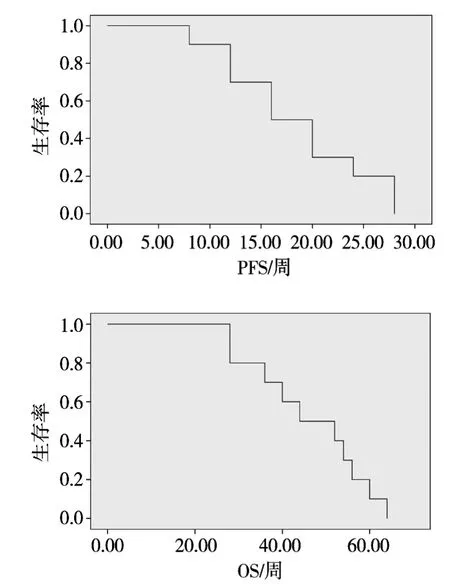
图2 疾病无进度生存和总生存期
2.3.4 血清AFP水平 入组时,有7例患者血清AFP异常增高,治疗后4~6周复查,与治疗前相比,血清AFP 平均水平明显下降,由(10 590.4±571.9)μg/L 降低到(5 630.2±320.3)μg/L。 AFP 反应率为 30.8%。
3 讨论
传统TACE是利用碘油和阿霉素的混悬乳剂作为栓塞剂(加或不加明胶海绵颗粒),作为最经典模式已历经数10载,是治疗不可切除HCC以及肝移植术前过渡治疗的主要手段[14-15]。根据循证医学依据以及我们实际工作中的经验,这种碘油与阿霉素混悬液最大的不足是碘油会逐渐被血流冲刷而流失,而最常见局部栓塞坏死不彻底或复发也常常源于此。碘油的流失在某些状况下可以导致异位肺栓塞[16]或脑栓塞[17]。2002 年 Camma 等[18]Meta 分析中包括了1980-2000年度的18个随机对照临床试验数据,结论是:添加化疗药物的TACE与不添加化疗药物单纯栓塞TAE对比并没有明显的生存优势(OR 1.007; 95%CI: 0.79~1.27; P=0.95)。 从而将肝动脉栓塞所用的栓塞剂研究方向转向了着重以能否达到彻底栓塞为目的,而逐渐开始忽略其中化疗药物的作用。因此,随后一大批载药或不载药的颗粒栓塞剂相继问世[19]。新型的颗粒栓塞剂更加注重对肿瘤血管床的彻底栓塞,而极大程度上避免了类似碘油一样随血流冲刷流失甚至引起肺栓塞的可能。
液体栓塞材料易于操作,可通过细长微导管直接注入血管[20-21]。本研究使用液态温敏栓塞剂属于聚合物改进的智能材料,在环境发生微小变化时,其微结构发生可逆变化,低温时,材料在水中溶胀,大分子链因水合而伸展形成液态溶胶:当温度升至体温36~37℃水平时,材料发生急剧的脱水合作用,大分子链聚集收缩而形成凝胶,从而起到栓塞作用。该聚合物具有水溶性,不需要有机溶剂,无毒、非黏附性等独特的优点。在之前国内刘作勤等、盛希忠等[22-23]已实施了系列的动物试验,尝试其在神经介入治疗动静脉畸形当中的应用。本实验使用液态温敏栓塞剂混入碘化油成分,赋予其突出特点之一是具有X线下显影的特性,使其更加安全,实际肝脏肿瘤介入栓塞手术操作时可视性好,即使在栓塞后数月仍在瘤体内可看到明显沉积,温敏栓塞剂改变了碘油的黏性和沉积效果,大大降低了可能被冲刷流失的可能。
温敏型栓塞剂是一种新型的栓塞材料,在透视下可视,用于肿瘤的栓塞治疗,已于2011年9月19日通过了国家食品药品监督管理局济南医疗器械质量监督检验中心检验(编号:Y2009030511)在之前的多项动物实验以及Ⅰ期临床试验当中,该栓塞剂的生物相容性较好,已排除其可能的生物或化学毒性。该栓塞剂在人体内物理性质非常稳定,体温状态下不可逆转化,栓塞效果确切。在我们的试验中,所有入组患者均未发现任何毒性或过敏等反应,术后的不良反应也符合常规栓塞治疗后常见表现。其生物安全性已得到充分证实。
本研究是初步的临床试验,仅入组10例患者作为首批对象。主要研究目的着重于临床观察使用的安全性和有效性的探索。样本量少,相对获得的PFS与OS结果仅供参考,而不能完全体现其真正临床疗效,未来期待在积累使用后的经验后,更大样本量来说明和体现其实用价值。
本文所用栓塞剂有以下特点:①X线下可显影,可接近对比剂显影效果,便于实际栓塞过程中的观察和控制;②使用之前的体外试验训练非常必要,同时要注意使用过程中环境的温度控制,在不同环境温度下,该栓塞剂表现出的黏稠度和流动性有一定差别,目前尚不能精准具体量化指标,需要操作者亲身操作体验练习,才能使用得当;③栓塞剂属于非黏性液体栓塞剂,使用中不会导致导管与血管粘连,使用后注意生理盐水及时冲管,不容易出现堵塞导管的现象;④该栓塞剂为永久栓塞,高CT值的沉积灶或供血动脉分支内的残留可以经术后长时间间隔CT观察到,持久存在,便于术后评效;⑤该栓塞剂可造成肿瘤供血动脉分支铸型,瘤体内的分布沉积并不一定能达到完美,凝固后便很难再有变化,会导致该动脉分支的持久闭塞以及侧支循环形成,使得肿瘤栓塞不彻底,且再次经该分支实施介入治疗的可能性降低。故操作中建议应间断注射并反复用生理盐水冲管,尽可能使栓塞物质进入瘤体毛细血管床,而避免仅仅栓塞动脉分支;⑥10例患者使用中和使用后未发现有异位栓塞现象,栓塞剂相对沉积凝固速度较快,发生异位栓塞的可能性较低。故提示对于瘤体较大,或可能存在隐性动-静脉瘘的病灶等异位栓塞风险较高的靶病灶可能存在使用安全优势。
综上所述,经过国内外同行[24]的体外试验,动物实验,以及此次我们在临床中的尝试栓塞治疗晚期HCC,探索其临床应用的安全性和可实施性,初步得出小样本量患者PFS及OS参数。此类栓塞剂具有较独特的自身特点,可以丰富我国中晚期HCC介入治疗手段。因此,持续的积极探索和尝试改进具有重要的科学意义和实用价值,有望进一步开展更大规模临床研究以及与其它栓塞剂的对照研究。
[1]Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int JCancer,2010,127:2893-2917.
[2]Prajapati HJ,Dhanasekaran R,El-Rayes BF,et al.Safety and efficacy of doxorubicin drugeluting bead transarterial chemoembolization in patients with advanced hepatocellular carcinoma[J].J Vasc Interv Radiol,2013,24:307-315.
[3]Petruzzi NJ,Frangos AJ,Fenkel JM,et al.Single-center comparison of three chemoembolization regimens for hepato-cellular carcinoma[J].JVasc Interv Radiol,2013,24:266-273.
[4]Ngan H,Lai CL,Fan ST,et al.Transcatheter arterial chemoembolization in inoperable hepatocellular carcinoma:four-year followup[J].JVasc Interv Radiol,1996,7:419-425.
[5]王绍胜,张文堃,董 杰.新型温敏性栓塞剂用于脑动静脉畸形实验研究[J].介入放射学杂志, 2010, 19: 471-474.
[6]盛希忠,刘作勤,武乐斌,等.新型温度敏感性液体栓塞材料的实验研究[J].医学影像学杂志, 2005, 15: 177-180.
[7]李敬伟,王 杰,吕朋华,等.非黏附性液体栓塞剂-BCD合剂的实验研究[J].中国临床医学影像杂志,2005,16:156-160.
[8]万智勇,张 磊,卢子碹,等.温敏药物缓释栓塞剂行兔肝动脉栓塞的实验研究[J].介入放射学杂志,2011,20:559-562.
[9]曹艳霞,张 灿,平其能.温度敏感型材料聚(N-异丙基丙烯酰胺)壳聚糖的制备与表征[J].高分子材料科学与工程,2005,21:236-239.
[10]杜 浩,马廉亭,吴佐泉,等.非黏附液体栓塞材料甲基丙烯酸羟乙酯聚合物的溶解及栓塞性能[J].中国组织工程研究与临床康复,2008,12:9643-9646.
[11]Trotti A,Colevas AD,Setser A,et al.CTCAE v3.0: development of a comprehensive grading system for the adverse effects of cancer treatment[J].Semin Radiat Oncol,2003,13:176-181.
[12]Lencioni R,Llovet JM.Modified RECIST(mRECIST) assessment for hepatocellular carcinoma[J].Semin Liver Dis,2010,30:52-60.
[13]姚雪松,李 槐.不可手术切除的肝细胞癌的疗效评价标准——改良RECIST标准更可靠[J].介入放射学杂志,2012,21:177-179.
[14]Llovet JM,Real MI,Montana X,et al.Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma:a randomised controlled trial[J].Lancet,2002,359:1734-1739.
[15]敖 劲,张跃伟,徐 克.明胶海绵微粒经动脉栓塞治疗原发性肝癌的研究现状[J].介入放射学杂志,2011,20:1010-1013.
[16]Xu H,Yang R,Wang X,et al.Symptomatic pulmonary lipiodol embolism after transarterial chemoembolization for hepatic malignant tumor: clinical presentation and chest imaging findings[J].Chin Med J(Engl),2014,127:675-679.
[17]刘 朝,管 生,李明省,等.肝脏肿瘤介入术后碘油异位脑栓塞(附报道2例并文献复习)[J].介入放射学杂志,2011,20: 135-137.
[18]Camma C,Schepis F,Orlando A,et al.Transarterial chemoembolization for unresectable hepatocellular carcinoma:meta-analysis of randomized controlled trials[J].Radiology,2002,224:47-54.
[19]刘 影,张跃伟.肝癌介入治疗用微粒型栓塞剂的研究进展[J].介入放射学杂志, 2012, 21: 969-972.
[20]Heskins M,Guillet JE.Solution properties ofpoly(N-isopropylacrylamide).Macromol Sci Chem (A),1968,2:1441-1455.
[21]Matsumaru Y,Hyodo A,Nose T,et al.Application of thermosensitive polymers as a new embolic material for intravascular neurosurgery[J].JBiomater Sci Polym Ed,1996,7:795-804.
[22]盛希忠,刘作勤,武乐斌,等.温敏型液体栓塞材料的实验研究[J].实用放射学杂志, 2005, 21: 1233-1236.
[23]盛希忠,刘作勤,赵成如,等.温度敏感型液体栓塞剂治疗脑动静脉畸形的实验研究[J].中国医学影像技术,2005,21:1353-1355.
[24]Pothmann D,Ulusans S,Prols F,et al.Liquid 2-P-HEMA for endovascular tumor therapy:in vivo feasibility study[J].Med Sci Monit,2004,10:BR286-BR293.
