自膨式支架成形术治疗基底动脉粥样硬化性狭窄围手术期并发症分析
2015-03-25贺迎坤蔡栋阳王子亮李天晓李钊硕
贺迎坤, 蔡栋阳, 王子亮, 许 斌, 李天晓, 李钊硕
基底动脉狭窄引起的后循环缺血(PCI)致残、致死率高,抗栓治疗效果较差,腔内支架成形术作为抗栓治疗的重要补充治疗手段在临床上广泛开展[1-3]。然而,近期几项针对颅内动脉狭窄的研究结果显示,由于腔内支架成形术较高的围手术期并发症发生率,腔内支架成形联合强化药物治疗并不能比单纯强化药物治疗使患者获得更多益处[3-4]。但该项研究入组人群主要是白人和黑人,其结果是否适用于黄种人群,还需进一步验证。本研究通过回顾性分析郑州大学人民医院介入科采用自膨式Wingspan支架治疗症状性重度基底动脉粥样硬化性狭窄患者的相关资料,探讨腔内支架成形术围手术期并发症发生率、危险因素及预防措施。
1 材料与方法
1.1 一般资料
经我院医学伦理委员会同意,对2007年7月至2013年4月在介入科完成基底动脉Wingspan支架成形术的96例症状性重度基底动脉粥样硬化性狭窄患者资料进行收集。5例伴有颅外椎动脉开口狭窄并接受支架成形术治疗患者被排除本研究,因而共有91例患者纳入本研究,其中4例伴发椎动脉优势侧V4段狭窄。
91例患者中男性66例,女性25例,平均年龄(61.3±9.2)岁;伴有高血压病 79例、糖尿病 36例、血脂异常40例、吸烟史34例、冠心病史12例、既往脑卒中史27例。病变特点:术前有穿支梗死灶43例、非穿支梗死灶14例、无后循环梗死灶34例;病变长度>10 mm 10例、5~10 mm 77例、<5 mm 4例;病变末次事件距离手术时间平均(20.4±14.4)d;病变累及基底动脉中段者57例、累及基底动脉下段者32例、累及基底动脉上段者2例。
1.2 手术过程
所有手术均在全身麻醉下进行,全身肝素化250~300 s(70 U/kg普通肝素静脉推注,之后每小时增加1 000 U)。通过股动脉入路置入6 F动脉鞘(美国强生公司),常规使用6 F导引导管或在长鞘(美国强生公司)配合下将导引导管头置于椎动脉椎间孔段末端平直处,行三维造影选择最佳操作角度,使用路径图,在微导管配合下将0.014英寸微导丝穿过狭窄段,导丝头置于大脑后动脉环池段较平直血管处;沿微导丝输送Gateway球囊导管(美国史塞克公司)至狭窄段,球囊直径选择为狭窄两端正常血管直径的80%~90%,长度要求完全覆盖狭窄段或略长于狭窄段,对位准确后使用50%对比剂缓慢充盈球囊至6 atm,持续10~20 s,造影观察血管狭窄即刻改善情况;沿微导丝交换Wingspan支架(美国史塞克公司)至狭窄段(支架直径选择略大于正常血管直径,长度要求完全覆盖狭窄并至少超出狭窄两端各3 mm),准确对位后释放支架,即刻造影观察残余狭窄及远端血管分支,残余狭窄≤30%、远端血管未见减少后可撤出微导丝及导引导管。
1.3 药物管理
术前常规口服抗血小板药物氯吡格雷(75 mg/d)和肠溶阿司匹林(100 mg/d)至少 3~5 d,急症手术前一次性给予肠溶阿司匹林300 mg和氯吡格雷300 mg,或术中使用盐酸替罗非班。术前2 h静脉应用尼莫地平。支架成形术后即刻行CT扫描排除脑出血;自然中和肝素;继续使用尼莫地平1~3 d,将血压控制在基础血压下限。排除出血后给予低分子肝素(4 000~6 000 U/12 h)皮下注射,连续 3 d;术后双联抗血小板6个月后改口服肠溶阿司匹林(100 mg/d),同时规范控制其它动脉粥样硬化危险因素。
1.4 临床及影像学评估
记录术中及术后30 d内所有脑卒中、死亡及短暂性脑缺血发作(TIA)情况。术前、术后即刻及出院前根据改良Rankin量表(mRS)和美国国立卫生研究院脑卒中量表(NIHSS)进行评分,出院后 1、3、6 个月对患者神经系统作临床评估,术后12个月及以后每年进行临床随访,对疑有脑卒中复发患者行头颅CT或MRI检查。建议患者术后第6个月随访CTA或DSA。
1.5 统计学方法
采用SPSS 17.0软件进行统计学分析。年龄、末次事件距离手术时间、术前狭窄度、术后残余狭窄度、病变长度、随访时间等计量资料以x±s表示;性别、高血压、糖尿病、血脂异常、吸烟、冠心病史、既往脑卒中史、术前有穿支梗死灶、术前有非穿支梗死灶、术前无后循环梗死灶、病变长度、病变部位、术中经验等分类资料以%表示,将早期完成的30例患者定义为A组,中期完成的30例患者定义为B组,近期完成的31例患者定义为C组。计量资料比较采用t检验、分类资料比较采用卡方检验。
2 结果
91例症状性重度基底动脉粥样硬化性狭窄患者全部成功植入支架,平均狭窄率由术前(82.2±5.8)%改善至术后即刻(15.9±5.7)%。围手术期30 d内发生脑卒中事件13例(14.3%,13/91),其中穿支卒中8 例(8.8%,8/91)、血栓形成 4 例(4.4%,4/91)、蛛网膜下腔出血1例(1.1%,1/91);致死致残性脑卒中(mRS评分≥4分)2例(2.2%,2/91),其中 1例死亡,1例重度残疾;遗留轻微神经功能障碍8例;3例患者术后1个月时无明显神经功能缺失症状。12例缺血性脑卒中患者中8例考虑与穿支事件相关,均有不同程度的神经功能障碍,术后1个月时mRS评分1分2例、2分5例、3分1例;4例与支架内血栓形成相关(2例为球囊选择偏大、2例支架释放时操作时间长),死亡1例、重残1例(1个月时mRS评分5分),2例无明显神经功能症状。1例SAH病例考虑与梗死后高渗相关,出院时无症状。未出现其它非脑卒中相关并发症。
统计学分析显示围手术期缺血性脑卒中的发生与病变累及基底动脉中段(P=0.049)、病变节段长(P=0.002)、狭窄度较重(P=0.001)相关(表 1、2),与手术医师手术经验不相关(P=1.000)。
3 讨论
支架植入与强化药物治疗预防颅内动脉狭窄再发脑卒中对照试验(SAMMPRIS)研究结果显示,基底动脉支架成形术30 d内患者缺血性脑卒中发生率为20.8%,年累积脑卒中发生率为25%,30 d后再发脑卒中发生率仅增加4.2%[3-4]。因此,基底动脉支架成形术围手术期安全性是能否有效预防脑卒中再发的重点。本研究结果也显示,支架成形术治疗基底动脉狭窄的围手术期并发症发生率高,但致残致死性并发症发生率较低。
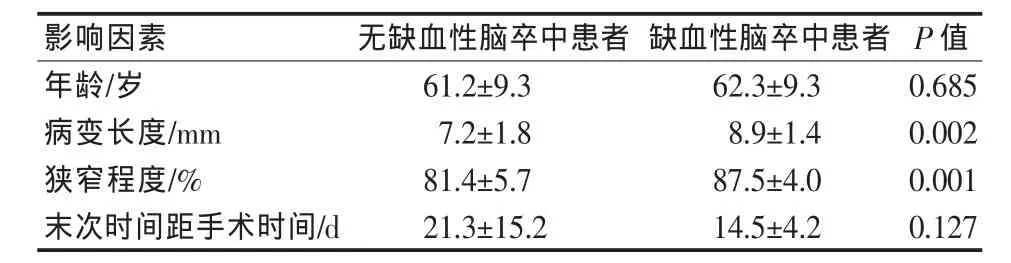
表1 缺血性脑卒中与连续变量的统计学分析
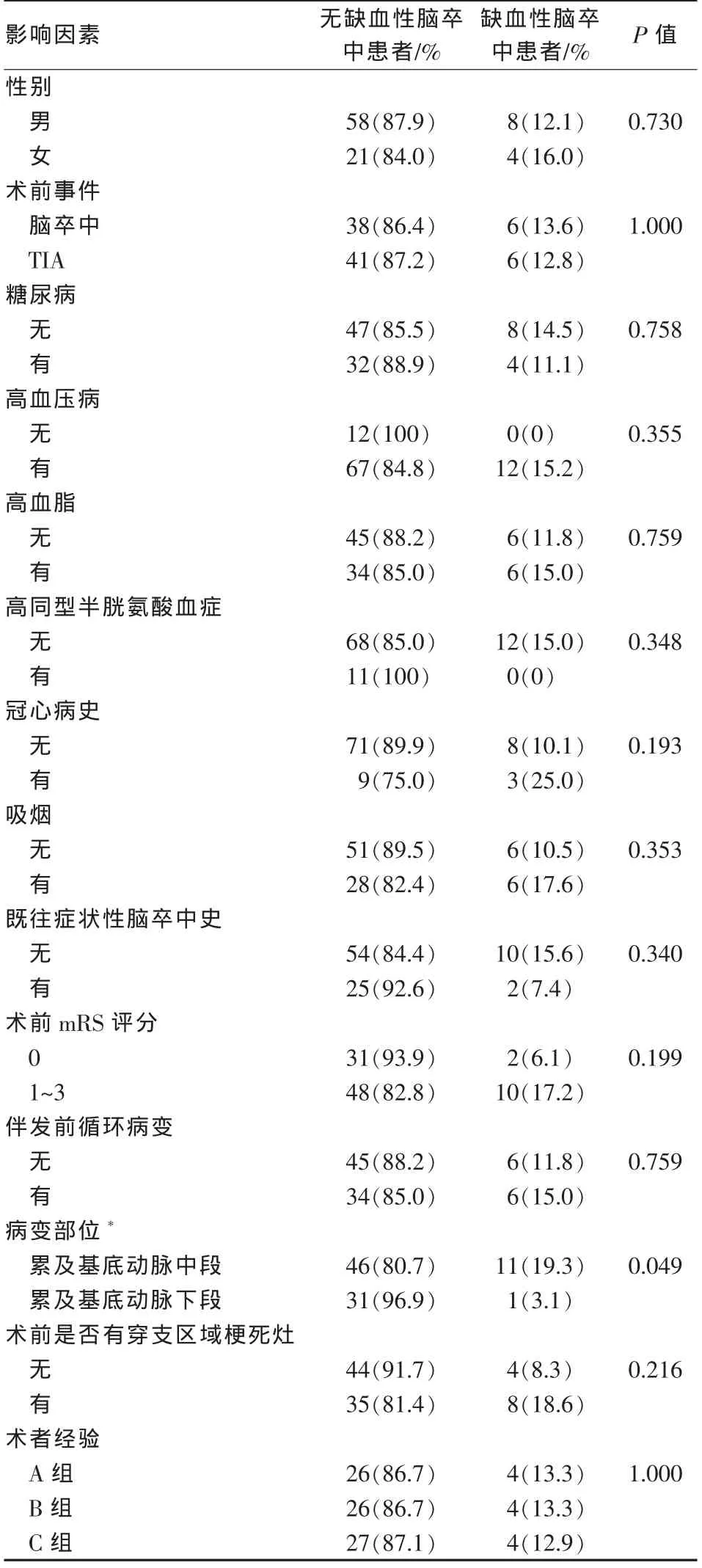
表2 缺血性脑卒中与分类变量的统计学分析
然而,本组患者并发症发生率远低于SAMMPRIS研究。我们认为主要归因于两方面,首先是学习曲线方面,本中心5名手术医师人均在早期完成的颅内所有部位Wingspan支架成形术至少20例,在施行前30例基底动脉支架成形术时已完成学习曲线,如本组支架成形术分析结果未表现出统计学差异。很多学者认为,学习曲线是影响颅内支架成形术并发症的一个独立危险因素[5-6], 尽管随后的SAMMPRIS研究认为手术医师手术例数多少与手术并发症发生率不相关[7]。其次是入组患者筛选方面,病变特点是手术风险高低的一个独立危险因素。本组数据显示,基底动脉中段狭窄、极重度狭窄、长节段病变与并发症呈相关性。基底动脉发出诸多重要穿支动脉,且多为终末支,侧支代偿差,在长节段、重度狭窄、病变位于基底动脉中段病例中雪犁效应会更加明显。我们在手术开展早期已意识到这种现象,有意规避了一些高危患者,而SAMMPRIS研究中完全采用随机分配原则,无法规避高风险患者。我们认为,慎重选择入组患者,避免高危患者入组,可降低围手术期并发症发生率。然而,就此类手术高危患者而言,采用单纯药物治疗,可能同样具有更高的脑卒中风险,针对此类患者的治疗方案有待进一步探究。
本组患者缺血性脑卒中并发症发生率高于Jiang 等[8]、张磊等[9]等报道,原因可能与本组患者所选球囊偏大、血管扩张充分有关。本组平均狭窄率由术前(82.2±5.8)%降为术后即刻的(15.9±5.7)%,残余狭窄率低于大宗病例报道[8-9]。选用偏大球囊扩张,一方面增加了雪犁效应,另一方面会加重对血管内膜的损伤,增加支架内急性血栓形成的发生率。本组2例支架内急性血栓形成患者考虑与此相关。因此,对极重度狭窄患者,推荐选用小球囊、亚满意扩张,不应刻意追求解剖上完全修复。本组另2例支架内急性血栓并发症患者可能与操作时间过长、支架系统尾端未接高压滴注有关,其中1例因麻醉问题于支架释放前出现躁动,使支架系统在体内停留过长时间,支架释放后即刻发现支架内有血栓存在;1例因椎动脉路径迂曲,支架定位困难,释放后即发现血栓形成。这些均提示,应遵循支架植入操作流程,支架系统尾端应连接高压滴注,引入支架前充分准备,尽量减少支架系统在体内停留时间,防止支架释放前血栓形成。
目前国内关于颅内支架临床应用研究报道主要是一些大中心回顾性研究,其临床效果大多较好,这些良好结果可能与单中心、固定的有经验的手术医师完成手术有关,但单中心回顾性研究缺乏对入组患者的详细评估及对研究的监管,可能会遗漏一些小的不良事件。单纯强化药物治疗对中国人群效果如何,支架成形术能否为强化药物治疗的中国患者带来好处,这些均亟待研究探索。因此,目前正在进行的针对中国人群的前瞻性、多中心随机对照研究[10]意义重大。
[1]李 迪,高 众,王苏平.经皮血管内支架成形术治疗症状性椎基底动脉狭窄的临床观察[J].中华老年心脑血管病杂志,2014, 16: 92-94.
[2]刘英慧,赵 卫,石 潆.颅内动脉狭窄支架成形术围手术期并发症分析及处理对策[J].介入放射学杂志,2014,23:550-553.
[3]Derdeyn CP,Chimowitz MI,Lynn MJ,et al.Aggressive medical treatment with or without stenting in high-risk patients with intracranial artery stenosis(SAMMPRIS):the final results of a randomised trial[J].Lancet,2014,383:333-341.
[4]Chimowitz MI,Lynn MJ,Derdeyn CP,et al.Stenting versus aggressive medical therapy for intracranial arterial stenosis[J].N Engl JMed,2011,365:993-1003.
[5]许 斌,史怀璋,徐善才,等.Wingspan支架治疗症状性椎动脉颅内段和基底动脉狭窄的临床观察[J].中华神经外科杂志,2012,28:1226-1229.
[6]Zaidat OO,Klucznik R,Alexander MJ,et al.The NIH registry on use of the Wingspan stent for symptomatic 70-99%intracranial arterial stenosis[J].Neurology,2008,70:1518-1524.
[7]Derdeyn CP,Fiorella D,Lynn MJ,et al.Impact of operator and site experience on outcomes after angioplasty and stenting in the SAMMPRIStrial[J].JNeurointerv Surg,2013,5:528-533.
[8]Jiang WJ,Yu W,Du B,et al.Wingspan experience at Beijing Tiantan Hospital:new insights into the mechanisms of procedural complication from viewing intraoperative transient ischemic attacks during awake stenting for vertebrobasilar stenosis[J].J Neurointerv Surg,2010,2:99-103.
[9]张 磊,杨志刚,张永巍,等.自膨式支架治疗症状性基底动脉狭窄围手术期并发症的分析[J].中国脑血管病杂志,2013,10: 348-352.
[10]高 鹏,焦力群,赵振伟,等.症状性颅内动脉狭窄不同疗法的多中心随机对照研究设计方案[J].中国脑血管病杂志,2014: 329-336.
