酵母膏对α-溶血性链球菌发酵代谢甘露聚糖肽的影响
2015-03-24高梦祥
许 翠,熊 秋,吴 佳,高梦祥,2,*
(1.长江大学生命科学学院,湖北荆州 434025;2.长江大学荆楚特色食品研发中心,湖北荆州 434025)
酵母膏对α-溶血性链球菌发酵代谢甘露聚糖肽的影响
许 翠1,熊 秋1,吴 佳1,高梦祥1,2,*
(1.长江大学生命科学学院,湖北荆州 434025;2.长江大学荆楚特色食品研发中心,湖北荆州 434025)
研究发酵培养基中酵母膏的添加量对α-溶血性链球菌生长及其代谢甘露聚糖肽的影响规律。结果表明:当酵母膏的添加量小于7g/L时,随着酵母膏添加量的增加,α-溶血性链球菌的菌落数明显增加,最大菌落数为1.9×109,比对照组7.6×108增加了1.5倍,而且α-溶血性链球的延迟期由8h缩短到5h之内,对数期的生长速率由2.83增加到11.02,进入稳定期的时间也由27h以上缩短到23h。当酵母膏添加量大于7g/L时,这一规律就不再明显。同时,酵母膏使菌体量快速增加的时间提前了2~4h,当酵母膏添加量为7g/L时,在发酵4h时,比生长速率最大,为0.38;在发酵27h时,甘露聚糖肽的代谢量最大,为1.04g/L。
α-溶血性链球菌,发酵,酵母膏,甘露聚糖肽
酵母膏是以新鲜啤酒酵母乳液经酶解分离、浓缩得到的纯天然制品。它是由氨基酸、肽类、水溶性维生素及酵母多糖、酵母核酸组成的一种混合物,是各种微生物所必需的生长元素。在培养基中的主要作用是补充氮源和提供生长所需的多种维生素和氨基酸。酵母膏常常作为主要成分来优化微生物培养基,而单独探讨酵母膏对微生物的生长及其代谢产物的影响的报道还相对较少。Suarez[1]的研究表明了酵母膏能提高大肠杆菌分批发酵培养的发酵能力。Amrane[2]报道了分批培养中酵母膏浓度对瑞士乳杆菌生长和代谢产物的耦合效应。Pereira[3]探讨了酵母膏对紫红曲霉生长动力学和代谢红色素产量的影响规律,结果表明含酵母膏的培养基中细胞生物量和红曲色素的产量较对照组(不含酵母膏的培养基)均较高,而对照组所产的水溶性红曲色素的含量要稍高些。
α-溶血性链球菌(α-hemalyticstreptococci)是链球菌中的一类条件致病菌[4-5],该菌经深层发酵可产生甘露聚糖肽。甘露聚糖肽是一种具有多种生物活性的糖肽类物质,是我国独立研制的具有自主知识产权的新型免疫增强剂,具有改善和增强机体的应激机能,能减轻放疗化疗的毒副作用,增强和调节患者的免疫功能,升高白细胞和血小板,提高近期疗效[6-10]。其对再生障碍性贫血、特发性血小板减少性紫癜、血细胞减少症、感染过敏性关节炎、多种口腔粘膜病、儿童反复吸道感染等非肿瘤疾患均有较好的疗效[11-13]。因此,如何提高甘露聚糖肽发酵产量成为了近年来国内外研究的热点,而发酵培养基配方优化[14-15]和甘露聚糖肽的提取方法报道较多[16-18]。然而,单独讨论酵母膏对α-溶血性链球菌生产及代谢甘露聚糖肽的影响未见报道。本研究欲探讨发酵培养基中酵母膏的用量对α-溶血性链球菌生长及代谢甘露聚糖肽的影响规律,为深入研究甘露聚糖肽的发酵条件提供基础数据。
1 材料与方法
1.1 材料与器材
1.1.1 菌种来源 α-溶血性链球菌(α-Hemolyticstreptococcus)长江大学生命科学学院微生物实验室提供。
1.1.2 实验药品 葡萄糖、胰蛋白胨、蛋白胨、酵母膏、牛肉膏、氯化钠、氢氧化钠、浓硫酸、D-甘露糖、α-萘酚、无水乙醇等。
1.1.3 所配试剂 无菌生理盐水:称取0.9g氯化钠溶解于100mL蒸馏水中,转入250mL的锥形瓶加塞封口后于立式压力蒸汽灭菌器中灭菌121℃,25min。灭菌后低温保藏,以备重复使用。
0.1mol/L的NaOH溶液:称取0.4g NaOH溶解于100mL蒸馏水中,封好瓶口,低温保藏,以备重复使用。
1.1.4 仪器与设备 XYQ-LS-50B立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;5PX-250B5-II生化培养箱 上海新苗医疗器械制造有限公司;PCDX-W-20超纯水机 成都品成科技有限公司;UV-3300PC紫外可见分光光度仪 上海美谱达仪器有限公司;PICO-117离心机 Germany;HZ250LBG恒温光照摇床 武汉瑞华仪器设备有限责任公司;DL-820B智能超声波清洗器 上海之信仪器有限公司;pH-3C精密pH计 上海雷磁仪器厂;HFsafe-1200生物安全柜 上海力申科学仪器有限公司;A型双层铁皮电炉 上海申航五金电器厂丹阳分厂;LG4-218L中雪豪华立式冷藏陈列柜 佛山市南海中雪制冷设备有限公司;TE124S型电子天平 METTLER-TOLEDO 公司。
1.2 实验方法
1.2.1 培养基的制备 试管液体菌种培养基:葡萄糖0.5%,胰蛋白胨0.5%,蛋白胨0.5%,酵母膏0.3%,牛肉膏0.5%,氯化钠0.5%,琼脂0.5%,pH7.2。每支试管装量10mL,灭菌121℃,20min。
摇瓶种子培养基:葡萄糖2.0%,蛋白胨1.0%,酵母膏1.0%,牛肉膏0.5%,氯化钠1.0%,pH 7.5。装瓶量40%,灭菌121℃,30min。
发酵培养基:蛋白胨0.3%,牛肉膏1.0%,氯化钠0.5%,酵母膏,pH 7.2。装瓶量小于50%,灭菌121℃,25min。
1.2.2 菌种预处理 菌种活化:将血平板中的菌种于无菌室接入试管液体培养基中,在37℃下,培养18~24h,经无菌考查和形态学鉴定合格后再接入试管液体培养基中,37℃培养18~24h,反复两次。挑选生长旺盛、活力强、形态特征等符合要求的菌种,活化后的菌种如不及时使用,则需将其在2~4℃冰箱中保存。菌种活化目的在于提高活力。
摇瓶种子的制备:将优良的试管液体菌种,按0.2%的接种量在无菌条件下接入摇瓶培养基中,静置37℃下,培养24h,镜检,长势良好,无杂菌。制备摇瓶种子的目的在于提高菌种的活力,以便于以后的接种。
1.2.3 发酵培养与指标测定 发酵培养:将摇瓶种子在无菌条件下分别接种到不同的发酵培养基(蛋白胨3g/L,牛肉膏10g/L,氯化钠5g/L,酵母膏的添加量分别为0、3、5、7、9、11g/L,pH调至7.2,121℃灭菌25min)中,置于37℃、转速为150r/min恒温摇床中培养。分别测定发酵时间为2、4、6、8、11、14、17、20、23、27、30h的发酵液中的活菌数和甘露聚糖肽的吸光值。
活菌数的测定:制备不同浓度的α-溶血性链球菌菌悬液,以血琼脂平板测定其菌落数,并作为纵坐标,同时测定这些菌悬液在405nm处的吸光值,并作为横坐标,得到回归方程为y=149.7x+8.947,R2=0.908。吸取不同时间段的发酵液0.5mL,加入无菌生理盐水2mL,摇匀制成5倍稀释液,在405nm处测定其吸光值,由回归方程计算出活菌数。
甘露聚糖肽的测定:称取经105℃恒重的D-甘露糖10mg,置100mL容量瓶中,加水使溶解至刻度,摇匀得100μg/mL标准溶液。再精密量取标准液0、0.2、0.4、0.6、0.8、1.0、1.2mL分别置试管中,用水稀释至2mL,各加2.5% α-萘酚溶液0.5mL,摇匀并置冰水中冷却,加入浓硫酸5mL,快速摇匀后立即放入沸水浴中煮沸3min,再移置冰水浴中冷却,10min后在570nm处进行比色,测定其吸收度,以此吸光度为纵坐标,甘露聚糖肽的含量为横坐标,得回归方程 y=0.7457x-0.0201,R2=0.9974。
吸取不同时间离心后的发酵液1.0mL,用蒸馏水稀释至30mL。再精密量取稀释液1.0mL,用水稀释至2mL,依据标准曲线方法在570nm处进行比色,测定吸光度,由回归方程计算甘露聚糖肽含量[16]。
1.2.4 数据统计与分析 采用Excel 2003进行数据录入、简要计算和图表绘制。统计分析采用SPSS软件进行,每次实验至少3次重复,平均值显著性水平为5%,菌体比生长速率(表1)的结果中用字母a-e表示。
2 结果与分析
2.1 酵母膏添加量对α-溶血性链球菌生长的影响
发酵20h时,菌落数随酵母膏添加量的变化规律,如图1所示。从图1中可以看出,发酵培养基中酵母膏的添加量很明显地影响α-溶血性链球菌的生长。以0g/L为对照组,当酵母膏的添加量从3g/L到7g/L时,α-溶血性链球菌的菌落数由8.9×108增加到1.6×109,是对照组5.1×108的1.7到3.1倍,影响显著。当酵母膏添加量从7g/L增加到11g/L时,酵母膏对其生长的影响不明显,所以7g/L的酵母膏添加量能够满足α-溶血性链球菌的生长需求。

表1 酵母膏添加量对菌体比生长速率的影响(1/h)Table 1 Effect of yeast extract on specific growth rate of α-hemolytic streptococcus(1/h)
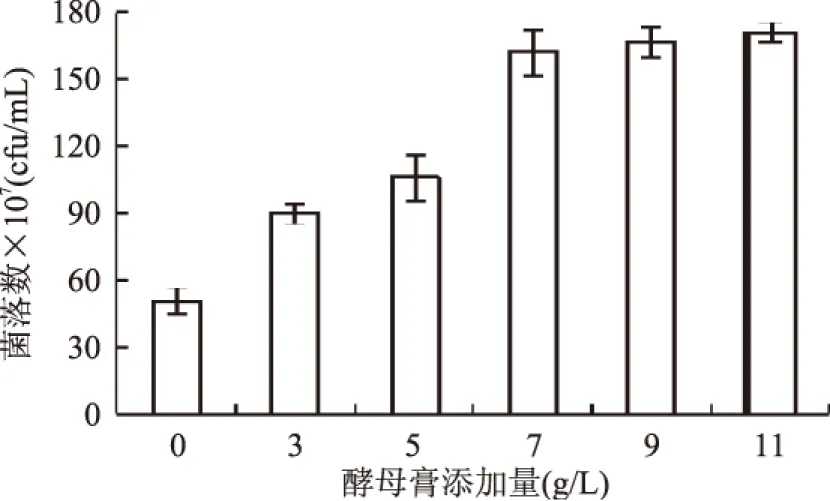
图1 酵母膏添加量对α-溶血性链球菌生长的影响 (发酵时间为20h)Fig.1 Effect of yeast extract on the number of colonies of α-hemolytic streptococcus at fermentation time 20h
酵母膏的添加量对α-溶血性链球生长曲线的影响如图2所示,由图2可知,随着酵母膏添加量的增大,α-溶血性链球的延迟期越来越短,对数期的生长速率由2.83增加到11.02,进入稳定期的时间也由28h以上缩短到23h。当酵母膏添加量大于7g/L时,这一规律就不再明显。

图2 酵母膏添加量对α-溶血性链球菌生长曲线的影响Fig.2 Effect of yeast extract on growth curves of α-hemolytic streptococcus
酵母膏添加量对α-溶血性链球菌的比生长速率的影响变化如表1所示。在表1中以0g/L的酵母膏含量为对照,对相同的发酵时间条件下,酵母膏添加量对菌体比生长速率进行了显著性分析。由表1可知,酵母膏对α-溶血性链球菌的比生长速率都具有较大的促进作用。酵母膏的添加量越多,越促进该菌的生长,最大比生长速率越大,达到最大比生长速率的时间也提前。以0g/L的酵母膏含量为对照,当酵母膏的添加量为3g/L时的最大比生长速率到达时间与对照组的时间一致,同为6h,最大比生长速率比对照组增加17.6%。5g/L和7g/L时的最大比生长速率比对照组提前2h到达,最大比生长速率分别比对照组增加33.3%和41.6%。当酵母膏添加量为9g/L和11g/L时,最大比生长速率比对照提前4h到达,最大比生长速率分别比对照组增加23.9%和30.3%。表明酵母膏使菌体量快速增加的时间提前,这一结果也验证了图2所示的规律。所以,考虑最大比生长速率,选择7g/L的酵母膏添加量作为发酵培养基的最适添加量。
2.2 酵母膏添加量对甘露聚糖肽代谢的影响
发酵20h时,酵母膏添加量对α-溶血性链球菌代谢的甘露聚糖肽的影响如图3所示。从图中可以看出,添加酵母膏时,甘露聚糖肽的代谢量远高于对照组。当酵母膏添加量为7g/L时,甘露聚糖肽代谢量最大,达到0.718g/L。当酵母膏添加量在9、11g/L时,甘露聚糖肽的代谢量反而略有下降,这可能因为培养基酵母膏含量过高,会破坏培养基的营养协调,影响微生物生长的微环境,反而不利于微生物的生长代谢[19]。由此可得出:α-溶血性链球菌生产出最多的甘露聚糖肽时,发酵培养基中酵母膏添加量为7g/L。
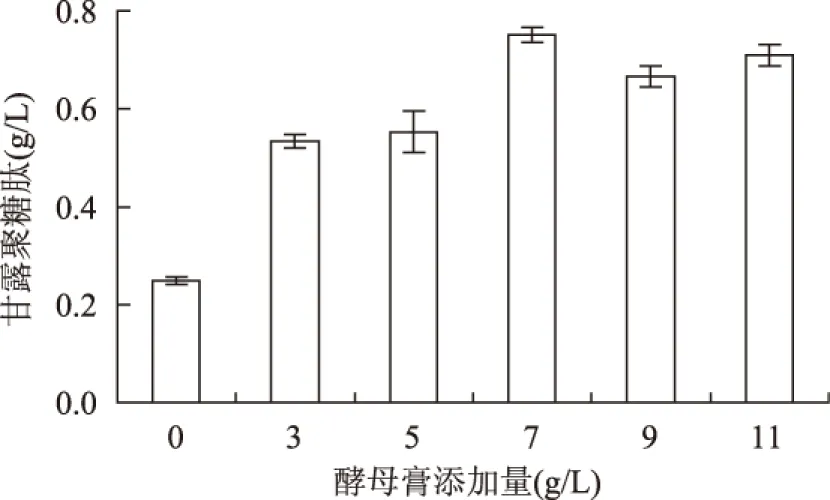
图3 酵母膏添加量对α-溶血性链球菌 代谢甘露聚糖肽的影响 (发酵时间为20h)Fig.3 Effect of yeast extract on α-hemolytic streptococcus producing mannan peptide at fermentation time 20h
从酵母膏添加量对α-溶血性链球菌代谢的甘露聚糖肽代谢曲线的影响(图4)可知,对照组甘露聚糖肽的最大值代谢量发生在发酵16h左右,即在α-溶血性链球菌处于对数期的中期。发酵培养基中有酵母膏存在时,甘露聚糖肽的最大值代谢量都发生在发酵24~27h之间,即在α-溶血性链球菌处于稳定期的时间,这一时间段,此菌的比生长速率也相对偏低(表1),控制了菌体量的过快增长,使甘露聚糖肽维持在较高水平。当酵母膏的添加量在3g/L到7g/L之间时,酵母膏的添加量极大程度上促进了α-溶血性链球菌代谢甘露聚糖肽。当酵母膏添加量从7g/L增加到11g/L时,此现象就不明显,且当酵母膏添加量为7g/L,发酵27h时,甘露聚糖肽最大值代谢量高于酵母膏其它添加量,其代谢量为1.04g/L。所以,7g/L酵母膏添加量是最优酵母膏添加量。

图4 酵母膏添加量对 α-溶血性链球菌代谢曲线的影响Fig.4 Effect of yeast extract on α-hemolytic streptococcus producing mannan peptide curves
3 结论
酵母膏添加量可明显地影响α-溶血性链球菌的生长,发酵培养基中酵母膏添加量越大,对α-溶血性链球菌的生长的促进作用越强,α-溶血性链球菌的延迟期越短,进入对数期越快。当酵母膏添加量大于7g/L时,这种现象就不再那么明显。在7g/L的酵母膏添加量下,最大菌落数为1.9×109,最大的比生长速率数值为0.38。
发酵培养基中有酵母膏存在时,甘露聚糖肽的最大值代谢量到来时间从α-溶血性链球菌生长的对数期推迟到稳定期,代谢量也相应提高。酵母膏添加量为7g/L时,甘露聚糖肽的代谢量在发酵27h时最大,最大代谢量为1.04g/L。所以,7g/L酵母膏添加量是最优酵母膏添加量。
[1]Suarez D C,Liria C W,Kilikian B V.Effect of yeast extract onEscherichiacoligrowth and acetic acid production[J].World Journal of Microbiology & Biotechnology,1998,14:331-335.
[2]Amrane A,Prigent Y.Influence of yeast extract concentration on batch cultures ofLactobacillushelveticus:growth and production coupling[J].World Journal of Microbiology & Biotechnology,1998,14:529-534.
[3]Pereira D G,Kilikian B V.Effect of yeast extract on growth kinetics ofMonascuspurpureus[J].Applied biochemistry and Biotechnology,2001,91:311-316.
[4]黄云昆,廖力微,赵云,等.下呼吸道标本中α-溶血性链球菌的分离和临床致病性初探[J].临床检验杂志,2003,12(5):273-274.
[5]颜建英,蒋玲玲.溶血性链球菌感染与不良妊娠结局[J].中华产科急救电子杂志,2013,2(2):94-100.
[6]刘忠山,王铁君,吴国民,等.甘露聚糖肽对头颈部肿瘤患者免疫功能的影响[J].中国老年学杂志,2011,31(22):4356-4357.
[7]陈志富.甘露聚糖肽胶囊联合利血生片治疗慢性乙型肝炎并白细胞减少症的临床观察[J].吉林医学,2012,33(8):1622-1623.
[8]郭冬生,彭小兰,司国立.免疫增强性多抗甲素的作用机理及其研究进展[J].兽药与饲料添加剂,2003,8(2):15-16.
[9]谢蓉,唐明,李薇,等.甘露聚糖肽对放射治疗与化学治疗所致白细胞减少症的疗效观察[J].中国医药导刊,2013,15(12):2086-2087.
[10]陈志富,庹田.IV期非小细胞肺癌同步放化疗中应用甘露聚糖肽序贯治疗的观察[J].中国医药导刊,2013,15(2):293-294,300.
[11]李吉海,李春晖.甘露聚糖肽对口腔粘膜病患者的临床疗效及淋巴细胞活性的影响[J].实用药物与临床,2014,17(1):66-68.
[12]Hu Q L,Wang H,Wang Y S,et al.Influences of Polyactin A on activity of human monocytesinvitro[J].ZhongguoYaoli Xuebao,1991,12(6):483-488.
[13]周晓娜.甘露聚糖肽配合捏脊疗法治疗小儿反复呼吸道感染疗效观察[J].中国现代药物应用,2012,6(10):82-83.
[14]梁琳琳,杨育芳,孙雪梅,等.B群链球菌培养条件的优化研究[J].微生物学免疫学进展,2004,32(3):20-25.
[15]夏帆,高梦祥,廉方,等.甘露聚糖肽产生菌发酵培养基的筛选[J].大众商务,2009(97):91-92.
[16]冯锁民,任苏娟.同时高产甘露聚糖肽和乳酶生的发酵条件研究[J].安徽农业科学,2011,39(19):11889-11891.
[17]陈云华,余清和,李军,等.甘露聚糖肽及其制备工艺和用途[P].中国专利:03117579.1,2004-10-27.
[18]马宏伟,李丽,陈爽,等.高纯度甘露聚糖肽的制备方法[P].中国专利:200710093102.2,2012-08-22.
[19]周德庆.微生物学教材(第3版)[M].北京:高等教育出版社,2011:4.
Effect of yeast extract on Mannan peptide byα-Hemolyticstreptococcus
XU Cui1,XIONG Qiu1,WU Jia1,GAO Meng-xiang1,2,*
(1.College of Life Science,Yangtze University,Jingzhou 434025,China;2.Jingchu Food Research and Development Center,Yangtze University,Jingzhou 434025,China)
The effect of amounts of yeast extract in fermentation medium on growth and metabolism of α-hemolyticstreptococcuswere studied. The results showed that:the number of colonies of α-hemolyticstreptococcusincreased obviously with the amount of yeast extract when the amount of yeast extract was from 3g/L to 7g/L,the most number of colonies was 1.9×109,2.5 times as high as the control group 7.6×108. The lag phase of α-hemolyticstreptococcusreduced from 8h to less than 5h. The logarithmic growth rate increased from 2.83 to 11.02. And the stationary phase reduced from more than 27h to 23h. When the yeast extract content was more than 7g/L,those rules were no longer apparent. At the same time,the yeast extract made bacteria volume increase rapidly ahead of time for 2~4h. The largest specific growth rate was 0.38 at fermentation time 4h,and the maximum yield of mannan peptide was 1.04g/L at fermentation time 27h when the yeast extract content was 7g/L.
α-hemolyticstreptococcus;fermentation;yeast extract;mannan peptide
2014-06-13
许翠(1988-),女,硕士研究生,研究方向:微生物代谢的物理调控方法。
*通讯作者:高梦祥(1971-),男,博士,教授,研究方向:主要从事微生物代谢的物理调控方法和农产品保鲜加工方法的研究。
湖北省自然科学基金项目(2013CFB392)。
TS261
A
1002-0306(2015)05-0185-05
10.13386/j.issn1002-0306.2015.05.030
