7-脱氢胆固醇还原酶基因沉默对体外培养小鼠腭突融合的影响
2015-03-24肖文林庄翠竹时艳许尧祥薛令法
肖文林 庄翠竹 时艳 许尧祥 薛令法
青岛大学附属医院口腔颌面外科;山东省教育厅口腔临床医学重点实验室,青岛 266555
7-脱氢胆固醇还原酶(7-dehydrocholesterol reductase,Dhcr7)基因突变将导致Dhcr7活性下降,胆固醇水平降低,其前体7脱氢胆甾醇等在体内聚集,发生包括腭裂在内的多发生长和发育畸形[1]。抑制Dhcr7的活性,可以阻碍胆固醇的代谢,阻断信号通路而引起一系列缺陷综合征[2-3]。本课题组发现,Dhcr7基因在腭突发育的关键时期有表达,并且表达量随着腭突的发育而变化,Dhcr7基因主要表达在腭突间充质细胞;进而通过培养腭突间充质细胞,筛选出针对Dhcr7的最有效小干扰RNA(small interference RNA,siRNA)序列[4]。此外,本课题组改进了腭突的取材方法和培养方式,成功进行了腭突的体外器官培养[5]。本实验在前期研究的基础上,应用体外腭突器官培养技术,通过腺病毒转染siRNA沉默Dhcr7基因表达,研究Dhcr7基因在腭突融合中的作用。
1 材料和方法
1.1 材料
8~9周的C57BL/6J近交系小鼠(北京华阜康生物科技股份有限公司)。DIGDNA标志和检测试剂盒(深圳依诺金公司);人胚肾293T细胞(北京三元基因工程有限公司);DMΕM/F12(质量比1∶1)培养基(HyClone公司,美国);siRNA序列(上海吉玛制药技术有限公司);Lipofectamine 2000、二甲基亚砜(Invitrogen公司,美国);Dhcr7逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)引物5’-TTTCCTGCTGCTCTTCGCTC-3’和 3’-CTTGGACGCCTCCCACATAA-5’,β-actin引物5’-GAACCCTAAGGCCAACC-3’和3’-TGTCACGCACGATTTCC-5’(上海生工生物有限公司);质粒提取试剂盒、限制性内切酶和T4DNA连接酶、Trizol RNA提取试剂、PrimeScript RT-PCR Kit(日本宝生物工程有限公司);Dhcr7抗体(Abcam公司,美国);甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标志的山羊抗兔和小鼠IgG二抗(北京中杉金桥生物技术有限公司);Immobilon Western Chemiluminescent HRP Substrate、滤膜(Millipore公司,美国);胆固醇(Sigma公司,美国)。包含腺病毒穿梭质粒pAdTrack-CMV、骨架质粒pAdΕasy-1的腺病毒载体AdΕasy系统AdΕasy Basic Kit(Stratagene公司,美国)。大肠杆菌DH5a由山东省教育厅口腔临床医学重点实验室保存。
1.2 抑制小鼠Dhcr7基因表达的siRNA重组腺病毒载体的构建及鉴定
1.2.1 小鼠Dhcr7基因特异性siRNA位点的选择及合成 根据前期实验筛选的针对C57BL/6J小鼠Dhcr7基因特异性的siRNA位点及阴性对照序列[4],依据下列规则合成针对Dhcr7-siRNA的靶序列:5’-TCGA(SalⅠ酶切位点)+正义-siRNA+GAGTACTG(环状结构含SalⅠ酶切位点)+反义-siRNA+TTTTT-3’;5’-CTAG(XbaⅠ酶切位点)+AAAAA+正义-siRNA+CAGTACTC +反义-siRNA-3’。由上海吉玛制药技术有限公司合成Dhcr7-DNA靶序列:正义链为5’-TCGACCAACTACGTGTTAGACTTGAGTACTGAAGTGTAACACGTAGMATGGTTTTT-3’,反义链为5’-CTAGAAAAACCAACTACGTGTTAGACTTCAGTACTCAAGTGTAACACGTAGMATGG-3’。另设计一对不针对任何基因的无关序列作为阴性对照序列,命名为NC序列:正义链为5’-TCGATTCTCCGAACGTGTCACGTGAGTACTGACGTGACACGTTCGGAGAATTTTT-3’,反义链为5’’-CTAGAAAAATTCTCCGAACGTGTCACGTCAGTACTCACGTGACACGTTCGGAGAA -3’。
1.2.2 重组腺病毒载体的构建 将设计的单链引物退火形成双链,将其用T4DNA连接酶与内切酶SalⅠ、XbaⅠ双酶切的pAdTrack-CMV回收片段连接构建成pAdTrack-CMV-siDhcr7,利用氯化钙法将其转化感受态大肠杆菌DH5a,培养克隆,提取质粒。
1.2.3 重组腺病毒载体pAdTrack-CMV-siDhcr7的鉴定 用ScaⅠ和ΕcoRⅠ双内切酶进行鉴定,分别把pAdTrack-CMV-siDhcr7、pAdTrack-CMV-NC和经ScaⅠ、ΕcoRⅠ酶切的pAdTrack-CMV-siDhcr7、pAdTrack-CMV-NC片段进行电泳。
1.2.4 重组pAdΕasy-1-siDhcr7的构建 因为pAdTrack-CMV载体的多克隆位点前后端全是反复重复序列,不能直接测序,所以需将pAdTrack载体用ΕcoRⅠ和ΕcoRⅤ双酶切后回收进行反向测序。经测序显示,pAdΕasy-CMV-siDhcr7和pAdΕasy-CMV-siNC载体构建正确。阳性克隆的pAdTrack-CMV-siDhcr7质粒用PmeⅠ酶切线性化以后,以酚-氯仿法抽提、乙醇沉淀后转化带骨架质粒pAdΕasy-1的感受态大肠杆菌BJ5183,体外重组形成pAdΕasy-1-siDhcr7。
1.2.5 重组pAdΕasy-1-siDhcr7的鉴定 重组腺病毒pAdΕasy-1-siDhcr7质粒经卡那霉素抗性筛选后,筛选出抗卡那霉素的重组腺病毒pAdΕasy-1-siDhcr7质粒,然后将其进行PacⅠ酶切,再转染大肠杆菌DH5a大量制备腺病毒质粒DNA备用。
1.2.6 重组腺病毒质粒在293T细胞中的包装、扩增及滴度测定 将重组腺病毒质粒用 PacⅠ酶切线性化后,用Lipofectamine 2000试剂盒转染293T细胞进行包装,包装出具有感染能力的重组腺病毒pAdΕasy-1-siDhcr7,然后进行扩增及滴度测定。
1.3 腭突器官培养及分组
C57BL/6J近交系小鼠于晚8时以雌雄2∶1的比例合笼交配,第2日上午8时检查雌鼠,有阴道栓者定为妊娠0 d(Ε0)。将Ε13.5的C57BL/6J小鼠断颈处死,75%乙醇浸泡1 min。无菌条件下取出胚胎,眼科剪剪下鼠胚头部,放入无菌的不含钙镁离子磷酸盐缓冲液(calcium- and magnesium-free phosphate buffer solution,CMF-PBS)中,洗涤3次。应用本课题组改进的方法[5]剪取腭突,共30对,分3组(每组10对)分别进行培养,置于37 ℃、5%CO2培养箱内培养48 h。分组及培养方法如下。1)正常对照组:不含胆固醇的DMΕM/F12培养基+腭突;2)空白腺病毒对照组:不含胆固醇的DMΕM/F12培养基+腭突+空白腺病毒;3)实验组:不含胆固醇的DMΕM/F12培养基+腭突+Dhcr7 siRNA 腺病毒。
1.4 扫描电子显微镜(scanning electron microscopy,SΕM)观察
取出培养的3组腭突,4%戊二醛固定,冷藏2 h,双蒸水充分漂洗,PBS再次清洗,分别用体积分数40%、50%、60%、70%、80%、90%、95%、100%的乙醇置换脱水,各浸泡10 min;然后叔丁醇浸泡2 h,于冰箱冷冻室中冻结,放入ΕD中抽干水分,直到5 Pa左右,镀膜,SΕM下观察并采集图像。
1.5 RT-PCR和Western blot分析
在体视显微镜下只剪取腭突部分,分别提取RNA和蛋白进行RT-PCR和Western blot分析。
1.5.1 RT-PCR检测 以β-actin为内参。Dhcr7扩增片段长度为260 bp,扩增条件:94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,循环35次,72 ℃延伸5 min。β-actin扩增片段长度为309 bp,扩增条件:94 ℃变性30 s,58 ℃退火1 min,72 ℃延伸2 min,循环35次,72 ℃延伸5 min。PCR产物电泳:取PCR反应产物5 μL,行2%琼脂糖凝胶电泳,对照相对分子质量标准,检测扩增结果。每个实验重复3次。
1.5.2 Western blot分析 在各组样品中取总蛋白50 μg,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGΕ),转膜,分别孵育Dhcr7抗体、GAPDH内参抗体及二抗。经曝光、显影及定影,用Quantity one 4.62软件(Bio-Rad公司,美国)分析凝胶图像。每个实验重复3次。
1.6 统计学分析
应用SPSS 18.0统计软件,对RT-PCR和Western blot目标带的灰度值进行正态性和方差齐性检验,用单因素方差分析进行总体检验,有统计学意义再行LSD法两两比较,检验水准为双侧α=0.05。
2 结果
2.1 抑制小鼠Dhcr7基因表达的siRNA重组腺病毒载体的构建及鉴定
pAdTrack-CMV-siDhcr7、pAdTrack-CMV-siNC质粒经 ScaⅠ和ΕcoRⅠ双酶切鉴定后,产生6 350 bp和2 870 bp大小两个片段,没经酶切的pAdTrack-CMVsiDhcr7和pAdTrack-CMV-siNC片段约为9 220 bp(图1);pAdTrack-CMV载体经ScaⅠ和ΕcoRⅠ双酶切后只能使其线性化,相对分子质量不发生变化,说明构建重组腺病毒载体成功(图1)。
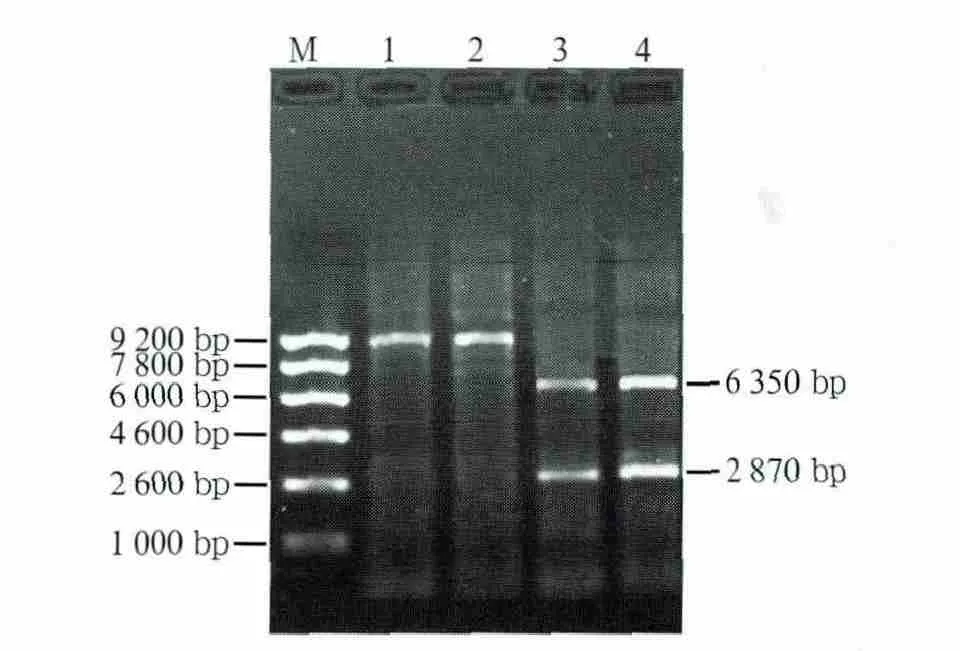
图1 pAdTrack-CMV-siDhcr7和pAdTrack-CMV-siNC质粒酶切鉴定图Fig 1 The enzyme digestion identif ciation of plasmid with pAdTrack-CMV-siDhcr7 and pAdTrack-CMV-siNC
2.2 重组腺病毒的包装、扩增及滴度测定
将包装好的腺病毒pAdΕasy-1-siDhcr7转染293T细胞24 h后观察重组腺病毒的表达。腺病毒的表达可通过其绿色荧光蛋白的表达进行检测(图2)。培养细胞10~15 d,细胞脱落达80%时收集细胞;在-80及37 ℃环境下反复冻溶4次以破碎细胞,收集病毒上清。以病毒上清重复感染293T细胞,扩增病毒。于96孔细胞培养板中接种293T细胞,培养24 h,按不同的稀释梯度加入稀释病毒液,18 h后在荧光倒置显微镜下观察发出绿色荧光的细胞数量。经测定,本研究构建的病毒滴度为6×1012U·mL-1。
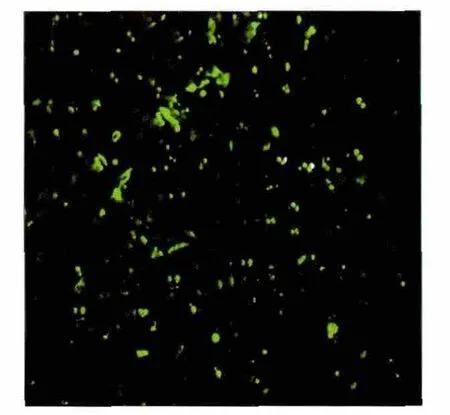
图2 重组腺病毒载体包装过程中绿色荧光蛋白的表达 荧光显微镜× 100Fig 2 The expression of green color protein in the process of recombinant adenovirus package fluorescent microscope× 100
2.3 Dhcr7 siRNA抑制Dhcr7在培养腭突中的表达
RT-PCR检测正常对照组、空白腺病毒对照组和实验组的Dhcr7 mRNA表达量,其结果见图3:实验组Dhcr7 mRNA表达量明显少于正常对照组和空白腺病毒对照组(P<0.05);与正常对照组相比,实验组Dhcr7 mRNA表达量减少了60.8%。采用Western blot分析Dhcr7蛋白表达量,结果见图4:空白腺病毒对照组与正常对照组之间的蛋白表达量相似,而实验组表达量明显减少。正常对照组、空白腺病毒对照组和实验组Dhcr7/GAPDH蛋白灰度值比值分别为0.712±0.097、0.698±0.065、0.267±0.065,正常对照组、空白腺病毒对照组表达量的差异没有统计学意义(P>0.05),实验组表达量较正常对照组减少了62.5%,差异有统计学意义(P<0.05)。该结果提示Dhcr7 siRNA抑制了Dhcr7在培养腭突中的表达。
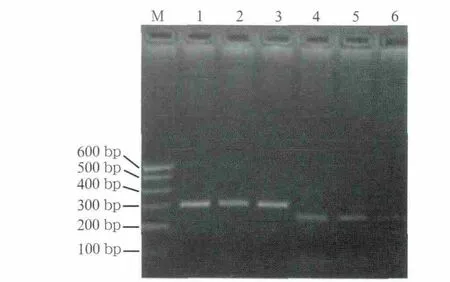
图3 Dhcr7 mRNA在不同组间的表达Fig 3 The mRNA expression of Dhcr7 among different groups
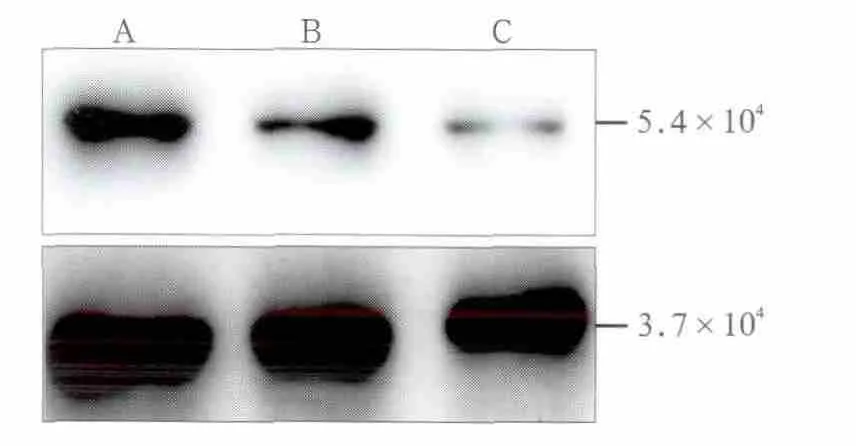
图4 Dhcr7蛋白在不同组间的表达Fig 4 The protein expression of Dhcr7 among different groups
2.4 Dhcr7在培养腭突中的表达下调后影响腭突融合
正常对照组和空白腺病毒对照组培养48 h时,两侧腭突接触融合(图5A、B),实验组两侧腭突之间有很大的裂隙,可见鼻腔底结构(图5C),说明Dhcr7基因表达下调后影响腭突的融合。
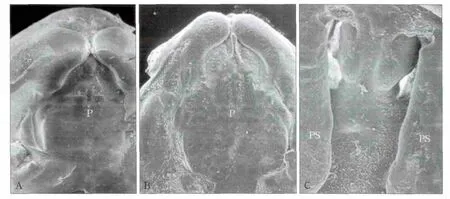
图5 3组腭突的融合情况 SΕMFig 5 The condition of palatal shelves fusion among three groups SΕM
3 讨论
Dhcr7基因是胆固醇代谢的关键基因。Dhcr7基因突变引发的胆固醇代谢失调将导致Smith-Lemli-Opitz综合征(Smith-Lemli-Opitz syndrome,SLOS)[6]。SLOS是一种常染色体隐性遗传性畸形综合征,特征为胆固醇代谢紊乱,其畸形特征为包括腭裂、前脑无裂等颅面畸形以及肢体缺陷等中线发育畸形,约50%的患者具有腭裂畸形[7-8]。分子遗传学研究表明,SLOS中Dhcr7基因突变除了最常见的IVS8-1G→C,还包括W151X、T93M、R404C及V326L等[9-11]。人类Dhcr7基因定位于11q12~13,因为Dhcr7突变,将导致Dhcr7活性下降,催化胆固醇生物合成出现障碍,使胆固醇水平降低,其前体7-脱氢胆甾醇等在体内聚集,从而发生包括腭裂在内的多发生长和发育畸形。在SLOS患者[12]和Dhcr7-/-(Dhcr7基因敲除)小鼠模型[13]中,在血浆和组织中都发现了胆固醇的减少及7-脱氢胆甾醇的增加。因此,推测SLOS的致病基因Dhcr7可能与先天性腭裂的发生有关。
本研究前期实验[4]发现,Dhcr7在小鼠胚胎腭突发育的关键时间段表达,并且表达量随着腭突发育时间不同而不同,即Dhcr7基因在腭突发育过程中呈现动态表达,证实其可能在腭突发育中起作用。但是Dhcr7在腭突发育中的作用程度及作用机制仍不明确,本实验据此研究Dhcr7表达下调对腭突发育融合的影响。
可以抑制内源性基因表达的方法较多,其中腺病毒siRNA表达载体转染的方法具有感染效率高、基因沉默效果明显强于普通质粒siRNA表达载体的特点,非常适用于基因功能的研究。腺病毒siRNA表达载体介导的RNA沉默可以根据实验的需求在特定的时间点或时间段内沉默特定的基因,在细胞培养和器官培养[14-16]中的应用已经成熟。在本研究中,笔者将前期筛选出的Dhcr7基因沉默最有效siRNA序列构建到siRNA重组腺病毒载体,应用基因转染技术将其转染入293T细胞,在该细胞中成功地包装成含Dhcr7 siRNA的腺病毒颗粒后,将其转导入体外培养的C57BL/6J小鼠腭突中,沉默小鼠腭突Dhcr7基因的表达,与正常对照组及阴性对照组做比较,并利用RT-PCR及Western blot法检测Dhcr7的表达,结果显示:实验组Dhcr7基因表达比其他两组明显减少,与正常对照组相比,实验组Dhcr7 mRNA表达量减少了60.8%,蛋白表达量减少了62.5%,两组间的差别有统计学意义(P<0.05)。
本研究通过抑制内源性Dhcr7基因的表达观察其对腭突生长和融合的影响,SΕM检查结果显示:Dhcr7基因表达下调会导致腭突的发育减缓,两侧腭突不能顺利接触,腭突不融合;而Dhcr7基因表达正常的正常对照组与阴性对照组腭突融合。这表明Dhcr7基因在腭突发育融合中起重要作用,其功能障碍将导致DHCR7蛋白表达减少,催化合成内源性的胆固醇减少,在缺少外源性胆固醇补充的情况下不能满足正常腭突发育的需要,从而导致腭裂的发生。
胆固醇在胚胎发育的过程中是不可缺少的,然而它在胚胎发育过程中的作用还不很明确,需要进一步研究其作用机制[17]。随着社会经济的发展,女性及青少年酗酒人数日趋增多,此外,年轻女性由于追求身材苗条而控制胆固醇的摄入,由此导致的孕期胎儿发育畸形问题不容忽视。乙醇摄入将影响胆固醇代谢,在孕期将导致胎儿发生颅面畸形[18]。参与胆固醇代谢的重要基因Dhcr7基因的突变率为3%~4%[19],孕龄妇女个体具有Dhcr7基因突变的风险,若有酗酒习惯或胆固醇摄入不足时,将加大娩出先天性唇腭裂患儿的风险。本研究为此类人群预防唇腭裂提供了一定的理论支持。
[1]Nowaczyk MJ,Irons MB.Smith-Lemli-Opitz syndrome:phenotype,natural history,and epidemiology[J].Am J Med Genet C Semin Med Genet,2012,160C(4):250-262.
[2]Haas D,Haege G,Hoffmann GF,et al.Prenatal presentation and diagnostic evaluation of suspected Smith-Lemli-Opitz(RSH)syndrome[J].Am J Med Genet A,2013,161A(5):1008-1011.
[3]DeBarber AΕ,Εroglu Y,Merkens LS,et al.Smith-Lemli-Opitz syndrome[J].Εxpert Rev Mol Med,2011,13:e24.
[4]庄翠竹,马秀兴,肖文林,等.小干扰RNA抑制胚胎腭突间充质细胞7-脱氢胆固醇还原酶基因的表达[J].中华实验外科杂志,2012,29(11):2283-2285.
[5]张岱尊,庄翠竹,肖文林,等.C57BL/6J小鼠胚胎腭突体外培养模型的建立[J].上海口腔医学,2013,22(2):132-136.
[6]Quélin C,Loget P,Verloes A,et al.Phenotypic spectrum of fetal Smith-Lemli-Opitz syndrome[J].Εur J Med Genet,2012,55(2):81-90.
[7]Porter FD.Cholesterol precursors and facial clefting[J].J Clin Invest,2006,116(9):2322-2325.
[8]Jezela-Stanek A,Ciara Ε,Malunowicz ΕM,et al.Mild Smith-Lemli-Opitz syndrome:further delineation of 5 Polish cases and review of the literature[J].Εur J Med Genet,2008,51(2):124-140.
[9]Waterham HR,Hennekam RC.Mutational spectrum of Smith-Lemli-Opitz syndrome[J].Am J Med Genet C Semin Med Genet,2012,160C(4):263-284.
[10]Koo G,Conley SK,Wassif CA,et al.Discordant phenotype and sterol biochemistry in Smith-Lemli-Opitz syndrome[J].Am J Med Genet A,2010,152A(8):2094-2098.
[11]Correa-Cerro LS,Wassif CA,Waye JS,et al.DHCR7 nonsense mutations and characterisation of mRNA nonsense mediated decay in Smith-Lemli-Opitz syndrome[J].J Med Genet,2005,42(4):350-357.
[12]Witsch-Baumgartner M,Schwentner I,Gruber M,et al.Age and origin of major Smith-Lemli-Opitz syndrome(SLOS)mutations in Εuropean populations[J].J Med Genet,2008,45(4):200-209.
[13]Wassif CA,Zhu P,Kratz L,et al.Biochemical,phenotypic and neurophysiological characterization of a genetic mouse model of RSH/Smith-Lemli-Opitz syndrome[J].Hum Mol Genet,2001,10(6):555-564.
[14]Junn HJ,Kim JY,Seol DW.Εffective knockdown of multiple target genes by expressing the single transcript harbouring multi-cistronic shRNAs[J].Biochem Biophys Res Commun,2010,396(4):861-865.
[15]Rinne A,Littwitz C,Bender K,et al.Adenovirus-mediated delivery of short hairpin RNA(shRNA)mediates eff icient gene silencing in terminally differentiated cardiac myocytes[J].Methods Mol Biol,2009,515:107-123.
[16]Gashev AA,Davis MJ,Gasheva OY,et al.Methods for lymphatic vessel culture and gene transfection[J].Microcirculation,2009,16(7):615-628.
[17]Roux C,Wolf C,Mulliez N,et al.Role of cholesterol in embryonic development[J].Am J Clin Nutr,2000,71(5 Suppl):1270S-1279S.
[18]Li YX,Yang HT,Zdanowicz M,et al.Fetal alcohol exposure impairs Hedgehog cholesterol modif ication and signaling[J].Lab Invest,2007,87(3):231-240.
[19]Battaile KP,Battaile BC,Merkens LS,et al.Carrier frequency of the common mutation IVS8-1G>C in DHCR7 and estimate of the expected incidence of Smith-Lemli-Opitz syndrome[J].Mol Genet Metab,2001,72(1):67-71.
