每搏量与脉搏压变异度对机器人辅助肝脏手术预测液体反应的价值
2015-03-24米卫东
陈 宇,傅 强,米卫东
每搏量与脉搏压变异度对机器人辅助肝脏手术预测液体反应的价值
陈 宇,傅 强,米卫东
目的 探讨每搏量变异度(stroke volume variation,SVV)、脉搏压变异度(pulse pressure variation,PPV)对机器人辅助肝脏手术预测液体的准确性及阈值变化的价值。方法 选择拟在全身麻醉下行机器人辅助肝脏手术患者26例,全身麻醉后连续监测心率(HR)、平均动脉压(MAP)、每搏量(SV)、每搏量指数(SVI)、SVV、PPV等血流动力学指标,在反Trendelenburg体位下建立人工气腹后进行容量负荷试验,记录输液前后各血流动力学指标数值,然后以输液前后每搏量变异指数的差(ΔSVI)将患者分为两组,即有反应组(ΔSVI≥15%)和无反应组(ΔSVI<15%)组,绘制SVV和PPV判断扩容效应的受试者工作特征性(ROC)曲线,确定机器人辅助肝脏手术特殊的体位及气腹条件下SVV和PPV预测容量状况的准确性、诊断阈值及两者的相关性。结果 SVV和PPV判断扩容有效的ROC曲线下面积分别为0.830和0.875,SVV的诊断阈值为13.5%,PPV的诊断阈值为14.5%,两者的相关性为r=0.772(P<0.01)。结论 SVV和PPV均能准确预测机器人辅助肝脏手术中全身麻醉机械通气患者的容量状况,两者预测容量状况的准确性相似且呈正相关,但两者的诊断阈值较标准值均有所降低。
每搏量变异度;脉搏压变异度;气腹;反Trendelenburg体位;机器人辅助肝脏手术
达芬奇机器人辅助肝脏手术是近年来兴起的一项新的微创技术,由于肝脏的解剖与周围血管关系复杂,因此被认为是最具挑战性的手术之一[1]。研究认为,SVV及PPV较中心静脉压(central venous pressure,CVP)等传统容量监测指标更能准确预测全身麻醉机械通气患者的容量状况,并且两者有很好的相关性[2]。然而,达芬奇机器人辅助肝脏手术中,不仅体位是反Trendelenburg体位,还要应用气腹,在这种条件下,二者的预测价值及阈值还不清楚。由于时间较长,而且对容量控制要求较高,因此对于麻醉医师要求也随之增高。本研究的目的是评估在反Trendelenburg体位合并应用气腹(15 mmHg),SVV和PPV监测容量状况的准确性、诊断阈值及两者的相关性。
1 对象与方法
1.1 对象 本研究经解放军总医院医学伦理委员会批准,患者或家属均签署知情同意书。随机选择2013-12至2014-07拟在全身麻醉下行机器人辅助肝脏手术的患者28例,其中机器人辅助肝脏肿瘤肝部分切除术16例,机器人辅助肝囊肿剥除术12例。ASA分级Ⅰ~Ⅱ级,年龄34~62岁,血红蛋白>110 g/L,无高血压、冠心病、心律失常、心内分流、外周血管疾病等病史,无长期口服血管活性药等药物史;液体治疗前及液体治疗过程中使用血管活性药者被排除。
1.2 方法
1.2.1 麻醉前准备 入室后开放外周静脉,按4 ml/(kg·min)的速率于外周静脉通路输注乳酸钠林格平衡液(批号H12020009,天津大冢制药有限公司)。采用Inte Hivue MP50监测仪常规监测心电图、心率、血压、脉搏氧饱和度、呼吸末二氧化碳分压,并连接脑电双频指数(bispectral index,BIS)监测仪(Aspect XP,美国Aspect公司)。
1.2.2 麻醉诱导 给予咪达唑仑0.05 mg/kg,丙泊酚1~2 mg/kg,芬太尼3μg/kg,爱可松0.6 mg/kg, 静脉快速诱导行气管内插管,容量控制模式。呼吸参数:潮气量8 ml/kg,呼吸频率10~14次/min,维持呼气末二氧化碳分压在35~40 mmHg,氧流量设定为1 L/min。
1.2.3 麻醉维持 微量输注泵持续静脉输注丙泊酚50~100 μg/(kg·min),瑞芬太尼0.1~0.2 μg/(kg·min)维持麻醉,输注速度根据BIS监测值进行调控,维持BIS值在40~60。完成气管插管后,行左或右桡动脉穿刺置管,连接FloTracTM传感器,1根传感器连接InteHivue MP50监测仪(荷兰Philips公司)监测HR、MAP及PPV;另一端连接Vigelo/FloTrac监测仪(美国Edwards公司),连续监测SV、SVI、心输出量(CO)、心指数(CI)、SVV等指标;建立人工气腹(15 mmHg)且变为反Trendelenburg体位后3 min,待血流动力学基本稳定,于10 min内静脉输注6%羟乙基淀粉氯化钠注射液(130/0.4,批号81EF241,FRESENIUS KABI 公司,德国),总输液量7 ml/kg,进行容量治疗反应的临床观察。
1.3 观察指标 于麻醉后仰卧位时(T1)、建立人工气腹且在反Trendelenburg体位下输注羟乙基淀粉前(T2)和输注结束后即刻(T3)记录HR、MAP、SV、SVI、CO、CI、SVV、PPV,计算SVI变化的百分比即ΔSVI。ΔSVI=(输注羟乙基淀粉后SVI值-输注羟乙基淀粉前SVI值) /输注羟乙基淀粉前SVI值×100%。根据ΔSVI的值将26例分成两组,ΔSVI≥15%视为对容量扩张有反应组(n=12),ΔSVI<15%视为对容量扩张无反应组(n=14)。

2 结 果
2.1 两组患者一般情况 两组患者年龄、性别构成比、体重、身高、手术类型比较,差异无统计学意义 (表1)。
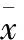
表1 两组患者一般情况比较 (±s)
2.2 血流动力学指标变化 与平卧位(T1)时刻相比较,患者在建立人工气腹且在反Trendelenburg体位下输注羟乙基淀粉前(T2)时刻 SVV、PPV明显增大(P<0.05),其他血流动力学指标HR、MAP、SV、SVI、CO、CI变化无统计学意义(P>0.05)。容量负荷试验前后比较:输注结束后即刻(T3)与输注前(T2)相比,SV、SVI、CO、CI均明显增加,而SVV、PVV明显减小(P<0.05),而HR、MAP无明显变化(P>0.05,表2)。
2.3 ROC曲线结果分析 人工气腹(15 mmHg)且在反Trendelenburg体位下,全身麻醉机械通气患者潮气量为8 ml/kg时,以ΔSVI≥15%定义对容量治疗有反应的标准,SVV、PPV判断扩容有效的ROC曲线下面积及其95%可信区间分别为0.830(0.671~0.990)、0.875(0.730~1.000)。SVV的诊断阈值为13.5%,判断扩容有效的灵敏度为66.7%,特异度为85.7%;PPV的诊断阈值为14.5%,监测容量反应的灵敏度为75%,特异度为100%(图1)。

表2 不同时点血流动力学指标变化情况比较
注:T1:麻醉后仰卧位时,T2:建立人工气腹且在反Trendelenburg体位下输注羟乙基淀粉前,T3:输注结束后即刻;与T1时刻比较,①P<0.05;与T2时刻比较,②P<0.05

图1 SVV、PPV判断扩容有效的ROC曲线
2.4 SVV与PPV的Pearson相关性 SVV与PPV呈显著的线性相关(r=0.74,P<0.01)。
3 讨 论
目前认为,传统的静态监测指标如CVP、肺动脉楔压(PAWP)等对容量状况的预测价值较低,而SVV、PPV等动态功能性血流动力学参数越来越广泛使用,但多种因素可影响动态功能性血流动力学监测的准确性,如体位、腹压的大小、潮气量、进行容量治疗时输注液体的种及试验环境的温度,都有可能对研究结果产生影响[3,4]。
达芬奇机器人辅助肝脏手术是近年来国际上流行的微创手术方式,它创伤小、视野清晰、操作灵活,是未来手术的发展方向。应用达芬奇机器人进行肝脏手术时,由于需要大量内镜下吻合技术,术中常采用反Trendelenburg体位维持低中心静脉压。在实践中,大部分医师认为术中采取反Trendelenburg体位由于重力作用,不仅有利于减少出血,而且肝脏韧带可获得较轻松的暴露和游离,减少了手术难度[5]。在反Trendelenburg体位时,患者呈头高脚低30o,可以减少了右心房与上下腔静脉的血容量,导致整个正压通气过程中SV均降低,SVmean亦降低,故SVV升高。同理,脉搏压(PP)=k×SV/动脉顺应性, PPV=(PPmax-PPmin)/PPmean,因此,SV的降低使得PPV升高。
另外,达芬奇机器人辅助肝脏手术需在气腹条件下进行(15 mmHg),当腹腔内压力增高,膈肌上抬,致胸内压增高,引起静脉回心血量减少和全身血管阻力的增加,致SV和CO的降低[6,7],因此气腹条件下SVV和PPV均会升高。综合以上体位和气腹两个因素,在达芬奇机器人辅助肝脏手术中,SVV和PPV均会升高,这与本研究结果一致。血流动力学阈值的变化,给临床监测的实施造成了一定的困难。因此,寻找准确的监测阈值,客观地监测与评估机体容量状态,才能得出合理的液体治疗方案,从而达到优化术中患者容量管理的目的。
本研究显示,SVV和PPV均可用于预测达芬奇机器人辅助肝脏手术术中患者的容量状态,两者预测能力相似,且有较好的相关性。ROC曲线显示SVV、PPV判断扩容有效的曲线下面积分别0.830和0.875,说明SVV、PPV预测容量反应的准确性较好。SVV 和 PPV的诊断阈值分别为13.5%和14.5%,均高于正常腹压下的阈值(SVV>13%;PPV>13%),这说明在气腹条件下尽管SVV及PPV虽然可以较准确地监测容量状况,但其诊断阈值较正常情况下要略增大,在这一类似条件下,利用SVV 或 PPV监测机体容量状况,应考虑到诊断阈值的相应变化。
本研究随机选取健康成年人,手术类型固定,手术时患者体位固定,无肢体活动,且选择血流动力学及容量状态平稳时进行测量,基本排除了手术、容量状态等因素的干扰。但由于每组样本例数相对偏少,采及SVV、PPV时可能存在主观性偏差从而产生偏倚,尚需采用更大样本进行深入验证。
综上所述,SVV 和 PPV 均可用于预测达芬奇机器人辅助肝脏手术全身麻醉机械通气患者的容量状况,两者的准确性相似且相关性较好,但两者的诊断阈值较正常腹压时相比均有所增大,临床医师在应用SVV、PPV进行容量预测时应充分考虑到这一变化,客观地监测与评估机体容量状态,得出合理的液体治疗方案。
[1] Pelletier J S, Gill R S, Shi X,etal. Robotic-assisted hepatic resection: a systematic review[J]. Int J Med Robot,2013,9(3):262-267.
[2] Cannesson M,Besnard C, Durand P G,etal. Relation between respiratory variations in pulse oximetry plethysmographic waveform amplitude and arterial pulse pressure in ventilated patients[J].Crit Care,2005,9(5):562-568.
[3] Xiaomei Liu, Qiang Fu, Weidong Mi,etal. Pulse pressure variation and stroke volume variation predict fluid responsiveness in mechanically ventilated patients experiencing intra-abdominal hypertension[J].Bio Science Trends, 2013,7(2):101-108.
[4] Kumar A, Anel R, Bunnell E,etal. Pulmonary artery occlusion pressure and central venous pressure fail to predict ventricular filling volume, cardiac performance, or the response to volume infusion in normal subjects[J]. Crit Care Med ,2004,32(3):691-699.
[5] Soonawlla Z F, Stratopoulos C, Stoneham M,etal. Role of the reverse-Trendel-enberg patient position in maintaining low-CVP anaesthesia during liver resections[J].Langenbecks Arch Surg, 2008, 393(2): 195-198.
[6] Michard F, Teboul J L. Predicting fluid responsiveness in ICU patients: a critical analysis of the evidence[J]. Chest,2002,121(6):2000-2008.
[7] Michael R P, Didier P. Functional Hemodynamic Monitoring[J]. Crit Care, 2005,9(6): 566-572.
(2014-09-12收稿 2014-12-20修回)
(责任编辑 岳建华)
Clinical value of stroke volume variation and pulse pressure variation in predicting fluid responsiveness during robot-assisted hepatic surgery
CHEN Yu, FU Qiang,and MI Weidong.
Anesthesia and Operation Center,General Hospital of Chinese PLA,Beijing 100853,China
Objective To evaluate the abilities and thresholds of stroke volume variation (SVV) and pulse pressure variation (PPV) in predicting fluid responsiveness during robot-assisted hepatic surgery. Methods 26 patients, undergoing robot-assisted hepatic surgery were studied. All patients were also monitored with Vigileo/FloTrac system. Haemodynamic data such as MAP,HR,SVI,SVV,PPV were recorded before and after volume expansion(HES 6%,7 ml/kg). Fluid responsiveness was defined as an increase in SVI≥15%(△SVI≥15%). Results The SVV threshold of 13.5% before volume expansion was able to discriminate the responders from the non-responders with a sensitivity of 66.7%, and a specificity of 85.7%. The threshold for PPV was 14.5%, the sensitivity of 75% and specificity of 100% were obtained. There was no significant difference between the area under the receiver operating characteristics (ROC) curves of SVV and PPV (0.839, 0.875), and there was a significant correlation between the baseline SVV and the baseline PPV (r=0.772 ,P<0.01).Conclusions SVV and PPV can predict fluid responsiveness accuratly during robot-assisted hepatic surgery, the baseline SVV is correlated well with baseline PPV, and the ability of SVV and PPV in predicting fluid responsiveness is similiar.
stroke volume variation; pluse pressure variation; increased intra-abdominal pressure; re-Trendelenburg position; robot-assisted hepatic surgery
陈 宇,硕士,主治医师,E-mail:smmugeneral@aliyun.com
100048 北京,解放军总医院麻醉手术中心
米卫东,E-mail:wwdd1962@aliyun.com
R614
