硼酸对非洲雏鸵鸟肺组织形态学的影响
2015-03-23郑昕婷朱黛云孙鹏鹏王艳红王晓艺彭克美
唐 娟,肖 珂,郑昕婷,朱黛云,王 为,王 静,杨 智,孙鹏鹏,王艳红,王晓艺,彭克美*
(1.华中农业大学动物医学院 动物组织学与胚胎学实验室,武汉 430070;2.河南金鹭特种养殖股份有限公司,郑州 450008)
硼酸对非洲雏鸵鸟肺组织形态学的影响
唐 娟1,肖 珂1,郑昕婷1,朱黛云1,王 为1,王 静1,杨 智1,孙鹏鹏1,王艳红2,王晓艺2,彭克美1*
(1.华中农业大学动物医学院 动物组织学与胚胎学实验室,武汉 430070;2.河南金鹭特种养殖股份有限公司,郑州 450008)
旨在探明饮水中添加不同剂量硼酸对 45 d非洲雏鸵鸟肺组织形态学的影响。1 d非洲雏鸵鸟 24 羽,随机分为 6 组,分别在饮水中添加 0(A 组,对照组)、40(B 组)、80(C 组)、160(D 组)、320(E 组)、640 mg·L-1(F 组)剂量的硼酸。饲喂至45 d 取肺组织进行石蜡包埋,切片,通过 HE 染色,MASSON 染色和TUNEL 技术进行分析。与对照组相比,HE 染色观察发现,添加40和80 mg·L-1硼酸剂量组,肺组织结构清晰,发育良好,无明显病变,而从160 mg·L-1剂量开始,肺组织形态结构出现病变,异嗜性粒细胞增多,炎症反应加重,细胞间质增厚;MASSON 染色观察发现,320和640 mg·L-1剂量组肺组织胶原纤维沉淀明显增加;运用 IPP 软件对 TUNEL试验结果进行统计显示,添加硼酸剂量 40 mg·L-1时可减少雏鸵鸟肺组织细胞凋亡,剂量高于320 mg·L-1时增加肺组织细胞凋亡。综合上述结果,在饮水中添加硼酸,40 mg·L-1时可减少雏鸵鸟肺组织细胞凋亡,剂量高于160 mg·L-1时能促进肺组织中发生炎症反应,剂量高于 320 mg·L-1时能增加肺组织细胞凋亡和诱导肺纤维化。
肺纤维化;细胞凋亡;硼酸;肺;鸵鸟
非洲鸵鸟(Struthiocamelus)是现存最大的鸟纲动物,不会飞行但善于奔跑。鸵鸟是原始残存鸟类,有重要的进化地位。1973年,非洲鸵鸟就已被列入《濒危野生动植物种国际贸易公约》中,至今数量仍在减少。目前国内外对鸵鸟的研究主要集中在鸵鸟神经系统、消化系统、免疫系统、泌尿生殖系统、循环系统、骨骼结构特点、内分泌腺和激素分泌规律等方面,而对鸵鸟呼吸系统的研究相对薄弱。
呼吸系统是机体相对开放的系统,肺通过气管与外界相通,发生气体交换。雏鸵鸟肺组织并未发育完善,且雏鸵鸟是呼吸道疾病的易感动物群,很容易受到流行病,传染病等的侵害,导致了很高的死亡率,尤其是前三个月的雏鸵鸟[1]。
近年来不断有研究者提出硼是人和多种动物维持多项正常生物学功能的必需微量元素[2,3]。硼在人和动物机体内参与骨代谢、底物能量代谢及多种微量元素代谢进程,能影响血细胞、免疫相关细胞(主要是T、B淋巴细胞)和生殖细胞的增殖与分化,调节血液生化指标和激素水平,改变动物生长性能、脑功能和免疫功能,且在胚胎发育中不可或缺,低硼或无硼饮食都会对机体产生不利影响[4]。然而硼对呼吸系统的影响却无报道。本研究从形态学角度观察不同剂量的饮水硼酸对雏鸵鸟肺组织结构的影响,为进一步研究硼酸对鸵鸟肺组织发育的作用机制以及预防鸵鸟呼吸系统相关疾病提供理论基础。
1 材料与方法
1.1 主要试剂
硼酸(国药集团药业股份有限公司);多聚甲醛(国药集团药业股份有限公司);磷钼酸(国药集团药业股份有限公司);丽春红s(国药集团药业股份有限公司);亮绿SF(上海源叶生物科技);苏木色精(国药集团药业股份有限公司);伊红Y(国药集团药业股份有限公司);红色氧化汞(北京金星);中性树胶(国药);多聚赖氨酸(武汉博士德);TUNEL试剂盒(Roche,cat.No.11684817910,瑞士豪夫迈·罗氏公司)。
1.2 试验动物分组饲养管理
临床健康1 d鸵鸟24羽随机分为 6 组,每组 4 羽。各组饮水中硼酸质量浓度分别为0(对照组)、40、80、160、320、640 mg·L-1,分别编号为A组(对照组)、B组、C组、D组、E组、F组。雏鸵鸟按河南鸵鸟养殖园企业饲养标准进行标准化饲养管理,各组除饮水外,日粮及其他饲养条件完全相同。这些鸵鸟被安置在相同温度、湿度和光控的房间,12 h光照,12 h黑暗。在前两周,雏鸵鸟室温保持在25 ℃的恒定温度下。将室内温度每周降低1 ℃,直到45日龄取材[1],将肺组织迅速投入4%多聚甲醛缓冲液固定48 h。
1.3 制备石蜡切片
4%多聚甲醛缓冲液固定的鸵鸟肺组织块,梯度酒精脱水,二甲苯或水杨酸甲酯透明,60 ℃浸蜡后包埋,制作成4 μm厚的石蜡切片。
1.4 HE染色
切片脱蜡至水,苏木素染色8 min,流水冲洗 5 min,1%盐酸分化液稍分化,再冲洗返蓝10 min 后镜检。梯度酒精脱水,二甲苯透明,中性树胶封固。
1.5 MASSON染色
切片脱蜡至水,蒸馏水洗3次,每次5 min;苏木素染色液7 min,流水冲洗1 min;1% 盐酸酒精分化5 s,流水冲洗10 min,蒸馏水洗3 min;MASSON丽春红酸性复红染液染色8 min,2% 冰醋酸水溶液浸洗2次,每次 30 s;1% 磷钼酸水溶液分化4 min(避光操作),不水洗直接用亮绿染液8 min;2% 冰醋酸水溶液浸洗1 min;梯度酒精脱水各3 min,二甲苯2次,各5 min,中性树胶封片。
1.6 细胞凋亡检测技术(TUNEL法)
该工程主要工程量为全段河道断面的扩挖,土方工程量大,工期紧、任务重;全段边坡的护砌采用C25(抗渗W6、抗冻 F150、厚度 0.2 m)模袋混凝土护坡(在不断航情况下施工),由于坡比大,给模袋混凝土护坡充灌增加了一定难度,需合理控制充灌压力。
切片脱蜡至水,双蒸水洗涤3次,每次5 min;滴加Proteinase K工作液(Proteinase K原液,1∶200 TBS稀释)处理组织,37 ℃孵育30 min 。PBS 洗涤2次每次5 min;将切片上的液体甩净,滴加 TUNEL反应混合液(TdT 与荧光素标记的dUTP 液 1∶9 混匀),阴性对照组仅加荧光素标记液(label solution),置于湿盒中,37 ℃孵育1 h。PBS 洗涤 3 次每次5 min,滤纸吸干组织周围液体;玻片干后加 converter-POD于组织上,37 ℃避光反应30 min。PBS洗涤3次,每次5 min;滴加DAB工作液,室温显色3~5 min,镜检控制显色深度。蒸馏水洗涤3次,每次5 min;苏木素复染 5 min,流水冲洗7 min后1%盐酸分化液稍分化,再冲洗返蓝10 min 后;梯度酒精脱水各 1 min,二甲苯2次各3 min,中性树胶封片。
1.7 显微摄影及图像分析
切片进行 HE染色和MASSON染色,OLYMPUS DP2_BSW 显微摄影系统明视野观察组织显微结构变化,并进行显微摄影;TUNEL技术用荧光显微镜暗视野观察荧光信号,并进行显微摄影;运用IPP(Image-Pro Plus)软件批量检测MASSON染色图片和TUNEL荧光图片的胶原纤维和凋亡阳性信号的IOD(integral optical density,积分光密度)值,对各组的IOD值进行统计,辅助SPSS软件用单因素分析法对IOD值进行显著差异性统计分析,运用作图软件Graphpad Prism。各试验组均与对照组比较并作差异显著性分析:差异不显著(P>0.05);差异显著(P<0.05),用*表示;差异极显著(P<0.01),用**表示,n=4。
2 结 果
2.1 HE 染色观察硼酸对非洲雏鸵鸟肺组织结构的影响
通过制作石蜡切片,HE染色发现,与对照组(图1A)相比,40、80 mg·L-1硼酸剂量组(图1B、C)肺组织结构无明显变化,肺组织结构清晰,三级支气管、肺房及呼吸毛细管结构完整,无明显充血、出血或炎性浸润等现象,上皮细胞结构清晰,发育良好;160 mg·L-1硼酸剂量组(图1D)有稍微的间质增厚现象,异嗜性粒细胞较前几组多,组织结构没有明显的病理变化;320、640 mg·L-1硼酸剂量组(图1E、F)肺组织已有明显病变,组织结构破坏严重,形态模糊不易辨认,肺房被压缩变形甚至塌陷,异嗜性粒细胞增多,局部炎性细胞浸润,细胞间质增厚,细胞排列紊乱,局部肺实变,部分三级支气管腔有脱落细胞,三级支气管腔变小,呈弥散性肺纤维化(图1)。
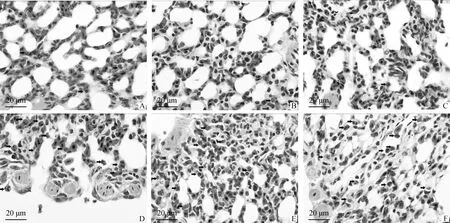
A.对照组,添加0 mg·L-1 硼酸;B.添加40 mg·L-1 硼酸组;C.添加80 mg·L-1 硼酸组;D.添加160 mg·L-1 硼酸组;E.添加320 mg·L-1 硼酸组;F.添加640 mg·L-1 硼酸组。箭头所示异嗜性粒细胞A.Control group,0 mg·L-1 boric acid;B.40 mg·L-1 boric acid;C.80 mg·L-1 boric acid;D.160 mg·L-1 boric acid;E.320 mg·L-1 boric acid;F.640 mg·L-1 boric acid.Arrow.Heterophilic granulocyte图1 45 d非洲雏鸵鸟肺组织结构(HE染色,100 ×)Fig.1 The lung tissue structure of 45 d African ostrich chicks(HE staining,100 ×)
为了得到肺组织病理改变的量化标准,故将光镜下肺组织病理改变程度人为分为无、轻度和重度3级进行比较性研究,比较内容包括毛细血管充血、肺泡腔纤维蛋白渗出、肺泡腔及其间隔异嗜性粒细胞渗出、管腔内脱落上皮细胞和肺泡间隔增宽[4]。参考肺组织病理分级标准(表1),对鸵鸟肺组织进行了病理分级评分(表2)。
表1 肺组织病理改变分级标准
Table 1 Lung histopathology grading

分级指标Classificationindex病变分级Histopathologygrading无None轻度Slight重度Severe毛细血管充血无有少许红细胞红细胞较多或几乎充满管腔肺泡腔纤维蛋白渗出无有少许纤维蛋白渗出渗出较多或几乎充满肺泡腔肺泡腔及间隔异嗜性粒细胞渗出无可疑中性粒细胞渗出散在或呈小灶状渗出管腔内脱落上皮细胞无可疑上皮细胞脱落管腔内上皮细胞脱落肺泡间隔增宽无稍有增宽显著增宽或失去正常肺泡结构
表2 鸵鸟肺组织病理分级
Table 2 The grades of lung histopathology grading of ostrich
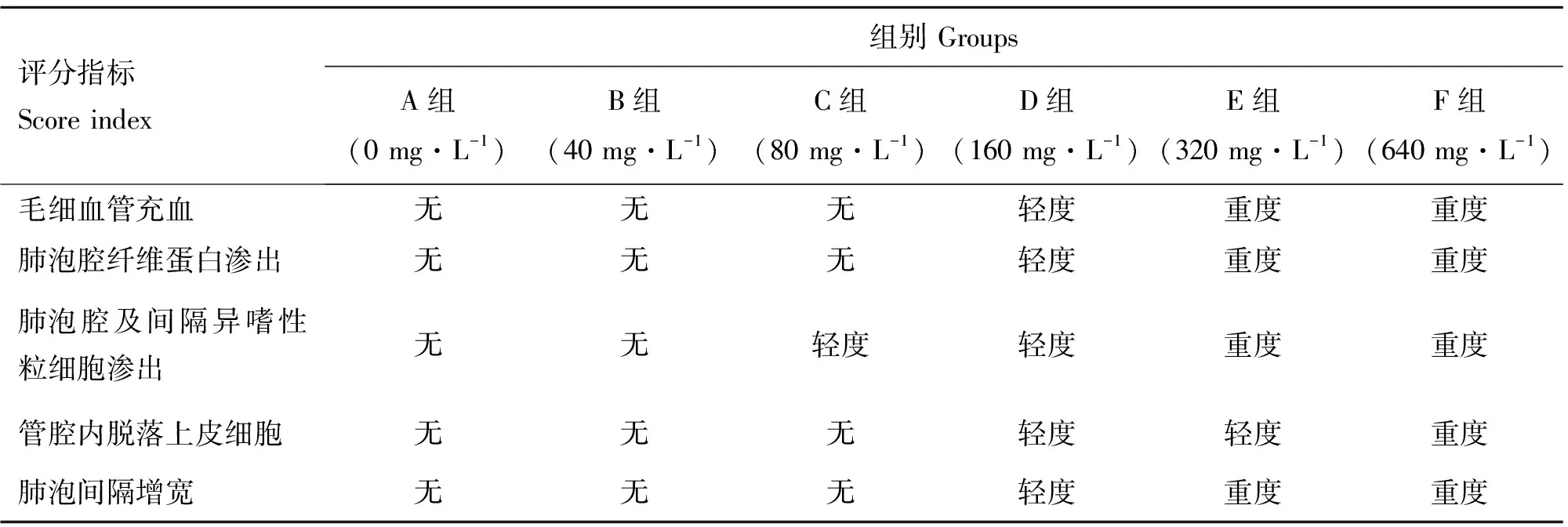
评分指标Scoreindex组别GroupsA组(0mg·L-1)B组(40mg·L-1)C组(80mg·L-1)D组(160mg·L-1)E组(320mg·L-1)F组(640mg·L-1)毛细血管充血无无无轻度重度重度肺泡腔纤维蛋白渗出无无无轻度重度重度肺泡腔及间隔异嗜性粒细胞渗出无无轻度轻度重度重度管腔内脱落上皮细胞无无无轻度轻度重度肺泡间隔增宽无无无轻度重度重度
2.2 MASSON 染色观察硼酸对非洲雏鸵鸟肺纤维化的影响
鸵鸟肺组织石蜡切片经MASSON染色后可清晰观察到鸵鸟肺组织纤维化形成,对照组(图2A)显示的是正常鸵鸟肺组织MASSON染色结构,胶原纤维呈绿色,肌纤维成褐红色,红细胞呈金黄色,细胞核呈黑色,鸵鸟肺组织含有少量的胶原纤维,为细胞外基质的主要成分,所以鸵鸟肺组织肺房周围有一层被染成丝线状浅绿色的胶原纤维。与对照组(图2A)相比,40、80和160 mg·L-1硼酸剂量组(图2B、C、D)肺组织结构无显著区别,甚至胶原纤维着色更浅一些;320和 640 mg·L-1硼酸剂量组(图2E、F)肺组织中绿色的胶原纤维增多,平滑肌和肺间质细胞中几乎都有胶原纤维出现,尤其是640 mg·L-1硼酸剂量组(图2F)最为明显。
通过IPP软件批量检测MASSON染色图片胶原纤维的IOD值,发现与对照组相比,320和 640 mg·L-1硼酸剂量组(图3)肺组织中胶原纤维IOD值显著增多,差异极显著(P<0.01)。
2.3 TUNEL 技术观察硼酸对非洲雏鸵鸟肺组织细胞凋亡的影响
鸵鸟肺组织石蜡切片经TUNEL技术荧光显色后可清晰观察到鸵鸟肺组织细胞凋亡情况,对照组(图4A)显示的是正常鸵鸟肺组织细胞凋亡情况,图中绿色荧光为阳性信号,即凋亡阳性细胞,阳性细胞主要分布于肺房和呼吸性毛细管周围,平滑肌上几乎没有荧光信号,三级支气管腔内也无任何荧光信号。与对照组(图4A)相比,40、80、160 mg·L-1硼酸剂量组(图4 B、C、D)荧光信号减弱,320和 640 mg·L-1硼酸剂量组(图4 E、F)荧光信号增强。

A.对照组,添加0 mg·L-1 硼酸;B.添加40 mg·L-1 硼酸组;C.添加80 mg·L-1 硼酸组;D.添加160 mg·L-1 硼酸组;E.添加320 mg·L-1 硼酸组;F.添加640 mg·L-1 硼酸组。原图中被染成金黄色的是红细胞,褐红色的是平滑肌,绿色是胶原纤维,深蓝色的是细胞核,黑白图中未显示A.Control group,0 mg·L-1 boric acid;B.40 mg·L-1 boric acid;C.80 mg·L-1 boric acid;D.160 mg·L-1 boric acid;E.320 mg·L-1 boric acid;F.640 mg·L-1 boric acid.The golden color.Red blood cells;Green color.Collagen fibers;The mazarine color.Nucleus,those can’t be displayed by black-and-white pictures图2 45 d 非洲雏鸵鸟肺组织纤维分布(MASSON 染色,40×)Fig.2 The distribution of lung tissue fiber in 45 d African ostrich chicks(MASSON staining,40×)
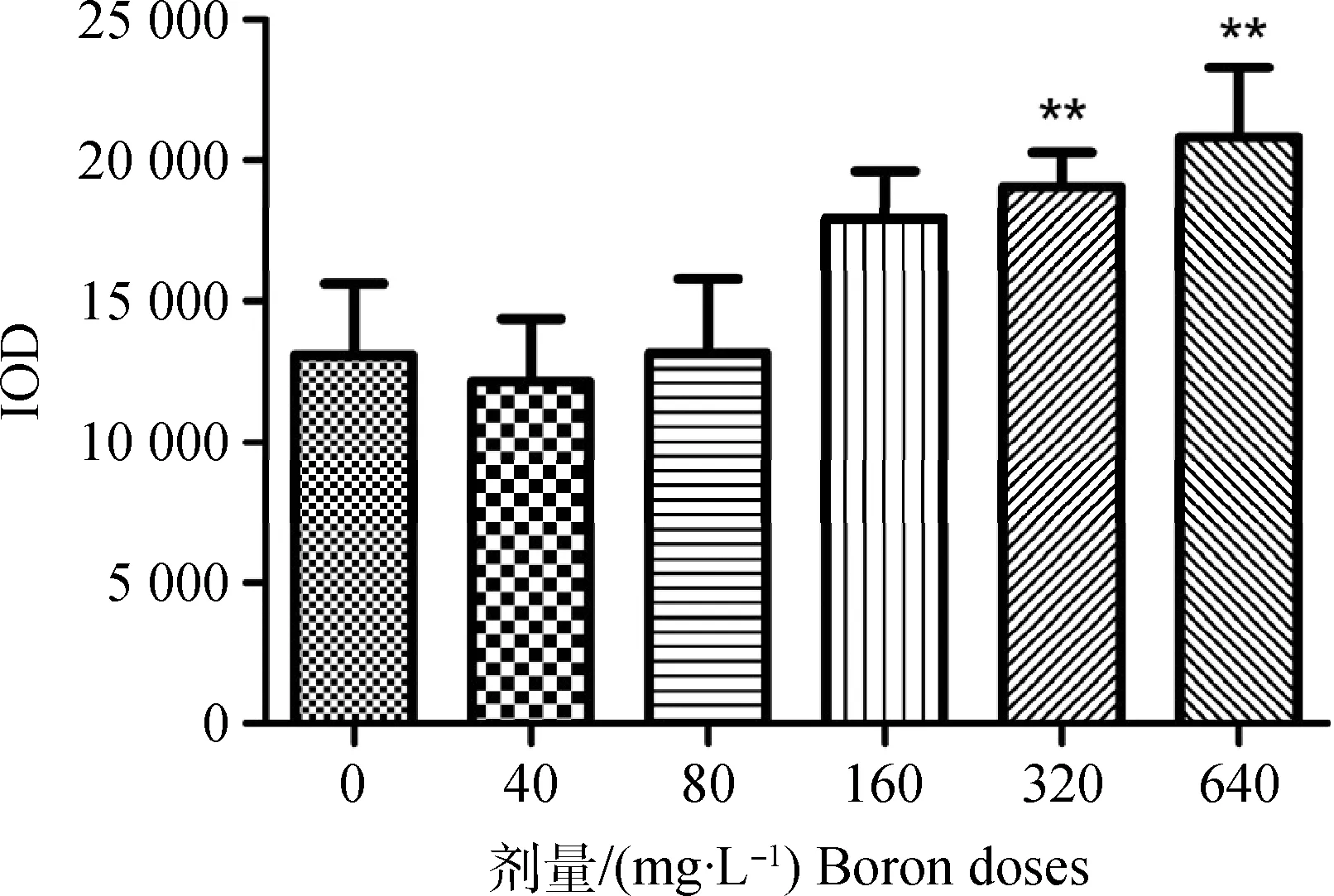
与对照组相比,**.P<0.01,n=4Compared with control group,** showed highly significant difference (P<0.01),n=4 per group图3 45 d 鸵鸟肺组织胶原纤维IOD值测定Fig.3 The detection of ostrich lung tissue collagen fiber IOD values
通过IPP软件检测批量检测TUNEL荧光图片凋亡细胞的IOD值,发现与对照组相比,40 mg·L-1硼酸剂量组肺组织凋亡细胞IOD值显著减少,320和 640 mg·L-1硼酸剂量组肺组织中凋亡细胞IOD值显著增多(图5),差异极显著(P<0.01)。
3 讨 论
3.1 非洲鸵鸟肺组织
非洲鸵鸟原本是野生动物,目前鸵鸟已经被世界各地农场集体饲养,这让雏鸵鸟成为各种传染病、疾病和应激原的易感动物,导致了很高的死亡率,尤其是前三个月的雏鸵鸟,死亡率高达50%[1,5]。雏鸵鸟的生长趋势很特别,生长发育很快,并且同一年龄段的鸵鸟大小悬殊很大[6-7],特别是在鸵鸟生长的前三个月(育雏期)最为明显[8]。所以本试验选择雏鸵鸟作为研究对象。
非洲鸵鸟肺组织结构比较特别,具有哺乳动物和禽类肺组织的双重结构特点。鸵鸟肺次级支气管黏膜有明显的皱襞,绒毛很发达,假复层柱状纤毛上皮,固有膜为疏松结缔组织,外侧为平滑肌层;三级支气管与肺房、呼吸毛细管有开口,管壁不完整,黏膜为单层立方上皮,固有膜结缔组织少,下皮有散在分布的平滑肌;肺房小而多,排列不规则,肺房和呼吸毛细管有开口;呼吸毛细管管壁为单层扁平上皮,周围有丰富的毛细血管;肺实质有孤立淋巴小结散在分布[9];油镜下可观察到类似于哺乳动物的Ⅰ型细胞和Ⅱ型细胞。

A.对照组,添加0 mg·L-1 硼酸;B.添加40 mg·L-1 硼酸组;C.添加80 mg·L-1 硼酸组;D.添加160 mg·L-1 硼酸组;E.添加320 mg·L-1 硼酸组;F.添加640 mg·L-1 硼酸组;图A中右上角所附小图为阴性对照组,无任何荧光信号A.Control group,0 mg·L-1 boric acid;B.40 mg·L-1 boric acid;C.80 mg·L-1 boric acid;D.160 mg·L-1 boric acid;E.320 mg·L-1 boric acid;F.640 mg·L-1 boric acid图4 45 d 非洲雏鸵鸟肺组织细胞凋亡分布(TUNEL技术荧光显微照片,20×)Fig.4 Effect of boric acid on the apoptosis cells in ostrich lung(TUNEL method,20×)

与对照组相较,**表示差异极显著(P<0.01),n=4Compared with control group,**.P<0.01, n=4 per group图5 45 d 鸵鸟肺组织细胞凋亡IOD的检测Fig.5 The detection of ostrich lung tissue apoptosis cells IOD values
非洲鸵鸟肺在组织结构和生理功能上与其他鸟类有所不同。从结构上看,鸵鸟肺与其他鸟类相较,新肺不发达,这被认为是走鸟类的普遍特征[10]。由此,鸵鸟肺组织的形态学特性和独特功能,解释了鸵鸟在持续高温环境中也不会发生呼吸性碱中毒的机制[10]。
3.2 硼酸对肺组织的影响
研究表明,适当剂量的硼在整个生命周期中有多种生物学功能,并且具有抗炎效应[11],在维持细胞的完整性中起着重要的作用[12],本研究发现,添加硼酸剂量低于80 mg·L-1,肺组织中异嗜性粒细胞无明显变化,而添加硼酸剂量超过 160 mg·L-1时(高剂量硼酸),肺组织中异嗜性粒细胞明显增加,促使肺组织发生炎症反应。因此,适宜剂量的硼酸能够发挥有效的抗炎作用;当硼酸剂量超过160 mg·L-1时,硼酸作为机体的外来刺激物,诱导雏鸵鸟肺发生炎症反应。炎症是机体对于刺激的一种防御反应,异嗜性粒细胞和巨噬细胞是呼吸系统对抗外来刺激的第一道防线[13]。当肺组织受到刺激原刺激,上皮细胞、巨噬细胞等会分泌白介素1β,TNF-α、TGF-β、INF-γ等大量细胞因子[14],从而激发机体的炎症应答。
通过TUNEL技术可见,饮水硼酸添加质量浓度为40 mg·L-1时可显著抑制雏鸵鸟肺组织细胞凋亡,剂量高于 320 mg·L-1时能显著促进肺组织细胞凋亡。细胞凋亡是由基因控制的细胞自主的有序的死亡。适度的细胞凋亡可帮助组织修复生长,调节细胞增殖及分化,维持机体组织器官正常的结构等。异常细胞凋亡则可导致机体损伤,造成组织病态修复,结构破坏及功能失常等。W.T.Barranco等研究表明,硼酸抑制人前列腺癌细胞增殖并呈现剂量依赖性,却未检测到硼酸引起caspase-3活性和细胞凋亡两个指标的变化[15],然而之后有研究表明,硼酸能够诱导前列腺癌和乳腺癌两种细胞系凋亡,试验中检测到caspase-3活性有变化[16]。最近有研究报道低浓度的硼酸可抑制雏鸵鸟胸腺细胞凋亡,高浓度硼酸可诱导雏鸵鸟胸腺细胞凋亡[17]。综合以上研究报道,本试验中硼酸与细胞凋亡的关系与前人研究结论一致。
MASSON染色可见,添加硼酸剂量大于320 mg·L-1时,肺组织胶原纤维沉淀增加,可推测为高剂量硼酸可诱导肺组织纤维化。肺纤维化的发病机制并不十分清楚,有研究认为其发生的主要机制是氧化应激、炎症反应和细胞凋亡[18]。肺纤维化主要是由于肺泡上皮细胞损伤,细胞外基质过度沉积,最终导致肺组织异常,结构重塑[13,19]。在肺纤维化过程中,成纤维细胞和上皮细胞的增殖和凋亡发挥着一个平衡作用。在肺纤维化进程中成纤维细胞凋亡减少[20],肺泡上皮细胞凋亡明显升高[21]。在本试验中,添加硼酸剂量为40 mg·L-1时可显著抑制雏鸵鸟肺组织细胞凋亡,剂量高于 320 mg·L-1时能显著诱导肺组织细胞凋亡,我们不清楚肺组织中凋亡的是成纤维细胞还是上皮细胞,所以此处只能结合本试验中的其他结果综合考虑,首先是HE染色可见高剂量加硼酸组(>160 mg·L-1)细胞间质增厚,炎症反应增强,MASSON染色可见高剂量加硼酸组(>320 mg·L-1)胶原蛋白沉淀较前几组显著增加,疑似发生肺纤维化,而肺纤维化能够促进肺组织细胞凋亡[22]。综上所述,饮水添加硼酸浓度高于320 mg·L-1可诱导鸵鸟肺组织发生炎症反应和细胞凋亡,从而导致肺的纤维化,但是硼酸对鸵鸟肺纤维化的具体作用机制仍需进一步研究。
[1] BONATO M,EVANS M R,HASSELQUIST D,et al.Ostrich chick humoral immune responses and growth rate are predicted by parental immune responses and paternal colouration[J].BehavEcolSociobiol,2013,67(12):1891-1901.
[2] NIELSEN F H.Is boron nutritionally relevant?[J].NutrRev,2008,66(4):183-191.
[3] HUNT C D.Dietary boron:progress in establishing essential roles in human physiology[J].JTraceElemMedBiol,2012,26(2-3):157-160.
[4] 卢 岩,宿英英,冯景阳,等.大鼠急性脑缺血时肺脏病理改变及内皮素-1含量变化[J].中华老年心脑血管病杂志,2002,4(5):337-340. LU Y,SU Y Y,FENG J Y,et al.The pathomorphological changes of lung and the changes in endothelin-1 contents in plasma and bronchoalveolar lavage fluid in rats with acute cerebral ischemia[J].ChineseJournalofGeriatiricHeartBrainandVesselDiseases,2002,4(5):337-340.(in Chinese)
[5] DEEMING D C.Rearing environments around the world[M]//The ostrich:biology,production and health.CABI Publishing,1999:191-216.
[6] DEEMING D C,AYRES L.Factors affecting the rate of growth of ostrich(Struthio camelus) chicks in captivity[J].VetRec,1994,135(26):617-622.
[7] DEEMING D C,AYRES L,AYRES F J.Observations on the commercial production of ostrich(Struthio camelus) in the United Kingdom:rearing of chicks[J].VetRec,1993,132(25):627-631.
[8] BUNTER K L,CLOETE S W.Genetic parameters for egg-,chick-and live-weight traits recorded in farmed ostriches(Struthiocamelus)[J].LivestProdSci,2004,91(1):9-22.
[9] 靳二辉,彭克美,宋 卉,等.非洲雏鸵鸟呼吸器官的形态学研究[J].中国兽医学报,2008,28(5):553-556. JIN E H,PENG K M,SONG H,et al.The morphological observation of the respiratory organs in African ostrich chicks[J].ChineseJournalofVeterinaryScience,2008,28(5):553-556.(in Chinese)
[10] MAINA J N,NATHANIEL C.A qualitative and quantitative study of the lung of an ostrich,Struthio camelus[J].JExpBiol,2001,204(13):2313-2330.
[11] CAO J,JIANG L P,ZHANG X M,et al.Boric acid inhibits LPS-induced TNF-α formation through a thiol-dependent mechanism in THP-1 cells[J].JTraceElemMedBio,2008,22(3):189-195.
[12] MAHABIR S,SPITZ M R,BARRERA S L,et al.Dietary boron and hormone replacement therapy as risk factors for lung cancer in women[J].AmJEpidemiol,2008,167(9):1070-1080.
[13] 卫张蕊,周国锋,田 琼.炎症细胞和细胞因子在肺纤维化中作用的研究进展[J].细胞与分子免疫学杂志,2005,21(suppl):85-87. WEI Z R,ZHOU G F,TIAN Q.Study progress of influence and related mechanism of cytokines in pulmonary fibrosis[J].JournalofCellularandMolecularImmunology,2005,21(suppl):85-87.(in Chinese)
[14] WYNN T A.Integrating mechanisms of pulmonary fibrosis[J].JExpMed,2011,208(7):1339-1350.
[15] BARRANCO W T,ECKHERT C D.Boric acid inhibits human prostate cancer cell proliferation[J].CancerLett,2004,216(1):21-29.
[16] CARPER S,ELEGBEDE A,HALL C,et al.Boric acid induces apoptosis in both prostate and breast cancer cell lines[J].CancerRes,2007,67(9 Supplement):4220(Abstract).
[17] XIAO K,ANSARI A R,REHMAN Z U,et al.Effect of boric acid supplementation of ostrich water on the expression of Foxn11 in thymus[J/OL].HistolHistopathol,2015:11595.[2014-8-17].http://www.hh.um.es/Articles-Proofs/11-595-manuscript.pdf.
[18] WALTERS D M,CHO H Y,KLEEBERGER S R.Oxidative stress and antioxidants in the pathogenesis of pulmonary fibrosis:a potential role for Nrf2[J].AntioxidRedoxSignal,2008,10(2):321-332.
[19] THANNICKAL V J,TOEWS G B,WHITE E S,et al.Mechanisms of pulmonary fibrosis[J].AnnuRevMed,2004,55:395-417.
[20] BÜHLING F,WILLE A,RÖCKEN C,et al.Altered expression of membrane-bound and soluble CD95/Fas contributes to the resistance of fibrotic lung fibroblasts to FasL induced apoptosis[J].RespirRes,2005,6:37.
[21] UHAL B D.Apoptosis in lung fibrosis and repair[J].Chest,2002,122(6suppl):293S-298S.
[22] 李今朝,李艳杰,李振华,等.实验性肺纤维化细胞凋亡及Fas/FasL基因变化[J].中华结核和呼吸杂志,2005,28(3):184-187. LI J Z,LI Y J,LI Z H,et al.Cell apoptosis and the changes of Fas/FasL gene in experimental pulmonary fibrosis[J].ChineseJournalofTuberculosisandRespiratoryDiseases,2005,28(3):184-187.(in Chinese)
(编辑 白永平)
Effect of Boric Acid on the Morphology of African Ostrich Chicks Lung
TANG Juan1,XIAO Ke1,ZHENG Xin-ting1,ZHU Dai-yun1,WANG Wei1,WANG Jing1,YANG Zhi1,SUN Peng-peng1,WANG Yan-hong2,WANG Xiao-yi2,PENG Ke-mei1*
(1.CollegeofAnimalScienceandVeterinaryMedicine,HuazhongAgriculturalUniversity,Wuhan430070,China;2.HenanJinluSpecialLivestockBreedingCo.,LTD.,Zhengzhou450008,China)
The aim of the present study was to detect the effects of boric acid on the morphology of African ostrich chick lung.Twenty-four healthy ostrich chicks were randomly divided into 6 groups:Group A(control group),B,C,D,E,F,and supplemented with boric acid at the concentration of 0,40,80,160,320,and 640 mg·L-1,respectively.The morphology changes of lung were observed by using light microscope and the HE staining technology,the collagen fiber changes were detected by MASSON staining,and TUNEL methods were used to label the apoptosis cells in ostrich lung.The results were as followings,compared with the control group,when the boric acid dose less than 80 mg·L-1(group A,B,C),the lung structure was well developed,cell morphology was intact,nucleus was stained darkly and the lung organizational structure was clearly,especially at 80 mg·L-1.Adversely,when boric acid doses higher than 160 mg·L-1(group D,E,F),the high dose boric acid damaged the lung tissue structure,heterophilic granulocytes were increased,the interstitial was thickening with HE staining,especially at 640 mg·L-1.MASSON staining showed that compared with the control group,collagen deposition was increased in high dose boric acid group(more then 320 mg·L-1boric acid).Compared with control group,the IOD of apoptosis cells was significantly decreased in the 40 mg·L-1boric acid group,whereas,the IOD of apoptosis cells was significantly evaluated in the 320 and 640 mg·L-1boric acid groups.Add 40 mg·L-1boric acid can inhibit apoptosis in lung,more than 160 mg·L-1boric acid can promote inflammation,more than 320 mg·L-1boric acid can increase apoptosis and cause pulmonary fibrosis.
pulmonary fibrosis;apoptosis;boric acid;lung;ostrich chicks
10.11843/j.issn.0366-6964.2015.12.022
2015-01-16
国家自然科学基金(31272517)
唐 娟(1988-),女,河南南阳人,硕士生,主要从事动物组织学与胚胎学研究,E-mail:783443066@qq.com,Tel:027-87286970
*通信作者:彭克美,教授,博导,E-mail:kemeip@163.com
S852.1
A
0366-6964(2015)12-2291-08
