塞来昔布和埃罗替尼对结肠癌细胞HT-29的协同抑制作用
2015-03-23付晓霏
陈 曦,付晓霏,赵 逵
(1.遵义医学院附属医院消化内科,贵州遵义563000;2.娄底市中心医院消化内科,湖南417000)
塞来昔布和埃罗替尼对结肠癌细胞HT-29的协同抑制作用
陈 曦1,付晓霏2,赵 逵1
(1.遵义医学院附属医院消化内科,贵州遵义563000;2.娄底市中心医院消化内科,湖南417000)
目的 探讨表皮生长因子受体(EGFR)抑制剂及环氧化酶-2(COX-2)抑制剂埃罗替尼、塞来昔布及二者联合用药对结肠癌细胞HT-29增殖的抑制作用及其机制。方法 将HT-29细胞分为对照组(完全培养基)、塞来昔布组(220μmol/L)、埃罗替尼组(50μmol/L)及联合用药组(塞来昔布220μmol/L、埃罗替尼50μmol/L)四组,作相应处理后均在适宜条件下培养;48 h后采用MTT法观察细胞抑制率,Real-time PCR法及Western blotting法检测EGFR、COX-2mRNA及蛋白表达情况,ELISA法检测前列腺素E2(PGE2)含量。结果 48 h后塞来昔布组和埃罗替尼组对HT-29细胞抑制率分别为(56.6±4.3)%和(56.9±3.9)%,联合用药组抑制率为(86.1±7.1)%,与单独用药组比较,联合用药组对HT-29细胞增殖的抑制作用更明显,差异有统计学意义(P<0.05或0.01);与对照组比较,埃罗替尼组、塞来昔布组均能降低HT-29细胞中COX-2及EGFR的mRNA及蛋白表达水平,也可降低HT-29细胞PGE2的分泌,且联合用药组效果较单一用药组更显著,差异均有统计学意义(P<0.01)。结论 塞来昔布和埃罗替尼均能抑制结肠肿瘤的细胞生长,可同时阻断EGFR、COX-2信号通路,二者联合应用具有协同作用,其机制可能是抑制EGFR、COX-2的表达及PGE2的分泌。
受体,表皮生长因子; 前列腺素内过氧化物合酶类; 抗肿瘤药; 结肠肿瘤; 细胞增殖; 细胞抑制剂
目前治疗结肠癌的新热点是寻求多靶点治疗[1]。塞来昔布(celecoxib)是一种选择性的环氧化酶-2(COX-2)抑制剂,属非甾体抗炎昔布类药物,1999年被美国食品药品管理局(FDA)首肯用于临床治疗骨关节炎和家族性息肉病,现已被用于结肠癌Ⅲ期的临床预防试验[2]。埃罗替尼(erlotinib)是一种小分子表皮生长因子受体(EGFR)酪氨酸激酶抑制剂,属喹唑啉类,近年对埃罗替尼抑制肿瘤的研究主要集中在肺癌、胰腺癌方面[3]。但塞来昔布及埃罗替尼联合使用是否能协同抑制结直肠肿瘤细胞增殖尚不清楚。本研究观察了塞来昔布同埃罗替尼联合使用对结肠癌细胞HT-29增殖的影响,分析其可能机制,现将结果报道如下。
1 材料与方法
1.1 材料 人结肠癌HT-29细胞(中科院上海细胞库);胎牛血清(Hyclone公司);胰蛋白酶与MTT、McCoy′S5A培养基(Sigma公司);塞来昔布(北京贝科里生物科技有限公司);埃罗替尼(上海英轩医药科技有限公司);Trizol试剂及LipofectamineTM2000(Invitrogen公司);反转录和荧光定量PCR试剂(Takara公司);山羊抗人COX-2多克隆抗体、小鼠抗人EGFR单克隆抗体、小鼠抗人βactin多克隆抗体(Santa Cruz公司);辣根过氧化物酶标记山羊抗小鼠IgG及兔抗山羊IgG(中杉金桥公司);ELISA试剂盒(上海西唐生物科技有限公司)。
1.2 方法
1.2.1 细胞培养 用含10%胎牛血清的McCoy′S 5A培养基常规培养HT-29细胞,待细胞生长到80%~90%时消化传代,待细胞生长良好且处于对数期时进行实验。
1.2.2 实验分组及药物干预 将细胞分为对照组(加完全培养液)、塞来昔布组(220μmol/L)、埃罗替尼组(50μmol/L)及联合用药组(塞来昔布220μmol/L、埃罗替尼50μmol/L)四组,分别处理后于适宜条件下继续培养48h。
1.2.3 观察指标
1.2.3.1 MTT法检测细胞抑制率 将各组细胞常规消化后吹散成单细胞悬液,以每孔1×104个细胞接种于96孔板,待细胞贴壁后加药,每组重复6孔,于培养结束前4 h加入MTT溶液20μL,结束后弃上清液、加DMSO 150μL、震荡10min,充分溶解其中的结晶颗粒,最后用酶标仪测定在490 nm波长处光密度(OD)值。抑制率=(1-药物组OD值/对照组OD值)×100%,实验重复3次。根据金正均法[4],药物之间有无相互作用需通过q值判断,q>1是协同效应,q=1是相加效应,q<1是拮抗效应。
1.2.3.2 COX-2、EGFRmRNA表达情况 按Trizol试剂使用说明书提取各组细胞总RNA,采用Real-time PCR法检测COX-2、EGFRmRNA的表达。PCR引物均由北京赛百盛公司合成。EGFR引物序列:上游5′-ACCACGTACCAGATGGATGTGAAC-3′,下游5′-GAGCCGTGATCTGTCACCACATA-3′,扩增片段长度101 bp;COX-2引物序列:上游5′-CTGGAACATGGAATTACCCAGTTTG-3′,下游5′-TGGAACATTCCTACCACCAGCA-3′,扩增片段长度81 bp。扩增条件(参照说明书):37℃15min,85℃5 s。逆转录反应体系20μL,反应条件:95℃8min,95℃15 s,61.3℃1min,40个循环;55℃15 s,80个循环。实验重复3次。
1.2.3.3 COX-2、EGFR蛋白表达情况 采用Western blotting法检测。提取出各组细胞的总蛋白(采用RIPA裂解液),测定其浓度(BCA法),继上样(每孔40μg)后进行聚丙烯酰胺凝胶电泳(COX-2采用10%分离胶、EGFR采用6%分离胶)、转膜及封闭;然后采用山羊抗人COX-2多克隆抗体(1∶200)或者小鼠抗人EGFR单克隆抗体(1∶200)、小鼠抗人β-actin多克隆抗体(1∶1 000);4℃冰箱孵育过夜后洗膜3次,分别加入相应辣根过氧化物酶标记的二抗[兔抗山羊IgG(1∶500)、山羊抗小鼠IgG(1∶2 000)]常温下孵育1.5 h后洗膜,用滤纸吸干,应用鲁米诺(Luminol)显色,X线胶片于暗室中曝光;最后用凝胶图像分析系统分析结果。实验重复3次。
1.2.3.4 ELISA法测定前列腺素E2(PGE2)含量 收集各组细胞培养液,用人PGE2 ELISA试剂盒按照说明书操作,检测450 nm处各组细胞对应OD值,根据标准曲线计算PGE2的含量。实验重复3次。
1.3 统计学处理 应用SPSS17.0统计软件进行数据分析,计量资料以±s表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 各处理对HT-29细胞增殖的抑制作用比较 塞来昔布组和埃罗替尼组对HT-29细胞的抑制率为(56.6± 4.3)%和(56.9±3.9)%,联合用药组抑制率为(86.1±7.1)%;与单独用药组相比,联合用药组对HT-29细胞增殖的抑制作用更明显,差异有统计学意义(P<0.05或0.01),见图1。本实验q=1.055>1,表明塞来昔布与埃罗替尼对HT-29细胞有协同抑制作用。
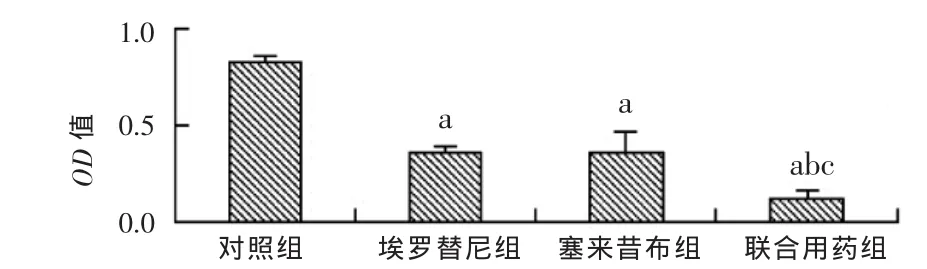
图1 各处理组对HT-29细胞增殖的抑制比较
2.2 各组COX-2及EGFRmRNA表达情况比较 塞来昔布组与埃罗替尼组COX-2与EGFRmRNA表达水平均低于对照组,差异有统计学意义(P<0.01),联合用药组COX-2、EGFRmRNA表达水平均低于其他各组,差异有统计学意义(P<0.01),见图2。
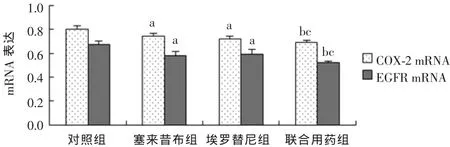
图2 各组COX-2、EGFRm RNA表达情况比较
2.3 各组COX-2、EGFR蛋白表达情况比较 HT-29细胞中COX-2、EGFR均呈阳性表达;塞来昔布、埃罗替尼组及联合用药组COX-2与EGFR的表达水平低于对照组,且联合用药组低于埃罗替尼组及塞来昔布组,差异均有统计学意义(P<0.01),见图3、4,与Real-time PCR结果基本一致。
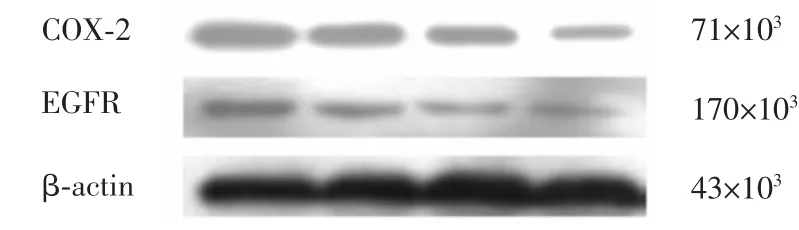
图3 各组COX-2、EGFR蛋白表达情况
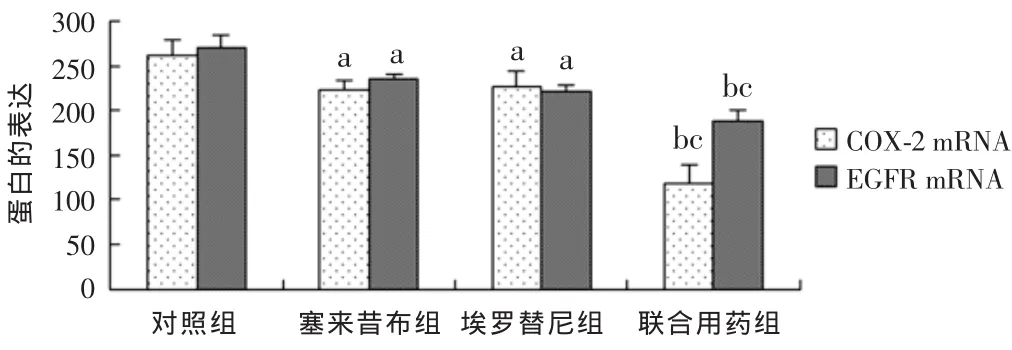
图4 各组COX-2、EGFR蛋白表达情况
2.4 PGE2的表达情况 塞来昔布、埃罗替尼均能抑制PGE2的合成,塞来昔布组抑制作用较强,联合用药组较单独用药组浓度降低更为明显,差异有统计学意义(P<0.05),见图5。
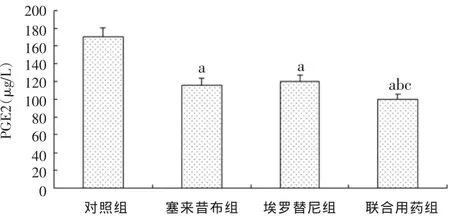
图5 各组对HT-29细胞PGE2分泌的影响
3 讨 论
肿瘤的进展过程涉及多个靶点、多个环节的调控,而开发多靶点的定向治疗已逐渐成为治疗肿瘤的重要研究方向[5]。研究发现,EGFR及COX-2是结肠癌潜在的治疗靶点分子,阻断EGFR和COX-2双靶点可起到协同抑制肿瘤的效应[6]。
EGFR是一种跨膜受体,是原癌基因 c-ErbB-1(HER-1)的表达产物,具酪氨酸激酶活性,EGFR通路活性增高可促进结直肠肿瘤的生长侵袭[7]。结肠癌患者中EGFR表达的阳性率为65%~70%[8]。转化生长因子-α(TGF-α)或表皮生长因子(EGF)与EGFR结合后,已知自身磷酸化因激活酪氨酸激酶所致,DNA的复制增加及细胞生长增殖均继发于细胞内的相关信号传导途径的激活[9]。COX-2是一种前列腺素合成过程中必需的限速酶,能促细胞增殖及肿瘤相关血管形成,在肿瘤进展中十分重要。COX-2促结肠肿瘤发生发展的可能机制为:(1)过表达可促进肿瘤新生血管生成及肿瘤细胞增殖;(2)使肿瘤细胞凋亡受到抑制;(3)通过抑制中性粒细胞浸润及巨噬细胞的活化来抑制抗肿瘤免疫监视机制[10]。研究发现,EGFR与COX-2之间存在交叉信号通路,恶性肿瘤组织中COX-2及EGFR 2条途径可被同时激活[11]。Lippman等[12]研究表明,PEG2由COX-2催化合成,其能同时促进肿瘤细胞的增殖及激活EGFR,并启动胞内的丝裂原活化蛋白激酶(MAPK)信号途径来传递信息,通过核转录因子kappa B(NF-κB)途径来促进COX-2表达,促进结肠癌的发生发展。
塞来昔布是一种COX-2选择性抑制剂,可干扰肿瘤细胞合成PGE2,显著遏制了结直肠肿瘤进展[2]。埃罗替尼是一种EGFR酪氨酸激酶抑制剂,其促进细胞凋亡及阻止细胞增殖均通过选择性阻断EGFR酪氨酸激酶,实现降低EGFR自身的磷酸化作用[3]。有研究发现,埃罗替尼及塞来昔布均可抗增殖及促凋亡,二者具有叠加效应。Buchanan等[13]发现,联合塞来昔布和埃罗替尼治疗可预防ApcMin/+小鼠形成息肉,对裸鼠皮下移植瘤的抑制作用优于单独用药。本研究结果显示,联合用药组和埃罗替尼组、塞来昔布组比较,HT-29细胞的增殖受到显著抑制,联合用药组、塞来昔布组、埃罗替尼组的COX-2、EGFRmRNA及蛋白表达较比对照组降低,联合用药组COX-2、EGFRmRNA及蛋白的表达均比单一用药组降低,提示二者联合应用具有协同抑制作用。
PGE2具有广泛生理活性,其与多种肿瘤的发病有关。PGE2可通过丝裂原活化蛋白激酶(MAPK)与磷脂酰基醇-3激酶(PI3K)信号途径活化肿瘤抗凋亡蛋白B淋巴细胞瘤-2(bcl-2)基因的表达,减少肿瘤细胞凋亡,同时还能通过β-catenin途径促进肿瘤细胞的增殖[14]。活化蛋白1介导的COX-2转录是因 EGFR信号激活导致MAPK活性增加,可促进PGE2合成。Siena等[15]研究发现,PGE2可以激活EGFR,MAPK的活化及细胞增殖可完全通过使用EGFR抑制剂来阻断。Rosas等[16]认为,COX-2的活性受塞来昔布抑制,从而使PGE2的数量减少,也抑制了EGFR信号通路激活。本研究结果显示,联合用药组、单一用药组的PGE2蛋白表达水平均较对照组降低,但联合用药组的PGE2蛋白表达又较埃罗替尼组及塞来昔布组下降,说明二者联合具有协同作用,同时增强了对COX-2及EGFR 2条途径的抑制。联合用药比单一用药具更显著的肿瘤抑制作用,且作用剂量在机体能耐受的不良反应剂量之内。
综上所述,塞来昔布及埃罗替尼联合应用能显著降低人结肠癌HT-29细胞中EGFR、COX-2mRNA及蛋白的表达,也可降低PGE2的表达水平,且具有显著叠加作用,可抑制结肠肿瘤细胞生长。二者联合应用同时阻断COX-2与EGFR 2条信号途径可能是治疗结肠癌的潜在有效途径之一。
参考文献
[1]Rolfo C,Bronte G,Sortino G,et al.The role of targeted therapy for gastrointestinal tumors[J].Expert Rev Gastroenterol Hepatol,2014,8(8):875-885.
[2]BenelliR,VenèR,MinghelliS,etal.Celecoxib inducesproliferation and Amphiregulin production in colon subepithelialmyofibroblasts,activating erk1-2 signaling in synergy with EGFR[J].Cancer Lett,2013,328(1):73-82.
[3]Mendoza L.Targeted therapies in the treatmentofadvanced non-smallcell lung cancer:update[J].Klin Onkol,2009,22(4):131-138.
[4]金正均.合并用药中的相加[J].中国药理学报,1980,1(2):70-76.
[5]Ghosh N,ChakiR,Mandal V,etal.COX-2 as a target for cancer chemotherapy[J].PharmacolRep,2010,62(2):233-244.
[6]Jalili A,Pinc A,Pieczkowski F,etal.Combination of an EGFR blocker and a COX-2 inhibitor for the treatmentofadvanced cutaneoussquamous cellcarcinoma[J].JDtsch DermatolGes,2008,6(12):1066-1069.
[7]Krasinskas AM.EGFR signaling in colorectal carcinoma[J].Patholog Res Int,2011:932.
[8]Stintzing S,Heinemann V,Moosmann N.The treatmentof colorectal carcinoma with monoclonal antibodies:the importance of KRASmutation analysisand EGFR status[J].Dtsch Arztebl Int,2009,106(12):202-206.
[9]Shepard HM,Brdlik CM,Schreiber H.Signal integration:a framework for understanding the efficacy of therapeutics targeting the human EGFR family[J].JClin Invest,2008,118(11):3574-3581.
[10]Smakman N,KranenburgO,Vogten JM,etal.Cyclooxygenase-2 isa targetof KRASD12,which facilitates the out growth ofmurine C26 colorectal livermetastases[J].Clin Cancer Res,2005,11(1):41-48.
[11]Hsia TC,Tu CY,Chen YJ,et al.Lapatinib-mediated cyclooxygenase-2 expression viaepidermalgrowth factor receptor/HuR interaction enhances theaggressivenessof triple-negativebreast cancer cells[J].Mol Pharmacol,2013,83(4):857-869.
[12]Lippman SM,Gibson N,Subbaramaiah K,etal.Combined targetingof the epidermalgrowth factor receptor and cyclooxygenase-2 pathways[J].Clin CancerRes,2005,11(17):6097-6099.
[13]Buchanan FG1,Holla V,KatkuriS,etal.Targeting cyclooxygenase-2 and the epidermal growth factor receptor for the prevention and treatment of intestinalcancer[J].Cancer Res,2007,67(19):9380-9388.
[14]Wang D,DuBois RN.An inflammatory mediator,prostaglandin E2,in colorectalcancer[J].Cancer J,2013,19(6):502-510.
[15]Siena S,Sartore-Bianchi A,Di Nicolantonio F.Biomarkers predicting clinical outcome of epidermal growth factor receptor-targeted therapy in metastaticcolorectal cancer[J].JNatl Cancer Inst,2009,101(19):1308-1324.
[16]Rosas C,Sinning M,Ferreira A,et al.Celecoxib decreases growth and angiogenesisand promotesapoptosis in a tumor cell line resistant to chemotherapy[J].BiolRes,2014,47(1):27.
Synergistic inhibitory effect of celecoxib and erlotinib on the proliferation of colorectal cancer cells
Chen Xi1,Fu Xiaofei2,Zhao Kui1
(1.DepartmentofDigestion,the Affiliated Hospitalof ZunyiMedicalUniversity,Zunyi,Guizhou 563000,China;2.DepartmentofDigestion,LoudiCentralHospital,Hunan 417000,China)
Objective To investigate the synergistic inhibitory effectof EGFR and COX-2 inhibitors named celecoxib and erlotinib or its combinationson the proliferation of colorectal cancer cell lines HT-29 and its possiblemechanism.M ethods The HT-29 cellswere divided into four groups such as the controlgroup(completemedium),the celecoxib group(220μmol/L),the erlotinib group(50μmol/L)and the combination group(220μmol/L celecoxib,50μmol/L erlotinib)according to different medications,all of which were cultivated under appropriate environments.It adopted MTT assay to observe the cell inhibitory rate,Real-time PCR and Western blotting assays to detect the expressionsof EGFR,COX-2mRNA and proteinand ELISA assay to measure the contentof PGE2 after48 hours.Results The inhibition rateson HT-29 cells in the celecoxib group and the erlotinib group after48 hourswere(56.6±4.3)%and(56.9±3.9)%respectivelywhile the combination group being(86.1±7.1)%,the proliferation ofHT-29 cellwas inhibited in the combination groupmore apparently than in the celecoxib group and erlotinib group,which had statistically significantdifference(P<0.05 or0.01);comparedwith the controlgroup,both the celecoxib group and theerlotinib group were reduced COX-2 in the HT-29,mRNA of EGFR and expression level of protein,aswell as PGE2 secretion of HT-29 cells.The combination group wasmore significant than the single group in effect,all ofwhich had statistical significance in dif ference(P<0.01).Conclusions Celecoxib and erlotinibmay depress thegrowth ofcolorectalcancercell lines,block the communication paths of EGFR and COX-2 simultaneously,both ofwhich have a synergistic inhibitory effect,whose possiblemechanism may be inhibitexpression of EGFR,COX-2 and secretion ofPGE2.
Receptor,epidermal growth factor; Prostaglandin-endoperoxide synthases; Antineoplastic agents;Colonic neoplasms; Cellproliferation; Cytostatic agents
10.3969/j.issn.1009-5519.2015.09.002
A
1009-5519(2015)09-1283-04
2015-01-26)
贵州省高层次人才科研条件特助经费基金资助(TZJF-2011-32)。
陈曦(1988-),女,江苏连云港人,在读硕士研究生,主要从事大肠癌的研究;E-mail:389173850@qq.com。
赵逵(E-mail:zhaok0852@126.com)。
