芒果细菌性黑斑病菌在不同场所的存活期
2015-03-23漆艳香喻群芳谢艺贤张辉强蒲金基
漆艳香,张 贺,喻群芳,谢艺贤,张 欣,陆 英,张辉强,蒲金基
(中国热带农业科学院环境与植物保护研究所,农业部热带农林有害生物入侵监测与控制重点开放实验室,海口 571101)
芒果细菌性黑斑病是由野油菜黄单胞杆菌芒果致病变种(Xanthomonascampestrispv.mangiferaeindicae,Xcm)引起的细菌性病害,其病原菌是我国和世界许多国家的进境植物检疫有害生物之一。自Doidge[1]首先报道芒果细菌性黑斑病在南非发生以来,该病相继在印度、巴西、墨西哥、巴基斯坦、澳大利亚、加纳、马来西亚、日本等国发生[2]。1972年,在我国台湾发现有该病的分布,随后在广东、广西、云南、海南、福建和四川等省(区)均有发生并呈上升趋势[3-5]。据调查,该病在我国芒果产区造成的产量损失一般为15%~30%,严重的可达50%[6]。目前该病在海南已逐渐成为芒果的第一大叶部和果面病害,严重影响了海南芒果的产量和质量,而现有防治效果不甚理想。明确病害的发生与流行规律,是制定病害防治方法的重要依据,但目前有关海南该病发生规律的系统研究尚未见报道。
芒果细菌性黑斑病暴发流行的主要初侵染源是越冬病枝、病叶上的病菌,尤以秋梢上的病菌最为重要。关于该病原菌在病斑中存活期的研究,国外有一些报道,但仍未有一致的定论[7-10]。此外,来源于土壤、水等其他场所的病原菌,其存活期以及在病害发生和流行中的作用等尚未见系统的研究报道。针对芒果细菌性黑斑病发生危害严重、而对该病流行学研究基础薄弱的现状,本文拟在海南省生态条件下,对芒果细菌性黑斑病病原菌在不同场所的越冬存活情况进行研究,以期为制定该病的综合治理措施提供参考。
1 材料与方法
1.1 供试材料
芒果细菌性黑斑病菌(Xanthomonascampestrispv.mangiferaeindicae,Xcm)野生菌株、抗利福平菌株RifXcm 及芒果感病品种‘贵妃’的离体叶片均由中国热带农业科学院热带果树病害课题组提供。
1.2 培养基
Xcm 扩大培养基(NA 培养基):蛋白胨5g,牛肉浸膏3g,琼脂18g,双蒸水1 000mL,121℃湿热灭菌20min,pH 7.0~7.2。
Xcm 半选择培养基(KC 培养基)[11]:酵母提取物7g,蛋白胨7g,葡萄糖7g,琼脂18g,双蒸水1 000mL,121℃湿热灭菌20min后,温度降至50℃左右,依次加入头孢氨苄40mg/L,春雷霉素20mg/L,丙环唑20mg/L,pH 7.0~7.2。
1.3 人工接种Xcm
1.3.1 健康芒果叶片上接种Xcm 及Xcm 的保存
取1支在28 ℃活化3d的抗利福平菌株RifXcm 斜面纯菌种,用无菌水配制成1.0×106cfu/mL细菌悬浮液,供接种用。2013 年8 月12 日取芒果感病品种‘贵妃’的健康叶片(本梢期达到最大面积时的新成叶)60片,每片叶进行叶背针刺接种,每叶共6个针刺点。取其中40片用灭菌滤纸圆片(直径4mm)吸足RifXcm 菌悬液,贴在针刺点上。接菌后的叶片放置在吸水纸保湿的培养皿内,2 片/皿,20个重复,置于28 ℃恒温培养箱,培养期间保持皿内有一定湿度,24h 后除去滤纸片,观察叶片发病情况。将发病的叶片装入尼龙网袋,20片置于室温保存,另外20片叶用灭菌吸水纸压制后置于15 ℃生化培养箱保存。无菌水接种的20片叶用灭菌吸水纸压制后也置于15 ℃生化培养箱,作为阴性对照。定期分离和检测叶片病斑里Xcm 的存活情况。
1.3.2 土壤中接种Xcm
将种植过香蕉、番木瓜等不同来源的土壤各5 kg均匀混合,用PCR 检测[12]确认混合土不携带Xcm,将混合土装入洁净盆钵中,每盆装土3kg。设无病残体土壤、有病残体土壤(每盆埋入剪碎捣烂的‘贵妃’芒果病叶和病枝条约500g)。2013年8 月12日进行人工接种,每盆接种200mL RifXcm 菌液(1.0×106cfu/mL),以不接菌为对照,淋自来水保持土壤湿润。将接种后的盆钵置于露天开放的自然环境中,定期浇自来水保持适宜土壤湿度。定期分离和检测土壤里Xcm 的存活情况。
从无病芒果园采集土壤装入18支试管中(10g土/支),同时把其中9支试管湿热灭菌(121 ℃1h)。2013年8月12日往18支试管中分别加入2mL 菌悬液(1.0×106cfu/mL),室温保存用于定期分离和检测土壤里Xcm 的存活情况,每次各检测1 支试管。
1.3.3 水中接种Xcm
2013年8月12 日,用无菌水将活化后并培养48h的RifXcm 配制成1.0×107cfu/mL 菌液,先取200mL菌液加入已盛有1 800mL水库水和自来水的盆钵,置于露天开放的环境中;取30 mL 加入盛有270mL无菌水的三角瓶(湿热高压灭菌),置于室内。定期分离和检测水里Xcm 的存活情况。
1.4 Xcm 的分离及存活期检测
分别采用直接分离、菌落PCR(Bio-PCR)和常规PCR 3种方法对人工接种的Xcm 的存活情况进行检测,如能直接分离出Xcm,则对获得的单菌落进行Bio-PCR;若不能直接分离出Xcm,则提取样品DNA 进行常规PCR 扩增。
1.4.1 芒果叶片中Xcm 存活期
定期取人工接种的芒果病叶单个病斑于研钵中,加5mL无菌水碾碎后,浸泡0.5h。所获浸提液以2 000r/min离心8min,取上清液用无菌水进行10倍梯度稀释,各取50μL均匀涂布于含50μg/mL利福平的KC半选择性平板上,28 ℃下培养3~4d,观察RifXcm 菌落生长情况,并对获得的单菌落进行PCR检测验证。
1.4.2 土壤中Xcm 存活期
定期取人工接种Xcm 的无病残体土壤和有病残体土壤各10g于研钵中碾碎后加50mL无菌水,浸泡1h;定期取灭菌与未灭菌的试管各1支,往每支试管中加入10 mL 无菌水,浸泡0.5h。所获浸提液以2 000r/min 离心8min,取上清液用无菌水进行10 倍梯度稀释,各取50μL 均匀涂布于含50 μg/mL利福平的KC半选择性平板上,28 ℃下培养3~4d,观察RifXcm 菌落生长情况,并对获得的单菌落进行PCR 检测验证。
1.4.3 水中Xcm 存活期
定期取水10mL,用无菌水进行10倍梯度稀释,各取50μL均匀涂布于含50μg/mL利福平的KC半选择性平板上,28℃下培养3~4d,观察RifXcm 菌落生长情况,并对获得的单菌落进行PCR检测验证。
1.5 Xcm 的PCR 检测
分别按植物DNA 小量提取试剂盒(Omega)和PowerSoil DNA Isolation Kit(MoBio)说明书提取芒果叶片gDNA、水gDNA 和土壤gDNA。菌落PCR与常规PCR均采用Xcm 的特异性引物,XcmHF(5′-GGT GGT CGA ACT CGT CGG CAT-3′)/XcmHR(5′-GCC TGC GCC TGG ATC GGT AT-3′)进行扩增[12]。PCR扩增产物片段大小为321bp。
扩增体系均为25μL:10×PCR buffer(Mg2+plus)2.5μL,dNTP mixture(各2.5mmol/L)2μL,正向和反向引物各(20μmol/L)各0.5μL,高保真Taq酶(TaKaRa)(5 U/μL)0.2μL,模板DNA(20 ng/μL)1μL,补灭菌双蒸水至25μL。引物扩增条件:94 ℃3 min;94 ℃45s,62 ℃1min,72 ℃1 min,30个循环;72 ℃5min。PCR 产物用1%琼脂糖凝胶进行电泳检测。
2 结果与分析
2.1 Xcm 在叶片病斑上的存活期
每隔30d对接种叶片进行半选择性平板直接分离和Bio-PCR 验证,同时提取叶片DNA 进行PCR 检测,以确定叶片中Xcm 的存活情况。RifXcm 菌株在含利福平的KC 培养基上菌落乳白色、圆形、轻微凸起、边缘整齐、黏液状。分离结果表明,接种120d后,采用选择性培养平板能分离出Xcm(表1,图1),接种150d 后直接分离不到Xcm,180d后室温保存的叶片用2 种方法都检测不到Xcm,而只有低温保存的叶片gDNA 能检测到Xcm(表1,图2),210d后低温保存的叶片用常规PCR检测不到Xcm,说明Xcm 在叶片病斑内常温下至少存活5 个月,15 ℃低温下至少可存活6个月。

表1 Xcm 在人工接种叶片上的存活期1)Table 1 Survival period of Xcm in mango leaves with RifXcm inoculated
2.2 Xcm 在土壤和水中的存活期
2.2.1 直接分离和Bio-PCR
每隔7d采用直接分离法从人工接种的无病残体土壤、病残体土壤、室内未灭菌土、灭菌土、水库水、自来水和无菌水等7种场所中分离Xcm,并用菌落PCR检测验证KC半选择性培养基上获得的疑似单菌落是否为活的Xcm。结果表明,接种28d后的无病残体土壤、病残体土壤、室内未灭菌土和灭菌土中都能分离到Xcm,35d后无病残体土壤和室内未灭菌土中均分离不到Xcm,49d后病残体土壤中分离不到Xcm,70d后室内灭菌土中分离不到Xcm。同样,接种28d后水库水、自来水及无菌水中都能分离到Xcm,35d后水库水中分离不到Xcm,49d后自来水中分离不到Xcm,175d后灭菌水中仍能分离到Xcm。

图1 接菌120d后菌落PCR 检测芒果叶片XcmFig.1 Detection of Xcm from mango leaves at 120d after inoculation by colony PCR
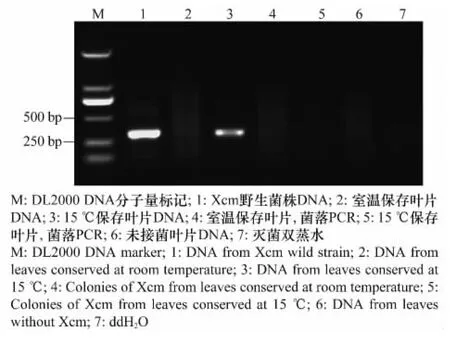
图2 接菌180d后常规PCR 检测芒果叶片XcmFig.2 Detection of Xcm from mango leaves at 180d after inoculation by conventional PCR
2.2.2 PCR 检测
由于Xcm 在自然环境中易受环境因素和其他微生物的影响,人工模拟接种后,Xcm 在28d后数量减少,用常规分离培养方法灵敏度有限,无法直接分离目标菌Xcm,因此,本试验进一步选用灵敏度更高的PCR 检测方法,用试剂盒提取土壤和水中的细菌gDNA,用Xcm 特异性引物PCR 检测不同场所中Xcm 的存活情况。
从接种后的第35 天起,提取供试土壤gDNA进行PCR 检测。结果表明,接种42d后无病残体土壤和室内未灭菌土中仍然检测到Xcm,在第49天则检测不到;在接种含病残体的土壤中63d之内均能检测到Xcm,而室内灭菌土在77d之内还能检测到Xcm,表明Xcm 在病残体土壤和室内灭菌土存活期稍长,但也非常有限,分别为49~63d和70~77 d。由此可知,Xcm 在土壤中存活期短,不可能在田间土壤中越冬而成为第2年初侵染源。
从接种后的第35 天起,提取供试水gDNA 进行PCR 检测,结果表明,接种42d后,水库水检测不到Xcm,56d 后自来水中检测不到Xcm,说明Xcm 在水库水和自来水中存活期有限,分别为35~42d和49~56d。而在无菌水中,280d之内还能检测到Xcm,说明Xcm 在无菌水中至少能存活10个月。由此可知,Xcm 在自然水中存活期较短,也不可能在田间水中越冬而成为第2年初侵染源。
3 结论与讨论
大量研究表明,控制和清除病害的初侵染源,是植物病害防治的关键技术之一,因此弄清楚芒果细菌性黑斑病菌在不同场所中的存活期是十分必要的。本研究通过人工接种的方法研究了芒果细菌性黑斑病菌在叶片、土壤和水等场所中的存活时间,结果表明,芒果细菌性黑斑病菌在接种叶片病斑内常温下至少可存活5个月,15 ℃低温下至少可存活6个月。这一研究结果与前人研究基本一致[7],他们认为“病株病斑内的病原菌存活期较长,是病害发生发展的最主要的再浸染源”。此外,由于芒果为常绿果树,只要有充足的雨水或灌溉,周年均可抽梢生长。3-5月抽生的枝梢为春梢,6-8月为夏梢,9-11月为秋梢,12-2月为冬梢,而在海南秋梢是主要结果母枝。这一研究结果表明,前一年的秋梢、夏梢叶片病斑内的病菌均能安全越冬成为第2 年初侵染源,其中以秋梢病斑内的病菌最为重要。
植物病原细菌单独在土壤中的存活期一般是很短的[13]。芒果细菌性黑斑病菌在无病残体土壤、病残体土壤和室内未灭菌土存活期均有限,其中以病残体土壤存活期稍长(49~63d),研究结果与Pruvost &Manicom[14]的结论一致,他认为“自然情况下黑斑病菌在土壤中的存活期有限”。因此,年前这些场所的病菌均不能越冬成为翌年的初侵染源。但假若夏季病果园土壤中有一定数量的病原菌存在,就有可能借雨水溅散至植株枝叶上而成为再侵染源。另外,病菌在水库水和自来水中的存活期分别为35~42d和49~56d,因此来自病果园的雨后流水(带菌)流经无病果园时,有传病的可能。而有关芒果细菌性黑斑病菌在作为主要初侵染源之一的枝条及其他初侵染源如未显症叶片及杂草等上的存活期,还有待进一步研究。
[1]Doidge E M.A bacterial disease of the mango,Bacillusmangiferaen.sp[J].Annals of Applied Biology,1915,2(1):1-45.
[2]中华人民共和国天津出入境检验检疫局,中华人民共和国广东出入境检验检疫局.GB/T 28094-2011,芒果细菌性黑斑病菌检疫鉴定方法[S].北京:中国标准出版社,2011.
[3]Liao C H.Studies on mango fruit spotⅠ.Symptoms and causal organisms[J].Journal of Taiwan Agricultural Research,1972,21(2):146-150.
[4]Liao C H.Studies on mango fruit spotⅡ.Pathogenicity[J].Bulletin of the Taiwan Agricultural Research Institute,1975(32):62-66.
[5]文衍堂,黄圣明.芒果细菌性黑斑病症状与病原菌鉴定[J].热带作物学报,1994(1):79-85.
[6]董春,何汉生.芒果细菌性黑斑病研究进展[J].果树科学,1999,16(S1):47-51.
[7]Gagnevin L.Analyse de la diversitégénétique deXanthomonaspv.mangiferaeindicaeet sa signification dans le pouvoir pathogène et la biologie de la bactérie[D].INA P-G,Paris,France:Implications dans l’épidémiologie de la maladie des taches noires du manguieràl’île de la Réunion,1998.
[8]Manicom B Q.Factors affecting bacterial black spot of mangoes caused byXanthomonascampestrispv.mangiferaeindicae[J].Annals of Applied Biology,1986,109(1):129-135.
[9]Pruvost O,Couteau A,Verniere C,et al.Epiphytic survival ofXanthomonascampestrispv.mangiferaeindicaeon mango buds[J].Acta Harticulturae,1993(341):337-344.
[10]Gagnevin L,Pruvost O.Epidemiology and control of mango bacterial black spot[J].Plant Disease,2001,85(9):928-935.
[11]Pruvost O,Roumagnac P,Gaube C,et al.New media for the semi selective isolation and enumeration ofXanthomonascampestrispv.mangiferaeindicae,the causal agent of mango bacterial black spot[J].Journal of Applied Microbiology,2005,99(4):803-815.
[12]中国热带农业科学院环境与植物保护研究所.NY/T2257-2012,芒果细菌性黑斑病原菌分子检测技术规范[S].北京:中国农业出版社,2012.
[13]许志刚.普通植物病理学[M].北京:中国农业出版社,1997:150-177.
[14]Pruvost O,Manicom B Q.Xanthomonascampestrispv.mangiferaeindicae,cause of bacterial black spot of mangoes[M]∥Swings J G,Civerolo E L.Xanthomonas.London,United Kingdom:Chapman & Hall,1993:91-95.
