海水养殖鱼类鳗弧菌(Vibrio anguillarum)临床分离株的血清型和抗生素耐药谱*
2015-03-22赵鲁宁李贵阳张乐萃莫照兰
赵鲁宁 李贵阳 李 杰 李 晨 张乐萃 莫照兰①
(1. 青岛农业大学动物科技学院 青岛 266109; 2. 农业部海洋渔业可持续发展重点实验室 青岛 266071;3. 中国水产科学研究院黄海水产研究所 青岛 266071)
鳗弧菌(Vibrio anguillarum)为革兰氏阴性菌, 广泛存在于沿岸海水、沉积物和海洋动物体体表和肠道中, 在世界范围内已引起多种淡水和海水鱼类出血性败血症(Austinet al, 1995), 还可感染对虾和贝类引起死亡(Aguirre-Guzmanet al, 2004; Christineet al,2004)。对病原进行血清型鉴定对流行病学研究和疾病控制具有重要意义, 美国、日本、丹麦、中国台湾的学者建立了鳗弧菌的各种血清型分型系统(Gouldet al, 1979; Ezuraet al, 1980; Kitaoet al, 1983, 1984;Chartet al, 1984; Sørensenet al, 1986; Tajimaet al,1986a, 1986b; Songet al, 1988; Austinet al, 1995), 其中, 日本学者Kitao等(1983)将267株鱼源鳗弧菌分为A—F血清型, 而Tajima和Ezura则将鳗弧菌分为JO1—JO8 (Tajimaet al, 1986a, 1986b); 丹麦学者Sørensen等(1986)综合了上述学者的血清型分析系统, 在吸收日本的JO1—JO3和A、B、C血清分型系统基础上, 建立了一种简单实用的血清分型系统, 将来自鱼类、环境和其它脊椎动物的鳗弧菌分为 O1—O10血清型,后来Grisez等(1995)和Pedersen等(1999)进一步补充,将鳗弧菌的血清型扩展至23种血清型。在23种血清型中, O1、O2以及部分的O3血清型为主要的致病性血清型(Pedersenet al, 1999), 后来发现O2a、O2b以及另外一种新的O2血清型亚型是引起大西洋鳕鱼弧菌病的主要病原(Knappskoget al, 1993; Larsenet al,1994; Mikkelsenet al, 2007)。鳗弧菌的致病机理也得到深入研究, 一些与趋化性、运动力、粘附、侵袭、繁殖和生长相关的致病因子已经被鉴定(Nakaet al,2011)。例如, 多数的O1血清型菌株都携带一个65kb的毒性质粒 pJM1, 该质粒编码铁摄取系统, 而一些不携带质粒的O1、O2、O3血清型菌株则在染色体上编码铁摄取系统(Soengaset al, 2006; Baladoet al,2008)。
近 20年来, 我国海水养殖对虾(郑国兴等,1990)、鲈鱼(肖慧等, 1999)、大黄鱼(李清禄等, 2001)、牙鲆(莫照兰等, 2002)、大菱鲆(陈吉祥等, 2005)等受到鳗弧菌的侵染, 带来了严重的经济损失。国内尚未系统开展鳗弧菌流行病学研究, 也不清楚当前流行于我国海水养殖的鳗弧菌主要有哪些血清型, 给疾病监测和疫苗防治带来了困难。本研究针对自 1999年以来分离和收集的临床鳗弧菌菌株进行生理生化、16S rRNA基因序列、血清分型、抗生素敏感性的分析, 旨在系统了解存在于我国海水养殖环境的鳗弧菌血清学特征及耐药特征, 为深入阐明鳗弧菌的分子流行病学和疾病控制提供理论支撑。
1 材料与方法
1.1 菌株和实验动物
本研究所用菌株见表1, 其中M0、M1由黄海所王印庚研究员赠送, 0401、1703、2301、112601、MN由黄海水产研究所王秀华研究员赠送, 279、285由中国水产科学研究院淡水渔业研究中心梁利国博士赠送, 其余为本实验室保藏菌株。体重2.0—2.5 kg的健康新西兰大白兔(Oryctolagus cuniculus)购自青岛康大兔业发展有限公司, 实验前暂养一周。

表1 本研究所用鳗弧菌菌株Tab.1 V. anguillarum strains used in this study
1.2 兔抗鳗弧菌血清制备
将表1所示的5株鳗弧菌ATCC标准菌株(O1—O5血清型)分别在胰大豆蛋白胨琼脂(TSA)平板划线,于 28°C培养 24h, 挑取单菌落转接胰大豆蛋白胨肉汤(TSB)培养过夜, 取适量菌液涂布 TSA 平板, 于28°C培养24h后用无菌的PBS缓冲液(0.01mol/L, pH 7.3)冲洗菌苔, 收集菌液于 100°C水浴灭活 2.5h后,再4000g离心10min, 收集菌体并用PBS重悬, 所得菌悬液用麦氏比浊管调整浓度至 109CFU/mL, 所得菌液即为鳗弧菌O抗原, 置于4°C冰箱保存。
按照文献方法免疫新西兰大白兔制备兔抗血清,制备的血清效价>1: 1600, 将得到的兔抗血清采用血清非特异抗原吸附法对兔抗血清进行纯化(窦勇等,2007)。
1.3 鳗弧菌株的生理生化及抗生素敏感性检测
用API ID 32E生化反应试剂条和ATB药敏检测系统(均购自法国梅里埃, BioMrieux)检测鳗弧菌的生化反应和抗生素药物敏感性, 使用 ATBTMNew软件判读结果。用 NYSYpc2.1软件的非加权组平均法(UPGMA)对生化反应性状进行聚类分析。
1.4 鳗弧菌株16S rRNA基因序列分析
按文献方法扩增鳗弧菌 16S rRNA基因序列(莫照兰等, 2002), 所用引物为 27F (5’-AGAGTTTGAT CMTGGCTCAG-3’和 1492R (5’-TACGGYTACCTTG TTACGACTT-3’), 所得 PCR产物经上海桑尼生物科技有限公司测序, 所得序列在 NCBI上使用 BLAST程序进行比对。从 GenBank数据库中获取其它细菌16S rRNA基因序列, 构建系统发育树, 用MEGA5.2软件采用邻位相连法(Neighbor-Joining)构建系统进化树, 用 Kimura模式计算遗传距离, 用 Boostrap法重复1000次进行评估(Saitouet al, 1987)。
1.5 鳗弧菌血清型的鉴定
采用玻片凝集法进行鳗弧菌血清型鉴定。具体步骤为: 将鳗弧菌在TSA划线, 挑取培养24h的菌落与20μL兔抗血清在玻璃片上混匀; 设置两组阴性对照:一组为细菌与20μL PBS混合, 另一组为20μL血清。所有混合物在10min内观察凝集情况, 并记录结果。
2 实验结果
2.1 生理生化检测结果
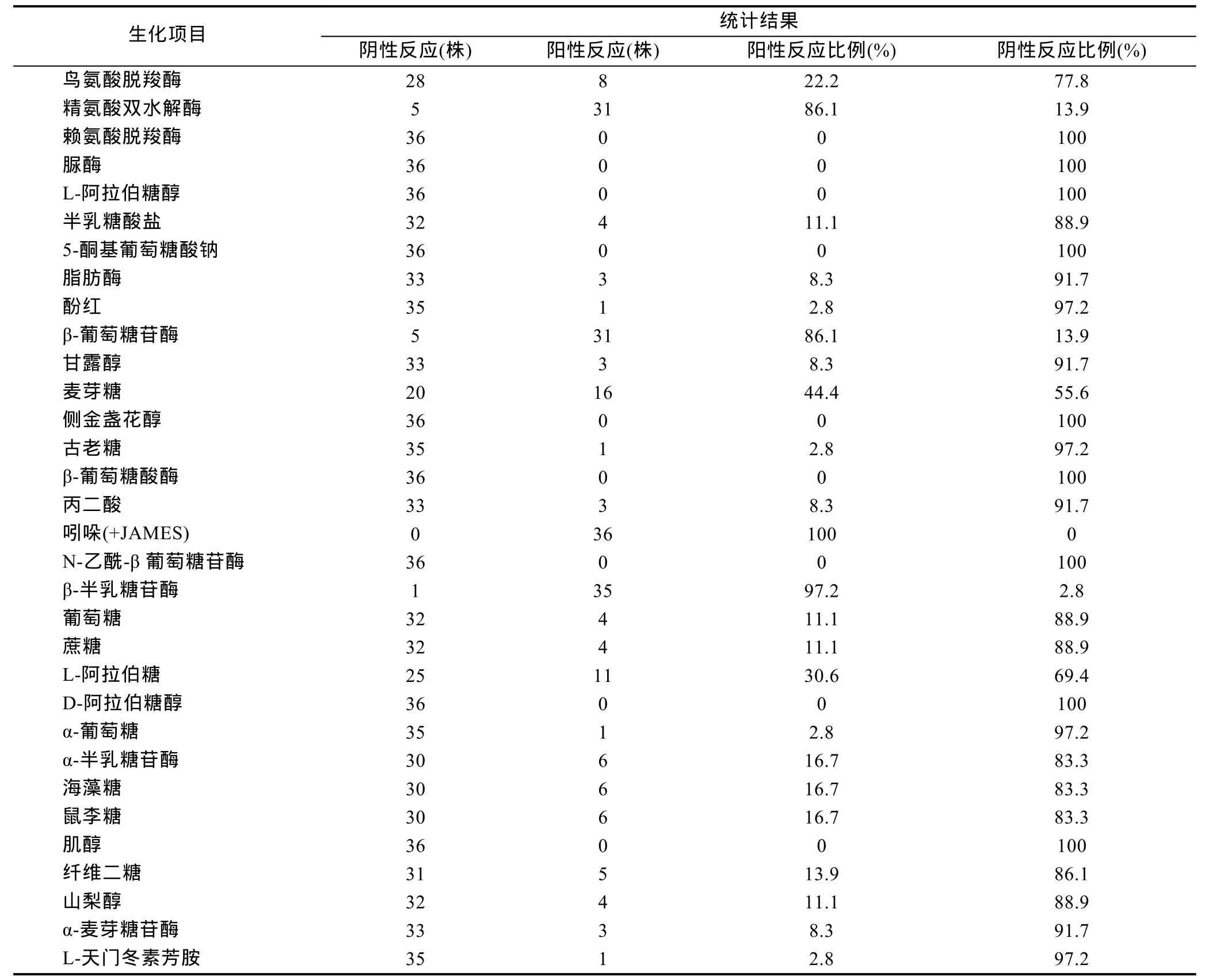
表2 鳗弧菌的API ID 32E生理生化分析结果Tab.2 Biochemical characteristics of V. anguillarum analyzed with API ID 32E
对31株临床分离菌株和5株标准菌株进行生理生化分析。所有菌株均为革兰氏阴性菌, 在2216E海水培养基和TSA培养基上生长良好。API ID 32E鉴定结果显示, 所有 36株菌在吲哚的反应为阳性, 在赖氨酸脱羧酶、脲酶、L-阿拉伯糖醇、5-酮基葡萄糖酸钠、侧金盏花醇、β-葡萄糖酸酶、N-乙酰-β葡萄糖苷酶、D-阿拉伯糖醇、肌醇的反应为阴性; 有 35株菌分别在β-半乳糖苷酶、β-葡萄糖苷酶和精氨酸双水解酶反应为阳性(表 2)。特别指出的是有2株菌的生理生化反应呈现特殊性: 菌株 34在酚红、L-天门冬素芳胺酶和古老糖的反应为阳性, 而其它菌株反应均为阴性; 菌株L62的α-葡萄糖反应显示阳性, 而其它菌株反应均为阴性。上述结果表明, 待检菌株既有稳定的生理生化性状, 也有生理生化性状的多样性。根据API ID 32E鉴定系统软件的鉴定结果, 未能将待检菌株鉴定到种的水平。应用UPGMA方法对生理生化形状的相似性进行聚类分析, 按照相似性>80%分为8个亚型, 其中Ⅱ型菌株数量最多(图1)。
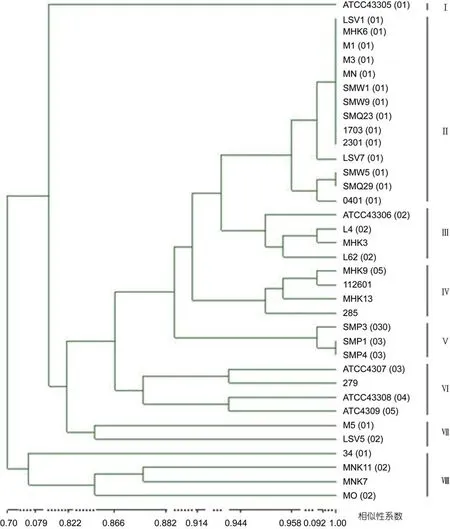
图1 基于鳗弧菌生理生化性状的UPGMA聚类分析Fig.1 Dendrogram of V. anguillarum strains analyzed with UPGMA cluster algorithm based on biochemical characteristics
2.2 16S rRNA基因序列分析
对31株临床分离菌株和5株鳗弧菌标准菌株进行16S rRNA基因扩增, 得到的序列在GenBank上进行BLAST, 结果显示, 所有菌株的序列均与GenBank中鳗弧菌(V. anguillarum)的16S rRNA基因序列具有最高相似性(99%—100%)。系统发育树分析结果显示,所检测的菌株与5株鳗弧菌ATCC菌株聚为一大簇,其它弧菌菌株聚为不同的几簇(图 2)。这个结果表明临床菌株与鳗弧菌具有最近的亲缘关系, 可鉴定为鳗弧菌。
2.3 鳗弧菌血清型鉴定
利用鳗弧菌标准菌株(O1-O5血清型)制备的兔抗血清对31株鳗弧菌临床菌株进行血清型分型。结果如表3显示, 检测到16株O1血清型菌株, O2、O3、O5血清型分别为5、3、1株, 没有检测到有O4血清型菌株, 有6株菌株不属于O1—O5血清型。
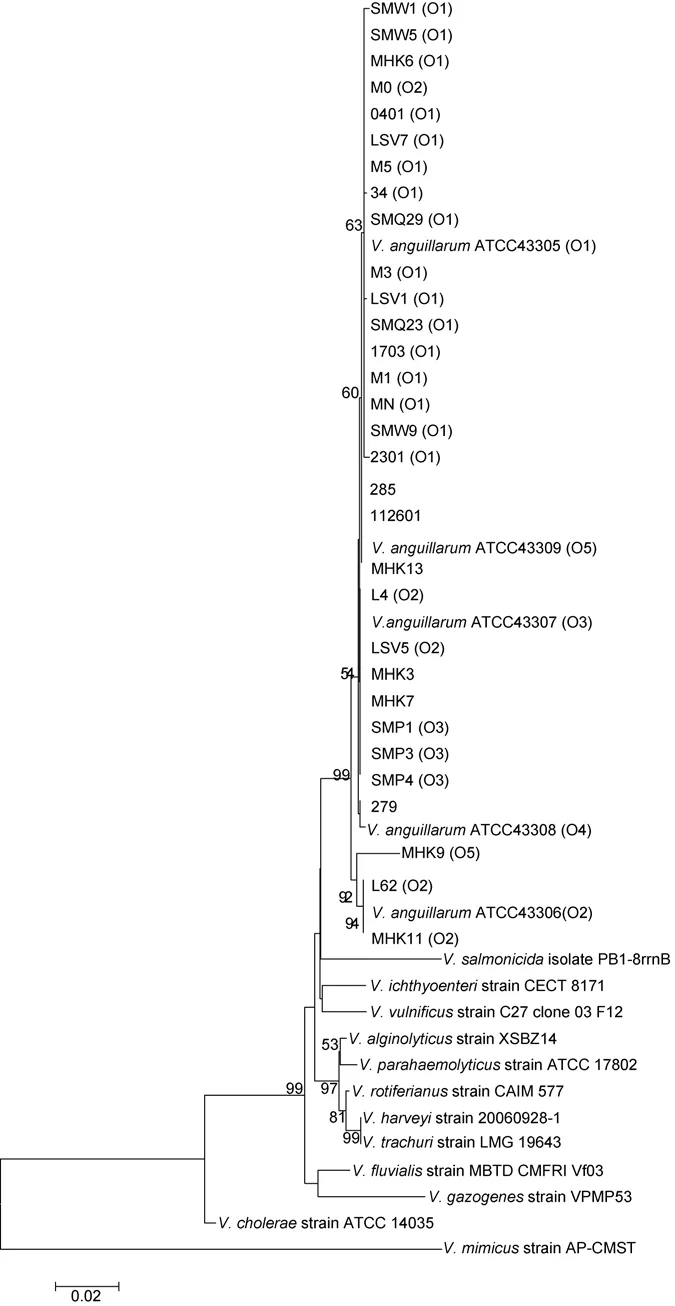
图2 鳗弧菌和其它弧菌的16S rRNA基因序列的系统发育树(括号指菌株的血清型)Fig.2 Phylogenetic tree of V. anguillarum and other Vibrio sp. strains based on 16S rRNA gene sequences(the bracket presents serotype assigned for the strain)

表3 鳗弧菌血清型分型Tab.3 Serotyping of V. anguillarum strains
2.4 鳗弧菌抗生素敏感性检测
对所有鳗弧菌菌株进行 ATB药敏检测, 统计结果显示, 97.2%(35株)的鳗弧菌菌株对氟甲喹、奥索利酸、大观霉素、庆大霉素等4种抗生素敏感, 94.4%(34株)菌株对依氟沙星和安普霉素敏感, 90.9%菌株(33株)对呋喃妥因和卡那霉素敏感。所有菌株对林可霉素、夫西地酸、甲硝唑、阿莫西林、阿莫西林/克拉维酸、苯唑西林、青霉素等 7种抗生素产生耐药,94.4%(34株)的菌株对红霉素、原始霉素、泰洛星等3种抗生素耐药, 86.1%(31株)菌株对磺胺甲恶唑耐药。图3给出了鳗弧菌对不同抗生素产生耐药率。
从耐药数量来看, 所有的 36株鳗弧菌菌株对 9种以上的抗生素产生耐药性, 有11株菌(30.6%)对12种抗生素产生耐药性。83.3%的菌株(30株)对12种以上的抗生素产生耐药, 其中有 24株 O1—O3血清型临床分离株。2002年分离到的 3株 O3血清型菌株(SMP1, SMP3, SMP4)对 18—19种抗生素产生耐药,2003年分离到的一株菌 MHK3(非 O1—O3血清型)对26种抗生素产生耐药(表4)。耐药种类涵盖大环内酯类(红霉素, 林克霉素, 原始霉素, 泰洛星)、多肽类抗生素(粘菌素)、β-内酰胺类(青霉素, 阿莫西林, 苯唑西林, 头孢噻吩)。
使用 UPGMA方法对抗生素敏感性进行聚类分析, 按照相似形>80%分为7个亚型, 其中Ⅰ型菌株数量最多(图4)。
2.5 血清型与表型和基因型之间的关系
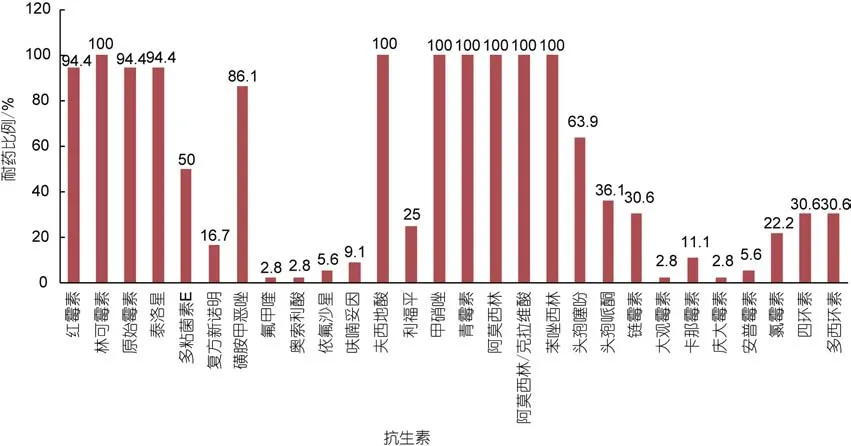
图3 鳗弧菌对不同抗生素的耐药率Fig.3 Percentage of V. anguillarum strains against different antibiotics
比较鳗弧菌血清型与生理生化聚类分析的结果,发现O1、O3血清型的大部分临床菌株分别聚为Ⅱ型和Ⅴ型, 但未与相应的标准血清型菌株聚在一起, 其它的菌株也与相应的标准血清型菌株分属不同的亚型。比较血清型与抗生素聚类分析的结果, 发现O1血清型的大部分临床菌株与 O1血清型标准菌株ATCC43305聚为Ⅰ型, 其它的菌株与相应的标准血清型菌株分属不同的亚型。比较血清型与16S rRNA基因系统发育树的结果, 发现所有O1血清型临床菌株与鳗弧菌标准菌株 ATCC43305(O1)聚为一支, 有 2株O2临床株与标准菌株ATCC43306(O2)聚为一支, 3株O3临床菌株与标准菌株ATCC43307(O3)聚为一支。

表4 鳗弧菌耐药分析Tab.4 Analysis of the antibiotics resistance of V. anguillarum strains
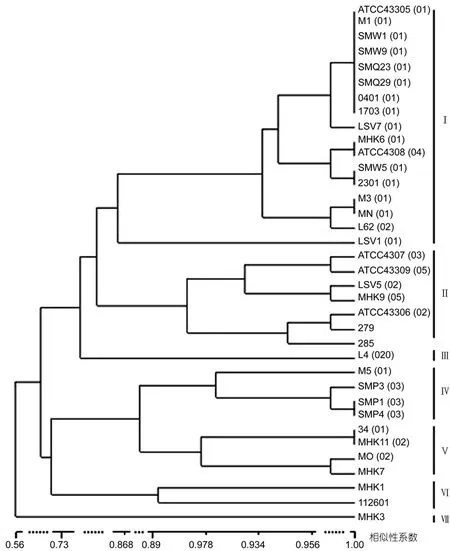
图4 基于鳗弧菌抗生素敏感性状的UPGMA聚类分析(括号指菌株的血清型)Fig.4 Dendrogram of V. anguillarum strains analyzed with UPGMA cluster algorithm based on antibiotics sensitivity(the bracket presents serotype assigned for the strain)
上述结果表明, 鳗弧菌的血清型与其生理生化性状、抗生素敏感性状、16S rRNA基因序列存在一定的相关性, 其中血清型与16S rRNA基因序列的相关性更明显。相同血清型的菌株数量越多, 相关性越显著。
3 讨论
本研究对1999—2013年从海水养殖环境分离得到的临床鳗弧菌菌株进行了表型和基因型的分类鉴定, 旨在确证这些细菌的分类地位。传统的表型鉴定方法是通过对细菌形态和生理生化反应的特征进行分类地位的分析。本研究在确定分离菌株为革兰氏阴性菌后, 利用API ID 32E细菌快速鉴定系统对分离菌株开展 32项生理生化反应指标的分析, 由于该快速检测系统主要用于陆地肠杆菌科和其它革兰氏阴性杆菌的鉴定, 海洋细菌模式种信息较少, 利用该系统未能将鉴定到种的地位。细菌的16S rRNA基因具有特征性的进化序列, 已被广泛用于细菌的分类和鉴定的分子标记, 本研究对分离菌株的16S rRNA基因序列进行分析, 结果显示所有临床株的 16S rRNA基因序列与标准鳗弧菌的相似性为 99%—100%, 在发育进化树中紧密地聚为一簇, 说明它们在进化中具有最近的亲缘关系。综合生理生化和16S rRNA基因的分析结果, 我们将这些待测菌鉴定为鳗弧菌。
细菌的血清学分型是根据细菌表面抗原(外膜蛋白和脂多糖)的不同, 将细菌分成不同血清型。O1、O2、O3血清型鳗弧菌可引起鱼类疾病(Pedersenet al,1999), O1和O2血清型分布在世界各地, O3血清型在丹麦、意大利和日本等国家偶有发现(Larsenet al,1994; Tiainenet al, 1997)。本研究结果显示, 在31株临床分离菌株中, O1型菌株数量最多, 其次为 O2、O3血清型菌株。本研究结果说明了流行于我国海水养殖鱼类的鳗弧菌存在3种潜在的致病性血清型, O1血清型菌株为主要的流行株。值得注意的是本次研究发现三株 O3血清型菌株(SPM1, SPM3, SMP4), 于2002年分离自苗种来源鱼欧洲的发病大菱鲆, 说明引种可导致外来病原入侵的危险。通过比较血清型分型结果与表型和基因型的聚类分析结果, 我们尝试建立血清型与生理生化表型和基因型的对应关系,结果显示鳗弧菌的血清型与其生理生化性状、抗生素敏感性状、16S rRNA基因序列存在一定的相关性, 其中血清型与16S rRNA基因序列的相关性更明显。
病原菌的耐药性, 特别是对多种抗生素的多耐药性给水产养殖和人类健康带来严重的安全问题。细菌的耐药性有天然性耐药和获得性耐药, 前者是由细菌染色体存在的耐药基因决定, 后者是在抗生素选择压力下, 某种细菌通过基因水平转移从别的细菌获得了抗性基因。本研究利用 ATB药敏系统检测了鳗弧菌株的耐药性, 结果显示鳗弧菌对 β-内酰胺类(阿莫西林、阿莫西林/克拉维酸、苯唑西林、青霉素)、林可酰胺类(林克霉素)、硝咪唑类(甲硝唑)和夫西地酸的耐药率为 100%, 其原因可能是鳗弧菌对这些抗生素具有天然性耐药的结果。另外, 结果还显示鳗弧菌对红霉素(大环内酯类)、原始霉素、泰洛星等3种抗生素的耐药率为94%(34株), 对磺胺甲恶唑的耐药率为86%(31株)。红霉素和原始霉素常用于医院的临床治疗, 红霉素还常用作水产饲料添加剂; 泰洛星为畜禽专用抗生素, 作为饲料添加剂用于预防畜禽疾病和促进畜禽生长发育; 磺胺类药物具有广谱性抗菌作用而广泛用于水产养殖。根据这些分析, 我们认为鳗弧菌对上述四种药物产生高耐药率的原因是医院、畜牧业、水产业大量使用和滥用这些抗生素引起的。进一步的分析结果还显示, 鳗弧菌对多种抗生素产生了耐药, 83%以上的菌株对12种以上的抗生素产生耐药, 耐药种类涵盖3种以上, 说明了鳗弧菌普遍存在多重耐药性。在具有潜在致病性的O1—O3血清型菌株中, 于 2001年分离自山东大菱鲆的三株菌(SMP1, SPM3, SPM4)对18—19种抗生素产生耐药性, 耐药种类含盖6类抗生素(大环内酯类, 多肽类抗生素, β-内酰胺类, 酰胺醇类, 四环素类, 磺胺类),这些潜在病原菌的多重耐药性增加了对病害防治的难度。
综上所述, 本研究首次对存在我国海水养殖鱼类的鳗弧菌进行了血清学鉴定, 同时还分析了它们对抗生素的耐药性, 研究结果明确了流行于我国海水养鱼类殖鳗弧菌血清学特征及其耐药特征, 对鳗弧菌病的流行病学研究、疫苗研制具有明确的指导作用。
李清禄, 陈 强, 2001. 海水网箱养殖大黄鱼细菌性病原鉴定与感染治疗研究. 应用与环境生物学报, 7(5): 489—493
肖 慧, 李 军, 王祥红等, 1999. 鲈鱼苗烂鳃、烂尾病病原菌的研究. 青岛海洋大学学报, 29(1): 87—93
陈吉祥, 李彩风, 颜显辉等, 2005. 大菱鲆病原鳗弧菌生物学及分子特征研究. 高技术通讯, 15(6): 92—96
郑国兴, 沈亚林, 李 何, 1990. 中国对虾病原菌(鳗弧菌)的研究. 水产学报, 14(1): 1—7
莫照兰, 茅云翔, 陈师勇等, 2002. 一株牙鲆皮肤溃烂症病原菌的鉴定. 微生物学报, 42(3): 263—269
窦 勇, 宁喜斌, 2007. 副溶血弧菌多克隆抗体的制备及其特性分析. 食品与生物技术学报, 26(3): 85—89
Aguirre-Guzmán G, Ruíz M H, Ascencio F, 2004. A review of extracellular virulence product ofVibrio speciesimportant in diseases of cultivated shrimp. Aquaculture Research,35(15): 1395—1404
Austin B, Alsina M, Austin D Aet al, 1995. Identification and typing ofVibrio anguillarum: a comparison of different methods. Systematic and Applied Microbiology, 18(2):285—302
Balado M, Osorio C R, Lemos M L, 2008. Biosynthetic and regulatory elements involved in the production of the siderophore vanchrobactin inVibrio anguillarum. Microbiology,154(5): 1400—1413
Chart H, Trust T J, 1984. Characterization of the surface antigens of the marine fish pathogenVibrio anguillarumandVibrio ordalii. Canadian Journal of Microbiology, 30(5): 703—710
Christine P, Frédérique L R, Borrego J J, 2004. Bacterial disease in marine bivalves: a review of recent studies: trends and evolution. Aquatic Living Resources, 17(4): 477—498
Ezura Y, Tajima K, Yoshimizu Met al, 1980. Studies on the taxonomy and serology of causative organisms of fish vibriosis. Fish Pathology, 14(4): 167—179
Gould R W, Antipa R, Amend D F, 1979. Immersion vaccination of sockeye salmon (Oncorhynchus nerka) with two pathogenic strains ofVibrio anguillarum. Journal of the Fisheries Board of Canada, 36(2): 222—225
Grisez L, Ollevier F, 1995. Comparative Serology of the Marine Fish PathogenVibrioanguillarum. Applied and environmental microbiology, 61(12): 4367—4373
Kitao T, Aoki T, Fukudome Met al, 1983. Serotyping ofVibrio anguillarumisolated from diseased freshwater fish in Japan.Journal of Fish Diseases, 6(2): 175—181
Kitao T, Aoki T, Muroga K, 1984. Three new O-serotypes ofVibrio anguillarum. Bulletin of the Japanese Society of Scientific Fisheries, 50(11): 1955
Knappskog D H, Rødseth O M, Slinde Eet al, 1993.Immunochemical analyses ofVibrio anguillarumstrains isolated from cod,Gadus morhuaL., suffering from vibriosis. Journal of Fish Diseases, 16(4): 327—338
Larsen J L, Pedersen K, Dalsgaard I, 1994.Vibrio anguillarumserovars associated with vibriosis in fish. Journal of Fish Diseases, 17(3): 259—267
Mikkelsen H, Lund V, Martinsen L - Cet al, 2007. Variability amongVibrio anguillarumO2 isolates from Atlantic cod(Gadus morhuaL.): Characterisation and vaccination studies.Aquaculture, 266(1—4): 16—25
Naka H, Crosa J H, 2011. Genetic determinants of virulence in the marine fish pathogenVibrio anguillarum. Fish Pathology,46(1): 1—10
Pedersen K, Grisez L, Van Houdt Ret al, 1999. Extended serotyping scheme forVibrio anguillarumwith the definition and characterization of seven provisional O-serogroups. Current Microbiology, 38(3): 183—189
Saitou N, Nei M, 1987. The neighbor-joining method: a new method for reconstructing phylogenetic trees. Molecular Biology and Evolution, 4(4): 406—425
Soengas R G, Anta C, Espada Aet al, 2006. Structural characterization of vanchrobactin, a new catechol siderophore produced by the fish pathogenVibrio anguillarumserotype O2. Tetrahedron Letters, 47(39): 7113—7116
Song Y L, Chen S N, Kon G N, 1988. Serotyping ofVibrio anguillarumstrains isolated from fish in Taiwan. Fish Pathology, 23(3): 185—189
Sørensen U B S, Larsen J L, 1986. Serotyping ofVibrio anguillarum. Applied and Environmental Microbiology,51(3): 593—597
Tajima K, Ezura Y, Kimura T, 1986a. Serological typing of thermostabile antigens ofV. anguillarum-I.V. anguillarumO-serotypes (J-O-1—J-O-3). Bulletin of the Faculty of Fisheries Hokkaido University, 37(3): 230—239
Tajima K, Ezura Y, Kimura T, 1986b. Serological typing of thermostabile antigens ofV. anguillarum-II.V. anguillarumO-serotypes (J-O-4—J-O-8). Bulletin of the Faculty of Fisheries Hokkaido University, 37(3): 240—245
Tiainen T, Pedersen K, Larsen J L, 1997.Vibrio anguillarumserogroup O3 andV. anguillarum-like serogroup O3 cross-reactive species-comparison and characterization.Journal of Applied Microbiology, 82(2): 211—218
