不同形态磷源对具槽帕拉藻(Paralia sulcata)生长和磷酸酶活性的影响*
2015-03-22袁泽轶吴惠丰赵建民
于 倩 王 清 袁泽轶 吴惠丰 赵建民①
(1. 中国科学院烟台海岸带研究所 中国科学院海岸带环境过程与生态修复重点实验室 烟台 264003;2. 国家海洋信息中心 天津 300171; 3. 中国科学院大学 北京 100049)
浮游植物是海洋生态系统中最主要的初级生产者, 其生长通常受到氮、磷等营养元素的限制(Huanget al, 2005)。传统的观点认为, 氮是近海浮游植物生长的主要营养盐限制因子(Rytheret al, 1971; Zehret al, 2011; Hoet al, 2013), 但初级生产的磷限制也相继在地中海、红海、马尾藻海和北大西洋等海区被发现(Thingstadet al, 1998; Wuet al, 2000)。
近年来, 由于陆源氮输入的增加和磷输入量的减少, 已导致我国近海磷潜在限制的趋势愈发严重(Xuet al, 2010)。在海洋环境中, 溶解态磷主要以溶解无机磷(Dissolved inorganic phosphorus, DIP)和溶解有机磷(Dissolved organic phosphorus, DOP)两种形式存在。现有研究发现, 浮游植物对不同形态磷源的利用能力存在差异, 且这种差异可能影响到种群在生态系统中的竞争地位(Hoppe, 2003; Kruskopfet al,2004; Xuet al, 2010)。通常来说, DIP可被多数浮游植物直接吸收利用, 而 DOP则需要通过一系列酶的水解作用转化为DIP后再被利用(Ohet al, 2002; Huanget al, 2005; 张清春等, 2005)。例如, 在DIP限制条件下,浮游植物可通过胞外碱性磷酸酶(Alkaline phosphatase,AP)分解水体中的 DOP, 释放磷酸根供细胞吸收利用(Hoppe, 2003; 唐洪杰等, 2006)。此外, 浮游植物也可以利用胞内酸性磷酸酶(Acid phosphatase, AcP)水解储存于胞内的磷, 以维持细胞的正常生长(赵艳芳等,2009)。
具槽帕拉藻(Paralia sulcata)隶属于中心硅藻纲、帕拉藻属, 是一种广泛分布在温带半咸水沿海区域的底栖硅藻(McQuoidet al, 2003; Gebühret al, 2009)。研究发现, 具槽帕拉藻的生长状态和外界环境紧密相关(Gebühret al, 2009); 同时, 该物种具有易沉降、难降解的特性, 使其能够在沉积物中得以较好地保存, 因此常被用作海洋环境的指示物种(McQuoidet al, 2003)。目前, 国内外学者已针对具槽帕拉藻的生态特征开展了相关研究(Hobsonet al, 1997; Zong 1997), 但关于其对不同磷源利用能力的研究尚未见报道。本文通过比较不同形态磷源对具槽帕拉藻生长及磷酸酶活力的影响, 可为探讨浮游植物对不同形态磷源的吸收利用特征提供基础资料。
1 材料与方法
1.1 藻种及试剂
实验所用具槽帕拉藻(Paralia sulcata)分离自渤海近岸海域, 并在本实验室保存。藻种采用 f/2培养基进行培养, 培养条件如下: 温度为(23.0±0.50)°C,光暗周期为14:10h, 光照强度为3.0×103lx。正式实验前, 通过添加抗生素(硫酸链霉素与青霉素钠盐混合液)的方式对预接种藻液进行灭菌处理(Kwonet al,2013)。
5种不同形态的磷源分别为磷酸二氢钾(KH2PO4)、β-甘油磷酸钠(Sodium-β-glycerophosphate, β-G-P)、葡萄糖-6-磷酸(Glucose-6-phosphate, G-6-P)、三磷酸腺苷二钠(Adenosine disodium triphosphate, ATP)和卵磷脂(Lecithin, LEC), 均购自Sigma公司。
1.2 实验设置
参照 Harrison等(1980)的方法配制人工海水, 经0.22µm 孔径醋酸纤维滤膜过滤后, 配制 f/2培养基,用于藻细胞培养。将处于指数生长期的具槽帕拉藻经5.0×103r/min离心 15min, 收集藻细胞并用人工海水清洗 2次, 接种于未添加营养盐的过滤消毒海水中(初始藻密度约为 5.0×103cells/mL), 培养 3天以消耗母液中的磷。
实验过程中, 设置5个处理组分别添加不同形态的磷源, 各形态磷的初始浓度均为 4.0μmol/L, 调整N︰P=16︰1, 其他营养盐成分按照f/2培养基进行添加, 每个处理组设置3个重复, 实验周期为7天。
1.3 藻细胞计数
采用浮游植物计数框进行显微镜镜检计数; 每24h取样一次, 各处理组平行取样3次并测算平均值,记录细胞生长数据并分析细胞生长情况(李英等,2005)。
1.4 DIP和DOP的含量测定
DIP含量的测定采用磷钼蓝比色法(Leeet al, 2013);培养液中的总溶解态磷(Total dissolved phosphorus,TDP)和藻细胞内的 TDP含量采用过硫酸钾(K2S2O8)氧化法测定(Jeffrieset al, 1979); DOP浓度以TDP减去DIP的浓度测算。
1.5 磷酸酶活性分析
AP和AcP活性的测定参照Wynne(1977)的方法进行, 采用对硝基苯酚磷酸盐(p-nitrophenyl phosphate,pNPP)作为底物。藻细胞分别经 Tris-HCl缓冲液(0.05mol/L, pH 9.0)和醋酸-醋酸钠缓冲液(0.20mol/L,pH 5.0)匀浆, 用于后续的AP和AcP活性测定。测定过程中, 以未加底物的藻细胞匀浆液作为空白组。酶活力单位定义如下: 在 30°C条件下, 单位时间内每个藻细胞产生的磷酸酶释放 1.0μg对硝基苯酚(p-nitrophenol, PNP)作为一个酶活力单位(U)。
1.6 数据处理
实验数据均以平均值±标准差表示; 利用 SPSS16.0软件对所得实验数据进行方差分析, 当P<0.05时认为处理之间存在显著差异。
2 结果与分析
2.1 不同磷源对具槽帕拉藻生长的影响
由图1可知, 5种不同形态磷源均可促进具槽帕拉藻的生长。其中, 以G-6-P为磷源处理组的藻细胞生长最好, 从第2天开始细胞密度就高于其它处理组,至第 6天时细胞密度达到最高值(3.2×104cells/mL);以ATP为磷源的处理组次之, 第5天时细胞密度达到峰值(2.7×104cells/mL), 但从第 6天开始细胞密度迅速下降; 以β-G-P和LEC为磷源的处理组中, 藻细胞生长趋势及细胞密度相近, 分别在第5天和第6天达到细胞密度的峰值(均为 2.5×104cells/mL)。相对于以DOP为磷源的处理组, 添加KH2PO4处理组的细胞生长较差, 第5天时细胞密度达到最大值(2.4×104cells/mL)。

图1 不同形态磷源对具槽帕拉藻生长的影响Fig.1 Effects of different phosphorus substrates on growth of P.sulcata
2.2 具槽帕拉藻的磷酸酶活性
不同形态磷源对具槽帕拉藻生长过程中 AP和AcP活性的影响如图2和图3所示。在实验期间, 具槽帕拉藻的 AP活性总体呈现先下降后上升的趋势;其中, 在以大分子 DOP为磷源的处理组中(LEC处理组), AP活性始终保持最高。以KH2PO4为磷源的处理组, AP活性在前2天迅速下降, 从第6天(0.55×10–5U/cell)开始出现升高至实验结束(0.74×10–5U/cell)。在以β-G-P、G-6-P和ATP三种小分子DOP为磷源的处理组中, AP活性均呈现降低趋势, 分别在第 5天(0.20×10–5U/cell)、第 4 天(0.16×10–5U/cell)和第 5 天(0.24×10–5U/cell)时酶活性达到最低; 之后 AP酶活性有所上升, 且 ATP处理组的酶活性较 β-G-P、G-6-P处理组上升缓慢。实验结束时, 在 3种小分子 DOP处理组中, AP活性由高到低的顺序分别为 β-G-P>G-6-P>ATP。

图2 不同形态磷源对具槽帕拉藻AP活性的影响Fig.2 Effects of different phosphorus substrates on AP activities of P. sulcata

图3 不同形态磷源对具槽帕拉藻AcP活性的影响Fig.3 Effects of different phosphorus substrates on AcP activities of P. sulcata
AcP活性在前两天呈上升趋势, 之后出现略微降低, 从第 4天开始呈上升趋势。在实验结束时, ATP处理组的 AcP 活性最高(0.80×10–6U/cell), KH2PO4处理组最低(0.58×10–6U/cell), 其它三组的 AcP活性水平相当(≈0.60×10–6U/cell)。
2.3 具槽帕拉藻胞内TDP和培养液中磷浓度的变化
具槽帕拉藻胞内TDP的变化如图4所示。总体而言, 胞内TDP在前2天呈现上升趋势, 各处理组的胞内TDP均达到最高值; 其中, 以KH2PO4处理组的胞内 TDP 浓度最高(5.9×10–8μmol/cell)。随培养时间的延长, KH2PO4、β-G-P、LEC、G-6-P处理组的胞内
TDP浓度相对平稳, 而ATP处理组则在第6天迅速下降。至第7天时, 5种磷源处理组的胞内TDP浓度由高到低的顺序为KH2PO4>β-G-P>LEC>G-6-P>ATP。

图4 不同形态磷源对具槽帕拉藻胞内TDP浓度的影响Fig.4 Effects of different phosphorus substrates on intercellular TDP of P. sulcata
在DOP处理组中, 培养液中的DOP浓度均迅速下降, 至第 2天已降至 0.20—0.30μmol/L; 而从第 3天至实验结束, DOP浓度变化幅度较小, 基本维持在平稳状态(图5)。对DIP而言, KH2PO4处理组的DIP在实验前2天迅速下降, 然后趋于稳定, 在第7天时DIP浓度为 0.91μmol/L; 而 DOP处理组培养液中的DIP在第2天达到峰值(0.80—1.20μmol/L), 随后从第3天开始逐步降低(图6)。
3 讨论
3.1 不同形态磷源对具槽帕拉藻生长的影响
磷是浮游植物赖以生存和繁殖的必需营养元素之一(Sañudo-Wilhelmyet al, 2004; Xuet al, 2010; Leeet al, 2013), 是近海初级生产力的重要限制性因子(Dyhrmanet al, 2006a; Hyneset al, 2009)。通常认为,DIP是浮游植物最重要的磷源; 但越来越多的证据表明, DOP也可作为浮游植物的重要磷源, 尤其是在DIP贫乏的海域(Cotneret al, 1992; Bonin, 1988)。

图5 不同形态磷源对培养液中DOP浓度的影响Fig.5 Effects of different phosphorus substrates on DOP concentrations of the culture medium
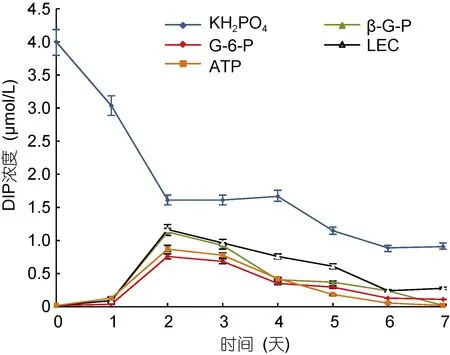
图6 不同形态磷源对培养液中DIP浓度的影响Fig.6 Effects of different phosphorus substrates on DIP concentrations of the culture medium
天然海水中含有分子量不同、种类繁多的 DOP化合物(Duursmaet al, 1981; 黄邦钦等, 1995)。研究表明, 不同浮游植物对 DOP化合物的利用特征存在差异。例如, 东海原甲藻(Prorocentrum donghaiense)可有效利用 G-6-P、ATP、β-G-P(Huanget al, 2005; 李英等, 2005); 球形棕囊藻(Phaecocystis globosa)在以LEC作为磷源的培养基中能够快速生长(王艳等,2006); 束毛藻(TrichodesmiumIMS101)具有高效代谢G-6-P、单磷酸腺苷的能力(Sañudo-Wilhelmy, 2006;Beversdorfet al, 2010)。此外, Wang 等(2011)研究发现,海洋卡盾藻(Chattonella marina)可以有效利用多种核苷酸和β-G-P, 但其对磷酸三乙酯(Triethyl phosphate,TEP)和对硝基苯磷酸二乙酯(Nitrophenyl phosphate,NPP)的利用效率较低。
在本研究中, 具槽帕拉藻在5种不同形态磷源下均能正常生长, 表明具槽帕拉藻具有较为广泛的磷源利用能力。进一步分析发现, 实验结束时 KH2PO4处理组培养液中的 TDP浓度最高, 即单位时间内的磷消耗量最少, 并且藻细胞在 KH2PO4中的生长速度也低于DOP处理组, 表明DOP比KH2PO4更有利于具槽帕拉藻的生长。通过与中肋骨条藻(Skeletonema costatum)比较发现, 在营养条件充足的情况下, 具槽帕拉藻相对于中肋骨条藻其延迟期较短, 表明其能够快速的适应环境, 这些特性可能是具槽帕拉藻成为夏季和冬季黄渤海海域主要优势种的原因之一。
3.2 不同磷源对AP活性的影响
众多研究证实, AP在磷生物地球化学循环过程中发挥着非常重要的作用(Dyhrmanet al, 1999; Labryet al, 2005)。Dyhrman等(2006b)在研究海岸系统中DOP的循环作用时, 将AP活性作为DOP生物可利用性的衡量标准。大量研究表明, 在DIP缺失的环境中, 藻细胞能够通过诱导合成 AP, 以分解水体中的DOP来维持细胞的生长和繁殖(Feuilladeet al, 1990;Huanget al, 2005; Baiet al, 2014)。
在实验起始阶段, 饥饿处理导致各处理组均具有较高的AP活性; 随着磷源的加入, 各处理组的AP活性均快速降低, 表明AP可以指示具槽帕拉藻受磷限制的状况。在本研究中, 3种小分子 DOP处理组AP的活性变化规律与 KH2PO4处理组相似; 而在大分子 DOP(LEC)处理组中, 虽然 AP活性在实验初期有所下降, 但从第3天开始变化不明显, 且在整个实验周期中始终保持较高活性。据此推测, 小分子DOP可能较大分子DOP更易于被AP水解, 从而导致其吸收利用与无机磷酸盐类似。此外, 具槽帕拉藻也存在直接吸收小分子DOP的可能性。洪华生等(1992)认为,藻类对 DOP的利用可能存在两条途径: 对于大分子DOP需要经过磷酸酶水解后被吸收利用; 另一方面,小分子DOP也能够被直接吸收利用。例如, Johannes(1964)研究发现,Achnanthes subhyalina能够直接吸收水生动物分泌的DOP, 以及自身代谢产生的DOP。由于海水中的 DOP化合物结构复杂, 不同种类浮游植物对DOP的利用方式仍需进一步研究。
3.3 不同磷源对AcP活性的影响
近年来, 胞内磷酸盐也被发现是影响浮游植物生长的重要因子之一(Senft, 1978; Hoppe, 2003)。已有研究发现, 某些浮游植物在外界磷酸盐充足的条件下, 能够在胞内积累和储存大量的磷酸盐; 而当胞外磷酸盐缺失时, 藻细胞可以利用胞内储存的磷酸盐来维持细胞的快速生长(Hernándezet al, 2002; Huanget al, 2005)。在本研究中, 实验初期培养液中的TDP浓度迅速下降, 并维持在较低水平, 而藻细胞内的TDP含量在实验初期快速上升, 表明在胞外磷源充足的时候, 具槽帕拉藻能够在胞内储存磷。
由图3可见, 藻细胞在实验起始阶段具有较低的AcP活性, 可能是由于饥饿处理导致胞内储存的磷被消耗殆尽, 进而限制了藻细胞生长并导致 AcP活性的降低。在添加营养盐后, 随着藻细胞对磷元素的吸收, AcP活性又表现出上升趋势。结合藻细胞生长曲线(图1)分析, 发现在3—5天胞外TDP浓度处于低水平时, 具槽帕拉藻并未立刻停止生长; 此时胞内 AcP活性有升高趋势而胞内 TDP呈下降趋, 表明在外界TDP浓度较低时, 具槽帕拉藻通过 AcP动员胞内储存的磷源以维持藻细胞生长。
王 艳, 唐海溶, 2006. 不同形态的磷源对球形棕囊藻生长及碱性磷酸酶的影响. 生态科学, 25(1): 38—40
李 英, 吕颂辉, 徐 宁等, 2005. 东海原甲藻对不同磷源的利用特征. 生态科学, 24(4): 314—317
张清春, 于仁诚, 周名江等, 2005. 不同类型含磷营养物质对微小亚历山大藻(Alexandrium minutum)生长和毒素产生的影响. 海洋与湖沼, 36(5): 465—474
赵艳芳, 俞志明, 宋秀贤等, 2009. 不同磷源形态对中肋骨条藻和东海原甲藻生长及磷酸酶活性的影响. 环境科学,30(3): 693—699
洪华生, 戴汉民, 郑效成, 1992. 海水中碱性磷酸酶活力的测定及其在磷的循环中的作用初探. 海洋与湖沼, 23(4):415—420
唐洪杰, 杨茹君, 张传松等, 2006. 几种海洋微藻的碱性磷酸酶性质初步研究. 海洋科学, 30(10): 61—64
黄邦钦, 洪华生, 王海黎等, 1995. 厦门西港浮游植物吸收磷酸盐的粒级特征. 台湾海峡, 14(3): 269—273
Bai F, Liu R, Yang Y Jet al, 2014. Dissolved organic phosphorus use by the invasive freshwater diazotroph cyanobacterium,Cylindrospermopsis raciborskii.Harmful Algae, 39: 112—120
Beversdorf L J, White A E, Bjorkman K Met al, 2010.Phosphonate metabolism byTrichodesmiumIMS101 and the production of greenhouse gases. Limnology and Oceanography,55(4): 1768—1778
Bonin D J, 1988. Rôle du phophore organique dissous dans la production primaire. Océanis, 14(2): 381—387
Cotner Jr J B, Wetzel R G, 1992. Uptake of dissolved inorganic and organic phosphorus compounds by phytoplankton and bacterioplankton. Limnology and Oceanography, 37(2):232—243
Duursma E K, Dawson R, 1981. Marine Organic Chemistry. New York: Elsevier Scientific Publication, 125—127
Dyhrman S T, Chappell P D, Haley S Tet al, 2006a. Phosphonate utilization by the globally important marine diazotrophTrichodesmium. Nature, 439(7072): 68—71
Dyhrman S T, Ruttenberg K C, 2006b. Presence and regulation of alkaline phosphatase activity in eukaryotic phytoplankton from the coastal ocean: Implications for dissolved organic phosphorus remineralization. Limnology and Oceanography,51(3): 1381—1390
Dyhrman S T, Palenik B, 1999. Phosphate stress in cultures and field populations of the dinoflagellateProrocentrum minimumdetected by a single-cell alkaline phosphatase assay. Applied and Environmental Microbiology, 65(7):3205—3212
Feuillade J, Feuillade M, Blanc P, 1990. Alkaline phosphatase activity fluctuations and associated factors in a eutrophic lake dominated byOscillatoria rubescens. Hydrobiologia,207(1): 233—240
Gebühr C, Wiltshire K H, Aberle Net al, 2009. Influence of nutrients, temperature, light and salinity on the occurrence ofParalia sulcataat Helgoland Roads, North Sea. Aquatic Biology, 7(3): 185—197
Harrison P J, Waters R E, Taylor F J R, 1980. A broad spectrum artificial sea water medium for coastal and open ocean phytoplankton. Journal of Phycology, 16(1): 28—35
Hernández I, Niell F X, Whitton B A, 2002. Phosphatase activity of benthic marine algae. An overview. Journal of Applied Phycology, 14(6): 475—487
Ho T -Y, Chu T -H, Hu C -L, 2013. Interrelated influence of light and Ni onTrichodesmiumgrowth. Frontiers in Microbiology,4: 1—6
Hobson L A, McQuoid M R, 1997. Temporal variations among planktonic diatom assemblages in a turbulent environment of the southern Strait of Georgia, British Columbia, Canada.Marine Ecology Progress Series, 150: 263—274
Hoppe H -G, 2003. Phosphatase activity in the sea.Hydrobiologia, 493(1—3): 187—200
Huang B Q, Ou L J, Hong H Set al, 2005. Bioavailability of dissolved organic phosphorus compounds to typical harmful dinoflagellateProrocentrum donghaienseLu. Marine Pollution Bulletin, 51(8—12): 838—844
Hynes A M, Chappell P D, Dyhrman S Tet al, 2009. Cross-basin comparison of phosphorus stress and nitrogen fixation inTrichodesmium. Limnology and Oceanography, 54(5):1438—1448
Jeffries D S, Dieken F P, Jones D E, 1979. Performance of the autoclave digestion method for total phosphorus analysis.Water Research, 13(3): 275—279
Johannes R E, 1964. Uptake and release of dissolved organic phosphorus by representatives of a coastal marine ecosystem.Limnology and Oceanography, 9(2): 224—234
Kruskopf M M, Plessis S Du, 2004. Induction of both acid and alkaline phosphatase activity in two green-algae(chlorophyceae) in low N and P concentrations.Hydrobiologia, 513(1—3): 59—70
Kwon H K, Oh S J, Yang H -S, 2013. Growth and uptake kinetics of nitrate and phosphate by benthic microalgae for phytoremediation of eutrophic coastal sediments.Bioresource Technology, 129: 387—395
Labry C, Delmas D, Herbland A, 2005. Phytoplankton and bacterial alkaline phosphatase activities in relation to phosphate and DOP availability within the Gironde plume waters (Bay of Biscay). Journal of Experimental Marine Biology and Ecology, 318(2): 213—225
Lee S -H, Ahn C -Y, Jo B -Het al, 2013.Increased microalgae growth and nutrient removal using balanced N:P ratio in wastewater. Journal of Microbiology and Biotechnology,23(1): 92—98
McQuoid M R, Nordberg K, 2003. The diatomParalia sulcataas an environmental indicator species in coastal sediments.Estuarine, Coastal and Shelf Science, 56(2): 339—354
Oh S J, Yamamoto T, Kataoka Yet al, 2002. Utilization of dissolved organic phosphorus by the two toxic dinoflagellates,Alexandrium tamarenseandGymnodinium catenatum(Dinophyceae). Fisheries Science, 68(2): 416—424
Ryther J H, Dunstan W M, 1971. Nitrogen, phosphorus, and eutrophication in the coastal marine environment. Science,171(3975): 1008—1013
Sañudo-Wilhelmy S A, 2006. Oceanography: A phosphate alternative. Nature, 439(7072): 25—26
Sañudo-Wilhelmy S A, Tovar-Sanchez A, Fu F Xet al,2004. The impact of surface-adsorbed phosphorus on phytoplankton Redfield stoichiometry. Nature, 432(7019): 897—901
Senft W H, 1978. Dependence of light-saturated rates of algal photosynthesis on intracellular concentrations of phosphorus.Limnology and Oceanography, 23(4): 709—718
Thingstad T F, Zweifel U L, Rassoulzadegan F, 1998. P limitation of heterotrophic bacteria and phytoplankton in the northwest Mediterranean. Limnology and Oceanography, 43(1): 88—94
Wang Z H, Liang Y, Kang W, 2011. Utilization of dissolved organic phosphorus by different groups of phytoplankton taxa. Harmful Algae, 12: 113—118
Wu J, Sunda W, Boyle E Aet al, 2000. Phosphate depletion in the western North Atlantic Ocean. Science, 289(5480): 759—762
Wynne D, 1977. Alterations in activity of phosphatases during thePeridiniumbloom in Lake Kinneret. Physiologia Plantarum, 40(3): 219—224
Xu S S, Song J M, Li X Get al, 2010. Changes in nitrogen and phosphorus and their effects on phytoplankton in the Bohai Sea. Chinese Journal of Oceanology and Limnology, 28(4):945—952
Zehr J P, Kudela R M, 2011. Nitrogen cycle of the open ocean:from genes to ecosystems. Annual Review of Marine Science, 3: 197—225
Zong Y Q, 1997. Implications ofParalia sulcataabundance in Scottish isolation basins. Diatom Research, 12(l): 125—150
