电解法制备微粒电解二氧化锰研究
2015-03-22陈海清牛莎莎王志兴蒋光辉
陈海清,牛莎莎,王志兴,蒋光辉
(1.湖南有色金属研究院,湖南长沙 410100;2.中南大学冶金科学与工程学院,湖南长沙 410083)
随着我国电池工业的迅速发展,作为其不可缺少的原料二氧化锰的需求不断增长,与之同时电解二氧化锰行业亦得到迅速发展[1,2]。电池工业使用的二氧化锰可分为四大类:天然矿,化学活性二氧化锰,电解二氧化锰,合成水化物,这四类二氧化锰,以电解二氧化锰品质为最佳[3]。
电解二氧化锰是制备锂离子电池正极材料锰酸锂重要的前驱体,同时是一种优良的电池去极化剂,因此电解二氧化锰成为电池工业的一种非常重要的原料[4]。目前,常用于生产二氧化锰的方法主要有化学法和电解法[5]。此外,还有新的方法:电位浸出法[6]、微生物浸取锰矿[7,8]、抗钝化钛合金阳极、加压高温电解法[9]。化学法虽具有产率高、纯度大的优点,但高温分解或酸碱处理过程中带来的有毒气体的排放以及生产过程的复杂性是人们所不能忽视的[10,11]。而电解二氧化锰在质量上具有优势,而且因为试验设备简单、操作安全、污染小、产品较纯净、易处理等诸多优点而受到更多人的重视[12,13]。电解二氧化锰均是γ型二氧化锰,具有高的电化学容量[14,15]。试验采用低温电解法制备微粒电解二氧化锰,产品不仅有比较高的纯度,而且避免了这些杂质元素溶于电池电解质溶液中而减少自放电及电池腐蚀漏液,而且微粒电解二氧化锰的制备不是MnO2沉积在电极上,而是呈微粒浆状悬浮于电解液中,省去破碎磨粉工序。
1 试验
1.1 微粒电解二氧化锰的阳极沉积机理
电解法制备微粒二氧化锰可能发生的阳极反应较为复杂,以MnSO4—H2SO4体系为电解液,通以大电流和低电压直流电进行电解,阳极上可能发生如下反应:

阴极反应:

微粒电解二氧化锰的形成过程主要分两步:阳极反应步骤和颗粒形成步骤。其中阳极反应步骤对颗粒形成步骤有很大的影响。在微粒电解二氧化锰制备的过程中,要控制电解条件使得阳极过程的主要反应为(2)。颗粒形成过程的主要反应为:

在(2)~(10)中生成的二氧化锰不溶于电解液,在溶液中直接结晶析出。所得到的颗粒即为微粒电解二氧化锰。
1.2 试验流程
试验流程如图1所示。

图1 微粒电解二氧化锰的制备流程
称取一定量的分析纯 MnSO4·H2O,置于烧杯中,加水溶解。用量筒称取一定量的分析纯浓硫酸,加入硫酸锰溶液中,最后用250 mL的容量瓶定容。电解槽为自制的有机玻璃电解槽,体积为600 mL,阳极采用铅银合金板,阴极采用不锈钢板。将电解液置于电解槽中,经电解一定时间之后,将阳极液过滤,用去离子水将产物洗涤2~3次,在一定的温度下将沉淀干燥。
1.3 材料的表征
取少量试样于砂纸抛光后的圆柱形铜棒上,用丙酮进行分散,吹干后装入 JEOL公司的 JSM-5600LV Scanning Electron Microscope观察其表面形貌特征,电子加速电压为20 kV。采用硫酸亚铁铵滴定法检测沉淀中的锰的含量,并计算电流效率。
2 结果与讨论
2.1 电流密度对微粒电解二氧化锰的影响
2.1.1 电流密度对槽电压及电流效率的影响
电流密度是微粒电解二氧化锰的一个非常重要的技术参数,它对于微粒电解二氧化锰的形貌、锰含量等有至关重要的影响。
试验采用0.8 mol/L硫酸锰及2.5 mol/L硫酸溶液作为电解液,在30℃下采用不同的电流密度电解120 min,之后将阳极液过滤,洗涤,干燥得微粒电解二氧化锰。槽电压、电流效率随电流密度变化曲线分别如图2、图3所示。

图2 槽电压随电流密度变化曲线

图3 电流效率随电流密度变化曲线
由图2、图3可知,在电解过程中,随着电流密度的升高,槽电压增大,当电流密度达35 A/dm2的时候,槽电压不再随电流密度的升高而变化。由此可知,在10~40 A/dm2电流密度范围内,电流效率随电流密度变化曲线可分为三部分:电流密度逐渐升至25 A/dm2时,电流效率快速升高;电流密度由25 A/dm2升高到30 A/dm2时,电流效率维持在较高位置,电流效率随着电流密度的升高降低的速率较小;但电流密度大于30 A/dm2时,电流效率随着电流密度的升高而快速减小,当电流密度过大时,溶液中可能发生了副反应,使得电流效率降低。
2.1.2 电流密度对微粒二氧化锰形貌的影响
试验产物样品的形貌如图4所示,试验所得到的二氧化锰颗粒为类球形颗粒。当电流密度升至30 A/dm2时,二氧化锰的粒径随电流密度的增大而增大;在10 A/dm2电流密度下颗粒的团聚现象较为严重,随着电流密度的增大,到30 A/dm2电流密度下,二氧化锰的颗粒近似于球形,形貌较好。当电流密度大于30 A/dm2时,随电流密度的增大,二氧化锰团聚现象增多,溶液中二氧化锰粒径的大小取决于四价锰离子过饱和度的大小,受电解过程中电流密度的影响。电流密度增大,阳极反应速率变快,Mn3+的歧化反应随之变快,生成Mn4+的速率越快,Mn4+水解过饱和度增大。形成的二氧化锰一次晶核数目增多,颗粒越小。但过饱和度过大,由于溶液中的一次晶核彼此聚合而导致颗粒粒度急剧增大。

图4 不同电流密度下的微粒电解二氧化锰的SEM图
2.2 电解温度对电解二氧化锰的影响
2.2.1 电解温度对槽电压及电流效率的影响
电解温度是微粒电解二氧化锰生产中控制的一个参数,对槽电压、电流效率、晶体的形成过程会产生一定的影响。本试验采用0.8 mol/L硫酸锰及2.5 mol/L硫酸溶液作为电解液,在不同电解温度下控制电流密度为30 A/dm2,电解120 min,电解所得到的沉积物,经过滤,洗涤,干燥后得到微粒电解二氧化锰。槽电压、电流效率随温度变化曲线分别如图5、图6所示。
由图5可以看出,随着电解温度的升高,槽电压随之降低。这是由于一方面随着电解温度的升高,溶液中的离子的运动速率加快,电解液的导电性增强,电解过程中的槽电压降低。另一方面,随着电解温度的升高,阳极的极化减小,导致阳极电位降低,槽电压随之降低。
由图6可以看出,随着电解温度的升高,电流效率下降。在试验中发现,随着温度的升高,阳极上放出气泡的速度越来越快,表明阳极的析氧反应越来越剧烈。电解液的颜色越来越深,可能有副反应发生,而且随着温度的升高,溶液中的Mn3+迁移到阴极上放电还原成Mn2+的副反应也有可能发生,导致电流效率降低。
2.2.2 温度对微粒二氧化锰形貌的影响
试验产物样品的形貌如图7所示,随着电解温度的升高,电解二氧化锰的平均粒径逐渐减小。电解温度的升高,原子迁移加剧,有利于Mn3+岐化反应向正向进行,加快Mn3+岐化反应速率。当温度升高,溶液中的Mn4+浓度升高,其过饱和度增大,提高成核速率,但是由于温度的升高,物质的溶解度也随之增加,从而不利于成核。同时温度的升高,使得阳极析氧反应加剧,由于气泡的扰动,使得二氧化锰的晶粒长大受阻。因此,在一定温度范围内,随着电解温度的升高,二氧化锰的粒径减小。
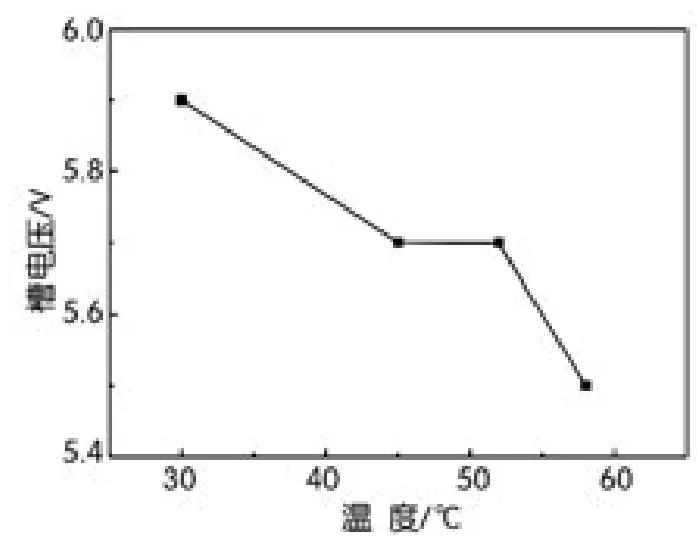
图5 槽电压随电解温度变化曲线

图6 电流效率随电解温度变化的曲线

图7 不同温度下的SEM图
2.3 硫酸浓度对电解二氧化锰的影响
2.3.1 硫酸浓度对槽电压和电流效率的影响
试验在30℃下,控制电流密度为30 A/dm2,电解120 min,电解所得到的产物过滤,洗涤,干燥。槽电压、电流效率随硫酸浓度变化曲线分别如图8、图9所示。

图8 槽电压随硫酸浓度变化曲线
由图8、图9可知,随着硫酸浓度的增加,槽电压逐渐降低。在其它条件相同时,硫酸浓度越大,电解液中的导电离子越多,电解液的导电性增强,槽电压降低。氢离子浓度的增大会使阴极极化减小,槽电压也会下降。硫酸浓度增大,电流效率提高。可见硫酸根浓度增大,对阳极反应起着有利作用。
2.3.2 硫酸浓度对微粒二氧化锰形貌的影响
试验产物样品的形貌如图10所示,在1.5 mol/L H2SO4浓度下颗粒的团聚现象较为严重,随着硫酸浓度的增大,到3 mol/L H2SO4浓度下,二氧化锰的颗粒近似于球形,形貌较好。

图10 不同硫酸浓度下的颗粒电解二氧化锰SEM图
2.4 锰含量分析
微粒电解二氧化锰中的锰含量见表1。二氧化锰中理论锰含量为63.22%,由表1可知,样品中锰含量与电解条件没有明显的线性关系。因为样品中含有一些水,所以检测的锰的含量较理论值偏低。
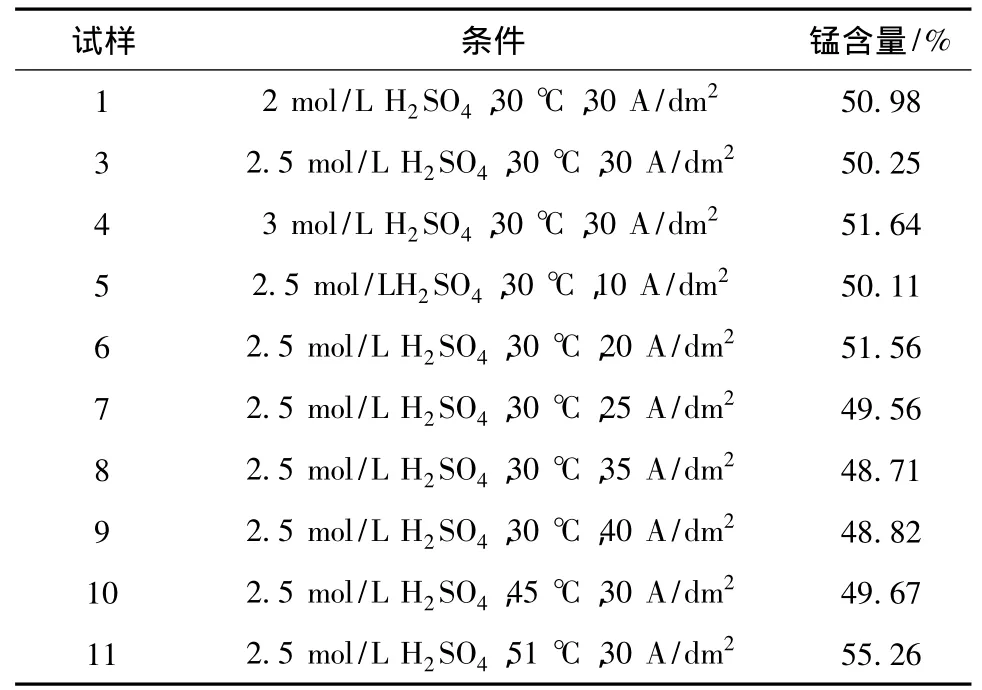
表1 微粒电解二氧化锰中锰含量分析
3 结论
1.用电解法制备所得微粒二氧化锰为类球形颗粒二氧化锰,颗粒小且均匀。采用电解法制备微粒二氧化锰可行。
2.系统地考察了电流密度、电解温度、硫酸浓度等条件对槽电压、电流效率、电解产物的组成及形貌的影响。结果表明,制备微粒电解二氧化锰的优化条件为:电流密度30 A/dm2,电解温度30℃,电解液成分:硫酸锰浓度0.8 mol/L,硫酸浓度2.5 mol/L。在此条件下所得粉末二氧化锰的电流效率为47%,且粉末二氧化锰的形貌较好。
[1] 谭柱中.中国电解金属锰工业现状[J].中国锰业,2005,23(2):5-6.
[2] 谭柱中,梅光贵.锰冶金学[M].长沙:中南大学出版社,2004.
[3] 钱伟文.我国电解二氧化锰工业的现状与展望[J].电池工业,2010,7(3):176 -178.
[4] 周柳霞.电池用二氧化锰的生产方法与研究进展[J].中国锰业,2010,28(3):1 -7.
[5] 马志成.在电解二氧化锰生产中去除硫酸锰溶液中As、Sb、Mo等离子的方法[J]. 中国锰业,2003,(4):43-52.
[6] Elsherief A.E..A study of the electroleaching of manganese ore[J].Hydrometallurgy,2000,55(3):311 -326.
[7] ACHARYA C.,KAR R.N..Studies on reaction mechanism of bioleaching of manganese ore[J].Minerals Engineering,2003,16(10):1 027-1 030.
[8] XIN Bao-ping,CHEN Bing,DUANB Ning,et al.Extraction of manganese from electrolytic manganese residue by bioleaching[J].Bioresource Technology,2011,102:1 683 -1 687.
[9] 李同庆.电解二氧化锰生产技术的新进展[J].电池工业,2007,(3):178 -180.
[10] Pagnanelli F,Sambenedetto C.,Furlani G.,et al.Preparation and characterisation of chemical manganese dioxide:effect of the operating conditions[J].Journal of Power Sources.2007,166:567 - 577.
[11] ZHANG W,CHENG C.Y..Manganese metallurgy,recovery and control——a literature review.Part I:Manganese metallurgy[J].CSIRO Minerals,2006,DMR -2809.
[12] ZHANG Wen-sheng,CHENG Chu-yong.Manganese metallurgy review.Part I:Leaching of ores/secondarymaterials and recovery of electrolytic/chemical manganese dioxide[J].Hydrometallurgy,2007,(89):137 -159.
[13] ZHANG Wen-sheng,CHENG Chu-yong.Manganese metallurgy review.Part II:Manganese separation and recovery from solution[J].Hydrometallurgy,2007,(89):160 -177.
[14]张莹,刘开宇,张伟,等.纳米二氧化锰的电化学电容性能[J].中南大学学报(自然科学版),2008,39(3):469-473.
[15] R.R.Maphanga,S.C.Parker,P.E.Ngoepe.Atomistic simulation of the surface structure of electrolytic manganese dioxide[J].Surface Science,2009,(603):3 184 -3 190.
