血清IMA联合血浆D-二聚体对比螺旋CT对肺栓塞患者的诊断指导意义
2015-03-22黄国华
黄国华
(广东省佛山市高明区人民医院呼吸内科,广东佛山 528500)
肺栓塞(PE)是一类严重威胁人类健康的疾病,是呼吸循环功能障碍的病理生理综合征,主要原因是来自全身的栓子阻塞肺动脉系统引起。其早期临床表现非特异,检查指标指向性差,病死率及误诊率极高。目前诊断PE的最主要的血液学指标为D-二聚体,其敏感性较强,但特异性较差。为了提高诊断PE的敏感性及特异性,更好评估其预后,寻找特异性更佳,或联合诊断能起到互补作用的标志物是非常必要的。通过文献及理论探讨,我们发现缺血修饰蛋白(IMA)是潜在的有效标志物。因此我们研究了可疑PE患者中IMA及D-二聚体的变化,并对照CT肺动脉造影CTPA结果,对结果进行统计学分析,探讨IMA及D-二聚体对PE诊断的价值,为PE的诊断和危险分层提供新的参考依据。
1 资料与方法
1.1 临床资料 选择(2008年1月至2014年6月)期间我院呼吸科56例疑似PE患者。患者临床表现有:呼吸困难、胸痛、咯血、下肢肿胀或深静脉血栓病史。其中男性24例,女性32例,诊断依据为2010年版《急性肺血栓栓塞症诊断治疗中国专家共识》[1]。所有疑似患者均行CTPA检查,明确诊断30例,年龄(65.13±15.94)岁;造影检查排除肺栓塞,但有急性心梗、冠脉支架植入术、肿瘤及慢性阻塞性肺疾病(COPD)病史患者26例作为非PE组,年龄(70.65±12.78)岁;同时选择30例健康人设为对照组,男性12例,女性18例,年龄(60.23±10.17)岁。各组在年龄、性别、身高、体重方面均无显著性差异(P >0.05)。
1.2 方法 所有疑似PE患者及对照组健康者入院后即抽血检验IMA、D-二聚体,并与30 min内送检。同时记录所有入选者年龄、性别,对疑似PE患者组记录生命体征、发病情况,完善心电图、心肌损伤标志物、超声心动图、血常规、生化功能,并行CTPA检查。
根据检查结果,将疑似患者分为PE组及非PE组。根据美国心脏协会指南,依据以下三方面进行进行评价,将确诊的PE患者进行危险分层(表1),分为高危,中危,低危3个亚组[2]:(1)血流动力学是否稳定;(2)右心室功能不全征象是否存在;(3)心肌有无损伤。其中,高危组:大面积肺栓塞组,急性肺栓塞伴有持续低血压或心源性休克(收缩压<90 mmHg或较基础血压下降幅度≥40 mmHg,持续15 min以上,排除其他原因(心律失常、低血容量、败血症、左室功能不全等)引起血压下降因素;中危组:次大面积肺栓塞组,急性肺栓塞不伴有血流动力障碍(收缩压≥90 mmHg),但合并右心功能不全或心肌损伤(有心脏超声、心电图、BNP/NT-proBNP、cTnI/cTnT异常改变);低危组:血流动力学稳定,血压正常,心肌标志物和右室功能正常。

表1 PE患者危险分层
1.3 仪器和试剂 MA检测:采用白蛋白-钴离子结合原理测量IMA值。D-二聚体测定:采用免疫比浊法,分别使用OlympusAU 5400全自动分析仪及ACL TOP全自动凝血分析仪检测,根据配套试剂盒的参数表设置参数。螺旋CT采用西门子公司生产16排螺旋CT机,碘海醇造影剂造影,扫描结束进行三维图像重建。
1.4 统计学方法 采用SPSS 17.0统计软件,定量数据以(x±s)表示,各组间对比采用t检验,若数据不符合正态分布,则采用非参数检验。通过ROC曲线取得诊断PE的最佳cut-off值。P<0.05判定差异有统计学意义。
2 结果
2.1 IMA、D-二聚体测定结果 186例受测人员被分为3组,分别为PE组、非PE组及对照组,3组间年龄无差别。PE组IMA、D-二聚体值与非PE组及对照组均有统计学差异(表2)。

图1 IMA检测PE的ROC曲线
2.2 联合IMA与D-二聚体诊断肺栓塞敏感性、特异性、阳性预测值、阴性预测值 (1)IMA:ROC曲线下面积为0.815,SD 0.054,95%CI 0.733 ~0.936,cut-off值为62.8 U·mL-1,诊断 PE 的敏感性86.3%,特异性81.5%。
(2)D-二聚体:ROC曲线下面积为0.876,SD 0.048,95%CI 0.782 ~0.959,cut-off值为 1.52 U·mL-1,诊断 PE 的敏感性93.8%,特异性65.6%。
(3)联合IMA及D-二聚体诊断PE,敏感性96.5%,特异性91.2%(表3)。
2.3 各亚组比较 高危及中危组的IMA及D-二聚体值相比低危组明显增高。但高危组及中危组间的比较虽有数值上的升高,但无统计学差异(表4)。
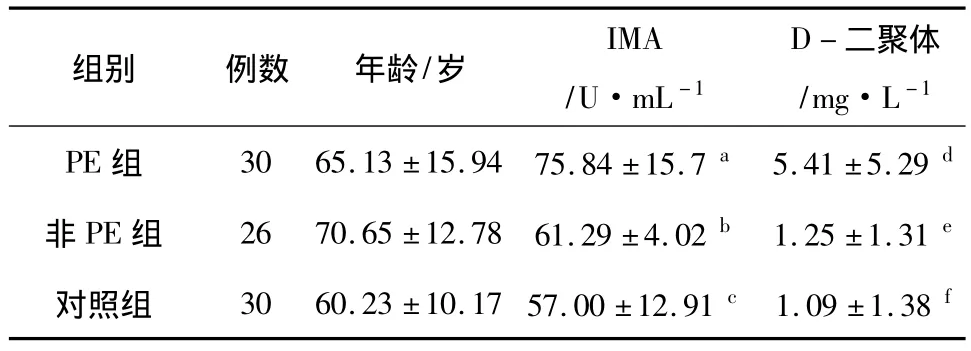
表2 各组患者年龄、IMA值及D-二聚体值

图2 D-二聚体检测PE的ROC曲线

表3 IMA、D-二聚体单独及联合诊断肺栓塞敏感性、特异性、阳性预测值及阴性预测值

表4 PE患者高危、中危、低危组IMA、D-二聚体值
2.4 对比螺旋CT肺动脉造影结果 30例确诊PE患者中,IMA结果正常者3例,D-二聚体结果正常者2例,需要注意的是,IMA及D-二聚体均升高者27例均通过CTPA确诊PE;26例非PE患者中,IMA升高者1例,D-二聚体升高者1例;健康对照组IMA及D-二聚体均正常。
3 讨论
肺栓塞可由多种栓子阻塞肺动脉系统引起肺呼吸循环障碍,从而产生一系列临床综合征。最常见的是血栓性肺栓塞。肺栓塞诊断困难,误诊漏诊率高[3],其典型三联征为:胸痛、咯血、呼吸困难。临床上容易和急性冠脉综合征、气胸、肺炎等疾病混淆。我国目前发病率在1‰[4],只有不足10%的患者得到及时正确的诊断和治疗[5]。多数患者表现为亚急性和慢性病变,临床症状可能仅仅是胸闷,只有大面积栓塞者可出现严重症状,如晕厥、急性肺源性心脏病,右心功能不全,休克甚至死亡。临床症状多与缺氧及肺动脉高压导致的血流动力学不稳定相关。据统计,PE患者未经诊治的死亡率高达30%[6]。经过充分治疗,病死率可降至8%以下[7]。肺栓塞的患者多存在诱因或其他病史,如下肢静脉血栓形成、慢性心肺疾病、手术、创伤、久卧久坐、恶性肿瘤、肥胖等。其中,下肢静脉血栓被认为是肺栓塞的首要诱因,但研究发现,COPD患者与下肢静脉血栓患者发生急性肺栓塞的风险相似[8]。多数指南均认为对有危险因素存在的患者,一旦出现无法解释的胸闷、呼吸困难、胸痛、咯血、晕厥等症状时要考虑肺栓塞的可能,应尽快进行影像学诊断,如:胸片、CT、CTPA、肺血管造影。其中CTPA诊断PE迅速准确,已取代有创造影成为诊断PE的金标准。在确诊PE患者时,我们采用了16排螺旋CTPA。CTPA有一定的局限性,比如对于造影剂过敏患者及肾功能损害患者,应避免使用造影术诊断。但CTPA仍是目前诊断PE的最佳手段,其特异性及敏感性高,但也受到栓子大小、所在部位[9]及成像软件[10]的影响,不在本文的探讨范围中,不做详述。本研究结果显示IMA及D-二聚体是非常重要的PE排查指标。
D-二聚体是反映体内高凝状态和继发性纤溶亢进的标志物[11]。机体内存在血栓,会激活纤溶过程,导致D-二聚体含量增高。肿瘤、炎症、创伤、手术等均可导致血栓形成。因此D-二聚体敏感性高而特异性差。虽然影响因素较多,但目前仍是诊断血栓性疾病的重要实验室指标,其在纤溶早期即可被检测出来,是肺栓塞发生发展的病理基础[12]。通常认为,若<0.5 mg·L-1,有排除急性肺栓塞的意义。低危患者的D-二聚体<0.5 mg·L-1,则发生PE的概率不足1%;对于高危患者,即使D-二聚体<0.5 mg·L-1,仍需要其他检查[13]。文献报道,D -二聚体对诊断肺栓塞的敏感性、特异性分别可达85.8%、42.5%[14]。另外,D - 二聚体对于 PE 的复发[15]、预后及危险分层也有重要意义[16]。
IMA是血清白蛋白在缺血再灌注后自由基修饰形成的一种非特异性缺血标志物,由肝实质细胞合成。在生理情况下,该区域是过渡金属(钴、镍、铜)的结合位点。组织缺血或再灌注发生时,酸中毒,组织局部氧化产物增加,细胞膜上离子泵破坏等一系列变化导致白蛋白的结构改变,与过渡金属结合力减弱,形成缺血修饰白蛋白(IMA),可作为PE排除性指标。IMA与临床评分结合时,阳性预测值比D-二聚体高,但阴性预测值和敏感性与D-二聚体相似[17]。
ROC曲线分析结果显示,IMA联合D-二聚体诊断PE时,阳性或阴性预测值比单独诊断时要增高,这对提高PE早期诊断与治疗具有重要意义。PE患者IMA显著增高,与D-二聚体联合可提高诊断PE敏感性及特异性。
危险分层对指导溶栓的治疗至关重要,高危组死亡率可达11%[18]。根据欧美心脏病协会的PE诊治指南,对PE患者进行分层,对高危患者早期溶栓治疗可降低死亡率[19]。低危患者无需溶栓。而中危患者溶栓治疗则未达成共识,需要对其疾病发展倾向及病情做出客观评价,以明确患者是否能在溶栓治疗中获益。
本研究结果显示PE患者与非PE患者比较,IMA及D-二聚体水平要明显升高,差异有统计学意义,提示了IMA及D-二聚体对于诊断PE的作用。同时我们发现,D-二聚体对PE诊断的敏感性和阴性预测值较高,但特异性和阳性预测值相对较低。分析原因可能与多种疾病均有使D-二聚体升高作用相关。而IMA诊断PE的特异性要高于D-二聚体,不管其阳性预测值还是阴性预测值,均要优于D-二聚体。而本研究针对亚组的分析显示,高危及中危组患者的IMA及D-二聚体值比低危组明显增高,这意味着检测指标越高,患者的风险越高,更应该积极溶栓。但高危组及中危组间的比较虽有数值上的升高,但无统计学差异。基于此,我们建议中危组患者治疗应更加积极,避免不必要的不良事件发生,但还需要更多的临床试验来印证此观点。通过对比CTPA结果,发现联合IMA及D-二聚体筛查的PE患者,CTPA均检出肺栓塞征象,而单独运用IMA或D-二聚体检测者,阳性率则有大幅度的降低,这可能与本研究纳入的标本较少有关。
综上所述,PE患者中,IMA、D-二聚体水平越高,患者的危险分层越高,病情越重。对于可疑的PE患者,联合检查IMA、D-二聚体有助于急性PE的的诊断,提高早期PE的诊断率,减少不必要的检查。
[1] 中华医学会心血管病学分会肺血管病学组,中国医师协会心血管内科医师分会.急性肺血栓栓塞症诊断治疗中国专家共识[J].中华内科杂志,2010,49(1):74 -81.
[2] Jaff MR,Mc Murtry MS,Archer SL,et al.Management of massive and submassive pulmonary embolism,iliofemoral deep vein thrombosis,and chronic thromboembolic pulmonary hypertension A scientific statement from the American Heart Association[J].Circulation,2011,123(16):1788 -1830.
[3] Alonso - Martinez JL,Sanchez FJ,et al.Delay and misdiagnosis in sub-massive and non-massive acute pulmonary embolism[J].European Journal of Internal Medicine,2010,21(4):278 -282.
[4] Yang Y,Liang L,Zhai Z,et al.Investigators for National Cooperative Project for Prevention and Treatment of PTE -DVT.Pulmonary embolism incidence and fatality trends in chinese hospitals from 1997 to 2008:a multi center registration study[J].PLoS One,2011,6(11):e26861.
[5] Gong DY,Liu XF,Huang FJ.Clinical feature analysis of fatal pulmonary thromboembolism:experiences from 41 autopsy-confirmed cases[J].European Review for Medical and Pharmacological Sciences,2013,17(5):701 -706.
[6] Nikolaou K,Thieme S,Sommer W,et al.Diagnosing pulmonary embolism:new computed tomography applications[J].J Thorac Imaging,2010,25(2):151 -160.
[7] 宋浩明,王乐民.肺栓塞治疗的进展[J].心脏杂志,2010,22(2):296-298.
[8] 何平,王 昶,马如华.COPD和 DVT患者发生急性肺栓塞早期诊断的研究[J].海南医学,2007,18(8):25 -26.
[9] 洪建斌,顾浩玉.16层螺旋CT肺动脉造影诊断肺栓塞的价值[J].海南医学,2014,25(5):676 -678.
[10]朱建国,郭 亮.双源CT软件对肺栓塞诊断的应用[J].放射学实践,2014,29(10):1167 -1172.
[11]王榕生.肺栓塞患者血浆D-二聚体检测结果分析[J].中国实用医药,2009,4(4):100 -101.
[12]田玉玲,雷力民,黄 伟.肺栓塞患者纤维蛋白原与D-二聚体测定的临床价值[J].广西中医药大学学报,2012,15(4):2.
[13] Den Exter PL,Klok FA,Huisman MV.Diagnosis of pulmonary embolism:Advances and pitfalls[J].Best Pract Res Clin Haematol,2012,25(3):295 -302.
[14]王 雯,刘志娟.血浆D-二聚体结合纤维蛋白原测定诊断肺栓塞的临床意义分析[J].中国医药指南,2013,11(31):55 -56.
[15] Poli D,Cenci C,Antonucci E,et al.Risk of recurrence in patients with pulmonary embolism:Predictive role of D-dimer and of residual perfusion defects on lung scintigraphy[J].Thromb Haemost,2012,29(2):109.
[16] Becattini C,Lignani A,Masotti L,et al.D -dimer for risk stratification in patients with acute pulmonary embolism[J].J Thromb Thrombolysis,2012,33(1):48 -57.
[17] Turedi S,Gunduz A,Mentese A,et al.The value of ischemia-modified album in compared with d-dimer in the diagnosis of pulmonary embolism[J].Respir Res,2008,9:49.
[18] Moores L,Zamarro C,Gomez V,et al.Changes in PESI scores predict mortality in intermediate-risk patients with acute pulmonary embolism[J].European Respiratory Journal,2013,41(2):354 -359.
[19] Cao Y,Zhao H,Gao W,et al.Systematic review and meta - analysis for thrombolysis treatment in patients with acute submissive pulmonary embolism[J].Patient Preference and Adherence,2014,8:943-948.
