临床相关剂量参附注射液预处理和后处理对大鼠肠缺血再灌注致急性肺损伤的影响
2015-03-22刘志刚刘永芳谢恒涛
刘志刚,刘永芳,胡 刚,谢恒涛
(武汉大学人民医院麻醉科,湖北武汉 430060)
胃肠道参与休克及多器官功能不全综合征(MODS)的病理生理过程,肠缺血再灌注期间胃肠道及远隔脏器损伤的保护是临床多学科研究的热点。其中以急性肺损伤引起的急性呼吸窘迫综合症尤为突出[1-3]。参附注射液 (shenfu injection,SFI)已应用于休克和多器官功能不全综合征的防治,尤其是胃肠道和肺损伤的保护,近年研究发现参附注射液可改善油酸所致的急性呼吸窘迫综合征(ARDS)的血流动力学、肺及血液的氧合功能,对肺损伤具有一定的保护和治疗作用[4-6]。本研究探讨临床相关等效剂量参附注射液预处理和后处理对肠缺血再灌注损伤所致的急性肺损伤的影响。
1 材料与方法
1.1 药品和试剂 参附注射液购自吉林卓怡康纳制药有限公司,每支60 mg,批号050301;氯化高铁血红素(Hemin),Sigma公司;兔抗人HO-1多克隆抗体,武汉博士德生物工程公司;免疫组化SABC、SOD、MDA试剂盒(Santa Cruz公司)。
1.2 动物 健康雄性Wistar大鼠56只,体重200~260 g,由武汉大学医学院实验动物中心提供(动物许可证号:00012298)。随机分成7组(n=8),即对照组(C组)、缺血再灌注组(I/R组)、参附注射液预处理组(SFPR组)、参附注射液后处理组(SFPO组)、血晶素组(Hemin组)、锌原卟啉IX+SFPR组(ZnPPIX+SFPR组)、锌原卟啉IX+SFPO组。
1.3 方法 实验前12 h禁食,自由饮水。称重,10%水合氯醛4 mg·kg-1腹腔麻醉后固定。参照Koji Ito等[7]的方法复制肠I/R模型,腹部正中脱毛,消毒铺巾,正中切口进腹,分离肠系膜上动脉,在其根部用一个套硅胶管小动脉夹钳夹,观察2 min,确定肠系膜上动脉血流被阻断后,肠壁苍白,血管无搏动,缝合伤口。1 h后经原切口进腹,松开动脉夹,恢复血供。整个手术过程中,于腹腔内滴加温热37℃生理盐水维持体内内环境平衡。对照组同样开腹,但不钳夹血管,仅轻扰腹腔后关腹。各组动物于再灌注2 h后颈动脉放血处死。
1.4 观察指标与方法
1.4.1 SABC免疫组化方法检测HO-1蛋白表达 采用免疫组化染色,以肺组织切片细胞胞浆中出现棕黄色颗粒状沉淀物为阳性细胞。采用HIPAS-2000型全自动图像分析系统,对HO-1的蛋白表达进行半定量分析,在显微镜下对阳性染色进行分析,测定HO-1平均吸光度(OD),随机测定5个高倍视野后计算其平均值。
1.4.2 血气分析测定 大鼠处死前右颈动脉采血1 mL抗凝行血气分析。按要求将血液填充到与i-STAT血气分析仪配套的血气分析测试片加样池中,避免气泡产生,将测试片插入自动血气分析仪,读取PaO2和PaCO2数值。
1.4.3 肺通透性指数测定 支气管肺泡灌洗液(BALF)中蛋白浓度与血清中蛋白浓度之比,即为肺通透性指数,指数增大说明肺毛细血管通透性增加,它是评价肺损伤的指标[8]。
采用考马斯亮兰蛋白测定法测支气管肺泡灌洗液中蛋白含量。
1.4.4 肺组织 MDA、SOD含量测定 取右肺中叶100 mg(湿重),以硫代巴比妥酸法测MDA,以黄嘌呤氧化酶法测SOD。
1.4.5 分析天平测量肺组织湿/干重比(wet weight to dry weight ratio,W/D) 取左肺部分组织,滤纸吸干表面附着水分,用分析天平准确测量湿重并记录,于80℃恒温箱烤24 h至肺干重恒定,称干重,计算W/D。
1.5 统计学分析 实验数据以(x±s)示,采用SPSS13.0软件进行分析,采用单因素方差分析,两两比较用q检验,P<0.05为差异有统计学意义。
2 结果
2.1 参附注射液对肺组织HO-1表达的影响 与C组比较,I/R组、SFPR组、SFPO组和Heim组肺组织HO-1细胞阳性表达增高;与I/R组比较,SFPR组、SFPO组和Heim组肺组织HO-1细胞阳性表达增高;ZnPPIX+SFPR组和ZnPPIX+SFPO组上述阳性细胞表达降低(P<0.05)。见表1。
2.2 参附注射液对肺通透性指数和肺组织MDA、SOD含量的影响 I/R组肺通透性指数与肺组织MDA含量明显高于C组,而SOD含量显著降低(P<0.05);与I/R组比较,SFPR组、SFPO组和Heim组肺通透性指数、肺组织MDA含量均显著降低,SOD 值明显升高(P <0.05或 P <0.01),ZnPPIX+SFPR组和ZnPPIX+SFPO组与I/R组比较差异无统计学意义(P>0.05)。见表1。
2.3 参附注射液对大鼠肺组织湿/干重比的影响与C组相比,I/R组肺组织湿/干重比增高50%(P<0.05),SFPR组、SFPO组和Heim组较I/R组分别降低17.4%、13.4% 和 18.6%(P < 0.05),但仍高于 C组(P<0.05);ZnPPIX+SFPR组和 Zn-PPIX+SFPO组与I/R组比较差异无统计学意义(P>0.05)。见表2。
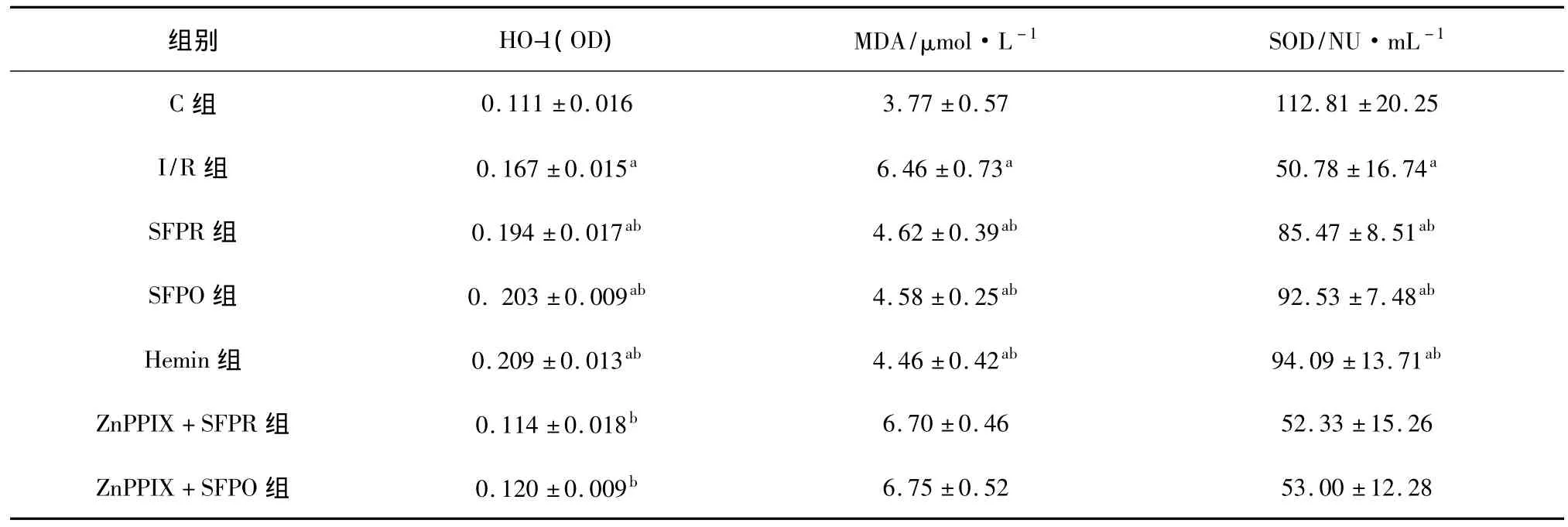
表1 参附注射液对肺组织HO-1(OD)和MDA、SOD含量表达的影响(x ± s,n=8)
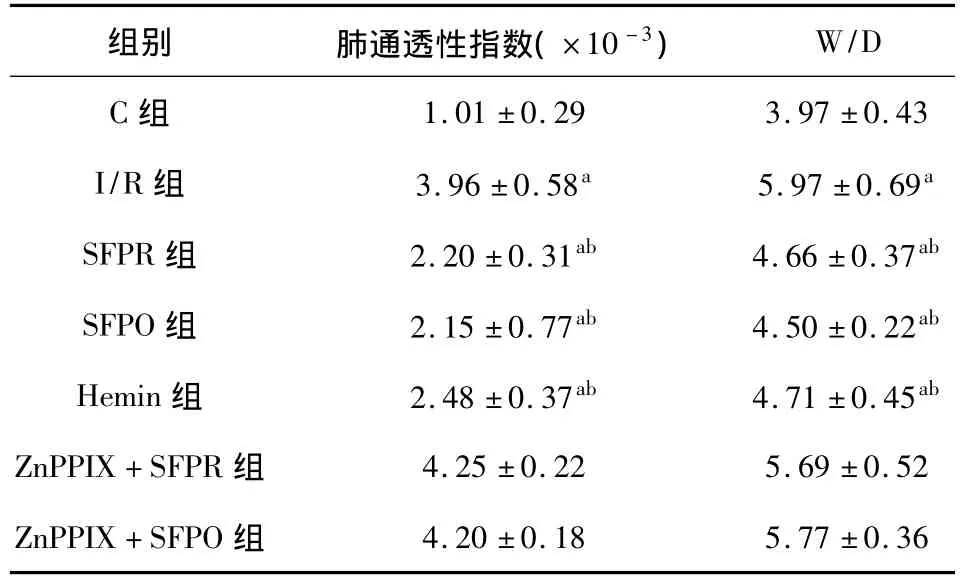
表2 参附注射液对肺通透性指数和肺组织湿/干重比的影响(x ± s,n=8)
2.4 参附注射液对动脉血气的影响 各组动物动脉血pH值相近,无显著统计学意义。大鼠缺血再灌注后,PaO2、PaCO2较 C 组显著下降(P <0.05)。SFPR组、SFPO组和Heim组PaO2、PaCO2明显高于I/R组,ZnPPIX+SFPR组和ZnPPIX+SFPO组与I/R组比较差异无统计学意义(P>0.05)。见表3。
3 讨论
肠缺血/再灌注损伤是临床上一种很常见且非常重要的临床现象,研究表明,肠缺血再灌注损伤不仅加重肠道损伤,而且造成肠外多种器官损伤,如肺、心、肾、肝功能受损,甚至出现多脏器功能障碍综合征(MODS)。肺脏是最易受损的器官,急性肺损伤(ALI)是MODS发展中出现最早、发生率最高的临床症状,严重时可发展成急性呼吸窘迫综合征(ARDS)[9-10]。所以肠缺血再灌注引起的急性肺损伤倍受关注。
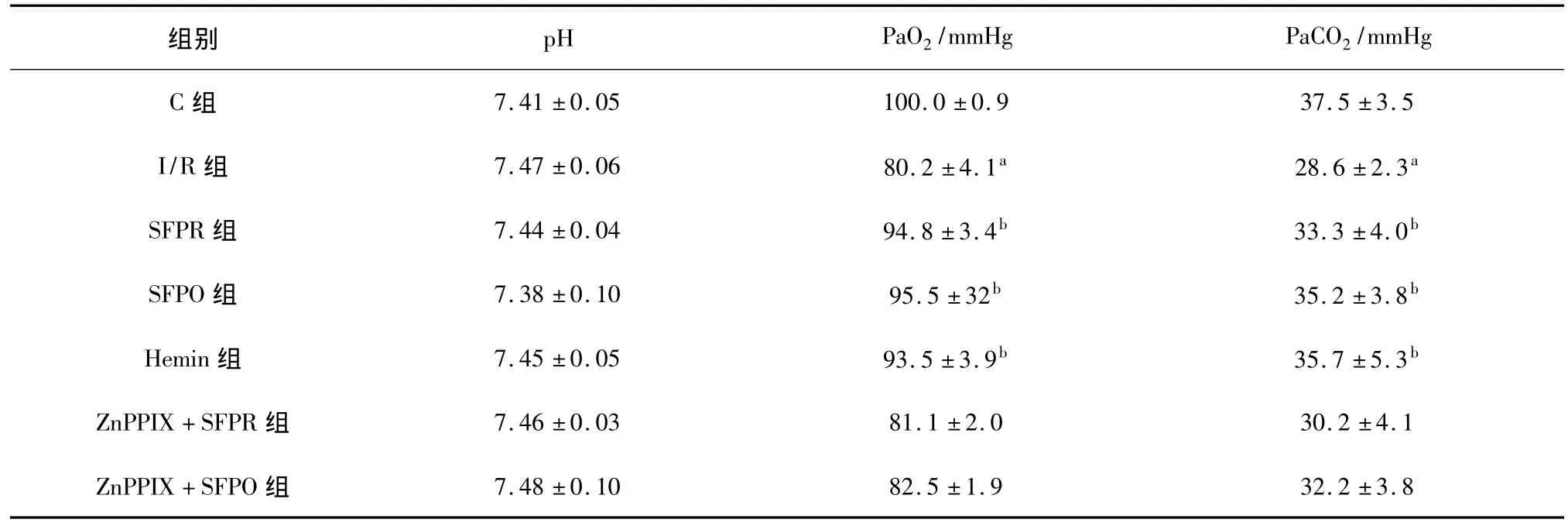
表3 各组大鼠动脉血气分析比较(x ± s,n=8)
本实验证实了大鼠肠缺血1 h再灌注2 h可引起典型的急性肺损伤病理表现。文献报道[11-13],肠缺血再灌注后,氧自由基造成的损害可能为重要的病理机制,并在肠缺血再灌注后的肺损伤中起重要作用;本研究的结果与之一致,肠缺血再灌注后,肺组织中SOD活性明显降低,MDA含量显著增高,与对照组相比差异非常显著,提示肠缺血再灌注后产生的氧自由基对肺血管内皮和肺泡细胞膜产生了明显损伤。
参附注射液作为一种传统的中药,具有稳定的强心升压作用,改善微循环,防治脏器缺血—再灌注损伤,主要应用于创伤、休克及危重病患者的急救;參附采用10 mL·kg-1是根据临床使用后换算而来的相关剂量[14-15]。
本研究发现:缺血再灌注组肺内组织HO-1表达增加,肺组织中SOD活性明显降低,MDA含量明显升高,氧和指数显著降低,肺组织出现典型的病理特征;当预防性的给予临床相关剂量的参附注射液和腹腔注射血红素加氧酶的诱导剂血晶素(Hemin)时,肺内 HO-1表达均明显增强,肺组织中MDA含量相应降低,而SOD活性显著增高,肺氧和指数明显改善。组织病理学改变减轻:肺组织病理变化在参附注射液预防组仅见部分肺泡及血管壁周围淋巴细胞浸润,损伤程度较缺血再灌注组明显减轻。结果表明预防性应用临床相关剂量的参附注射液对肠缺血再灌注导致的急性肺损伤有明显的保护作用,当腹腔注射血红素加氧酶的抑制剂锌原卟啉IX(ZnPPIX)时,尽管在缺血前预防性的给予临床相关剂量的参附注射液,但各项指标与I/R组差异无统计学意义(P>0.05),其保护作用不再呈现。提示SFI预处理对IIR肺损伤的保护作用可能与诱导HO-1的肺内高表达有关。
本研究还发现:当治疗性的给予临床相关剂量的参附注射液和腹腔注射血红素加氧酶的诱导剂血晶素(Hemin)时,肺内HO-1表达明显增强,肺组织中MDA含量相应降低,而SOD活性显著增高,肺氧合指数明显改善。组织病理学改变减轻,结果表明治疗性应用临床相关剂量的参附注射液对肠缺血再灌注导致的急性肺损伤也有明显的保护作用,当腹腔注射血红素加氧酶的抑制剂锌原卟啉IX(ZnPPIX)时,尽管在再灌注前治疗性的给予临床相关剂量的参附注射液,但各项指标与I/R组差异无统计学意义(P>0.05),其保护作用不再呈现。提示SFI后处理对IIR肺损伤的保护作用也可能与诱导HO-1的肺内高表达有关。
因此,临床相关剂量的参附注射液预处理和后处理均减轻了肺组织的病理损伤,从而改善肺功能,提高机体氧输送能力,改善机体缺氧状态,有着广阔的临床应用前景和实用价值。其共同机制可能与上调HO-1蛋白表达、一定程度上抑制脂质过氧化、拮抗氧自由基的损伤有关,但其保护作用的确切机制尚需进一步研究。
[1] 郭海峰,岳 辉,李铁灵.p38MAPK抑制剂对重症胰腺炎大鼠急性肺损伤的保护作用[J].安徽医药,2014,18(6):1034-1037.
[2] 司瑞超,蔡春玲,任原贞.肺与大肠相表里理论在治疗咳嗽中的应用[J].河南中医,2014,34(11):2244.
[3] Guan YF,Pritts TA,Montrose MH.Ischemic post-conditioning to counteract intestinal ischemia/reperfusion injury[J].World JGastrointest Pathophysiol,2010,1(4):137 - 143.
[3] 吉其舰,燕宪亮,赵宁军,等.黄芩苷预处理对脂多糖诱导的小鼠急性肺损伤的保护作用[J].中国现代医药,2014,16(9):31-34.
[4] 石亮亮,刘明东,朱 浩,等.丹参酮IIA磺酸钠对急性坏死性胰腺炎大鼠肺损伤的抗炎作用及其机制研究[J].胃肠病学,2014,19(6):332 -335.
[5] 刘华琴,邢玉英,全 彤,等.丙泊酚复合乌司他丁对大鼠肠缺血再灌注致急性肺损伤的影响[J].中国老年学,2010,30(5):1376-1378.
[6] Park YY.Ischemia/reperfusion Lung Injury Increases Serum Ferritin and Heme Oxygenase - 1 in Rats[J].Korean JPhysiol Pharmacol,2009,13(3):181 -187.
[7] Ito K,Ozasa H,Kojima N,et al.Pharmacological preconditioning protects lung injury induced by intestinal ischemial/reperfusion in rat[J].Shock,2003,19(5):462 -468.
[8] 刘 东,汪惠文,耿智隆,等.血红素氧合酶-1在远隔肢体缺血预处理减轻兔肺缺血再灌注损伤中的作用[J].中华麻醉学,2014,34(2):219 -222.
[9] Namba F,Go H,Murphy JA,et al.Expression level and subcellular localization of heme oxygenase-1 modulates its cytoprotective properties in response to lung injury:a mouse model[J].PLoS One,2014,9(3):51 -57.
[10] Santos CH,Gomes OM,Pontes JC,et al.The ischemic preconditioning and postconditioning effect on the intestinal mucosa of rats undergoing mesenteric ischemia/reperfusion procedure[J].Acta Cir Bras,2008,23(1):22 -28.
[11]成国哲,吴晓本,刘景磊,等.姜黄素对大鼠移植肝缺血再灌注损伤指标血红素氧合酶-1表达的影响[J].中华实验外科,2015,32(1):193 -194.
[12]孟庆涛,江 莹,孙 倩.缺血后处理对小鼠肠缺血再灌注所致急性肺损伤保护作用中炎症介质的影响[J].武汉大学学报(医学版),2012,33(4):487 -490.
[13]王艳蕾,崔国金,蔡庆艳,等.参麦注射液对肠缺血再灌注肺脂质过氧化损伤的影响[J].天津医药,2010,38(11):986 -989.
[14]徐 睿,李启芳,姜 虹.抑制低氧诱导因子-1α表达对小鼠肠缺血再灌注所致肺损伤的影响[J].国际麻醉学与复苏,2013,34(11):986 -989.
