奥拉西坦注射液有关物质分析方法及稳定性研究
2015-03-22胡雪,余捷
胡 雪,余 捷
(1.武汉市第十一医院,武汉市红十字会医院药剂科,湖北武汉 430015;
2.武汉市第一医院门诊药剂科,湖北 武汉 430022)
1974年由意大利史克比切姆公司最先合成,是一种促智药[2],目前上市剂型有片剂和注射液,奥拉西坦注射液于1990年在意大利上市,规格为5 mL∶1 g,奥拉西坦药理作用广泛,可有效改善患者的记忆学习能力[3-4],临床上用于脑损伤及引起的神经功能缺失、记忆与智能障碍等症的治疗[5-6],特别对预防老年人痴呆症有显著疗效[7]。目前国内已经有多家厂家生产奥拉西坦注射液,商品名有“欧兰同”,“倍清星”等。本文使用氰基键合硅胶柱建立了高效液相色谱法检测奥拉西坦注射液的有关物质,并对奥拉西坦注射液进行了影响因素试验和加速试验,考察了奥拉西坦注射液的稳定性。
1 仪器与试药
1.1 仪器 BT124S型十万分之一分析天平(Sartorius公司);UV2600紫外分光光度计(岛津);pHS-3C酸度计(上海精科);LC-10AT岛津高效液相色谱仪(LC-10AT泵、SPD-10A紫外检测器,日本岛津株式会社,配有岛津工作站)。
1.2 试药 奥拉西坦对照品(中国药品生物制品检定所,批号101032-201301);奥拉西坦注射液(自制,规格 5 mL∶1.0 g,批号 140607,140618,20140701,20140702,20140703);磷酸氢二钾(分析纯,天津市大茂化学试剂厂);乙腈(色谱纯,美国Fisher),磷酸为分析纯,水为纯化水。
2 方法与结果
2.1 色谱条件 色谱柱:氰基键合硅胶柱 (300 mm×4.6 mm,填料孔径 5μm);流动相;乙腈 -5 mmol·L-1;磷酸氢二钾-(5∶95)(用磷酸调节pH值至 5.0);检测波长:214 nm;柱温:室温;流速:0.6 mL·min-1;进样量:20 μL。
2.2 样品处理 精密量取本品适量,加流动相溶解并稀释制成每1 mL约含奥拉西坦0.5 mg的溶液,作为供试品溶液;精密量取供试品溶液1.0 mL,置100 mL量瓶中,加流动相稀释至刻度,摇匀,作为对照品溶液。取对照溶液20μL,注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的10% ~20%;再精密量取取供试品溶液与对照溶液各20μL,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2倍。供试品溶液中如显杂质峰,水解产物(相对保留时间约为0.8)峰面积不得大于对照主峰面积的1/2(0.5%),各杂质峰面积的和:不得大于对照溶液的主峰面积(1.0%)。
2.3 专属性考察 分别按“2.2”中方法配置对照品溶液和供试品溶液,同时按该方法配置奥拉西坦注射液处方比例的空白溶剂,空白辅料溶液,按“2.1”中色谱条件进行样品测定。色谱图见图1,由色谱图可知,奥拉西坦主峰与相邻杂质峰分离度为4.0,大于 1.5,空白溶剂和辅料均不出峰,不干扰本品有关物质的检查。表明该色谱条件适用于本品有关物质的检查。
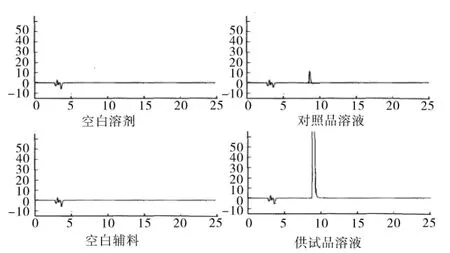
图1 奥拉西坦注射液有关物质检测专属性考察图谱
2.4 破坏试验 取奥拉西坦注射液(批号:140607)5.0 mL,置200 mL瓶中,用水稀释至刻度,摇匀,作为供试品贮备液。精密称取按处方配制的空白辅料63.0 mg,置100 mL量瓶中,用水溶解并稀释至刻度,摇匀,滤过;精密量取续滤液5 mL,置50 mL量瓶中,加水稀释至刻度,摇匀,作为空白辅料贮备液。分别量取供试品贮备液和空白辅料贮备液各5 mL进行如下处理:(1)加1 mol·L-1的氢氧化钠溶液1 mL,水浴加热1.0 h,放冷,用1 mol·L-1盐酸溶液调节pH值至中性,将溶液转移至50 mL量瓶中,用流动相稀释至刻度,摇匀。(2)加0.1 mol·L-1的盐酸溶液 1 mL,水浴加热 1.0 h,放冷,用0.1 mol·L-1氢氧化钠溶液调节pH值至中性,将溶液转移至50 mL量瓶中,用流动相稀释至刻度,摇匀。(3)水浴加热3.0 h,放冷,将溶液转移至50 mL量瓶中,用流动相稀释至刻度,摇匀。(4)置50 mL量瓶中,于照度为(4 500±500)Lx的条件下放置6 h,用流动相稀释至刻度,摇匀。(5)置50 mL量瓶中,加双氧水1μL,室温放置2.0 h,用流动相稀释至刻度,摇匀。
上述溶液滤过取续滤液各20μL,分别注入液相色谱仪,记录色谱图即得碱、酸、高温、光照、氧化破坏色谱图。由图可知,本品经碱、酸、高温、光照、氧化破坏试验后降解产物均能与奥拉西坦有效分离,主峰纯度良好,理论塔板数、分离度均符合规定,说明该色谱条件适用于本品有关物质检查。
2.5 线性关系试验 精密称取奥拉西坦对照品28.00 mg,置50 mL量瓶中,加流动相溶解并稀释至刻度,摇匀;精密量取上述溶液5 mL,置50 mL量瓶中,加流动相稀释至刻度,摇匀,作为对照品贮备溶液。分别精密量取对照品贮备溶液 0.05、0.1、0.2、0.5、0.8、1.0、1.5、1.8 mL,分别置 10 mL 量瓶中,加流动相稀释至刻度,摇匀,分别精密量取20μL注入液相色谱仪,记录色谱图,以奥拉西坦对照品峰面积A为纵坐标,以奥拉西坦浓度C(mg·L-1)为横坐标进行线性回归,得线性方程A=227 45C-883.11,相关系数 r=0.999 8。结果表明奥拉西坦在0.28 ~10.08 mg·L-1的浓度范围内,其浓度与峰面积线性关系良好。
2.6 量限和检测限试验 精密称取奥拉西坦对照品25.00 mg,置100 mL量瓶中,加流动相溶解并稀释至刻度,摇匀,精密量取5 mL置50 mL量瓶中,加流动相稀释至刻度,逐级稀释,精密量取溶液20 μL,注入液相色谱仪,记录色谱图。以检测器信号/仪器噪音(S/N)=10时为定量限,以检测器信号/仪器噪音(S/N)=3时为检测限,经测定奥拉西坦的定量限和检测限分别为1.32 ng和0.45 ng。
2.7 精密度试验 精密称取本品(批号:140607)适量,按2.2中对照品溶液配制方法配制样品,精密量取20μL,注入液相色谱仪,记录色谱图,连续重复进样6次,奥拉西坦样品峰面积相对标准偏差为0.81%。试验结果表明本法精密度良好。
2.8 溶液稳定性试验 分别精密量取本品(批号:140607)适量,加流动相稀释制成每1 mL约含奥拉西坦0.5 mg的溶液,作为供试品溶液。放置与室温(25 ℃)条件下,分别于第 0、1、2、4、6、8 h 时,精密量取供试品溶液20μL,注入液相色谱仪,记录色谱图,考察供试品溶液的稳定性。试验结果见表1。

表1 奥拉西坦注射液有关物质检查溶液稳定性试验
由试验结果可知,供试品溶液在25℃条件下放置8 h,与0 h比较,单杂和总杂变化不大,主峰面积基本无变化,说明有关物质检查供试品溶液在室温(25℃)条件下放置8 h内稳定。
2.9 有关物质测定 精密量取本品适量,按2.2中样品处理方法配置供试品溶液和对照品溶液;按2.1中色谱条件测定样品有关物质。各批样品及测定结果见表2。
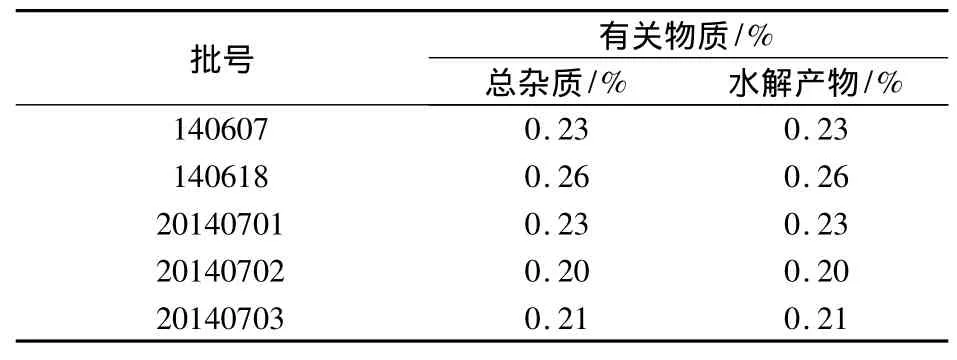
表2 奥拉西坦注射液有关物质检查结果
以上试验结果表明,自制奥拉西坦注射液多批产品水解产物、总杂质均控制在较小范围内。
2.10 稳定性考察 参照中国药典2015版附录XIXC原料药与药物制剂稳定性试验指导原则,对自制奥拉西坦注射液(批号20140701)进行影响因素试验,影响因素试验条件为高温60℃,高温40℃。光照(4500±500)Lx以及低温4℃,样品使用棕色玻璃安瓿瓶包装,于0、5、10 d检测样品有关物质,结果见表3。同时对自制奥拉西坦注射液(批号20140701、20140702、20140703)进行加速试验,加速试验条件为(40±2)℃,相对湿度(75±5)%,于0、1、2、3、6 月检测样品有关物质,结果见表4。

表3 奥拉西坦注射液影响因素试验有关物质检查结果

表4 奥拉西坦注射液加速试验有关物质检查结果
3 讨论
文献报道奥拉西坦注射液有关物质检测方法多为等度洗脱和梯度洗脱高效液相色谱法等,检测用色谱柱有 C8柱、C18柱[8-11]、氨基柱[12-13]以及氰基柱[14]等。使用紫外分光光度计在200~400 nm波长范围内对奥拉西坦进行光谱扫描,发现奥拉西坦为末端吸收,参照奥拉西坦原料标准确定采用214 nm作为检测波长。实验中对流动相进行了摸索,水相使用纯化水时样品容易浑浊,并且色谱图中奥拉西坦峰存在拖尾现象,通过使用磷酸氢二钾水溶液作为水相可以避免色谱峰拖尾,获得对称性良好的色谱峰,并且没有浑浊现象,奥拉西坦峰与相关杂质的分离效果良好。
通过对自制奥拉西坦注射液进行影响因素试验,发现样品在高温,低温,光照条件下有关物质均较稳定,说明自制制剂的制备工艺是合理的,加速试验6个月结果表明药物在6个月内有关物质呈上升趋势,但是变化不大,变化幅度均在要求范围内,进一步说明产品工艺的合理性及产品的稳定性,同时还需要通过性状,含量,澄明度等的稳定性考察情况进一步确定自制奥拉西坦注射液的稳定性。
[1] 王 卓,丁百莲,华方波,等.奥拉西坦注射液处方工艺及研究[J].辽宁化工,2014,4(11):1370 -1372.
[2] 邵枝定,张 洁,顾长斌.奥拉西坦联用B族维生素治疗血管性痴呆的疗效分析[J].皖南医学院学报,2015,34(3):249-251.
[3] 程秋实,贺彩霞,周长宏.奥拉西坦治疗血管性痴呆的临床疗效研究[J].实用心脑肺血管病杂志,2014,22(9):18 -19.
[4] 金 磊,李 博,叶 雷,等.奥拉西坦的临床前药理学研究[J].中国临床药理学与治疗学,2011,16(3):354 - 360.
[5] 曾祥海,石继和,胡正辉.奥拉西坦注射液治疗脑病临床进展[J].中国现代药物应用,2013,7(16):231 -232.
[6] 胡艳芹,卫青祥,陈睿红,等.注射用奥拉西坦对脑出血患者的疗效观察[J].河北医药,2012,34(21):3264.
[7] 方 兴.奥拉西坦治疗神经科疾病的研究进展[J].中西医结合心脑血管病杂志,2011,9(5):606 -607.
[8] 苏彦文,张凤荣,苏彦斌,等.奥拉西坦葡萄糖注射液中奥拉西坦含量及其有关物质的分析[J].吉林化工学院学报,2014,31(7):38-41.
[9] 刘宪勇,刘世军,孙克明,等.HPLC法测定奥拉西坦原料中的有关物质[J].中国药房,2014,25(1):66 -68.
[10]袁利杰,刘 辉,李婷婷,等.HPLC法测定奥拉西坦原料及其注射剂中奥拉西坦的含量和有关物质[J].中国药师,2014,17(7):1112-1116.
[11]汪六英,吴升德,曹小帅,等.高效液相色谱内标法测定奥拉西坦的含量[J].科学技术与工程,2013,13(16):4614 -4616.
[12]谭建平,卢瑞芯.HPLC法从测定奥拉西坦注射液中的有关物质[J].国际医药卫生导报,2012,18(10):1503 -1504.
[13]常 悦,毛远湖,张 毅,等.高效液相色谱法测定奥拉西坦有关物质的方法研究[J].化学试剂,2014,36(9):806 -808.
[14]崔 巍,李健和,阳巧凤,等.奥拉西坦注射液中奥拉西坦2种含量测定方法的比较[J].中南药学,2010,8(11):845 -847.
