鸡朊样蛋白Doppel基因的克隆及其与PrPC相互关系分析
2015-03-23张天亮杨润霞万学瑞张小丽
张天亮,吴 润*,杨润霞,魏 姣,万学瑞,刘 霞,刘 磊,张小丽
(1.甘肃农业大学动物医学院,兰州 730070;2.甘肃农业大学生命科学技术学院,兰州 730070)
鸡朊样蛋白Doppel基因的克隆及其与PrPC相互关系分析
张天亮1,吴 润1*,杨润霞1,魏 姣1,万学瑞1,刘 霞2,刘 磊1,张小丽1
(1.甘肃农业大学动物医学院,兰州 730070;2.甘肃农业大学生命科学技术学院,兰州 730070)
克隆鸡Doppel蛋白(ChDpl)基因(PRND)并初步分析其与正常细胞型朊蛋白(PrPC)的相互关系,为禽源Dpl结构与功能、Dpl与PrPC互作关系机制的研究提供理论依据与分子基础;以多物种Dpl氨基酸序列为基础,通过比对找到Dpl氨基酸序列保守区,设计简并引物并依据鸡的密码子偏好性对引物进行优化,以逐步降低其简并性。用此特异性引物以聚合酶链式反应(PCR)扩增鸡PRND基因,并将其克隆到pMD-18-T载体,鉴定后将序列上传GenBank数据库。结合Dpl与PrPC相关研究初步分析两者的相互关系;多物种Dpl氨基酸序列比对发现,第11—150位(139个氨基酸残基)为Dpl氨基酸序列保守区,以此区域设计引物并进行PCR扩增,得到约417 bp的目的条带,GenBank登录号为KP140962。综合分析PrPC与Dpl相关研究发现,尽管Dpl与PrPC具有相似的翻译后修饰和空间结构,但两者多表现为拮抗作用,即PrPC能够拮抗Dpl的神经毒作用,尤其是其N-端包含八肽重复区的第23—88位残基对于保护Purkinje细胞免受Dpl诱导的神经退化作用至关重要。禽源Dpl的成功克隆不仅填补了目前研究的空白,更在分子水平为后续研究Dpl结构与功能及其与PrPC的拮抗机制奠定了基础。
鸡;Doppel蛋白;PrPC;拮抗
作为PrPC的同系物,Dpl蛋白与PrPC相似,也是一种带有GPI锚的膜糖蛋白,且均由前体蛋白经历一系列修饰过程形成[1]。其编码基因PRND位于PRNP下游约16 kb(人位于27 kb)处。虽然Dpl与PrPC氨基酸序列相似性仅约23%[1],但两者翻译后修饰及空间结构却非常相似,并且均具有相似的C-端结构域,即由3个α-螺旋和2个β-折叠以及2个糖基化位点组成[2]。然而,越来越多的试验数据已证明PrPC与Dpl非但不是协同作用,而且两者还表现出拮抗作用。研究发现,PrPC的N-端八肽重复区可与Ca2+结合,发挥抗氧化作用[3],而Dpl缺失该区域。有学者通过构建N-端缺失PrPC转基因小鼠发现N-端包含八肽重复区在内的第23—88个氨基酸残基对于拮抗Dpl的神经毒作用至关重要,该区域的缺失将导致小鼠共济失调和Purkinje细胞的退化[4],因此PrPC的N-端结构域对于拮抗Dpl的神经毒性作用具有重要的意义。另外Dpl由于比PrPC多一个二硫键而趋于稳定,这也许是Dpl并不能转变成像PrPSc一样的致病形态的原因。目前,大多Dpl相关研究均集中在哺乳动物,而对于禽源Dpl的研究目前还处于空白。本研究拟通过生物信息学方法探索多物种Dpl的氨基酸序列保守区,设计简并引物并根据研究对象(鸡)的密码子偏好性优化并降低其简并性,以克隆鸡PRND基因为起始,初步掌握禽源Dpl的核苷酸序列,为进一步研究其氨基酸序列、蛋白质高级结构及功能区提供理论依据,并为将来进行禽源Dpl与PrPC拮抗机制的研究奠定基础。
1 材料与方法
1.1 血样
无菌采取10只成年健康青脚麻鸡新鲜血液,以抗凝剂(100 mL溶液中含柠檬酸0.48 g、柠檬酸三钠1.32 g、葡萄糖1.47 g)抗凝,抗凝剂与血液体积比为1∶5。采样地点为甘肃省康乐县某鸡场。
1.2 试剂
全血基因组DNA提取试剂盒购自捷瑞生物工程(上海)有限公司;PremixTaq酶、pMD-18-T、IPTG、氨苄青霉素、DNA Marker DL2000/DL750等购自宝生物工程(大连)有限公司;胰蛋白胨、酵母提取物为OXOID公司产品;琼脂粉(AGAR)购自日本公司;DNA片段快速胶回收试剂盒购自北京博大泰克生物基因技术有限责任公司;其他试剂为国产分析纯。
1.3 鸡全血基因组总DNA的提取
全血DNA提取按捷瑞公司基因组提取试剂盒方法进行。
1.4 多种生物Dpl氨基酸保守序列分析
在NCBI Protein数据库(http://www.ncbi.nlm.nih.gov/protein/)中获得14个物种的Dpl氨基酸序列,包括瘤牛(Bosindicus)AFI78991.1、普通牛(Bostaurus)AFI79095.1、印度水牛(Bubalusbubalis)XP_006047817.1、家犬(Canislupusfamiliaris)XP_005634877.1、山羊(Caprahircus)AAO44923.1、豚鼠(Caviaporcellus)XP_003476454.1、马(Equuscaballus)NP_001085006.1、猫(Feliscatus)XP_006929990.1、人(Homosapiens)AAQ89344.1、食蟹猴(Macacafascicularis)XP_005568469.1、小鼠(Musmusculus)AAH25140.1、绵羊(Ovisaries)ABD63006.1、蹄兔(Procaviacapensis)AAM94873.1、野猪(Susscrofa)XP_003359928.1。这些氨基酸序列经BioEdit、DNAMAN、MEGA 6.0等软件比对与分析获得Dpl氨基酸的保守区序列(图1)。

图1 14个物种PRND基因氨基酸保守区Fig.1 Conserved amino acid region of 14 species PRND gene
1.5 以Gallusgallus(鸡)密码子偏好性反向推导保守区氨基酸的DNA序列
在获得Dpl氨基酸保守区序列后,经Vector NTI软件Back Translation功能,以Gallusgallus密码子偏好性反向推导保守区氨基酸的DNA序列(图2)。
1.6 引物的设计与合成
首先以氨基酸序列经Primer Premier 5.0、Primer Select等软件设计简并引物(P1),再以Back Translation推导的DNA序列为模板,根据鸡的密码子偏好性进行优化以降低引物简并性(P2)(表1)。引物由生工生物工程(上海)股份有限公司合成。

图2 以Gallus gallus密码子偏好性反向推导第11-150位氨基酸的DNA序列Fig.2 Reverse deduced DNA sequence of 11-151 amino acids section with Gallus gallus codon preferences
表1 引物信息
Table 1 Information of primers

引物名Primername序列(5′⁃3′)Sequence(5′⁃3′)Tm值Tmvalue产物长度/bpProductlengthP1上游Upstream下游DownstreamGCYRWYKTNVHTCCRKMRSWYNARKTCSCANKVCTRNSGKVSHS45.444.5417P2上游Upstream下游DownstreamGCCATCGTGTGCATCCTGCTGTTGAAGTCGCAGTGCTTGGTGCTGC62.862.9417
M=A/C R=A/T W=A/T S=G/C Y=C/T K=G/T V=A/G/C H=A/C/T D=A/G/T B=G/C/T N=A/G/C/T
1.7 目的基因的PCR扩增
首先引物P1以DNA为模板序列进行温度梯度PCR扩增,得到目的条带较亮的温度范围。再以优化后的引物扩增目的条带。PCR体系(25 μL):PremixTaq12.5 μL、DNA (50 pmol·L-1)1.0 μL、上下游引物各1.0 μL(10 pmol·L-1)、ddH2O 9.5 μL。反应条件:第一步,94 ℃ 5 min;第二步,94 ℃ 45 s、55 ℃ 45 s、72 ℃ 45 s,共进行30个循环;第三步,72 ℃ 10 min。在BIO-RDA MyCyclerTM Thermal Cycler EN-61010 PCR仪上进行。PCR产物经1%琼脂糖凝胶电泳鉴定。
1.8 克隆与重组质粒的测序
连接体系:Solution I 4.8 μL、pMD-18-T 0.6 μL、目的DNA 5 μL;程序:16 ℃ 2 h、4 ℃ 12 h(过夜)、10 μL体系加50 μL DH5α感受态细胞、冰浴30 min、42 ℃热激45 s、冰浴1 min、加890 μL LB培养基(无Amp+)、37 ℃ 220 r·min-1摇床培养1 h、5 000 r·min-1离心5 min,弃上清(留50 μL左右)、吹打(轻)混匀后取30 μL涂布于100 μg·mL-1Amp+的LB平板先正面放置,待吸收后倒置培养,待菌落长好后,挑取单菌落于LB液体培养基(100 μg·mL-1Amp+)培养12~16 h,菌液PCR鉴定后送于华大基因科技测序。鉴定后向NCBI上传所得序列。
1.9 测序结果与GenBank数据库序列比对
GenBank数据库下载序列如下:Ailuropodamelanoleuca(XM_002924821.1)、Canislupusfamiliaris(XM_005634820.1)、Caviaporcellus(AY130773.1)、Condyluracristata(XM_004687375.1)、Elephasmaximus(AY130770.1)、Homosapiens(AK313404.1)、Homosapiens(EU009729.1)、Jaculusjaculus(XM_004661445.1)、Nomascusleucogenys(XM_003277983.2)、Oryctolaguscuniculus(XM_008256271.1)、Otolemurgarnettii(XM_003788035.1)、Pteropusalecto(XM_006921622.1)、Sorexaraneus(XM_004610986.1)、Tarsiussyrichta(XM_008068920.1)、Vicugnapacos(XM_006207355.1)。
2 结 果
2.1 最佳退火温度的摸索与引物的优化
首先以引物P1进行温度梯度PCR(40~65 ℃)获得最佳退火温度范围(55~58 ℃)(图3);再以经过不同程度优化的引物扩增目的条带,得到特异性引物P2(图4)。
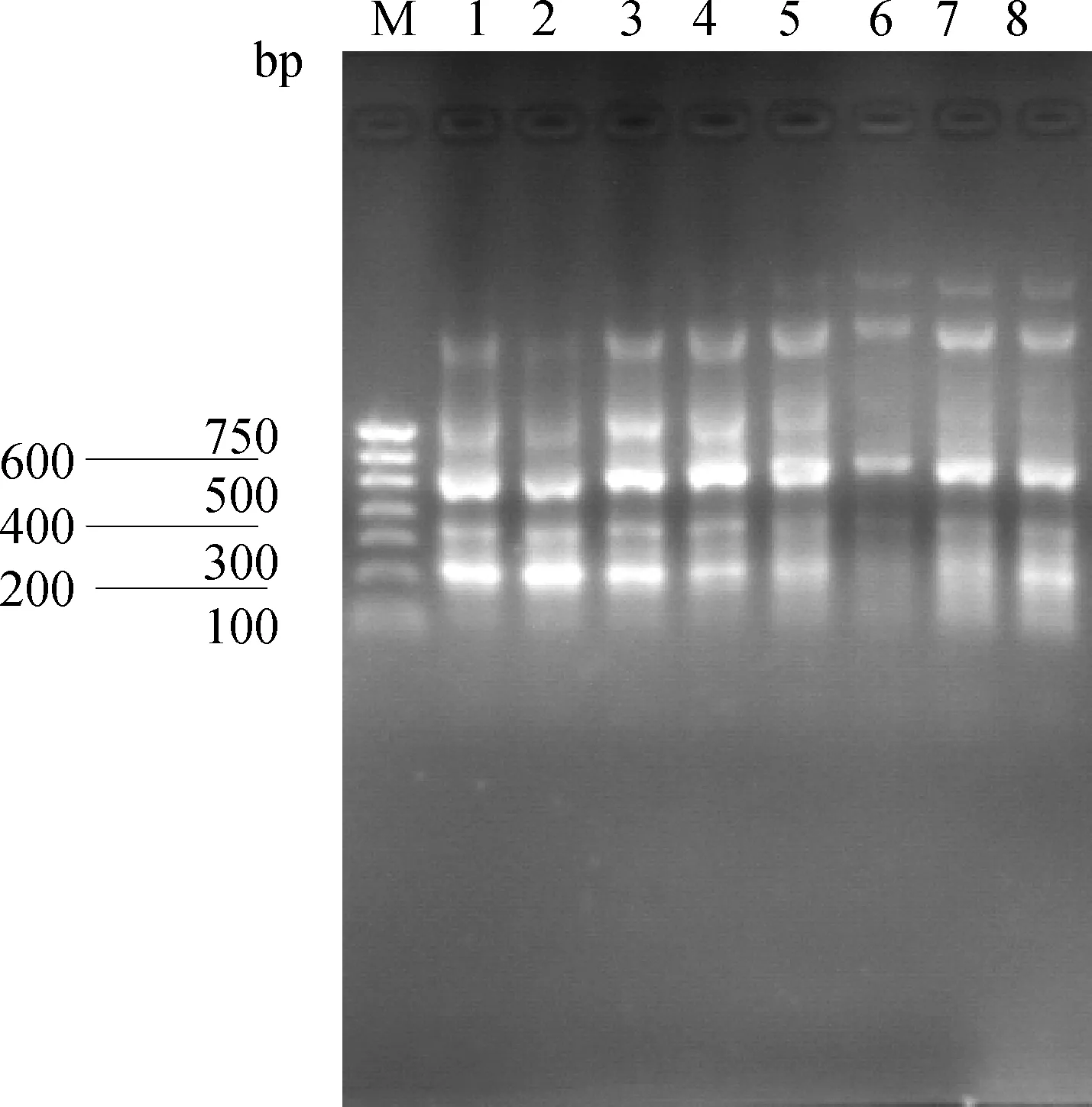
M.DNA相对分子质量标准DL750;1~8.40~65 ℃温度梯度PCR产物M.DNA marker DL750; 1-8.PCR products in the temperature gradient 40-65 ℃图3 引物P1以全血DNA为模板温度梯度扩增目的片段Fig.3 Amplify target fragment with whole blood DNA as template by primer P1
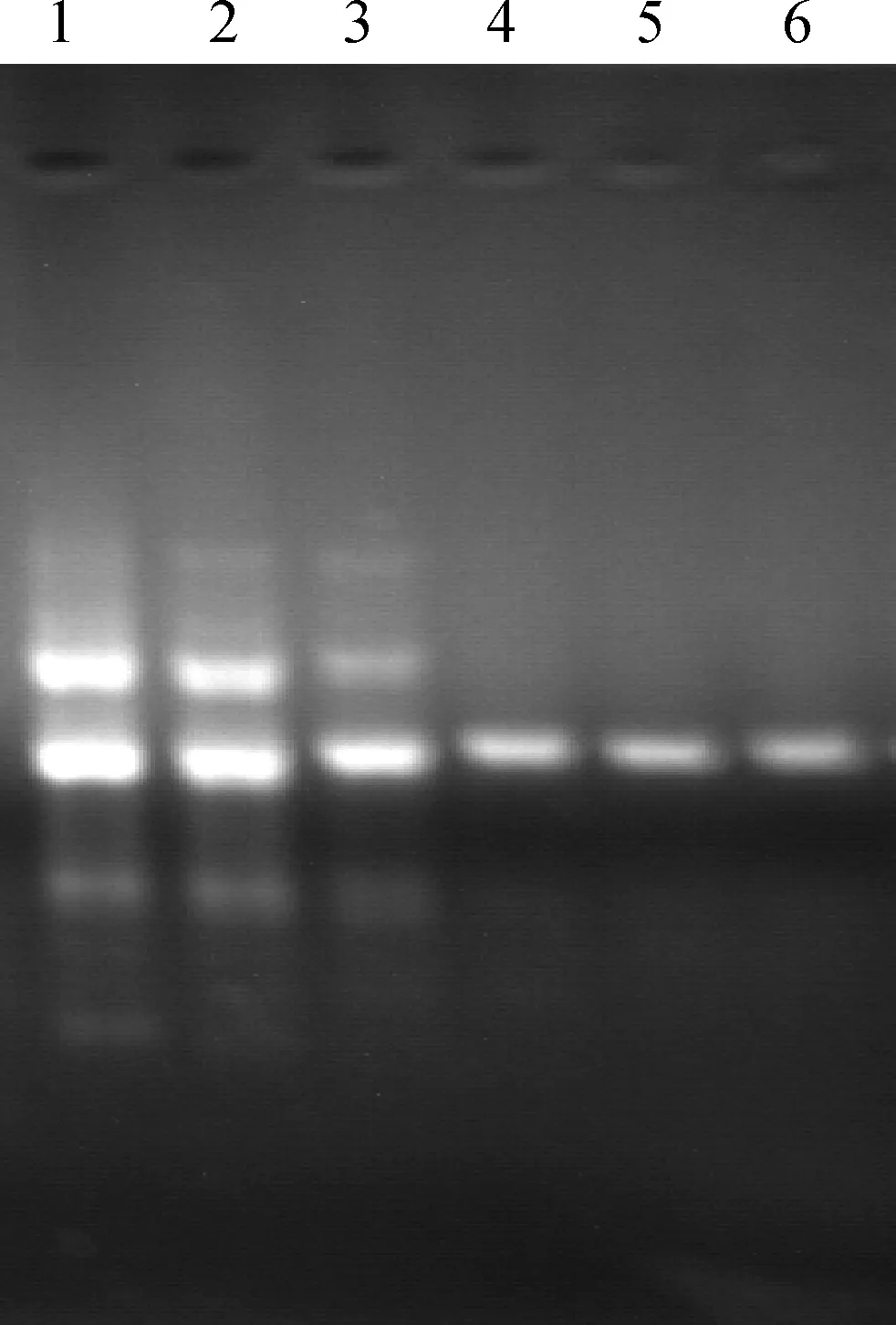
1~6.从P1到P2逐渐降低引物简并性1-6. Reduce primer’s degeneracy gradually from P1 to P2图4 以逐渐降低简并性的引物扩增目的片段Fig.4 Amplify target fragment with primer reduced degeneracy by degree
2.2 目的基因的PCR扩增
以优化后的引物P2进行PCR扩增,经琼脂糖凝胶电泳鉴定,获得约417 bp的预期目的产物(图5)。
2.3 菌液PCR鉴定及序列测定
对克隆菌液进行PCR鉴定,以1%琼脂糖凝胶电泳检测(图6)。将菌液送于华大基因进行测序,测序结果提交GenBank(登录号为:KP140962)。测序结果显示,此次克隆所得序列长度为417 bp,可编码139个氨基酸,在254 bp处存在PstⅠ酶切位点。

1~4. PCR产物;M. DNA相对分子质量标准DL20001-4. PCR products; M. DNA marker DL2000图5 引物P2扩增目的片段Fig.5 Amplify target fragment with primer P2

1、2. PCR产物;M. DNA相对分子质量标准DL7501,2. PCR products; M. DNA marker DL750图6 ChPRND克隆菌液PCR鉴定Fig.6 PCR identification of ChPRND clone bacteria
3 讨 论
Doppel蛋白(Dpl)、Shaddo蛋白(Sho)和朊病毒(PrPC)均属于朊蛋白家族[5]。Dpl与细胞型朊蛋白(PrPC)之间尽管有结构和生化相似性[1,6-8],但越来越多的证据表明两种蛋白间只有较小的功能相似性[5,9-10]。相反地,PrPC与 Dpl间存在一种活跃的拮抗作用[1]。Dpl基因的表达已在脊椎动物中得到广泛确认,包括鱼类、四足动物[11-13]、牛、羊[14]、山羊[15]、小鼠和人[1,16],且存在高度保守区域,这表明Dpl是一种保守蛋白质。然而,目前仍鲜有人了解Dpl的生理功能。据报道,PRND过表达,尤其在PrPC敲除(PrPC0/0)小鼠中,会导致小脑小叶中发生Purkinje细胞损失及进行性共济失调[1,17-18]和外周神经的脱髓鞘[19],这表明Dpl在PrPC缺失时,会模拟神经退行性疾病样诱导神经致病性损伤。然而,当PrPC存在时,其会拮抗Dpl的神经毒作用,尤其是N-端包含八肽重复区在内的第23—88位氨基酸残基发挥着重要的作用。以往的研究也进一步表明,Dpl在神经元N2a细胞中通过一种线粒体依赖机制诱导细胞凋亡[9]。PRND的诱变研究表明,αB/B′-loop-C区是Dpl-诱导细胞凋亡的核心因素[20]。
此外,研究结果显示,Dpl蛋白在多种肿瘤病中发挥作用。其中包括星形细胞瘤、胃腺癌、间变性脑膜瘤[21]、急性髓细胞性白血病(acute myelocytic leukemia,AML)和骨髓增生异常综合征(myelodysplastic syndrome,MDS)[22]。尽管PRND基因在这些癌症中的参与机制仍有待阐明,但多项研究结果表明PRND基因可能是一种肿瘤标记物或用于治疗的潜在新靶标[21]。S.Comincini等[21]研究了原发和继发性星形细胞瘤患者不同病理分级组织中及人工培养星形细胞瘤细胞系中的PRND和Dpl表达,发现在胶质母细胞瘤(glioblastoma multiforme,GBM)中PRND及相应Dpl蛋白高水平表达,这种表达似乎与GBM的恶性肿瘤相关。进一步研究了6例胃腺癌样品和6例间变性脑膜瘤样品中的PRND在表达,也发现PRND高水平表达[23]。E.Travaglino等[22]也发现,虽然Dpl蛋白在健康受试者骨髓中几乎检测不到或根本不表达,但其在白血病和MDS患者的骨髓样本中却被表达。此外,Dpl在正常骨髓标本中的表达仅限于CD34+干细胞,且在干细胞分化中被下调。这些研究表明,有必要进一步作Dpl在星形细胞瘤、胃腺癌、间变性脑膜瘤、急性髓细胞性白血病和骨髓增生异常综合征发生和发展中的作用研究,Dpl可能成为一种用于诊断和治疗的候选靶标。
本研究以前人研究为基础,通过比对获得多物种Dpl氨基酸序列保守区,设计简并引物并克隆获得鸡Dpl保守区核苷酸序列,其大小为417 bp,与所得保守区氨基酸序列长度(139个氨基酸残基)相吻合,说明Dpl与PrP类似,同样具有高度保守性。实验所得序列与GenBank数据库比对,发现其与鼹鼠、鼩鼱亲缘关系最近,与人类处于不同的进化分支(图7),这与种源关系相符。总之,Dpl自发现以来已逐渐露出其神秘面纱,无论是研究其与PrPC在氨基酸序列、蛋白质结构及亚细胞定位上的相似性及两者生物学功能上的拮抗作用,都需要全面、深入的了解其基因序列与蛋白结构特征。

图7 多种生物PRND系统发育树Fig.7 Phylogenetic tree of multi-creatures’ PRND
4 结 论
通过比对查询多物种Dpl氨基酸保守区,设计并优化引物克隆得到鸡PRND基因保守区序列(417 bp),并经Dpl与PrPC相互关系分析发现,PrPC具有拮抗Dpl神经毒作用,尤其是N-端第23—88位氨基酸残基。以RACE方法获取鸡PRND全长并对Dpl氨基酸序列、蛋白质高级结构特征、功能区进行分析,禽源Dpl与PrPC拮抗机制的研究将成为后续工作。
[1] MOORE R C,LEE I Y,SILVERMAN G L,et al.Ataxia in prion protein (PrP)-deficient mice is associated with upregulation of the novel PrP-like protein doppel[J].JMolBiol,1999,292(4):797-817.
[2] 姜海霞,许 良,祝艳华,等.朊蛋白(PrP)与叠朊(Doppel)蛋白相关性的研究进展[J].内蒙古民族大学学报:自然科学版,2008,23(2):172-175. JIANG H X,XU L,ZHU Y H,et al.Recent progress on the relationship between prion protein and Doppel[J].JournalofInnerMongoliaUniversityofNationalities:NaturalScienceEdition,2008,23(2):172-175.(in Chinese)
[3] PRUSINER S B.Prions[J].ProcNatlAcadSciUSA,1998,95(23):13363-13383.
[4] ATARASHI R,NISHIDA N,SHIGEMATSU K,et al.Deletion of N-terminal residues 23-88 from prion protein (PrP) abrogates the potential to rescue PrP-deficient mice from PrP-like protein/doppel-induced Neurodegeneration[J].JBiolChem,2003,278(31):28944-28949.
[5] WESTAWAY D,DAUDE N,WOHLGEMUTH S,et al.The PrP-like proteins Shadoo and Doppel[M].Prion Proteins.Springer Berlin Heidelberg,2011:225-256.
[6] LI A,SAKAGUCHI S,SHIGEMATSU K,et al.Physiological expression of the gene for PrP-like protein,PrPLP/Dpl,by brain endothelial cells and its ectopic expression in neurons of PrP-deficient mice ataxic due to Purkinje cell degeneration[J].AmJPathol,2000,157(5):1447-1452.
[7] SILVERMAN G L,QIN K,MOORE R C,et al.Doppel is an N-glycosylated,glycosylphosphatidylinositol-anchored Protein.Expression in testis and ectopic production in the brains of Prnp(0/0) mice predisposed to Purkinje cell loss[J].JBiolChem,2000,275(35):26834-26841.
[8] QIN K,COOMARASWAMY J,MASTRANGELO P,et al.The PrP-like protein Doppel binds copper[J].JBiolChem,2003,278(11):8888-8896.
[9] QIN K,O’ DONNELL M,ZHAO R Y.Doppel:more rival than double to prion[J].Neuroscience,2006,141(1):1-8.
[10] WATTS J C,WESTAWAY D.The prion protein family:diversity,rivalry,and dysfunction[J].BiochimBiophysActa,2007,1772(6):654-672.
[11] OIDTMANN B,SIMON D,HOLTKAMP N,et al.Identification of cDNAs from Japanese pufferfish (Fugu rubripes) and Atlantic salmon (Salmo salar) coding for homologues to tetrapod prion proteins[J].FEBSLett,2003,538(1-3):96-100.
[12] RIVERA-MILLA E,OIDTMANN B,PANAGIOTIDIS C H,et al.Disparate evolution of prion protein domains and the distinct origin of Doppel-and prion-related loci revealed by fish-to-mammal comparisons[J].FASEBJ,2006,20(2):317-319.
[13] SUZUKI T,KUROKAWA T,HASHIMOTO H,et al.cDNA sequence and tissue expression of Fugu rubripes prion protein-like:a candidate for the teleost orthologue of tetrapod PrPS[J].BiochemBiophysResCommun,2002,294(4):912-917.
[14] TRANULIS M A,ESPENES A,COMINCINI S,et al.The PrP-like protein Doppel gene in sheep and cattle:cDNA sequence and expression[J].MammGenome,2001,12(5):376-379.
[15] UBOLDI C,DEL VECCHIO I,FOTI M G,et al.Prion-like Doppel gene (PRND) in the goat:genomic structure,cDNA,and polymorphisms[J].MammGenome,2005,16(12):963-971.
[16] PEOC′H K,GUÉRIN C,BRANDEL J P,et al.First report of polymorphisms in the prion-like protein gene (PRND):implications for human prion diseases[J].NeurosciLett,2000,286(2):144-148.
[17] MOORE R C,MASTRANGELO P,BOUZAMONDO E,et al.Doppel-induced cerebellar degeneration in transgenic mice[J].ProcNatlAcadSciUSA,2001,98(26):15288-15293.
[18] ROSSI D,COZZIO A,FLECHSIG E,et al.Onset of ataxia and Purkinje cell loss in PrP null mice inversely correlated with Dpl level in brain[J].EMBOJ,2001,20(4):694-702.
[19] NISHIDA N,TREMBLAY P,SUGIMOTO T,et al.A mouse prion protein transgene rescues mice deficient for the prion protein gene from purkinje cell degeneration and demyelination[J].LabInvest,1999,79(6):689-697.
[20] DRISALDI B,COOMARASWAMY J,MASTRANGELO P,et al.Genetic mapping of activity determinants within cellular prion proteins:N-terminal modules in PrPC offset pro-apoptotic activity of the Doppel helix B/B′ region[J].JBiolChem,2004,279(53):55443-55454.
[21] COMINCINI S,FACOETTI A,DEL VECCHIO I,et al.Differential expression of the prion-like protein doppel gene (PRND) in astrocytomas:a new molecular marker potentially involved in tumor progression[J].AnticancerRes,2004,24(3a):1507-1517.
[22] TRAVAGLINO E,COMINCINI S,BENATTI C,et al.Overexpression of the Doppel protein in acute myeloid leukaemias and myelodysplastic syndromes[J].BrJHaematol,2005,128(6):877-884.
[23] TARABOULOS A,RAEBER A J,BORCHELT D R,et al.Synthesis and trafficking of prion proteins in cultured cells[J].MolBiolCell,1992,3(8):851-863.
(编辑 白永平)
Clone of Chicken Prion-likeDoppelGene and the Analysis of Its Interrelation with PrPC
ZHANG Tian-liang1,WU Run1*,YANG Run-xia1,WEI Jiao1,WAN Xue-rui1, LIU Xia2,LIU Lei1,ZHANG Xiao-li1
(1.CollegeofVeterinaryMedicine,GansuAgriculturalUniversity,Lanzhou730070,China; 2.CollegeofLifeScienceandTechnology,GansuAgriculturalUniversity,Lanzhou730070,China)
This study aimed to clone the chicken Doppel protein (ChDpl) gene (PRND),preliminary analyze its relationship with the normal cellular prion protein (PrPC),and to provide a theoretical and molecular basis for the research of avian Dpl structure and function,and the mechanism of the interaction relationship between Dpl and PrPC.Based on the amino acid sequence of multi-species Dpl,the conserved region of Dpl amino acid sequence was found,and the degenerate primers and optimize primers were designed with chicken codon preference to reduce the degeneracy gradually.ChickenPRNDgene was amplified by polymerase chain reaction (PCR) with the specific primers,and then was inserted into pMD-18-T vector.The sequence was uploaded to the GenBank database after identified.Besides,the relationship between Dpl and PrPCwas analyzed.Through the alignments of multi-species Dpl’s amino acid sequence,we found that the section 11-150 bits (140 amino acid residues) was the conserved region of Dpl’s amino acid sequence,by designing primers with this area and PCR amplification,we obtained about 417 bp target band,its GenBank accession number was KP140962.Through comprehensively analysis of the related researches of Dpl and PrPC,we found that although Dpl and PrPChave a similar post-translational modifications and spatial structure,they mostly show antagonism,namely PrPCcan antagonize the neurotoxicity of Dpl,especially the 23-88 th residues of its N-terminal peptide containing octapeptide repeat region are crucial for the protection of Purkinje cells from Dpl induced neurodegeneration.The successful cloning of avian Dpl not only fills the gaps of current researches,even more at the molecular level laid a foundation for further study of the structure and function of Dpl and its antagonistic mechanism with PrPC.
chicken;Doppel protein;PrPC;antagonize
10.11843/j.issn.0366-6964.2015.08.019
2014-11-25
国家自然科学基金资助项目(31160510);甘肃省自然科学研究基金计划项目(1107RJZA198)
张天亮(1988-),男,甘肃天水人,硕士生,主要从事鸡朊蛋白及朊样蛋白研究,E-mail:382598970@qq.com
*通信作者:吴 润,男,教授,博士生导师,E-mail:wurun@gsau.edu.cn
S852.659.7
A
0366-6964(2015)08-1425-07
