牦牛和雄性不育犏牛睾丸FABP5和FABP9基因mRNA水平及能量代谢相关酶活力的比较
2015-03-22刘文静李彩霞金素钰林亚秋郑玉才
付 伟,黄 林,刘文静,任 亮,李彩霞,金素钰,林亚秋,郑玉才*
(1.西南民族大学生命科学与技术学院,成都 610041; 2.西南科技大学生命科学与工程学院,绵阳 621010)
牦牛和雄性不育犏牛睾丸FABP5和FABP9基因mRNA水平及能量代谢相关酶活力的比较
付 伟1,黄 林1,刘文静2,任 亮1,李彩霞1,金素钰1,林亚秋1,郑玉才1*
(1.西南民族大学生命科学与技术学院,成都 610041; 2.西南科技大学生命科学与工程学院,绵阳 621010)
本研究旨在测定牦牛表皮细胞型脂肪酸结合蛋白(FABP5)和睾丸型脂肪酸结合蛋白(FABP9)基因序列,比较其在牦牛和雄性不育犏牛睾丸中的表达,并结合睾丸中部分能量代谢相关酶的活力分析,以探索这两个基因及能量代谢与犏牛雄性不育之间的联系。试验从牦牛睾丸中提取总RNA,采用PCR方法获得了牦牛FABP5和FABP9基因的cDNA序列,编码区长度分别为408和399 bp,与普通牛相比分别有1个和6个碱基差异,后者导致FABP9基因推导的氨基酸序列存在5个氨基酸差异。实时荧光定量PCR分析显示,FABP5基因在犏牛睾丸中的表达量极显著大于牦牛,而FABP9基因表达量差异不显著。犏牛睾丸中异柠檬酸脱氢酶活力极显著高于牦牛(P<0.01),而β-羟脂酰CoA脱氢酶和乳酸脱氢酶活力与牦牛接近。犏牛睾丸中FABP5基因表达上调以及参与三羧酸循环的柠檬酸脱氢酶活力提高,可能提示雄性不育犏牛睾丸组织在脂肪酸氧化供能水平上高于成年牦牛。
牦牛;FABP基因;杂交雄性不育;睾丸;能量代谢
脂肪酸结合蛋白(FABPs)广泛存在于动物组织的多种细胞内,主要参与长链脂肪酸的吸收、转运及代谢[1-2]。根据表达及功能差异,可将FABPs分为9种类型,包括脑型(B-FABP)、肝型(L-FABP)、心型(H-FABP)、肠型(I-FABP)、脂肪细胞型(A-FABP)、回肠型(IL-FABP)、髓磷脂型(My-FABP)、表皮细胞型(E-FABP)和睾丸型(T-FABP)。E-FABP(又称FABP5)来源于动物上皮细胞,参与并调控脂肪酸代谢、信号转导及癌症发生等多个过程,对细胞的正常生长发育至关重要[3-4];T-FABP(又称FABP9、PERF15)是动物睾丸特异的,在圆形精子和早期长形精子中大量表达,也是精子顶体的主要组分[5],参与精子发生、成熟和受精,在雄性生殖中发挥重要作用[6-7]。
牦牛(Bosgrunniens)是青藏高原特有的牛种,它与普通牛(Bostaurus)的杂交后代(称犏牛)在产乳、产肉等方面具有明显的杂种优势,但表现为回交3代内雄性不育,无法产生正常的精子[8],而雌性杂交后代生殖正常,其机制一直未得到令人信服的解释。已有的研究表明,与生殖相关的很多基因在犏牛睾丸中的mRNA水平都低于其亲本(牦牛和普通牛),如SYCP3、PIWIL1、Dmrt7、Bvh等[9-12]。本课题组在研究牦牛睾丸蛋白质组学时发现,与牦牛相比,犏牛睾丸中大多数蛋白质表达下调,而FABP5表达显著上调[13]。后续研究又观察到犏牛睾丸中参与脂肪酸氧化的中链酰基辅酶A脱氢酶表达亦上调(待发表资料)。另外,成年牦牛睾丸中参与脂肪酸氧化的β-羟脂酰CoA脱氢酶(HAD)活力显著低于性未成熟的犊牦牛[14]。这些结果促使人们提出这样的假设:雄性不育犏牛睾丸的能量代谢(特别是脂肪酸氧化)可能与成年牦牛有显著差异。
本研究通过PCR产物直接测序的方法,比较牦牛与犏牛FABP5和FABP9基因序列,并利用实时荧光定量PCR分析其在牦牛和犏牛睾丸中的mRNA水平;另外测定睾丸中分别参与脂肪酸氧化、三羧酸循环和糖酵解的3种酶活力,包括β-羟脂酰CoA脱氢酶(HAD)、异柠檬酸脱氢酶(ICDH)和乳酸脱氢酶(LDH),以探索FABP5和FABP9表达水平及能量代谢与犏牛雄性不育的可能关联。
1 材料与方法
1.1 样品的采集
麦洼牦牛(Bosgrunniens)和犏牛(公黄牛与母麦洼牦牛的杂交后代)的睾丸组织均采自成都市青白江区屠宰场。健康的成年公牦牛(n=13)和公犏牛(n=7)在屠宰后立刻取其睾丸,纵切面剖开后用干冰带回实验室,-80 ℃保存备用。
1.2 主要试剂和仪器
RevertAid First Strand cDNA Synthesis Kit购自美国Thermo Scientific公司;Trizol Reagent购自美国Ambion公司;Cycle-pure Kit 购自美国OMEGA公司; QuantiFast SYBR Green PCR Kit购自德国QIAGEN公司;SuperTaqDNA Polymerase购自美国GeneCopoeia公司;丙酮酸钠、异柠檬酸、乙酰乙酰-CoA、NADH和NADP均购自美国Sigma公司;DL2000 marker购自天根生化科技(北京)有限公司。
C1000 Thermal Cycler梯度PCR仪、C1000 Touch Thermal Cycler荧光定量PCR仪、Versa Doc 1000凝胶成像系统均为美国Bio-Rad公司产品;DR 2800分光光度计为美国HACH公司产品;CR21G高速冷冻离心机为日本日立公司产品。
1.3 总RNA的提取及反转录
按试剂盒说明书用Trizol法提取牦牛睾丸总RNA。用紫外分光光度法测定核酸浓度。用RevertAid First Strand cDNA Synthesis Kit以2 μg总RNA为模板,利用随机引物进行反转录,得到cDNA第一链。
1.4 引物设计与PCR扩增
参照GenBank中野牦牛FABP5预测序列(XM_005897263.1)和普通牛FABP5序列(NM_174315.3),以及野牦牛FABP9预测序列(XM_005897261.1)和普通牛FABP9序列(NM_001192410.1),用Primer Premier 5.0软件分别设计PCR引物(表1)。引物由上海生工生物工程有限公司合成。
表1 本试验所用引物序列
Table 1 Primers for the present experiment

目的基因Targetgene引物序列(5'-3')Primersequence退火温度/℃Annealingtemperature产物长度/bpFragmentsizeFABP5F:AGCTCACCTGTCACGCCTGTR:TTTCTGTGCAAAATGATGAGGG62470FABP9F:CACCTCTTCTCTGCAAGCTTTCR:CACATCTTCTTCAAGTCCCAGC60489FABP5(Q-PCR)F:ACTGGGAGAGAAGTTTGAAGAGACCR:GACCCGAGTACAGGTAACATTGTTC62187FABP9(Q-PCR)F:GAACTGGGAGTGAGTGTTGCACTCR:TGCCGGTTATCTATGGTGGTTTC62173GAPDHF:CGACTTCAACAGCGACACTCAR:GGTCCAGGGACCTTACTCCTT6016918SRNAF:CTGAGAAACGGCTACCACATCR:CAGACTTGCCCTCCAATGG60168
牦牛睾丸总RNA经反转录得到cDNA,再进行PCR扩增,反应体系(25 μL):10×Reaction Buffer 2.5 μL,SuperTaqDNA Polymerase 0.2 μL,10 mmol·L-1dNTP 0.5 μL,模板1 μL,上、下游引物各1 μL,加超纯水至25 μL。PCR程序:95 ℃ 3 min;95 ℃ 30 s,60~62 ℃ 30 s,72 ℃ 90 s,共35个循环;72 ℃ 5 min,4 ℃保存。扩增产物用1.5%琼脂糖凝胶电泳检测。
1.5 基因的测序及序列分析
以3头牦牛睾丸cDNA为模板,用PCR分别扩增FABP5和FABP9基因序列,PCR产物送上海生工生物工程有限公司进行直接测序。用DNAMAN4.0软件分析测序结果。
1.6 睾丸组织FABP5和FABP9基因的定量分析
以本研究获得的牦牛睾丸FABP5和FABP9基因序列为模板设计定量PCR引物,以普通牛GAPDH(NM_001034034)和18SRNA(NR_036642)为内参基因。以反转录获得的牦牛(n=13)和犏牛(n=7)睾丸组织cDNA为模板,采用实时荧光定量PCR方法检测FABP5和FABP9基因的相对表达量。PCR体系(25 μL):2×QuantiFast SYBR Green PCR Master Mix 12.5 μL,上、下游引物各1 μL,模板cDNA 1 μL,RNase-free water 9.5 μL。PCR条件:95 ℃预变性5 min;95 ℃变性15 s,60~62 ℃退火20 s,72 ℃延伸15 s,共40个循环,65~95 ℃制作熔解曲线。
1.7 睾丸组织中酶活力测定
在冰上解冻牦牛(n=13)和犏牛(n=7)睾丸组织,分别准确称取0.1 g于装有1.4 mL匀浆液(10 mmol·L-1Tris,pH 8.0,0.25 mol·L-1蔗糖,2 mmol·L-1EDTA)的EP管中,参照C.Jurie等的方法[15],在冰上匀浆20 s,-80 ℃冻融2次,超声波2 min(每9 s停止3 s,输出功率250 W)。取0.5 mL匀浆液以1 700 g于4 ℃离心15 min,上清液用于HAD活力测定;剩余部分10 000 g于4 ℃离心10 min,上清液分装用于测定ICDH和LDH活力。所有样品于-80 ℃保存。
HAD和ICDH活力测定参照C.Jurie等的方法[15],LDH活力测定参照L.Marchat等的方法[16]。酶活力的定义为在25 ℃条件下,每克新鲜组织每分钟催化1 μmol底物转化为1个单位。
1.8 数据统计
采用2-△△Ct法计算FABP5和FABP9基因在睾丸中的相对表达水平。数据以Bio-Rad公司的CFX manager 3.0用GAPDH和18SRNA为内参进行标准化,以牦牛睾丸的表达量为对照。试验数据用“平均值±标准误”表示,用SPSS18.0软件对荧光定量数据和酶活力数据进行t检验。
2 结 果
2.1 牦牛FABP5和FABP9基因测序
试验设计的PCR引物从牦牛睾丸总RNA中均扩增出了与预期长度相符的产物(图1)。PCR产物经测序证实为FABP5和FABP9基因,长度分别为470和489 bp。
牦牛FABP5基因(GenBank登录号:KM659856)的编码区(CDS)长度为408 bp,与野牦牛预测序列(XM_005897263.1)完全相同;与普通牛序列(NM_174315.3)相比存在1个碱基差异(第372位碱基,牦牛为T而普通牛为C),相似性为99.75%。牦牛FABP5基因推导的氨基酸序列包含135个氨基酸,与野牦牛预测序列(XP_005897325.1)和普通牛序列(NP_776740.1)相同,理论分子量为15.039 ku,预测等电点为7.82。
牦牛FABP9基因(GenBank登录号:KM659857)的编码区与野牦牛预测序列(XM_005897261.1)和普通牛序列(NM_001192410.1)的长度均为399 bp,但与后者存在6个碱基差异,相似性98.50%。牦牛FABP9基因推导的氨基酸序列含有132个氨基酸,理论分子量为14.854 ku,预测等电点为5.96,与野牦牛预测氨基酸序列(XP_005897323.1)相同,但与普通牛FABP9(NP_001179339.1)在预测等电点(8.46)上存在明显差异,这是由于二者序列存在5个氨基酸差异(表2),且普通牛中第25和80位分别为甘氨酸(中性氨基酸)、赖氨酸(碱性氨基酸),而牦牛中相应位置分别为谷氨酸(酸性氨基酸)、谷氨酰胺(中性氨基酸),氨基酸序列相似性为96.21%。

M.DNA相对分子质量标准DL2000;1、2.FABP5和FABP9基因PCR产物M.DL2000 marker;1,2.PCR products of FABP5 and FABP9 genes,respectively图1 牦牛FABP5和FABP9基因的扩增结果Fig.1 Amplification of FABP5 and FABP9 genes of yak
2.2FABP5和FABP9基因在牦牛和犏牛睾丸中的表达
以GAPDH和18SRNA为内参基因,对牦牛和犏牛睾丸中FABP5和FABP9基因mRNA表达水平进行了荧光定量PCR检测,扩增效率为98.6%~99.8%,标准曲线线性关系好(R2>0.99)。犏牛睾丸中FABP5基因的表达量极显著高于牦牛(P<0.01),相差约两倍;而FABP9基因表达量差异不显著(图2)。
表2 牦牛与普通牛FABP9基因推导的氨基酸序列对比
Table 2 Comparison of deduced amino acid sequences ofFABP9 gene between yak and cattle

牛种Species氨基酸位置Aminoacidposition253080129132牦牛YakGluLeuGlnTyrVal普通牛CattleGlyValLysCysLeu
2.3 牦牛和犏牛睾丸中酶活力分析
睾丸组织酶活力测定显示,犏牛睾丸中参与三羧酸循环的ICDH活力极显著高于牦牛(P<0.01),而参与脂肪酸氧化的HAD和参与糖酵解的LDH活力未见显著改变(表3)。另外,睾丸FABP5和FABP9的mRNA水平与酶活力之间未见显著相关性。
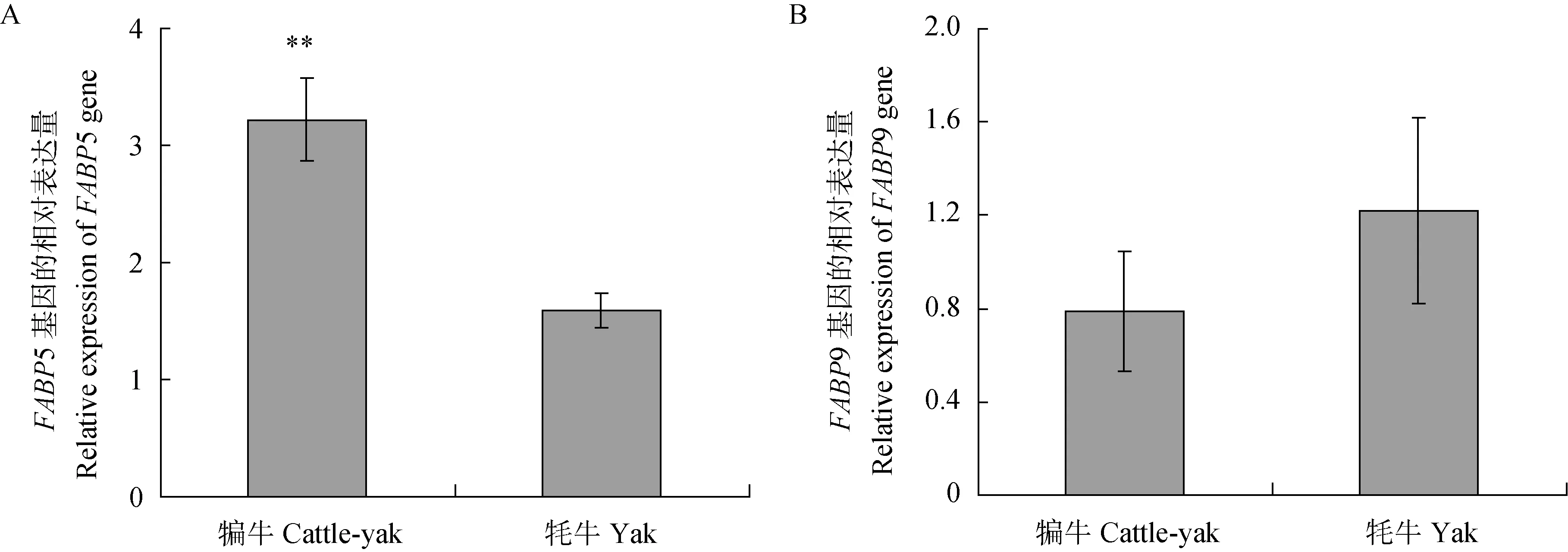
**.P<0.01图2 FABP5(A)和FABP9基因(B)在牦牛和犏牛睾丸中的相对表达量Fig.2 Relative expression of FABP5 (A) and FAPB9 (B) genes in the testes of yak and F1 hybrids
表3 牦牛和犏牛睾丸中的酶活力
Table 3 Enzyme activities in the testes of yak and F1 hybrids

酶Enzyme犏牛F1hybrids(n=7)牦牛Yak(n=13)β-羟脂酰CoA脱氢酶β-hydroxyacylCoAdehydrogenase(HAD)3.58±0.243.62±0.27异柠檬酸脱氢酶Isocitratedehydrogenase(ICDH)1.44±0.11**0.96±0.09乳酸脱氢酶Lactatedehydrogenase(LDH)31.92±1.8327.94±1.01
**.P<0.01
3 讨 论
本研究从牦牛睾丸中成功获得了FABP5和FABP9基因的cDNA序列。牦牛FABP5基因编码的氨基酸序列与普通牛完全相同,说明该基因具有高度的保守性;而牦牛FABP9基因编码的氨基酸序列与普通牛相比存在较大差异,相似性为96.21%,稍低于已报道的其他一些蛋白质[17-18],提示牦牛FABP9基因进化相对较快。FABP9氨基酸序列的差异是否会影响其功能尚需进一步研究。
实时荧光定量PCR分析显示,FABP5基因在犏牛睾丸中的表达量极显著高于牦牛,表达量相差约两倍,这与本实验室近期发现的FABP5蛋白在犏牛睾丸中的表达量比牦牛高2.6倍的结果吻合[13]。有研究表明,FABP5在牛睾丸支持细胞中表达[19],也存在于脂肪细胞、肝、心等细胞或组织中[20]。M.Furuhashi等发现,敲除FABP5基因可提高小鼠对胰岛素的敏感性,而在脂肪细胞中过量表达该基因则产生相反的效果[21],提示FABP5基因表达直接影响机体的能量代谢。犏牛睾丸中参与脂肪酸氧化的中链酰基辅酶A脱氢酶表达上调(本课题组待发表资料),以及犊牦牛睾丸中HAD活力显著高于成年牦牛的结果[14],提示睾丸脂肪酸代谢(也可能包括糖代谢)与睾丸精子发生可能有一定关系。犏牛睾丸中FABP5基因mRNA水平和中链酰基辅酶A脱氢酶蛋白水平的上调,均提示其脂肪酸β-氧化代谢的加强,但本研究未检测到参与脂肪酸β-氧化的HAD活力的显著改变,可能与HAD基础水平高,不属于限速酶有关。
有研究证实,男性不育患者睾丸中某些酶的活力存在异常[22]。睾丸组织的间质细胞和支持细胞中存在丰富的参与脂肪酸β-氧化的酶[23],部分酶也存在于精母细胞和精子细胞中[24]。支持细胞可以通过β-氧化为精子发生提供能量[25]。对精子尾部蛋白质组学研究发现,约1/4的蛋白质与脂肪代谢有关,抑制脂肪酸氧化相关酶的活性可显著降低精子活力[26]。这些说明脂肪酸代谢对精子发生十分关键。本研究发现,犏牛睾丸中参与三羧酸循环的ICDH活力极显著高于牦牛,而HAD和LDH活力则未见显著差异。大鼠精子中三羧酸循环相关酶活力显著低于精母细胞、精子细胞等生殖细胞[27],表明精子发生不同阶段能量代谢情况存在差异。牦牛与犏牛睾丸组织在细胞组成方面有显著差异[28],犏牛睾丸中无正常精子,这很可能与犏牛睾丸ICDH活力高有直接关系。笔者推测,犏牛睾丸ICDH活力的提高可能与脂肪酸代谢的改变相关。
FABP9特异表达于动物睾丸组织,是精子顶体的结构蛋白,与精子发生、获能等过程关系密切[6-7]。本研究表明,FABP9基因在牦牛和犏牛睾丸中均表达,但表达量差异不显著。J.Jamshidi等[29]研究发现,精子发生障碍患者睾丸中FABP9基因无突变体存在;另有研究表明,缺乏FABP9的小鼠精子头部发育异常,但小鼠仍具有生殖能力,说明FABP9虽然是精子形成的重要蛋白,但该蛋白的单独缺失并不能完全阻断整个生殖过程[30]。本研究结果初步表明,牦牛与普通牛FABP9存在较多的氨基酸差异,但可能不是导致犏牛雄性不育的关键蛋白质。
[1] CHMURZYN'SKA A.The multigene family of fatty acid-binding proteins (FABPs):function,structure and polymorphism[J].JApplGenet,2006,47(1):39-48.
[2] ZIMMERMAN A W,VEERKAMP J H.New insights into the structure and function of fatty acid-binding proteins[J].CellMolLifeSci,2002,59(7):1096-1116.
[3] SANSON B,WANG T,SUN J,et al.Crystallographic study of FABP5 as an intracellular endocannabinoid transporter[J].ActaCrystallogrDBiolCrystallogr,2014,70(Pt 2):290-298.
[4] ZHANG Y,SUN Y,RAO E,et al.Fatty acid binding protein E-FABP restricts tumor growth by promoting IFNβ responses in tumor-associated macrophages [J].CancerRes,2014,74(11):2986-2998.
[5] KORLEY R,POURESMAEILI F,OKO R.Analysis of the protein composition of the mouse sperm perinuclear theca and characterization of its major protein constituent[J].BiolReprod,1997,57(6):1426-1432.
[6] KIDO T,ARATA S,SUZUKI R,et al.The testicular fatty acid binding protein PERF15 regulates the fate of germ cells in PERF15 transgenic mice[J].DevGrowthDiffer,2005,47(1):15-24.
[7] OKO R,MORALES C R.A novel testicular protein,with sequence similarities to a family of lipid binding proteins,is a major component of the rat sperm perinuclear theca[J].DevBiol,1994,166(1):235-245.
[8] 张旭静.牦牛和普通牛种间杂种公牛睾丸的组织学观测与研究[J].畜牧兽医学报,2001,32(4):314-318. ZHANG X J.An observation and study of testicular histology in hybrid bull copulated by yak and cattle[J].ActaVeterinariaetZootechnicaSinica,2001,32(4):314-318.(in Chinese)
[9] 屈旭光,李齐发,刘振山,等.牦牛、犏牛睾丸组织中SYCP3基因mRNA表达水平研究[J].畜牧兽医学报,2008,39(8):1132-1136. QU X G,LI Q F,LIU Z S,et al.The study on the expression level ofSYCP3 mRNA in yak and cattle-yak testis[J].ActaVeterinariaetZootechnicaSinica,2008,39(8):1132-1136.(in Chinese)
[10] GU Y,LI Q,PAN Z,et al.Molecular cloning,gene expression and methylation status analysis of PIWIL1 in cattle-yaks and the parental generation[J].AnimReprodSci,2013,140(3-4):131-137.
[11] 金 帅,郭 宪,包鹏甲,等.牦牛和犏牛Dmrt7基因序列分析及其在睾丸组织中的表达水平[J].中国农业科学,2013,46(5):1036-1043. JIN S,GUO X,BAO P J,et al.Sequence analysis and study on the expression level of Dmrt7 gene in yak and cattle-yak testis[J].ScientiaAgriculturaSinica,2013,46(5):1036-1043.(in Chinese)
[12] LUO H,ZHOU Y,LI Y,et al.Splice variants and promoter methylation status of the bovine vasa homology (Bvh) gene may be involved in bull spermatogenesis[J].BMCGenet,2013,14(1):58.doi:10.1186/1471-2156-14-58.
[13] 付 伟,李彩霞,刘文静,等.利用双向电泳-质谱技术鉴定牦牛和犏牛摹丸中的差异表达蛋白质[J].西南民族大学学报:自然科学版,2014,40(1):11-15. FU W,LI C X,LIU W J,et al.Identification of the differentially expressed testis proteins between yaks and cattle-yaks by two-dimensional electrophoresis combined with mass spectrometry[J].JournalofSouthwestUniversityforNationalities,NaturalScienceEdition,2014,40(1):11-15.(in Chinese)
[14] 邱 翔,林亚秋,王国生,等.牦牛睾丸组织能量代谢相关酶活力的分析[J].四川动物,2010,29(5):590-592. QU X,LIN Y Q,WANG G S,et al.Analysis of energy metabolism-related enzyme activities in yak testis tissue[J].SichuanJournalofZoology,2010,29(5):590-592.(in Chinese)
[15] JURIE C,ORTIGUES-MARTY I,PICARD B,et a1.The separate effects of the nature of diet and grazing mobility on metabolic potential of muscles from Charolais steers[J].LivestSci,2006,104(1-2):182-192.
[16] MARCHAT L,LOISEAU P M,PETEK F.Purification and characterization of lactate dehydrogenase isoenzyines 1 and 2 fromMolinemadessetae(Nematoda:Filarioidea)[J].ParasitolRes,1996,82(8):672-680.[17] BAI W L,YIN R H,ZHENG Y C,et al.Cloning and molecular characterization of a yak α-lactalbumin cDNA from mammary tissue[J].LivestSci,2010,129(1-3):122-128.
[18] DING Y,XU Y O,LIN Y Q,et al.Cloning and expression profiles of yak lipoprotein lipase gene[J].JAppliedAnimRes,2012,40(4):311-315.
[19] KINGMA P B,BOK D,ONG D E.Bovine epidermal fatty acid-binding protein:determination of ligand specificity and cellular localization in retina and testis[J].Biochemistry,1998,37(10):3250-3257.
[20] MAEDA K,UYSAL K T,MAKOWSKI L,et al.Role of the fatty acid binding protein mall in obesity and insulin resistance[J].Diabetes,2003,52(2):300-307.
[21] FURUHASHI M,HOTAMISLIGIL G S.Fatty acid-binding proteins:role in metabolic diseases and potential as drug targets[J].NatRevDrugDiscov,2008,7(6):489-503.
[22] AMORY J K,ARNOLD S,LARDONE M C,et al.Levels of the retinoic acid synthesizing enzyme aldehyde dehydrogenase-1A2 are lower in testicular tissue from men with infertility[J].FertilSteril,2014,101(4):960-966.
[23] FUKASAWA M,ATSUZAWA K,MIZUTANI K,et al.Immunohistochemical localization of mitoehondrial fatty acid β-oxidation enzymes in rat testis[J].JHistochemCytochem,2010,58(2):195-206.
[24] BAJPAI M,GUPTA G,JAIN S K.Lipid metabolising enzymes in isolated rat testicular germ cells and changes associated with meiosis[J].Andrologia,1998,30(6):311-315.
[25] XIONG W,WANG H,WU H,et al.Apoptotic spermatogenic cells can be energy sources for Sertoli cells[J].Reproduction, 2009,137(3):469-479.
[26] AMARAL A,CASTILLO J,ESTANYOL J M,et al.Human sperm tail proteome suggests new endogenous metabolic pathways[J].MolCellProteomics,2013,12(2):330-342.
[27] BAJPAI M,GUPTA G,SETTY B S.Changes in carbohydrate metabolism of testicular germ cells during meiosis in the rat[J].EurJEndocrinol,1998,38(3):322-327.
[28] LOU Y N,LIU W J,WANG C L,et al.Histological evaluation and Prdm9 expression level in the testis of sterile male cattle-yaks[J].LivestSci,2014,160:208-213.
[29] JAMSHIDI J,POURESMAEILI F,DARVISH H,et al.FABP9 mutations are not detected in cases of infertility due to sperm morphological defects in Iranian men[J].IntJFertilSteril,2014,7(4):275-280.
[30] SELVARAJ V,ASANO A,PAGE J L,et al.Mice lacking FABP9/PERF15 develop sperm head abnormalities but are fertile[J].DevBiol,2010,348(2):177-189.
(编辑 郭云雁)
Comparison of the mRNA Levels ofFABP5 andFABP9 Genes and Activities of Some Enzymes Related to Energy Metabolism in the Testes of Yak and Sterile F1 Male Hybrids between Male Cattle and Female Yak
FU Wei1,HUANG Lin1,LIU Wen-jing2,REN Liang1,LI Cai-xia1,JIN Su-yu1,LIN Ya-qiu1,ZHENG Yu-cai1*
(1.CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu610041,China;2.SchoolofLifeScienceandEngineering,SouthwestUniversityofScienceandTechnology,Mianyang621010,China)
The epidermal type fatty acid binding protein (FABP5) and testicular fatty acid binding protein (FABP9) genes of yak were sequenced,and their expressions as well as activities of some enzymes related to energy metabolism in the testes were compared between yak and sterile F1 males (male cattle × female yak),aiming to explore the association between the two genes and energy metabolism with the sterility of F1 males.Total RNA was extracted from yak testes and the cDNA sequences ofFABP5 andFABP9 genes were obtained using conventional PCR methods.The coding region of yakFABP5 andFABP9 genes were 408 and 399 bp,respectively,and showed 1 and 6 nucleotide differences compared with those of cattle,respectively,the latter caused 5 amino acid substitutions in the deduced amino acid sequences.Real-time quantitative PCR analysis showed that the expression ofFABP5 gene in the sterile F1 testes was significantly greater than yak,but not forFABP9 gene.Isocitrate dehydrogenase activity in sterile F1 testes was significantly higher than yak (P<0.01),while β-hydroxyacyl CoA dehydrogenase and lactate dehydrogenase activities were similar in the testes of yak and sterile F1 males.The up-regulated expression ofFABP5 gene and the increased activity of isocitrate dehydrogenase involved in citric acid cycle in the sterile F1 testes may indicate that the level of fatty acid oxidation for energy is higher in the testes of sterile F1 males than adult yak.
yak;FABPgene;hybrid male sterility;testes;energy metabolism
10.11843/j.issn.0366-6964.2015.04.008
2014-07-02
国家自然科学基金(31240053)
付 伟(1989-),男,四川资阳人,研究生,主要从事动物生化与分子遗传学研究,E-mail:fuwei11223344@163.com
*通信作者:郑玉才,教授,博士,E-mail:yucaizheng65@hotmail.com
S823.8
A
0366-6964(2015)04-0561-07
