猪SOCS4基因的克隆、生物信息学分析及热应激条件下的表达
2015-03-22巨向红雍艳红贾汝敏马铭龙赵云涛
王 萍,巨向红,雍艳红,贾汝敏,马铭龙,赵云涛,廖 明
(1.广东海洋大学动物科学系,湛江 524088; 2.广东海洋大学动物医学系,湛江 524088;3.农业部动物疫病防控重点开放实验室,广州 510642; 4.广东海洋大学现代生化中心,湛江 524088;
5.华南农业大学兽医学院,广州 510642)
猪SOCS4基因的克隆、生物信息学分析及热应激条件下的表达
王 萍1,巨向红2,3,5*,雍艳红2,贾汝敏1,马铭龙1,赵云涛4,廖 明3,5
(1.广东海洋大学动物科学系,湛江 524088; 2.广东海洋大学动物医学系,湛江 524088;3.农业部动物疫病防控重点开放实验室,广州 510642; 4.广东海洋大学现代生化中心,湛江 524088;
5.华南农业大学兽医学院,广州 510642)
旨在研究和系统阐述热应激诱发猪免疫抑制及炎性因子紊乱的发生机理。本研究克隆了土杂(陆川猪×长白猪)猪SOCS4基因,发现其开放阅读框(ORF)长1 326 bp,编码441个氨基酸,N端包含285个氨基酸,与长白猪、牛、山羊、猫、马、犬、人和小鼠的氨基酸序列同源性分别为100.0%、96.1%、96.1%、95.2%、94.6%、94.3%、93.0%和88.1%;蛋白分子量为50.5 ku,等电点(PI)为6.60。荧光定量PCR结果显示,高温条件下,第3和第9天胸腺组织上SOCS4 mRNA显著上调表达(P≤0.05),而在第1和第6天的肠系膜淋巴结中极显著上调表达(P≤0.01)。与上述组织不同,SOCS4 mRNA在小肠和脾组织中却显著下调表达(P≤0.05)。本研究成功克隆了土杂猪SOCS4基因,发现其在高温条件下的表达量发生明显改变,并呈组织和时间依赖性。
猪;SOCS4;克隆;荧光定量;热应激
热应激已成为我国南方地区应激性致病因素中危害最大的一种,给养殖业造成了巨大的经济损失[1]。其使猪的生长速度下降、料耗增加和免疫能力降低[2-3],从而对各类传染性疫病的敏感性增高[4]。课题组前期的研究发现,热应激破坏猪T淋巴细胞亚群平衡、上调Toll样受体(TLR)2、TLR4和TLR4选择性剪切体的表达,而炎性因子IL-2、IFN-γ和IL-12的表达也发生改变,出现明显的炎性因子紊乱现象[3,5-9]。系统阐述这些现象发生的分子机理是热应激防控的关键。
细胞因子信号传导抑制因子(Suppressor of cytokine signaling,SOCS)是一类胞内受体信号调节因子,参与信号传导的负向调控,是炎症反应和免疫应答中重要的调控蛋白[10-11]。目前已发现的SOCS家族成员有8种,分别为SOCS1-7和CIS[12]。该家族成员之间结构相似,均具有中央SH2区和C末端的SOCS box区,因N末端的长度不一而功能各异[13]。研究发现,在SOCS家族中,仅SOCS1和SOCS3的N末端具有特异的保守KIR区,该结构具有阻断JAKs催化位点从而抑制其活性的功能[14-15]。另外,尽管同家族中的SOCS4、SOCS5、SOCS6和SOCS7均具有较长的N末端,但仅SOCS4和SOCS5的N末端存在一段保守区(N-terminal conserved region,NTCR4-5)[16]。
据报道,SOCS4不仅在颗粒细胞分化过程中发挥负向调节功能,参与卵泡的发育调控[17-18], 还在调节表皮生长因子受体(Epidermal growth factor,EGF)[19]和IL-4[20]受体的相互作用上扮演重要的作用。但目前有关SOCS4在免疫调控中的作用及其N端NTCR4-5保守区的功能研究报道鲜见。探讨应激条件下SOCS4在中枢免疫系统和黏膜免疫系统中的表达规律,可能有助于阐述其在热应激致病过程中的作用机理。鉴于此,本研究以对热带亚热带气候条件下有较强适应性的本地土杂猪(陆川猪×长白猪)为研究对象,克隆SOCS4基因,分析其结构特征,研究其在热应激猪的胸腺、脾、肠系膜淋巴结和小肠组织中的表达变化,为进一步阐述SOCS4 N末端功能和系统阐述SOCS4在应激诱发猪免疫抑制中的调控机理奠定基础。
1 材料与方法
1.1 试验材料和仪器
1.1.1 试验动物 15头3~4月龄健康去势土杂猪(长白猪×陆川猪)购自湛江某猪场,体重40 kg左右。饲养于人工气候温室中(环境温度:(35±1)℃),24 h不间断供热。受试猪自由饮水,每日饲喂3次,早、中、晚各1次。饲养标准参照其他猪种。
1.1.2 主要试剂 Trizol、 Sample Protector、 pMD18-T载体、 ExTaq Mix酶、 DEPC、 DNA Marker DL-2000、 6×loading Buffer、 PrimeScriptⅡ1st Strand cDNA(gDNA) Synthesis Kit、SYBR@Prime Script RT-PCT Kit II均购自TaKaRa公司。Plasmid Mini Kit I、 Gel Extraction Kit购自OMEGA公司。琼脂糖、胰蛋白胨、酵母提取物和琼脂粉购于OXOID公司。氨苄青霉素购自上海生工生物工程公司。大肠杆菌工程菌DH5α为本实验室保存。Gold View核酸染料购自赛百盛公司。其他国产分析纯试剂均购自广州化学制剂厂。
1.1.3 主要仪器 台式高速冷冻离心机(美国Sigma公司)。梯度PCR仪、 水平电泳槽、 Chromo 4荧光定量PCR仪(美国Bio-Rad公司)。BioPhotometer plus核酸蛋白分析仪(德国Eppendorf公司),超低温冰箱(日本三洋),GDS-800凝胶成像系统(美国UPV公司)。
1.2 试验方法
1.2.1 样品采集 分别在高温处理开始后的第0、1、3、6和9天屠宰受试猪,每个时间点3头。分别采取脾、胸腺、空肠和小肠等组织,液氮速冻后存于-80 ℃低温冰箱,用于qRT-PCR。基因克隆所用样品与试验对照组样品均采自第0天的受试猪。
1.2.2 引物设计 根据GenBank登录的猪SOCS4基因序列(HM565936.1)和GAPDH基因序列(AF017079.1),利用Primer Premier 5.0软件设计扩增引物和荧光定量PCR引物(表1),设计好的引物交由英潍捷基(上海)贸易有限公司合成。
刘蜀贝在《比较文学:语文教学应有的开放视野》一文中指出,“比较文学作为研究文学的一种理念和方法,在中学语文教学中的普及和应用,对当前的语文教学改革有着非常积极的影响”。[9]具体到教学实践,他认为:
表1 PCR引物序列
Table 1 PCR primers used in present study
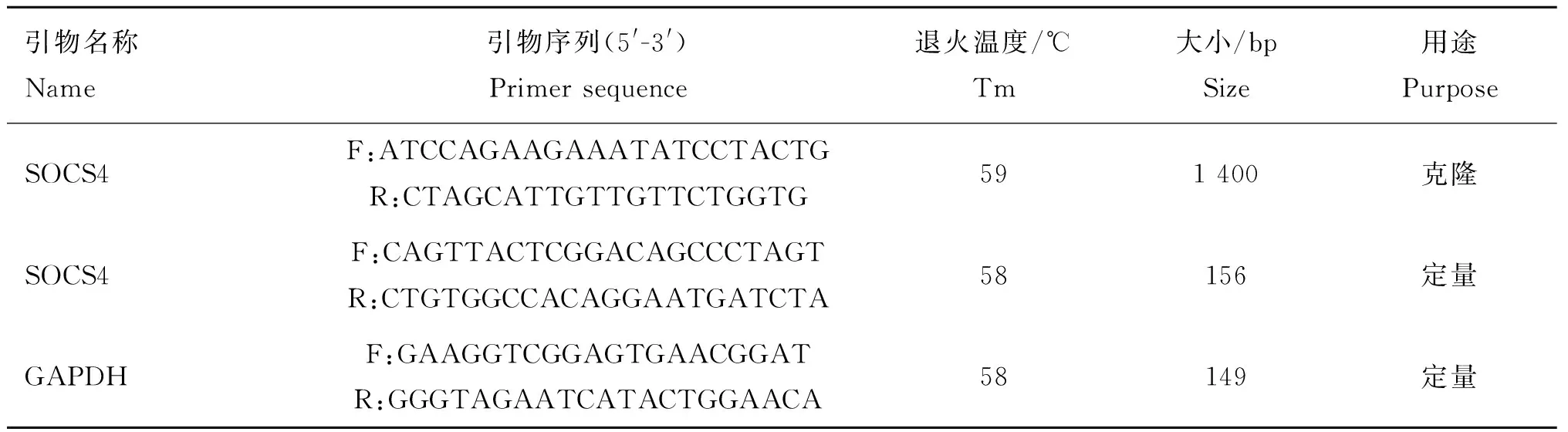
引物名称Name引物序列(5'-3')Primersequence退火温度/℃Tm大小/bpSize用途PurposeSOCS4F:ATCCAGAAGAAATATCCTACTGR:CTAGCATTGTTGTTCTGGTG591400克隆SOCS4F:CAGTTACTCGGACAGCCCTAGTR:CTGTGGCCACAGGAATGATCTA58156定量GAPDHF:GAAGGTCGGAGTGAACGGATR:GGGTAGAATCATACTGGAACA58149定量
1.2.3 RNA提取 TRIZOL法提取各组织总RNA,具体步骤按照试剂盒说明书进行。提取的总RNA用DEPC水充分溶解,-70 ℃保存备用。
1.2.4 RT-PCR
1.2.4.1 目的片段的扩增:根据PrimeScript反转录试剂盒进行cDNA第一链合成,具体步骤按说明书进行。扩增体系(50 μL):cDNA溶液2.0 μL,上游引物(10 μmol·L-1)1.0 μL,下游引物(10 μmol·L-1)1.0 μL,Master Mix(2×)25 μL,dH2O 21 μL。扩增参数: 94 ℃预变性3 min; 94 ℃变性30 s, 退火30 s, 72 ℃延伸1 min,40个循环; 72 ℃延伸10 min;4 ℃保存产物。
1.2.4.2 产物回收与转化:产物经1%的琼脂糖凝胶电泳,用Gel Extraction Kit回收目的片段,将回收的目的片段与pMD18-T载体连接(参考说明书),后转化到大肠杆菌DH5α感受态细胞涂布于预先加入Amp的LB琼脂平板,37 ℃过夜。
1.2.4.3 重组质粒鉴定与测序:挑选白色单菌落接种于10 μL LB液体培养基,参照以上反应条件,取1 μL菌液作为模板进行PCR扩增,检测结果为阳性时,将剩余9 μL接种于加有Amp(100 μg·μL-1)的10 mL LB液体培养基中,37 ℃ 160 r·min-1振荡培养13~16 h。按照Plasmid Mini Kit I说明书抽提质粒,阳性重组质粒送往英潍捷基(上海)贸易有限公司测序。
1.2.4.4 生物信息学分析:利用NCBI在线ORF Finder软件查找猪SOCS4开放阅读框,利用DNAStar软件翻译ORF核苷酸序列,用Clustal X1.81软件与GenBank上已发表的长白猪、人、小鼠和牛SOCS4的氨基酸序列进行同源性比较,并用Box Shade作图。Predictprotein(http://www.predictprotein.org/)预测SOCS4蛋白质二级结构,ESyPred3D Web Server 1.0同源建模预测SOCS4三维结构;通过ExpAsy的Protscale程序计算疏水性;通过NCBI CDD在线预测保守结构域;TargetP 1.1 Server软件预测亚细胞定位。
1.2.5 荧光定量PCR 荧光定量反应体系:10.0 μL SYBR Premix Ex Taq II (2×),0.4 μL上游引物(20 μmol·L-1),0.4 μL下游引物(20 μmol·L-1),2.0 μL cDNA模板,7.2 μL ddH2O。反应条件:94 ℃预变性1 min;94 ℃ 20 s,59 ℃ 20 s,72 ℃ 20 s,40个循环。每个循环后对体系中荧光信号进行检测。采用相对定量,用2-ΔΔCt法来计算SOCS4在各个组织的表达量,用SPASS软件进行显著性分析。将所得数据与第0天对照组经过归一化处理,处理组以对照组的倍数表示并作图。
2 结 果
2.1 猪SOCS4基因的克隆
2.2 猪SOCS4基因序列特征
克隆得到土杂猪SOCS4 ORF全长1 326 bp,编码441个氨基酸,蛋白分子量为50.5 ku,等电点(PI)6.60。NCBI在线CDD蛋白结构分析软件检测结果显示,克隆序列完整,具有SOCS家族特有的保守结构域SH2区与SOCS box区(图2)。不同物种氨基酸序列对比发现,SOCS4 N末端存在一段保守序列mSOCS470-151(图3黄色区域)。
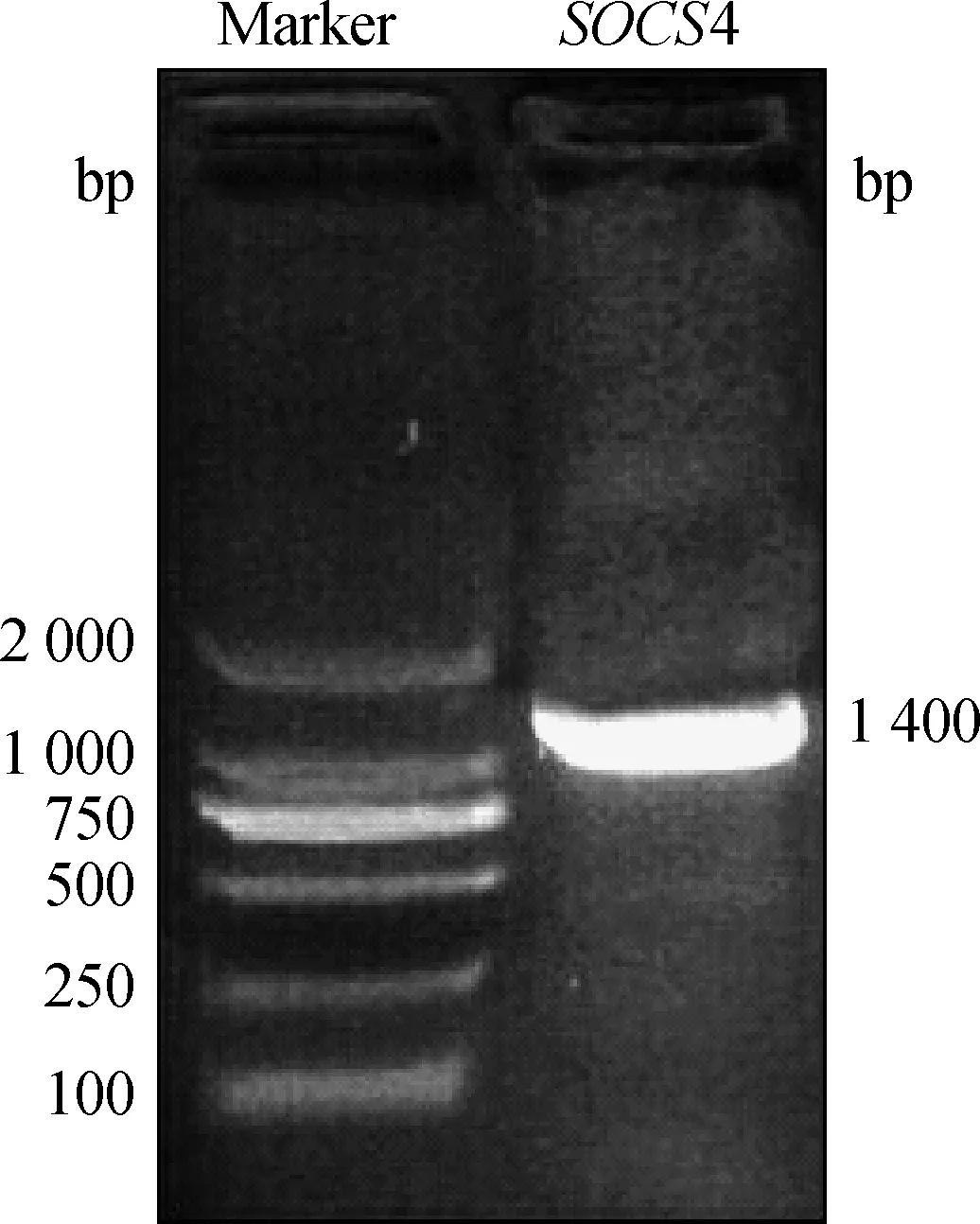
图1 SOCS4质粒 PCR电泳图Fig.1 The electrophoresis result of PCR product of SOCS4 plasmid
2.3 猪SOCS4基因同源性分析
利用DNAMAN软件中的多序列比对程序,将测序结果与长白猪(HM565936.1)、牛(NM_001076218.2)、山羊(XM_005685884.1)、猫(XM_004001462.1)、马(XM_005605169.1)、犬(XM_003435136.3)、人(NM_199421.1)和小鼠(BC_117814.1)进行同源性比对,分析结果显示分别为100.0%、96.1%、96.1%、95.2%、94.6%、94.3%、93.0%和88.1%(表2)。
对不同物种SOCS4氨基酸序列遗传距离进行计算,发现本地土杂猪与长白猪遗传距离为0,与牛、羊距离次之,为0.039,而与小鼠最远,为0.119。
2.4 疏水性分析
利用ExpAsy的Protscale程序计算猪SOCS4的疏水性并作图(图4)。可见SOCS4蛋白在275、276和374位疏水性最强。同时存在两个明显的亲水区,在247位亲水性最强。

图2 SOCS4保守结构域Fig.2 The conserved domain region of SOCS4
表2 土杂猪SOCS4氨基酸序列与其他动物的同源性比较
Table 2 The identical alignment of amino acid sequence of TZ pig SOCS4 compared with other animals
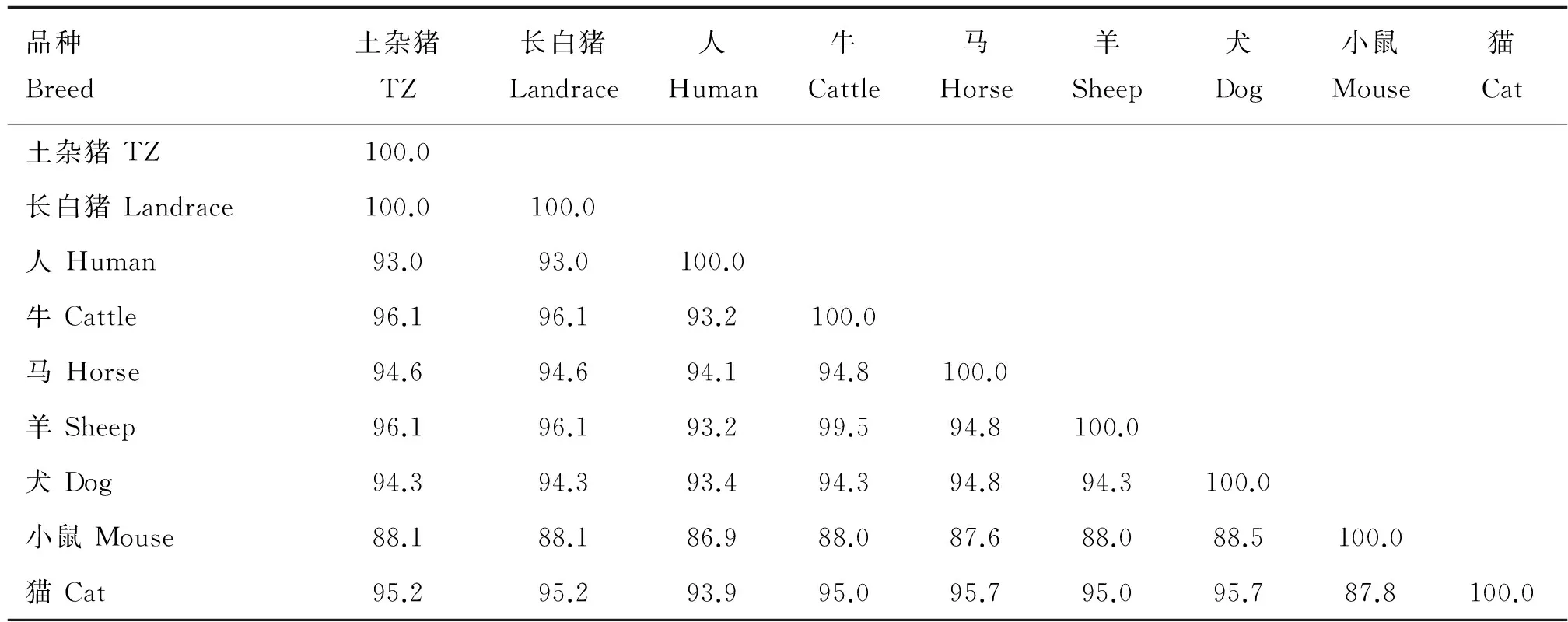
%

图中绿、红、黄色区域分别代表SOCS box、SH2和N末端保守域1(NTCR4-5).1.LKQKLQDAVG;2.HISELM;3.DLAFRWHFIKR)Regions marked with green,red and yellow displayed the SOCS box,SH2 and N-terminal conserved region 1(NTCR4-5).1.LKQKLQDAVG;2.HISELM;3.DLAFRWHFIKR),respectively图3 SOCS4在本地土杂猪与几种哺乳动物间的氨基酸序列同源对比图Fig.3 Identical alignment of the amino acid sequence of the local TZ pig with the corresponding parts of cattle(NM_001076218.2),human(NM_199421.1) and mouse(BC117814.1) SOCS4 proteins
2.5 亚细胞定位
TargetP1.1预测结果表明,SOCS4蛋白非叶绿体转运肽(Chloroplast transit peptide,cTP)和线粒体导肽(Mitochondrial targeting peptide,mTP),也不是分泌通道信号肽(Secretory pathway signal peptide,SP,图5)。
2.6 二级结构与三维结构分析
Predictprotein(http://www.predictprotein.org/)预测结果表明,SOCS4氨基酸残基由9.75%的α-螺旋,7.03%的β-折叠,和83.22%的无规卷曲组成。
将克隆序列所编码氨基酸序列提交到ESyPred3D Web Server 1.0(http://www.unamur.be/sciences/biologie/urbm/bioinfo/esypred/),同源建模结果显示SOCS4约由5个α-螺旋、多个β-折叠、转角以及无规卷曲组成(图6)。
Y轴为亲水指数:正数时表示疏水,数值越大,疏水越强;负数时表示亲水,数值越小亲水越强。X轴为SOCS4蛋白质各个氨基酸位置Y-axis displayed the hydrophilic index:a positive number indicates a hydrophobicity,the greater of the value indicated the more of hydrophobic;negative number indicates hydrophilic,the smaller of the value indicated the stronger of hydrophilic.X-axis displayed the positions of SOCS4 amino acids图4 猪SOCS4蛋白疏水性Fig.4 The hydrophobicity profile of pig SOCS4 protein
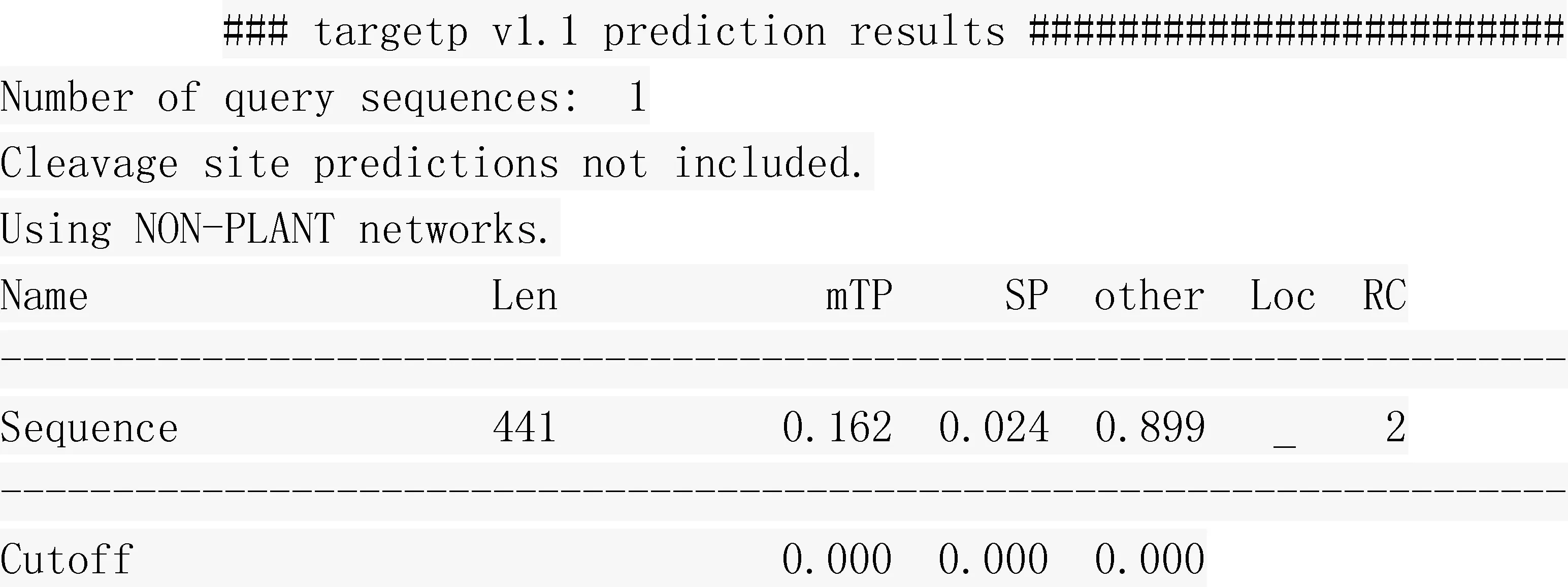
Len.氨基酸长度;Loc.基于mTP、SP和other 3项分数的高低对蛋白质叶细胞定位进行预测; -.代表其他;RC.可靠性评测值,分数由高到底分为1~5级,分数越低,预测越可靠Len.Sequence length;Loc.PredI:Ction of localization based on the scores of mTP,SP and other;-.Any other location;RC.Reliability class,scores from high in the end is divided into 1 to 5,the lower the score,the more reliable prediction图5 猪SOCS4氨基酸序列亚细胞定位分析Fig.5 The subcellular location analyses of pig SOCS4
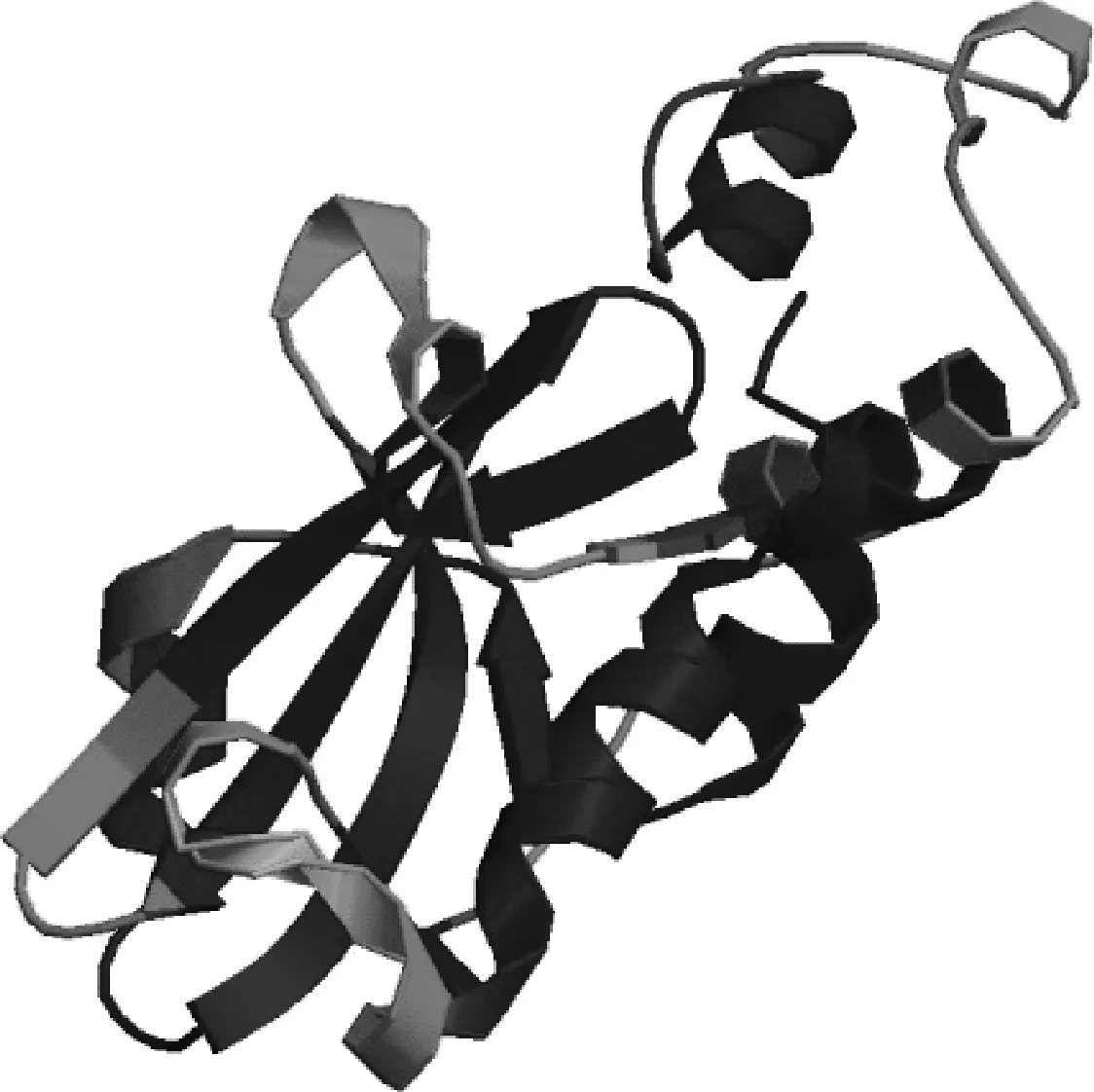
图6 猪SOCS4蛋白质三维结构模型Fig.6 The 3-dimensional structure model prediction of pig SOCS4
2.7 热应激条件下SOCS4的表达
本地土杂猪在高温环境处理后的第1和第3天,小肠和脾组织中SOCS4 mRNA表达量显著下调(P<0.05)。在胸腺组织中,SOCS4 mRNA的表达量在第3和第9天显著上调(P<0.05)。而在肠系膜淋巴结中,SOCS4的表达量在高温处理后的第1、6和9天显著上调(P<0.05)(图7)。
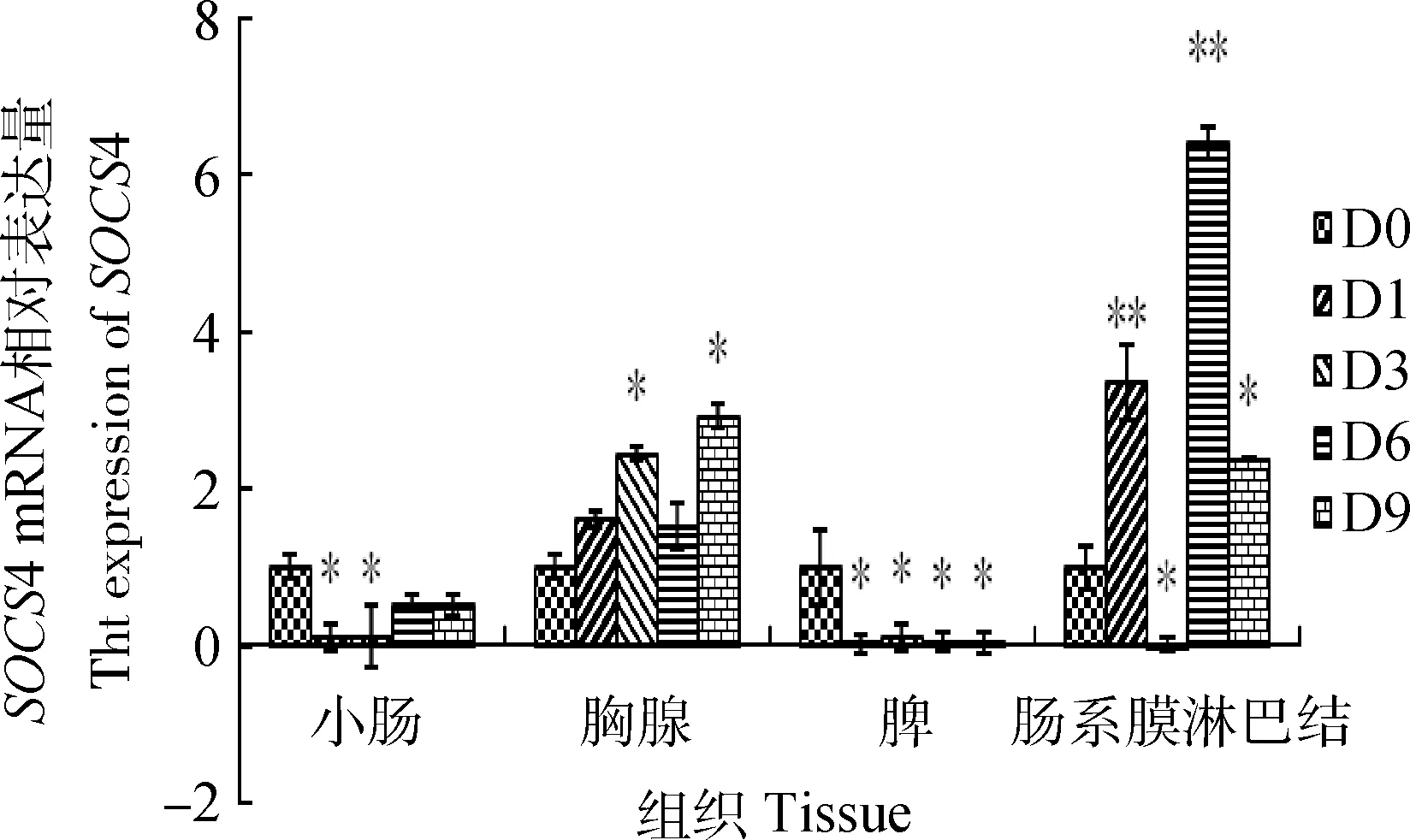
D0、D1、D3、D6和D9分别代表第0、1、3、6和9天;“**”表示差异极显著(P<0.01),“*”表示差异显著(P<0.05)D0,D1,D3,D6 and D9.The 0 day,1 day,3 day,6 day and 9 day,respectively.“*” and “**” indicated the difference are significant (P<0.05) and highly significant (P<0.01)图7 热应激不同时段SOCS4基因在肠系膜淋巴结、脾、胸腺和小肠中的表达Fig.7 The expression of SOCS4 mRNA at different time in indicated tissues by real-time PCR
3 讨 论
人类的SOCS4基因编码440个氨基酸的前体蛋白,而小鼠SOCS4基因编码的前体蛋白为436个氨基酸。本研究发现,本地土杂猪SOCS4基因同长白猪[21]一样,编码441个氨基酸的前体蛋白。同其他家族成员一样,SOCS4基因具有家族特异性的C端40个氨基酸的SOCS box区、中央SH2区和N末端区。虽然SOCS蛋白N末端结构域具有高度无序性,但SOCS4和SOCS5的N末端却存在一段保守序列(NTCR4-5)[16]。据报道,SOCS4的这段保守序列包含3个短小螺旋(88LKQKLQDAVG97,120HISELM125,和136DLAFRWHFIKR146)[22],而本研究发现,SOCS4的N末端保守域内同样存在这3段序列(图3)。序列同源对比发现,本地土杂猪SOCS4在不同哺乳动物物种之间相似性较高,多在90%以上。可见SOCS4基因在进化过程中具有高度保守性。
SOCS家族成员之间具有高度保守的中央SH2和SOCS box结构域。其中,中央SH2区参与识别同源磷酸酪氨酸基序[14],SOCS box则与延伸因子B、C、卡林5和环指结构域蛋白共同作用,来招募E2泛素交联酶,形成复杂的泛素机制,不仅可以使目标蛋白降解[23],还可保护SOCS蛋白免受蛋白酶体介导的干扰[24]。尽管SOCS4的泛素化机制尚未被证实,但它却可以通过结合EGFRpY1092因子来参与调解STAT3信号,而且低摩尔的SOCS4还能与JAK2pY1007结合发挥作用[25]。而由于N末端长度不一,结构和功能的变化较大,使得SOCS成员之间的三维结构并不存在相似性[25]。本研究中,猪SOCS4 N端由285个氨基酸残基组成,占自身总蛋白近2/3。其N末端结构域“NTCR4-5”除了有着蛋白整体的支架作用外[26],这段较为保守的序列是否还存在其它特殊功能,或是否在热应激诱发的免疫抑制中发挥作用,还有待进一步研究。
SOCS蛋白在CD4+T细胞的分化中扮演着重要的角色。研究显示,在T细胞分化时,SOCS4在小肠、大肠和胸腺组织上出现高表达[12]。胃癌细胞SOCS4启动子区的高甲基化可调节或参与肿瘤的生长[27]。人胆管上皮细胞SOCS4的表达受微小隐孢子虫的诱导可调节STAT3和STAT6的磷酸化[28]等。可见,SOCS4广泛参与了机体的生理病理变化。本研究中,高温条件下SOCS4表达量在小肠和脾脏组织中显著下调,而在胸腺组织上第3和9天的表达量显著上调,肠系膜淋巴结组织上的表达量不仅在第1和第6天表现极显著上调,且第9天也上调明显。说明SOCS4的表达量在高温环境下的猪各组织发生了变化,且呈组织和时间依赖性。处理时间的长短可能直接影响机体的状态,而不同状态下SOCS4也可能发挥不同的作用。根据报道,温和及较短时间的应激处理能增强机体的免疫力,而高强度、长时间的应激处理,动物出现明显的免疫抑制和炎性因子的紊乱现象[29]。此外,高温热应激可通过TLR4或TLR2调节炎性因子TNF-α、IL-6和IL-12等的表达[30],而IL-12、TNF-α等细胞因子的高分泌则是CD4+T细胞向Th1的方向分化的标志[31],进而引发自身免疫、迟发型超敏反应(DTH)等。但在热应激猪,SOCS4与TLRs介导的信号通路以及各种炎症因子之间的调控机制尚需进一步研究。
4 结 论
本研究成功克隆了猪SOCS4基因,并发现其在热应激条件下的表达发生明显的改变,且呈组织和时间依赖性。
[1] ST-PIERRC N,COBANOV B,SCHNITKCY G.Economic losses from heat stress by US livestock industries[J].JDairySci,2003,86:E52-E77.
[2] 巨向红,雍艳红,何健娥,等.热应激对巴马香猪免疫和生化指标的影响[J].中国畜牧杂志,2009,45:13. JU X H,YONG Y H,HE J E,et al.Effect of heat stress on baceline immune and bloood biochemical index in Ba-Ma miniature pig[J].ChineseJournalofAnimalScience,2009,45:13.(in Chinese)
[3] JU X H,YONG Y H,XU H J,et al.Impacts of heat stress on baseline immune measures and a subset of T cells in Bama miniature pigs[J].LivestSci,2011,135(2):289-292.
[4] HOOPER C.Effects of severe heat stress on immune function,biochemistry and histopathology in farmed Australian abalone[J].Aquaculture,2014,432:26-37.
[5] JU X H,YONG Y H,XU H J,et al.Selection of reference genes for gene expression studies in PBMC from Bama miniature pig under heat stress[J].VetImmunolImmunopathol,2011,144(1-2):160-166.
[6] JU X H.Heat stress upregulates the expression of TLR4 and its alternative splicing variant in Bama miniature pigs[J].JIntAgric,2014,13(11):2479-2487.
[7] JU X H,XU H J,YONG Y H,et al.Heat stress upregulation of Toll-like receptors 2/4 and acute inflammatory cytokines in peripheral blood mononuclear cell (PBMC) of Bama miniature pigs:aninvivoandinvitrostudy[J].Animal,2014,8(9):1462-1468.
[8] 徐汉进,雍艳红,安立龙,等.巴马香猪 TLR2 基因 cDNA 的克隆及生物信息学分析[J].中国兽医学报,2010,7:949-953. XU H J,YONG Y H,AN L L,et al.Cloning and bioinformatics analysis of TLR2 cDNA:in Bama miniaturc pig[J].ChineseJournalofVeterinaryScience,2010,7:949-953.(in Chinese)
[9] 巨向红,徐汉进,雍艳红,等.巴马香猪 Toll 样受体 4 基因 cDNA 的克隆及生物信息学分析[J].中国实验动物学报,2010,18(3):185-190. JU X H,XU H J,YONG Y H,et al.Cloning and bioinformatics analysis of TLR4 cDNA in Bama miniature pig[J].ActaLaboratoriumAnimalisScientiaSinica,2010,18(3):185-190.(in Chinese)
[10] ALEXANDER W S,STARR R,FENNER J E,et al.SOCS1 is a critical inhibitor of interferon γ signaling and prevents the potentially fatal neonatal actions of this cytokine[J].Cell,1999,98(5):597-608.
[11] CROKER B A,KREBS D L,ZHANG J G,et al.SOCS3 negatively regulates IL-6 signalinginvivo[J].NatImmunol,2003,4(6):540-545.
[12] DELGADO-ORTEGA M,MELO S,MEURENS F.Expression of SOCS1-7 and CIS mRNA in porcine tissues[J].VetImmunolImmunopathol,2011,144(3):493-498.
[13] KILE B T,SCHULMAN B A,ALEXANDER W S,et al.The SOCS box:a tale of destruction and degradation[J].TrendsBiochemSci,2002,27(5):235-241.
[14] DELGADO-ORTEGA M,MARC D,DUPONT J L,et al.SOCS proteins in infectious diseases of mammals[J].VetImmunolImmunopathol,2013,151(1):1-19.
[15] YOSHIMURA A,NAKA T,KUBO M.SOCS proteins,cytokine signalling and immune regulation[J].NatRevImmunol,2007,7(6):454-465.
[16] FENG Z,CHANDRASHEKARAN I R,LOW A,et al.The N-terminal domains of SOCS proteins:A conserved region in the disordered N-termini of SOCS4 and 5[J].Proteins:Structure,Function,Bioinformatics,2012,80(3):946-957.
[17] CROKER B A,KIU H,NICHOLSON S E.SOCS regulation of the JAK/STAT signalling pathway[J].InSeminarsinCell&DevelopmentalBiol,2008,19(4):414-422.
[18] SUTHERLAND J M,KEIGHTLEY R A,NIXON B,et al.Suppressor of cytokine signaling 4 (SOCS4):moderator of ovarian primordial follicle activation[J].JCellPhysiol,2012,227(3):1188-1198.
[19] SEGATTO O,ANASTASI S,ALEMS.Regulation of epidermal growth factor receptor signalling by inducible feedback inhibitors[J].JCellSci,2011,124(11):1785-1793.
[20] SEKI Y,HAYASHI K,MATSUMOTO A,et al.Expression of the suppressor of cytokine signaling-5 (SOCS5) negatively regulates IL-4-dependent STAT6 activation and Th2 differentiation[J].ProcNatlAcadSci,2002, 99(20):13003-13008.
[21] 段庆梓,何夏萍,吕学斌,等.猪 SOSC1,SOCS3 和 SOCS4 基因克隆及组织表达研究[J].四川大学学报 (自然科学版),2012,49(5):1121-1128. DUAN Q Z,HE X P,LÜ X B,et al.Suppressor of cytokine signaling 1,3 and 4 genes in pigs(Susscrofa):cDNA cloning and tissue expression[J].JournalofSichuanUniversity(NaturalScienceEdition),2012,49(5):1121-1128.(in Chinese)
[22] CUFF J A,BARTON G J.Application of multiple sequence alignment profiles to improve protein secondary structure prediction[J].Proteins,2000,40(3):502-511.
[23] KAMURA T,MAENAKA K,KOTOSHIBA S,et al.VHL-box and SOCS-box domains determine binding specificity for Cul2-Rbx1 and Cul5-Rbx2 modules of ubiquitin ligases[J].GenesDev,2004,18(24):3055-3065.
[24] PIESSEVAUX G.Contrasting epistatic interactions between rat quantitative trait loci controlling mammary cancer development[J].MammalGenome,2009,20(1):43-52.
[25] PIESSEVAUX G,LELLA V,RIVIRE M,et al.Structure of the SOCS4-ElonginB/C complex reveals a distinct SOCS box interface and the molecular basis for SOCS-dependent EGFR degradation[J].Structure,2007,15(11):1493-1504.
[26] CORTESE M S,UVERSKY V N,DUNKER A K.Intrinsic disorder in scaffold proteins:getting more from less[J].ProgBiophysMolBiol,2008,98(1):85-106.
[27] KOBAYASHI D,NOMOTO S,KODERA Y,et al.Suppressor of cytokine signaling 4 detected as a novel gastric cancer suppressor gene using double combination array analysis[J].WorldJSurgery,2012,36(2):362-372.
[28] HU G,ZHOU R,LIU J,et al.MicroRNA-98 and let-7 regulate expression of suppressor of cytokine signaling 4 in biliary epithelial cells in response to Cryptosporidium parvum infection[J].JInfectsDiseases,2010,202(1): 125-135.
[29] LAMBERT G.Stress-induced gastrointestinal barrier dysfunction and its inflammatory effects[J].JAnimSci,2009,87(14 suppl):E101-E108.
[30] NAKA T,FUJIMOTO M,TSUTSUI H,et al.Negative regulation of cytokine and TLR signalings by SOCS and others[J].AdvImmunol,2005,87:61-122.
[31] 王明军.树突状细胞和 Th 细胞分化的关系[J].上海免疫学杂志,2001,21(5):320. VVANG M J.The relationship of dendritic cell and Th cell differentiation[J].ShanghaiJournalofImmunology,2001,21(5):320.(in Chinese)
(编辑 郭云雁)
Cloning and Bioinformatics Analysis of PorcineSOCS4 cDNA and Its Dynamic during Heat Stress
WANG Ping1,JU Xiang-hong2,3,5*,YONG Yan-hong2,JIA Ru-min1, MA Ming-long1,ZHAO Yun-tao4,LIAO Ming3,5
(1.DepartmentofAnimalScience,GuangdongOceanUniversity,Zhanjiang524088,China; 2.DepartmentofVeterinaryMedicine,GuangdongOceanUniversity,Zhanjiang524088,China; 3.KeyLaboratoryofAnimalDiseaseControlandPrevention,MinistryofAgriculture,Guangzhou510642,China; 4.ModernBiochemicalCenter,GuangdongOceanUniversity,Zhanjiang524088,China; 5.CollegeofVeterinaryMedicine,SouthChinaAgriculturalUniversity,Guangzhou510642,China)
The aim of this study was to systematically elucidate the mechanism of heat stress-induced swine immunosuppression,and inflammatory factors disorder.The TZ (Luchuan pig×Landrace pig)porcineSOCS4 gene was cloned in this study,it consisted of 1 326 bp of ORF encoding a protein with 441 amino acids,285 amino acids of them formed the N-terminal of SOCS4.It shared high amino acid sequence identity with that in Landrace pigs(100.0%),BosTaurus(96.1%),CapraHircus(96.1%),Feliscatus(95.2%),Equuscaballus(94.6%),Canislupusfamiliaris(94.3%),Homosapiens(93.0%) andMusmusculus(88.1%).The molecular weight of SOCS4 protein was 50.5 ku,and PI was 6.60.qRT-PCR results showed that the expression ofSOCS4 in thymus gland of TZ pigs was significantly upregulated on day 3 and 9 after heat stress began (P≤0.05).As well in mesenteric lymph node,where it significantly upregulated on day 1 and 6 (P≤0.01).The expression ofSOCS4 decreased significantly in small intestine and spleen of TZ pigs during heat stress (P≤0.05).The TZ porcineSOCS4 cDNA was cloned successfully,and a significant changes ofSOCS4 mRNA expression were appeared in heat stressed pigs with a tissue and time dependence manner.
pig;SOCS4;cloning;qRT-PCR;heat stress
10.11843/j.issn.0366-6964.2015.02.021
2014-06-12
国家自然科学基金(31101862);中国博士后科学基金
王 萍(1988-),女,甘肃定西人,硕士生,主要从事动物应激性致病机理研究,E-mail: 870727290@qq.com
*通信作者:巨向红,博士,副教授,E-mail: juxh77@163.com
S858.31
A
0366-6964(2015)02-0323-09
