牦牛Fas和FasL基因克隆及其在主要组织器官中的表达
2015-03-22樊江峰余四九
樊江峰,陈 鹏,崔 燕,余四九,*
(1.甘肃农业大学动物医学院,兰州 730070; 2.甘肃省牛羊胚胎工程技术研究中心,兰州 730070)
牦牛Fas和FasL基因克隆及其在主要组织器官中的表达
樊江峰1,2,陈 鹏2,崔 燕1,余四九1,2*
(1.甘肃农业大学动物医学院,兰州 730070; 2.甘肃省牛羊胚胎工程技术研究中心,兰州 730070)
为了进一步理解Fas/FasL 系统,本研究拟克隆牦牛Fas和FasL基因,并对2个基因在各组织器官中的表达进行检测。采用RT-PCR方法克隆牦牛Fas和FasL基因,并利用相关软件进行生物信息学分析,结合RT-PCR方法及免疫组织化学方法对2个基因在牦牛主要组织器官中的表达进行检测。克隆得到了2 605 bp的牦牛Fas基因 cDNA和1 572 bp 的FasL基因 cDNA序列,与黄牛的相应序列有很高的同源性(分别为99.1%和99.4%)。除了在心中只检测到FasmRNA外,Fas和FasLmRNA共同表达于所有检测的组织中,且2个基因均在肝、脾、肾、淋巴结、胸腺和睾丸中强表达。免疫组化检测发现FasL蛋白存在于多种体细胞的胞浆中。结果表明,除了在淋巴器官和免疫赦免位点外,Fas和FasL还强表达于其他器官如肾和肝,表明Fas/FasL系统比以前所了解的要复杂。
Fas;FasL;基因克隆;表达;牦牛
Fas抗原,也称CD95、APO-1或TNFRSF6,是一种Ⅰ型膜蛋白,其分子大小为45 ku,属于肿瘤坏死因子(TNF)/神经生长因子受体家族[1]。 Fas抗原的胞外区含有3个富含半胱氨酸的重复区,为其配体识别位点;胞质区域含有一段约80个氨基酸的保守序列,称为“死亡域”,能将胞外的凋亡信号传到胞内[2]。Fas基因分别位于小鼠的19号和人的10号染色体上,包含9个外显子[3-4]。Fas抗原广泛地表达于淋巴性及非淋巴性组织和细胞[5-6]。FasL为Fas的天然配体,是一种40 ku的Ⅱ型膜蛋白,属于肿瘤坏死因子家族[7]。FasL基因位于小鼠和人的1号染色体上,包含5个外显子;FasL蛋白表达于多种组织,如眼睛、睾丸、胸腺、胎盘、食管及子宫等[5-6,8]。
Fas与FasL或Fas抗体结合后,导致Fas发生寡聚反应,随之引起死亡诱导信号复合体(DISC)的组装,该复合体激活起始Caspase,引起一系列酶的级联反应,最终导致Fas阳性细胞凋亡[9]。Fas/FasL凋亡通路最初在淋巴细胞稳态中被描述,认为与免疫系统的几个重要功能有关[10]。2种突变型小鼠(lpr小鼠和gld小鼠)在对Fas/FasL系统介导凋亡的研究中起了重要作用。lpr小鼠Fas基因的第2外显子插入了1个转座元件,导致不能转录出全长的FasmRNA,最终产生缺陷的Fas蛋白;gld小鼠的FasL基因发生点突变导致FasL蛋白胞外区的1个氨基酸发生改变,从而产生无功能的FasL蛋白。2种小鼠表现为以CD4-CD8-T细胞积累和自身性抗体产生为特点的淋巴组织增生和自身免疫性疾病,对这些小鼠的研究表明,Fas/FasL凋亡通路参与了外周淋巴器官中的自身反应性T细胞克隆的删除及与抗原反应后被激活的T细胞的消除。此外,Fas/FasL凋亡通路是细胞毒性T细胞杀死靶细胞的一种机制[11-13];FasL结构性的表达于多种免疫赦免位点,如眼睛、胎盘突和睾丸等,研究发现,FasL可以诱导侵入眼睛应答病毒感染对Fas敏感的炎性细胞的凋亡[14],结合其他证据表明FasL参与了眼睛免疫赦免现象[15],因此研究者们怀疑Fas/FasL系统能够介导浸入免疫赦免位点的淋巴细胞的凋亡,从而参与免疫赦免现象的维持;另外,FasL在多种肿瘤组织和细胞上表达,暗示Fas/FasL系统可能与肿瘤的免疫逃逸机制有关[16]; Fas/FasL系统还在病毒性疾病中被诱导,可能与病毒的发病机制及疾病进程有关[17]。近年来,越来越多的证据表明活化Fas可以导致非凋亡结果,如细胞增殖[18];例如,在人红细胞生成早期,Fas引起的caspase活化为红细胞生成提供一个阳性刺激,而非改变细胞增殖或引起凋亡[19]。
细胞凋亡是由基因控制的细胞主动死亡的现象,是在进化中保守的生物化学过程,对维持多细胞生物体的正常发育、组织和细胞的更新、清除自身反应性淋巴细胞,维持内环境稳态具有重要意义。尽管由Fas/FasL系统介导的细胞凋亡是细胞凋亡途径中研究的最为详尽的凋亡通路,但现有的研究主要集中在人和小鼠的免疫系统、免疫赦免位点以及肿瘤细胞和组织,有关Fas/FasL系统在其他组织中功能的研究相对较少,且研究Fas和FasL的资料在别的动物上还很罕见,为了进一步理解该系统,并为以后研究Fas/FasL系统提供资料依据,本研究克隆牦牛的Fas和FasL基因,并进行相关的生物信息学分析,对2个基因在牦牛各主要组织器官中的表达进行检测。
1 材料与方法
1.1 主要试剂
Ficoll-PaqueTMPLUS购自Amersham Biosciences;Trizol试剂、GoldScript cDNA synthesis kit 及TA Cloning kit购自英骏公司;Ex Taq Mix 和TaKaRa LA Taq购自宝生物公司;抗体购自Abcam(rabbit polyclonal to CD95,ab82419;rabbit polyclonal to FasL,ab2440);PV-9000 polymer detection system for immunohistological staining kit、DAB kit 及防脱片购自中杉金桥生物技术有限公司;Gel Extraction Spin Kit购自GENOMED,其余试剂均为国产分析纯。
1.2 试验方法
1.2.1 样品采集 血样采自青海省西宁市屠宰场,颈静脉采血,ACD抗凝,迅速带回实验室分离淋巴细胞。组织样除睾丸、卵巢、子宫、黄体、输卵管、胎盘突及泌乳乳腺采自西宁屠宰场成年牦牛外,其余的均采自大通牦牛场5月龄的屠宰小牛。动物屠宰后,用无菌剪刀迅速采集样品,无菌生理盐水将样品冲洗干净后修成约1.0 cm×1.0 cm×0.5 cm大小后,用于RT-PCR的样品迅速投入液氮中,用于免疫组化的样品固定于4%多聚甲醛中,带回实验室后换1次新鲜的固定液,4 ℃保存。所有组织样品均采集3份,来自不同牦牛个体。
1.2.2 总RNA提取 血样淋巴细胞用Ficoll-PaqueTMPLUS分离。Trizol法提取血样及组织样总RNA, 1.5%琼脂糖凝胶电泳及紫外分光光度计检测总RNA的质量,-70 ℃保存备用。
1.2.3 基因克隆及生物信息学分析 利用RT-PCR法克隆牦牛Fas和FasL基因。基于黄牛Fas(GenBank 登录号:NM_174662)和FasL(GenBank 登录号:NM_001098859)的cDNA序列,用Primer Premier 5软件在两个基因的编码区侧翼设计引物。得到3对引物(表1),引物1和引物2用于Fas基因克隆,引物3克隆FasL基因。引物1产物的3′和引物2产物的5′重叠。采用β-actin为内参基因,β-actin引物引自Ann-Sofi Bergqvist[20]。用Invitrogen公司的GoldScript cDNA synthesis kit试剂盒,以Oligo dT为引物,按说明进行cDNA第一链合成。得到的cDNA用作随后PCR扩增的模板。引物1、引物2、引物3及β-actin引物的扩增体系相同:上下游引物各0.5 μL(10 pmol·L-1),2 μL模板cDNA,0.2 μL LATaqDNA polymerase,1 μL 10 mmol·L-1dNTP,2 μL 10 ×LA Taq buffer 和18.8 μL 无菌去离子水。引物1、引物2、引物3的扩增条件除Tm值外均相同,如下:94 ℃预变性3 min;94 ℃ 30 s,Tm (引物1、引物2、引物3的Tm值分别为60、53、55 ℃) 50 s,72 ℃ 2 min,35个循环;72 ℃延伸 10 min。β-actin引物的扩增条件:94 ℃预变性3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃1 min,35个循环;72 ℃延伸 10 min。扩增产物的大小及质量用2%琼脂糖凝胶电泳检测。用凝胶回收试剂盒回收目的片段,克隆后筛选阳性克隆送交华大基因公司测序。
表1 试验中所用引物
Table 1 Primers used in this study

引物名称Primer上游(5'-3')Upstream下游(5'-3')Downstream产物大小/bpProductsize引物1AGTCGGGGCTCACTACTCAC(61)TGGAATGGGGTCAACCTGTG(1506)1465引物2TGTTCATCTTCTTGCCTGTT(1378)TTAGGTAGTTCGGAGCATC(2646)1287引物3TTCCTTCTCTTGAGCAGTCA(79)CACACACACACACCCCTACA(1631)1572β-actin引物GACCCAGATCATGTTTGAGACCATCTCCTTCTGCATCCTGTCAG598Fas检测引物TTTTGTTGTCAGCCTTGTCC(308)CATTTGGTGTTGCTCGTTGG(630)323FasL检测引物CAGCAGCCCTTGAATTACC(195)CTCCATCAGCACCATGTCC(857)663
括号中数字表示引物在参考序列中的位置
Numbers in brackets indicate the location of primers in reference sequences
利用DNAMAN软件进行序列组装、同源性分析、系统进化树分析、基因编码蛋白质序列的推导,利用NCBI的BLAST软件对克隆测序后的目的基因进行比对分析,使用ORF Finder软件进行ORF分析(http:// www.ncbi.nlm.nih.gov/gorf/gorf.html)。利用SignalP软件进行信号肽预测(http://www.cbs.dtu.dk/services/ SignalP-2.0/)和TMHMM软件进行跨膜区分析(http://www.cbs.dtu.dk/ services/TMHMM/)。用于同源性及系统进化分析的其他物种的Fas及FasL基因序列从GenBank上下载,登录号分别见表2和表3。
1.2.4 RT-PCR分析 对牦牛的各种组织进行RT-PCR分析,每个组织样品做3次平行,用于平行试验的同一组织样品来自3个不同牦牛个体。检测的组织:心、肝、脾、肺、肾、大脑、丘脑、垂体、脊髓、眼角膜、淋巴结、胸腺、骨骼肌、卵巢、子宫、输卵管、黄体、睾丸、胎盘突、乳腺、食管、真胃和结肠。cDNA第一链的合成与基因克隆步骤中相同。在基因的编码区内设计引物,目的产物跨越该基因不同的外显子。得到Fas及FasL检测引物(表1),仍以基因克隆步骤所用β-actin引物作为内参。Fas、FasL和β-actin引物的扩增体系相同:上下游引物各0.5 μL (10 pmol· L-1),2 μL cDNA 模板,12.5 μL ExTaqDNA 聚合酶,9.5 μL 无菌去离子水,总体系为25 μL。3对引物的扩增条件除退火温度不同外其余均相同:94 ℃预变性3 min;94 ℃ 30 s,Tm (Fas、FasL和β-actin引物的Tm值分别为54、55、58 ℃) 30 s,72 ℃ 1 min,33个循环;72 ℃延伸7 min。DNA污染检测在反转录时用去离子水代替反转录酶。取10 μL扩增产物用2%琼脂糖凝胶电泳进行检测,凝胶成像系统拍照,图片用Adobe Photoshope CS软件连接和标记。用凝胶回收试剂盒回收目的片段,送交生物公司测序以确定是否为目的产物。
1.2.5 免疫组化分析 保存于4 ℃,4%多聚甲醛固定的组织按常规方法进行石蜡包埋,4 μm厚切片,37 ℃烤片24 h。二甲苯脱蜡,梯度酒精水合,0.01 mol·L-1PBS(pH 7.4)浸泡5 min后进行抗原修复,具体步骤:将切片置于一含有约500 mL 0.01 mol·L-1(pH 6.0)柠檬酸盐的塑料罐中,置于微波炉(LG,WP700)中,调至高火加热,沸腾2 min后调至低火保持15 min,自然冷却。0.01 mol·L-1PBS(pH 7.4)洗3 min×2次;0.3% H2O2室温孵育10 min以消除内源性过氧化物酶;0.01 mol·L-1PBS(pH 7.4)洗3 min×3次,滴加一抗(用 PBS 将Fas抗体稀释80倍,FasL抗体稀释120倍),湿盒中37 ℃孵育2 h;0.01 mol·L-1PBS(pH 7.4)洗3 min×3次,免疫反应用PV-9000 polymer detection system for immunohistological staining kit,依据说明进行检测,DAB显色,苏木精复染,脱水透明后中性树脂封片,镜检照相。阴性对照用PBS代替一抗。
2 结 果
2.1Fas及FasL基因克隆及生物信息学分析
如预期结果,用引物1和引物2分别扩增得到1 465和1 287 bp cDNA序列,组装后得到2 605 bp的牦牛Fas基因cDNA序列。生物信息学分析表明该序列包含86 bp的5′非翻译区,969 bp的编码区和1 550 bp的3′非翻译区。969 bp的编码区编码1段长323个氨基酸的蛋白质序列,预计的分子量为36.22 ku,理论等电点为7.02。牦牛Fas蛋白在氨基端有1段长22个氨基酸残基的信号肽序列,中间有1段20个氨基酸的跨膜区,将整个蛋白分成胞外区(148个氨基酸残基)和胞质区(133个氨基酸残基)。用引物3扩增得到1 572 bp的牦牛FasL基因cDNA序列,大小与预期结果一致。该序列包含114 bp的5′非翻译区,831 bp的编码区和627 bp的3′非翻译区。牦牛FasL基因的编码区编码277个氨基酸序列,生物信息学分析显示羧基端179个氨基酸残基在胞外,氨基端75个氨基酸残基在胞内,跨膜区含23个氨基酸残基,无信号肽序列。克隆得到的牦牛Fas和FasL基因序列提交保存到GenBank中,收录号分别为JN880421和JN880420。
利用DNAMAN软件对牦牛Fas和FasL的核苷酸序列及氨基酸序列进行同源性分析,结果见表2和表3。Fas和FasL氨基酸序列的系统进化树分别如图1A和1B。
2.2 RT-PCR检测Fas及FasL基因在牦牛各器官中的表达
采用RT-PCR法对Fas和FasL基因在牦牛各组织中的表达进行分析,同一组织做3次平行试验,样品来自3个不同牦牛个体,结果见图2和表4。尽管未做定量分析,但不同组织目的条带亮度的差异可在平行试验中重复观察到,说明不同组织间条带亮度的差异是由目的基因mRNA浓度的差异而非试验误差引起。FasmRNA在所有被检测的组织中均表达,而在肝、脾、肾、淋巴结、睾丸、胎盘突、泌乳乳腺中表达量明显高于其他组织。FasLmRNA除在心中未检测到外,在别的器官中均能检测到,同Fas一样,在脾、肝、肾、淋巴结、胸腺、睾丸和胎盘突中强表达,而在别的器官中弱表达。
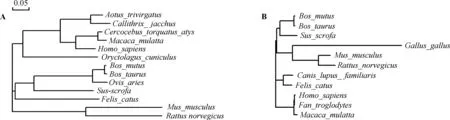
图1 不同物种Fas(A)和FasL(B)系统进化分析Fig.1 The evolution of Fas (A) and FasL (B) amino acid sequences among different species
表2 牦牛和不同物种间Fas基因序列和氨基酸序列同源性比较
Table 2 Homologous comparisons of nucleotide and amino acid sequences of yakFasgene with other species
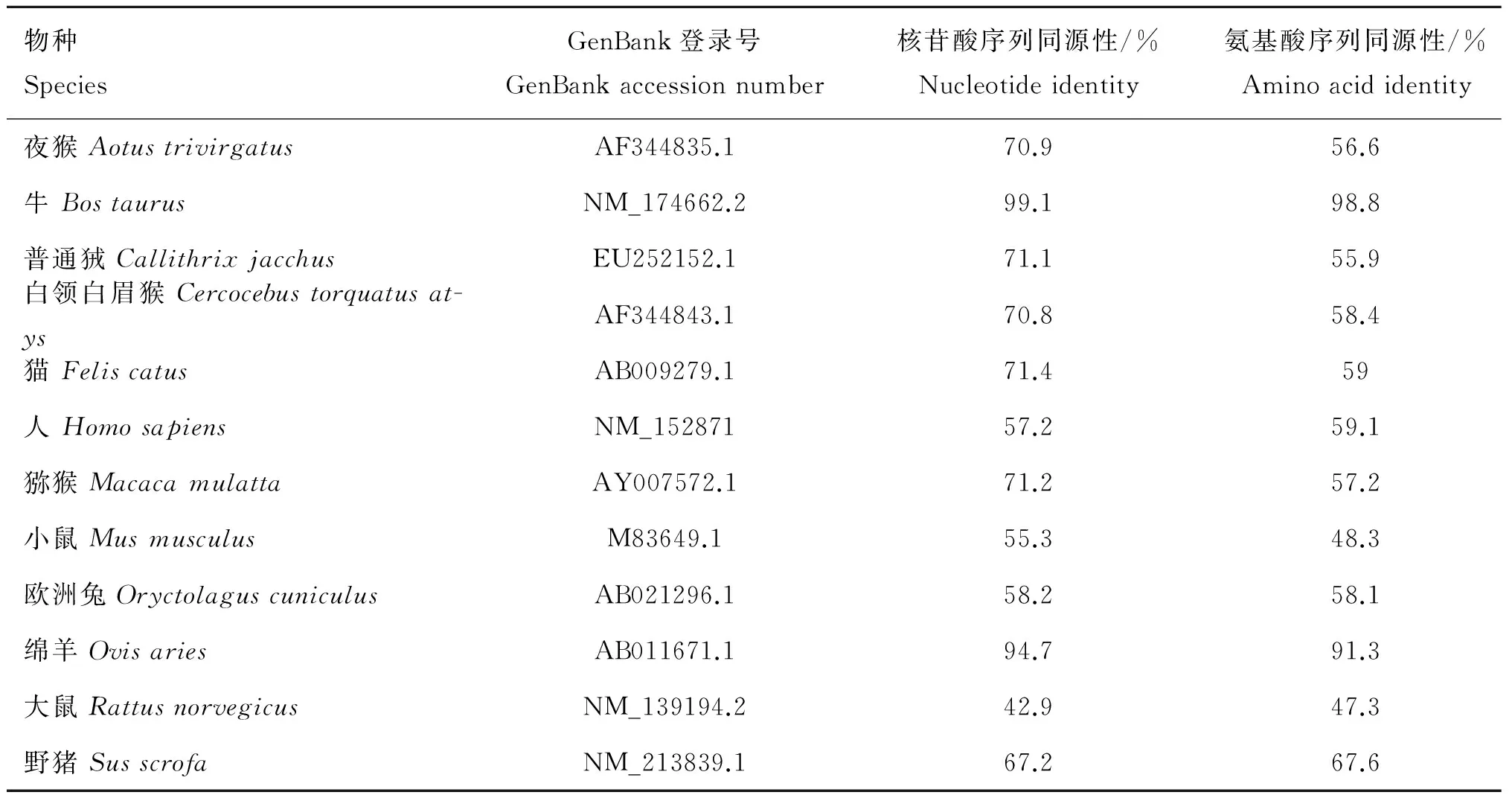
物种SpeciesGenBank登录号GenBankaccessionnumber核苷酸序列同源性/%Nucleotideidentity氨基酸序列同源性/%Aminoacididentity夜猴AotustrivirgatusAF344835.170.956.6牛BostaurusNM_174662.299.198.8普通狨CallithrixjacchusEU252152.171.155.9白领白眉猴Cercocebustorquatusat-ysAF344843.170.858.4猫FeliscatusAB009279.171.459人HomosapiensNM_15287157.259.1猕猴MacacamulattaAY007572.171.257.2小鼠MusmusculusM83649.155.348.3欧洲兔OryctolaguscuniculusAB021296.158.258.1绵羊OvisariesAB011671.194.791.3大鼠RattusnorvegicusNM_139194.242.947.3野猪SusscrofaNM_213839.167.267.6
表3 牦牛和不同物种间FasL基因序列和氨基酸序列同源性比较
Table 3 Homologous comparisons of nucleotide and amino acid sequences of yakFasLgene with other species
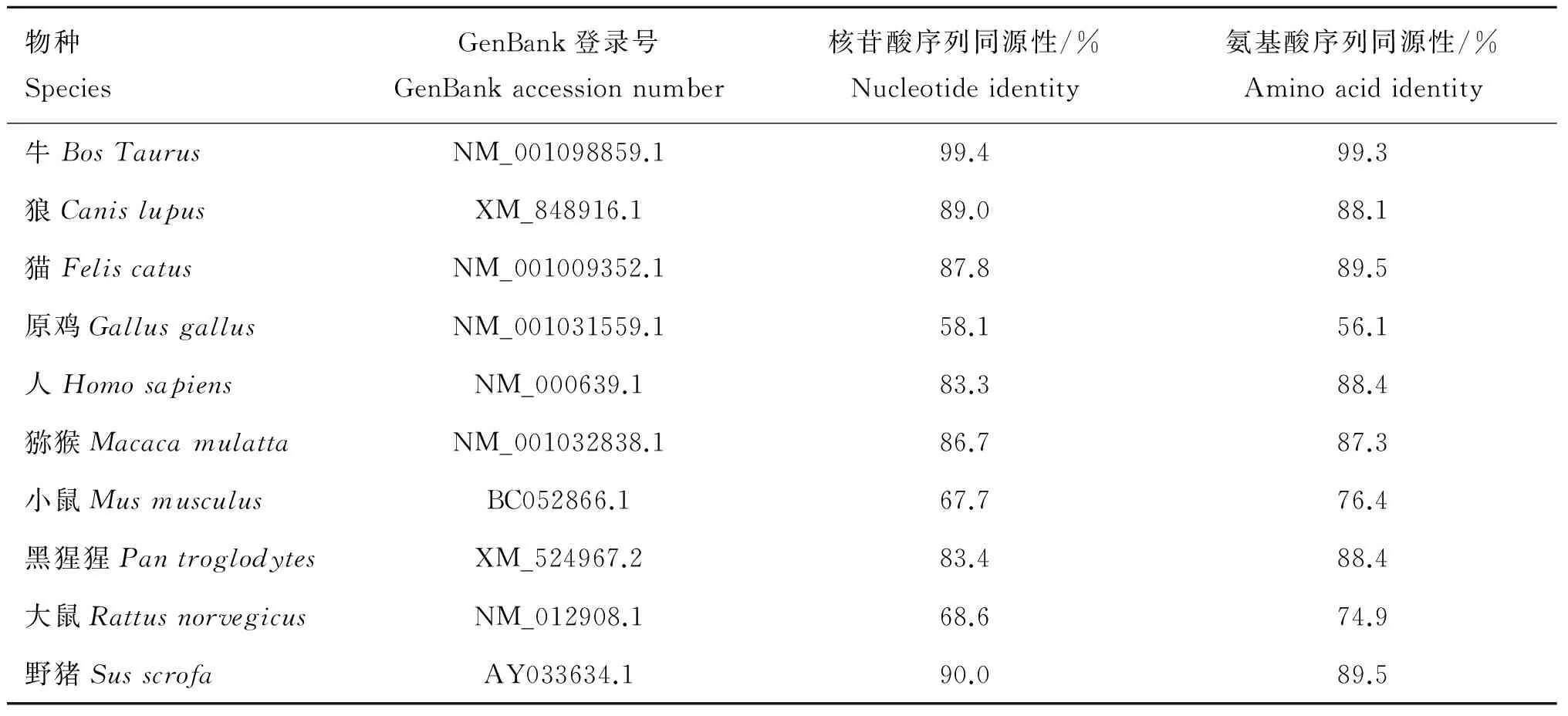
物种SpeciesGenBank登录号GenBankaccessionnumber核苷酸序列同源性/%Nucleotideidentity氨基酸序列同源性/%Aminoacididentity牛BosTaurusNM_001098859.199.499.3狼CanislupusXM_848916.189.088.1猫FeliscatusNM_001009352.187.889.5原鸡GallusgallusNM_001031559.158.156.1人HomosapiensNM_000639.183.388.4猕猴MacacamulattaNM_001032838.186.787.3小鼠MusmusculusBC052866.167.776.4黑猩猩PantroglodytesXM_524967.283.488.4大鼠RattusnorvegicusNM_012908.168.674.9野猪SusscrofaAY033634.190.089.5
2.3 免疫组化检测Fas和FasL在牦牛各器官中的表达
试验中所用Fas和FasL抗体均为兔抗鼠多克隆抗体(rabbit polyclonal to CD95,ab82419;rabbit polyclonal to FasL,ab2440)。Fas在所有组织中均未检测到阳性反应,可能由抗原之间的种属差异性造成。而FasL在肾、肝、垂体、真胃、子宫、结肠、胎盘突和黄体中检测到了阳性反应,如图3。在肾的近曲小管、远曲小管、肾小球和集合管中均有阳性反应,但在近曲小管中反应较强(图3a);肝中在肝细胞的胞质中有斑点状的阳性反应(图3b);腺垂体远侧部的部分细胞呈阳性(图3c);真胃的部分壁细胞和主细胞呈阳性(图3d);子宫和结肠腺体细胞呈阳性(图3e和图3f);在胎盘突中,部分滋养层巨细胞(包括单核和双核)呈阳性(图3g);黄体中多数颗粒性黄体细胞呈阳性(图3h)。阴性对照均呈阴性(资料未显示)。RT-PCR结果及免疫组化结果见表4。

1.心;2.肝;3.脾;4.肺;5.肾;6.大脑;7.丘脑;8.垂体;9.脊髓;10.眼角膜;11.淋巴结;12.胸腺;13骨骼肌;14.卵巢;15.子宫;16.输卵管;17.黄体;18.睾丸;19.胎盘突;20.乳腺;21.食管;22.真胃;23.结肠1.Heart;2.Liver;3.Spleen;4.Lung;5.Kidney;6.Brain;7.Thalamus;8.Pituitary gland;9.Spinal cord;10.Cornea;11.Lymph node;12.Thymus;13.Skeletal muscle;14.Ovary;15.Uterus;16.Oviduct;17.Corpus luteum;18.Testis;19.Placentome;20.Breast;21.Esophagus;22.Abomasums;23.Colon图2 Fas和FasL 在牦牛各组织中的表达Fig.2 Expression of Fas and FasL in yak tissues
3 讨 论
本试验克隆得到了包含完整编码区的牦牛Fas和FasL基因cDNA序列。人、小鼠和牛的Fas抗原分别由335、327和323个氨基酸组成,均在氨基末端有一信号肽序列。成熟的Fas抗原可分为胞外区、跨膜区和胞质区;胞外区富含半胱氨酸,可分为3个亚区域,是TNFR家族共同的特征,为各自配体提供识别位点;Fas抗原的胞质区域含有一段保守序列,称为“死亡域”,在TNFR家族中高度保守,其作用为将胞外的凋亡信号转到到胞内[4,21-22]。分析发现,牦牛Fas抗原由323个氨基酸残基组成,同人、小鼠和牛的一样,氨基端含有长22个氨基酸残基的信号序列,中间有1段20个氨基酸的跨膜区,将整个蛋白分成胞外区和胞质区,胞外区富含半胱氨酸,可分为3个亚区域,胞质区含有 “死亡域”。人、小鼠和牛的FasL分别由281、279 和278个氨基酸组成,末端无信号肽序列,中间有一段疏水序列,提示其为Ⅱ型膜蛋白;FasL的羧基末端在胞外,富含脯氨酸的氨基末端在胞内[7,23-24]。如结果所述,牦牛的FasL由277个氨基酸残基组成,胞外区含179个氨基酸残基,胞质区含75个氨基酸残基,跨膜区含23个氨基酸残基。同源性分析发现两个基因均与其他物种的相应序列有较高的同源性,与黄牛的同源性均在99%以上(表2和表3)。系统进化树分析表明,Fas和FasL在不同物种间同源性的高低与动物学分类结果一致,这种同源性不仅在一定程度上代表着物种亲缘关系的远近,同时也反映了蛋白质结构上的稳定性对其功能的重要性。此外,FasL在进化过程中似乎比Fas较为保守(图1)。
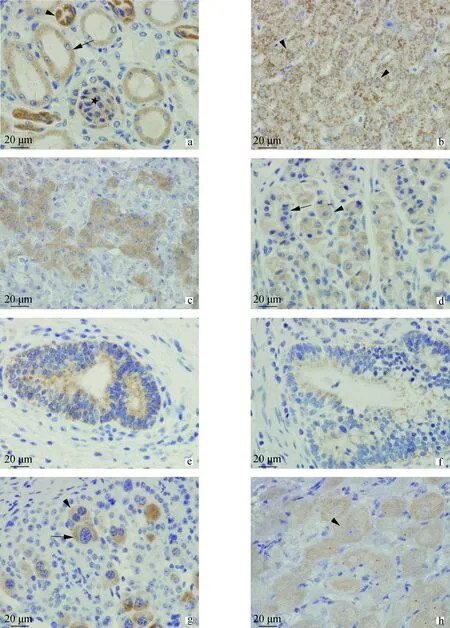
a.肾,近曲小管呈强阳性(如箭头所示),远曲小管(带尾箭头)和肾小球(星号)呈较强阳性;b.肝,肝细胞胞质中呈斑点状着色;c.垂体,腺垂体远侧部部分细胞呈强阳性;d.真胃,壁细胞(箭头)和部分主细胞(带尾箭头)呈阳性;e.子宫,腺体细胞呈阳性;f.结肠,腺体细胞呈阳性;g.胎盘突,部分单核(带尾箭头)和双核(箭头)滋养层巨细胞呈强阳性;h.黄体,颗粒性黄体细胞呈阳性(箭头)a.Kidney,strongly reaction are found in proximal convoluted tubules (arrowhead) and moderately stained are found in distal convoluted tubules (arrow),glomerulus (stellate);b.Liver,positive stains are found in cytoplasm of liver cells;c.Pituitary gland,positive reaction is found in cytoplasm of partial adenohypophysis cells;d.Abomasums,positive stains are found in cytoplasm of parietal cells (arrowhead) and some chief cells (arrow);e.Uterus,positive reaction is only found in gland;f.Colon,positive stains are only found in gland;g.Placentome,positive stains could be found in cytoplasm of both mononuclear (arrow) and binuclear (arrowhead) trophoblast giant cells;h.Corpus luteum,positive reaction is found in cytoplasm of granular lutein cell (arrowhead)图3 FasL蛋白在牦牛各器官中的定位Fig.3 Immunolocalization of FasL in yak tissues
表4Fas和FasL基因mRNA和FasL蛋白在牦牛各组织中的表达
Table 4 Expression ofFas,FasLmRNA and FasL in yak tissues

组织TissueRT-PCR检测RT-PCRpositivityFasFasLFasL免疫组化反应ImmunohitochemistrypositivityofFasL心Heart0.7620.000NF肝Liver1.8960.850####脾Spleen1.8842.107NF肺Lung1.4580.735NF肾Kidney3.0421.258####大脑Brain1.3960.280NF丘脑Thalamus1.4510.109NF垂体Pituitary1.250.559###脊髓Spinalcord1.770.609NF眼角膜Cornea0.8220.064NF淋巴结Lymphnode2.8581.312NF胸腺Thymus0.9470.740NF骨骼肌Skeletalmuscle1.0070.472NF卵巢Ovary0.9570.647NF子宫Uterus0.8930.122##输卵管Oviduct0.5040.973NF黄体Corpusluteum0.5170.516###睾丸Testis1.5352.669NF胎盘突Placentome0.5490.511####泌乳期乳腺Breast1.7370.826NF食管Esophagus1.0850.483NF真胃Abomasums1.0740.693###结肠Colon0.9780.085#
RT-PCR法及免疫组化法分析Fas及FasL在牦牛各器官中的表达。数值代表目的基因琼脂糖凝胶电泳条带灰度值与内参条带灰度值的比值。免疫反应强度:####、###、##、#分别代表强、中度、弱和很弱阳性,NF代表在该组织中未检测到阳性反应
RT-PCR and immunohistochemistry methods were carried out to analyze the expression of Fas and FasL in yak.Numerical values represent the gray value ratio of the bands of target gene to the internal reference gene.The immunoreaction intensity of FasL in analyzed tissues:####,###,##,# represent strong reaction,moderate reaction,weak reaction and very weak reaction,respectively,all the positive reactions are found in the cytoplasm of the positive cells.NF indicate no immunoreactions are found in analyzed tissues
E.Lars等[5]对Fas和FasL在小鼠各种组织器官中的表达进行了检测,发现2个基因共同表达于小鼠的多种组织中,FasmRNA在所有检测的组织中都表达,而FasLmRNA除在心、肝以及胰腺中未检测到外,在别的组织中也都表达;随后X.Luc等[6]对2个基因在人各种组织器官中的表达进行了检测,发现Fas广泛表达于人的各种组织中,而FasL只在胎盘、睾丸、肺、食管和子宫等少数组织中表达。Fas/FasL通过激活诱导细胞死亡(AICD)作用参与外周淋巴器官中的自身反应性T细胞及活性T细胞克隆的消除,从而在免疫系统中发挥重要作用;FasL在睾丸和胎盘突等免疫赦免位点可能通过诱导浸入的Fas阳性淋巴细胞的凋亡而使它们免受免疫反应的破坏;Fas/FasL介导的凋亡可能参与了子宫、食管等上皮组织正常的细胞更替[5-6]。本研究中,RT-PCR结果表明,Fas和FasL共同表达于牦牛除心之外的各种器官中,同在小鼠和人上所发现的一样,FasL不只是在淋巴性组织中表达,它与Fas还共同表达于免疫赦免位点(如睾丸和胎盘突)以及其他组织(如肝和肾),进一步说明Fas/FasL系统不只在免疫系统中起重要作用,还可能参与免疫赦免的维持以及上皮组织中正常的细胞更替。本研究发现,Fas和FasLmRNA的浓度在脾、淋巴结和胸腺等淋巴性组织中较高;对于典型的免疫赦免位点,睾丸和胎盘突中Fas和FasLmRNA浓度都较高,而眼睛和大脑中FasL的浓度都很低;在既非淋巴性组织也非免疫赦免位点的肝和肾中,Fas和FasLmRNA浓度也较高,而在别的组织中都相对较低,这种表达量的差异是否说明Fas/FasL系统在不同组织中有不同的功能还不清楚,需要进一步研究。另外,在小鼠和人的肝中均未检测到FasL,小鼠肝细胞组成型地表达Fas抗原,对FasL诱导的细胞凋亡相当敏感,给小鼠施以FasL或Fas抗体则会引起肝炎和肝损伤而致命[10],本试验发现,在牦牛的肝中Fas和FasL共同表达,似乎与在小鼠上的发现相矛盾,需要进一步深入研究。
FasL蛋白以膜结合(mFasL)和可溶性(sFasL)2种形式存在,sFasL是由金属蛋白酶裂解结合在细胞膜上的FasL得到的[25],A.Lorraine等通过构建2种基因工程小鼠研究得出,mFasL是Fas/FasL 介导细胞凋亡所必须的[26],mFasL和sFasL之间的平衡可能是调节Fas/FasL系统介导细胞凋亡的关键[27]。mFasL除了在细胞膜上存在外,还可以以囊泡的形式存在于胞质中,这种结合FasL的囊泡可分泌到胞外并能有效激活由Fas介导的培养细胞的凋亡[28]。通过一些来自人胎盘的研究资料可以对存在于胞质中的FasL功能进行推测。胎盘是一个典型的免疫赦免位点,因为母亲的免疫系统能够接受而非排斥带有一半异己抗原的胎儿[29]。表达FasL的人绒毛滋养层细胞能够诱导活化的淋巴细胞凋亡,被认为是母亲对胎儿产生免疫耐受的机制[30]。人胎盘FasL由合体滋养层细胞合成,以膜结合的形式结合在囊泡上后储存在胞质中,并可分泌到胞外。L.Frangsmyr[31]等对以囊泡形式存在于胞质中的FasL的功能进行了推测:首先,FasL以囊泡的形式存在可以保留其膜结合的形式,而mFasL是诱导细胞凋亡的关键;其次,FasL以囊泡的形式存在能比只结合到细胞膜上产生更大的表面积;再次,囊泡形式的FasL介导的细胞凋亡可以不依赖细胞与细胞的直接接触及重新合成FasL蛋白质;另外,囊泡形式的FasL较可溶性的FasL有较低的移动性,从而能够增加FasL的局部浓度,提高其起始凋亡的能力;还有,FasL以囊泡的形式分泌到细胞间隙内能够避免与靶细胞直接接触给胎盘带来的损毁,因为有试验证明膜结合的FasL可以引发炎性反应。在本试验中,免疫组化结果表明,FasL存在于牦牛肾、肝、垂体、真胃、子宫、结肠、胎盘突和黄体等几个器官的多种细胞的胞质中,而像脾、淋巴结、胸腺和睾丸等强烈表达FasLmRNA的器官中未检测到阳性信号,推测可能的原因是本试验中所用的FasL抗体只能与存在于胞质中的FasL而非结合到细胞膜上的FasL结合,说明有可能FasL在肾、肝、垂体、真胃、子宫、结肠、胎盘突和黄体等组织的细胞中以囊泡的形式存在于胞质中,通过分泌到胞外而发挥作用,而在淋巴性细胞中以及其余的组织中FasL合成后直接结合到细胞膜上,通过细胞与细胞间的接触而发挥作用。
Fas/FasL介导的细胞凋亡在免疫系统中的重要作用无可争议,然而还没有绝对的证据说明Fas/FasL系统是否真的参与免疫赦免现象的维持以及在上皮组织细胞的更替中起重要作用,因为在lpr和gld小鼠中这些组织未发现异常。在本文引言中提到,越来越多的证据表明Fas/FasL系统具有非凋亡的功能,所以很有必要揭示Fas/FasL系统在非淋巴性组织器官中起诱导细胞凋亡还是行使非凋亡的功能。
4 结 论
本研究克隆得到了牦牛Fas和FasL基因部分cDNA序列,均包含完整的开放阅读框,GenBank登录号分别为JN880421和JN880420;2个基因都与牛的相应序列有很高的同源性,分别为99.1%和99.4%;Fas和FasL基因共同表达于牦牛除心之外的各种器官中;FasL存在于牦牛多种体细胞的胞质中。
[1] ADACHI M,WATANABE-FUKUNAGA R,NAGATA S.Aberrant transcription caused by the insertion of an early transposable element in an intron of the Fas antigen gene of lpr mice [J].ProcNatlAcadSciUSA,1993,90:1756-1760.
[2] ORLINICK J R,VAISHNAW A,ELKON K B,et al.Requirement of cysteine-rich repeats of the Fas receptor for binding by the Fas ligand [J].JBiolChem,1997,272:28889-28894.
[3] INAZAWA J,ITOH N,ABE T,et al.Assignment of the human Fas antigen gene (Fas) to 10q24.1 [J].Genomics,1992,14:821-822.
[4] WATANABE-FUKUNAGA R,BRANNAN C I,ITOH N,et al.The cDNA structure,expression,and chromosomal assignment of the mouse Fas antigen [J].JImmunol,1992,148:1274-1279.
[5] LARS E,FRENCH M H,VIARD I,et al.Fas and Fas ligand in embryos and adult mice:Ligand expression in several immune-privileged tissues and co-expression in adult tissues characterized by apoptotic cell turnover [J].JCellBiol,1996,133:335-344.
[6] LUC X E D,HASSOUN J,MAWAS C,et al.Fas ligand is not only expressed in immune privileged human organs but is also coexpressed with Fas in various epithelial tissues[J].ClinPathol:MolPathol,1997,50:87-92.
[7] SUDA T,TAKAHASHI T,GOLSTEIN P,et al.Molecular cloning and expression of the Fas ligand,a novel member of the tumor necrosis factor family[J].Cell,1993,75:1169-1178.
[8] T SUDA T O,NAITO Y,YOKOTA T,et al.Expression of the Fas ligand in cells of T cell lineage[J].JImmunol,1995,154:3806-3813.
[9] GLOIRE G,CHARLIER E,PIETTE J.Regulation of CD95/APO-1/Fas-induced apoptosis by protein phosphatases[J].BiochemPharmacol,2008,76:1451-1458.
[10] OSNAT B C.Fas ligand as a tool for immunosuppression and generation of immune tolerance[J].StemCells,2004,22:908-924.
[11] NAGATA S,GOLSTEIN P.The Fas death factor[J].Science,1995,267:1449-1456.
[12] RIE WATANABE-FUKUNAGA C B,COPELAND N G,JENKINS N A,et al.Lymphoproliferation disorder in mice explained by defects in Fas antigen that mediates apoptosis[J].Nature,1992,356:314-317.
[13] MCP M H,IRMLER M,SCHRÖTER M,et al.Characterization of the non-functional Fas ligand of gld mice[J].IntImmunol,1995,7:1381-1386.
[14] THOMAS S,GRIFFITH T B,SHARON M,et al.Fas ligand-induced apoptosis as a mechanism of immune privilege[J].Science,1995,270:1189-1192.
[15] VAN PARIJS L,ABBAS A K.Role of Fas-mediated cell death in the regulation of immune responses[J].CurrOpinImmunol,1996,8:355-361.
[16] RESTIFO N P.Not so Fas:Re-evaluating the mechanisms of immune privilege and tumor escape[J].NatMed,2000,6:493-495.
[17] POONIA B,PAUZA C D,SALVATO M S.Role of the Fas/FasL pathway in HIV or SIV disease[J].Retrovirology,2009,6:91.
[18] WAJANT H,PFIZENMAIER K,SCHEURICH P.Non-apoptotic Fas signaling[J].CytokineGrowthFactorRev,2003,14:53-66.
[19] CARLILE G W,SMITH D H,WIEDMANN M.A non-apoptotic role for Fas/FasL in erythropoiesis[J].FEBSLett,2009,583:848-854.
[20] BERGQVIST A S,KILLIAN G,ERIKSON D,et al.Detection of Fas ligand in the bovine oviduct[J].AnimReprodSci,2005,86:71-88.
[21] YOO J,STONE R T,BEATTIE C W.Cloning and characterization of the bovine Fas[J].DNACellBiol,1996,15:227-234.
[22] NAOTO I S Y,ISHII A,YONEHARA M,et al.The polypeptide encoded by the cDNA for human cell surface antigen Fas can mediate apoptosis[J].Cell,1991,66:223-243.
[23] TAKAHASHI T,TANAKA M,BRANNAN C I,et al.Generalized lymphoproliferative disease in mice,caused by a point mutation in the Fas ligand[J].Cell,1994,76:969-976.
[24] TAKAHASHI T,TANAKA M,INAZAWA J,et al.Human Fas ligand:gene structure,chromosomal location and species specificity[J].IntImmunol,1994,6:1567-1574.
[25] KAYAGAKI N,KAWASAKI A,EBATA T,et al.Metalloproteinase-mediated release of human Fas ligand[J].JExpMed,1995,182:1777-1783.
[26] LORRAINE A,O’ REILLY LT,LEE L,et al.Membrane-bound Fas ligand only is essential for Fas-induced apoptosis[J].Nature,2009,461:659-663.
[27] RICCIOLI A,DAL SECCO V,DE CESARIS P,et al.Presence of membrane and soluble forms of Fas ligand and of matrilysin (MMP-7) activity in normal and abnormal human semen[J].HumReprod,2005,20:2814-2820.
[28] PASCAL S N H,BODMER J L,HAHNE M,et al.Conversion of membrane-bound Fas(CD95) ligand to its soluble form is associated with downregulation of its proapoptotic activity and loss of liver toxicity[J].JExpMed,1998,187:1205-1213.
[29] WEETMAN A P.The immunology of pregnancy[J].Thyroid,1999,9:643-646.
[30] SCOTT W,KAUMA T F H,HAYES N,et al.Placental Fas ligand expression is a mechanism for maternal immune tolerance to the fetus[J].JClinEndocrinolMetab,84:2188-2194.
[31] FRANGSMYR L,BARANOV V,NAGAEVA O,et al.Cytoplasmic microvesicular form of Fas ligand in human early placenta:switching the tissue immune privilege hypothesis from cellular to vesicular level[J].MolHumReprod,2005,11:35-41.
(编辑 郭云雁)
Cloning,Expression,and Localization ofFasandFasLGenes in Yaks
FAN Jiang-feng1,2,CHEN Peng2,CUI Yan1,YU Si-jiu1,2*
(1.CollegeofVeterinaryMedicine,GansuAgriculturalUniversity,Lanzhou730070,China; 2.TechnologyandResearchCenterofGansuProvinceforEmbryonicEngineeringofBovineandSheep&Goat,Lanzhou730070,China)
To further understand the function of Fas/ FasL system,theFasandFasLgenes of yak were cloned by RT-PCR method and their expressions were analyzed by combination of RT-PCR and immunohistochemistry.A complete cDNA sequences in 2 605 bp ofFasgene and 1 572 bp ofFasLgene of yak was obtained.These sequences were highly homology with cattle.FasandFasLmRNAs were co-expressed in all analyzed tissues except heart which expressedFasmRNA alone.The two genes strongly co-expressed in liver,spleen,kidney,lymphonodus,thymus and testis.A cytoplasmic form of FasL protein was detected in several cell types of various organs.Fas and FasL were strongly co-expressed in lymphoid organs and immune privilege sites,they were also strongly co-expressed in other tissues like kidney and liver.The results suggested that Fas/FasL system was more complicated.
Fas;FasL;gene cloning;expression;yak
10.11843/j.issn.0366-6964.2015.02.008
2012-02-09
甘肃省科技支撑计划项目(1204NKCA075);甘肃省青年科技基金计划项目(1208RJYA081)
樊江峰(1980-),男,甘肃静宁人,副教授,主要从事动物生殖生理方面的研究,E-mail:fanjf@gsau.edu.cn
*通信作者:余四九,教授,E-mail:sjyu@163.com
S823.8+5.2
A
0366-6964(2015)02-0228-11
