西妥昔单抗联合化疗一线治疗K-RAS野生型晚期结直肠癌疗效观察
2015-03-21张婷婷王以尚
李 娟,张婷婷,王以尚,韩 春,白 莉
解放军总医院 肿瘤内一科,北京 100853
西妥昔单抗联合化疗一线治疗K-RAS野生型晚期结直肠癌疗效观察
李 娟,张婷婷,王以尚,韩 春,白 莉
解放军总医院 肿瘤内一科,北京 100853
目的观察西妥昔单抗联合化疗一线治疗K-RAS野生型晚期结直肠癌的临床疗效及安全性。方法回顾性分析2008年2月- 2014年7月我院收治的98例经病理学证实的K-RAS基因野生型晚期结直肠癌患者的临床资料,其中44例应用西妥昔单抗联合奥沙利铂+亚叶酸钙+氟尿嘧啶(FOLFOX)或奥沙利铂+卡培他滨(XELOX)方案,54例应用西妥昔单抗联合伊立替康+亚叶酸钙+氟尿嘧啶(FOLFIRI)方案治疗。每例至少接受2个周期以上化疗,每6周进行疗效评价,按照实体瘤客观疗效评价标准1.1版评价疗效。结果98例均可进行疗效评价。其中西妥昔单抗联合奥沙利铂组完全缓解(complete response,CR) 2.27%、部分缓解(partial response,PR) 63.64%、病情稳定(stable disease,SD) 25%、病情进展(progression disease,PD) 9.09%;西妥昔单抗联合FOLFIRI组CR 0、PR 40.74%、SD 44.45%、PD 14.81%;两组客观缓解率(objective response rate,ORR)(65.91% vs 40.74%,P=0.013)差异有统计学意义,疾病控制率(disease control rate,DCR)(90.91% vs 85.19%,P=0.390)及中位无进展生存期(progression-free survival,PFS)(8.4个月vs 7.7个月,P=0.580)差异无统计学意义。结论西妥昔单抗联合以奥沙利铂为基础的化疗方案一线治疗K-RAS野生型晚期结直肠癌患者,其疗效不劣于西妥昔单抗联合FOLFIRI方案。两组不良反应无明显差异,值得临床推广。
结直肠肿瘤;西妥昔单抗;化学治疗
结直肠癌是最常见的消化道恶性肿瘤之一,其发病率居全球恶性肿瘤的第3位[1]。40% ~ 50%的结直肠癌患者确诊时已发生远处转移,从而失去了手术治疗机会,即使已行根治性手术的患者,仍有50%以上最终出现复发、转移[2-3]。晚期结直肠癌一线化疗药物主要为奥沙利铂、伊立替康、氟尿嘧啶、卡培他滨等,其治疗有效率为35% ~50%,中位总生存一般约20个月。随着分子靶向药物西妥昔单抗的问世及在临床中应用,对于K-RAS野生型患者,化疗联合靶向治疗的有效率高达60% ~ 70%,中位生存期已超过28个月[4]。为进一步验证西妥昔单抗在晚期结直肠癌治疗中的疗效,本研究回顾性分析了我院98例经病理学证实的K-RAS基因野生型晚期结直肠癌患者,其中44例采用西妥昔单抗联合奥沙利铂+亚叶酸钙+氟尿嘧啶(FOLFOX)或奥沙利铂+卡培他滨(XELOX)方案,54例采用西妥昔单抗联合伊立替康+亚叶酸钙+氟尿嘧啶(FOLFIRI)方案,现将其临床疗效及安全性汇报如下。
资料和方法
1 一般资料 收集2008年2月- 2014年7月我院肿瘤科收治的98例经病理学证实的晚期结直肠癌患者的临床资料,所有患者K-RAS基因检测(12、13密码子)均为野生型,ECOG评分≤2分,经CT或MRI等影像学检查证实均有可测量病灶,预计生存期≥3个月,血常规、心、肺、肝、肾功能正常,无明确化疗禁忌证。所有患者均签署知情同意书,接受至少两个周期的化疗。其中男性69例,女性29例,中位年龄55(21 ~ 75)岁,54例接受西妥昔单抗联合FOLFIRI方案治疗,44例行西妥昔单抗联合FOLFOX或XELOX方案治疗。临床资料详见表1。
2 治疗方法 西妥昔单抗(C225,默克雪兰诺有限公司)首剂为400 mg/m2,输注时间为120 min,之后每周250 mg/m2,输注时间为60 min,或首剂及之后每2周均为500 mg/m2。每次应用西妥昔单抗前均给予抗组胺药物预防输液反应和过敏反应。联合以奥沙利铂为基础的化疗:FOLFOX方案:奥沙利铂85 mg/m2,静脉滴注,d1;亚叶酸钙400 mg/m2,静脉滴注,d1;5-Fu 400 mg/m2,静脉推注,d1,2 400 mg/m2,连续静脉输注46 h;每2周为1个周期。XELOX方案:奥沙利铂130 mg/m2,静脉滴注,d1;卡培他滨850 ~ 1 000 mg/m2,2次/d,d1 ~ d14;每3周为1个周期。联合以伊立替康为基础的化疗:FOLFIRI方案:伊立替康180 mg/m2,静脉滴注,d1;亚叶酸钙400 mg/m2,静脉滴注,d1;5-Fu 400 mg/m2,静脉推注,d1,2 400 mg/m2,连续静脉输注46 h;每2周为1个周期。治疗持续至病情进展或患者不能耐受为止。化疗前所有患者均给予预防性止吐治疗。
3 疗效评价 近期疗效评价参照实体瘤客观疗效评价标准1.1版,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、病情稳定(stable disease,SD)和病情进展(progression disease,PD)。客观缓解率(objective response rate,ORR)为CR+PR的例数占所有病例的百分比,疾病控制率(disease control rate,DCR)为CR+PR+SD的例数占所有病例的百分比;无进展生存期(progression-free survival,PFS)为治疗开始至疾病进展或患者死亡时间。所有患者均每6周进行1次疗效评价。随访日期截止于2014年11月。
4 不良反应 按照美国国立癌症研究所通用毒性标准3.0版评价,分为1 ~ 5级。如果出现3级及以上的皮疹,则推迟使用西妥昔单抗直至皮疹降为2级以后再次使用,如果发生3级及以上的中性粒细胞减少、腹泻及神经毒性,下一周期化疗时化疗药物减量至原剂量的75%,如果2次剂量调整后仍出现3级及以上的不良反应,则停止治疗。
5 统计学方法 采用SPSS 17.0统计学软件,对汇总的资料进行统计学分析。应用Kaplan-Meier进行生存分析描绘,ORR和DCR的比较采用χ2检验,若有理论频数<5,则采用校正χ2检验,若有理论频数<1,则采用Fisher确切检验。P<0.05为差异有统计学意义。
结 果
1 一般资料 两组患者在男女比例、年龄、肿瘤转移部位个数、肿瘤分化程度以及应用西妥昔单抗的周期数方面,差异无统计学意义。其中在肿瘤部位、是否和卡培他滨联合治疗方面,两组数据差异有统计学意义(P<0.05)。西妥昔单抗联合奥沙利铂方案组与联合FOLFIRI方案组化疗的中位周期数分别为9和8。见表1。
2 疗效评价 98例均完成了至少两个周期的治疗,且均进行了疗效评价,其中西妥昔单抗联合奥沙利铂方案治疗组比西妥昔单抗联合FOLFIRI方案治疗组客观缓解率高(P=0.013),差异有统计学意义。见表2。
3 生存分析 西妥昔单抗联合奥沙利铂方案治疗组较联合FOLFIRI方案治疗组的中位无进展生存期延长0.7个月,但差异无统计学意义(P=0.580)。见表3和图1。
4 不良反应 入组患者出现的不良反应主要为皮疹、中性粒细胞减少、恶心、呕吐、腹泻、神经毒性等,其中大多比较轻微,以1、2级不良反应为主,3、4级不良反应较少见。两组患者颜面、颈部、前胸及后背部均出现不同范围的痤疮样皮疹(75% vs 81.48%),多出现在用药后第2、3周。伊立替康组腹泻发生率明显高于奥沙利铂组(44.45% vs 18.18%),但差异无统计学意义(P=0.550)。奥沙利铂组神经毒性发生率较伊立替康组明显增高(59.09% vs 5.56%),但差异无统计学意义(P=0.550)。其中西妥昔单抗联合XELOX方案7名患者中均未出现严重的腹泻,其中两名患者出现了2级的手足综合征。见表4。

图 1 两组结直肠癌患者无进展生存曲线Fig. 1 Progression-free survival curve of colorectal cancer patients in two groups

表1 两组结直肠癌患者的一般情况比较Tab. 1 Comparison of general data of colorectal cancer patients in two groups (n, %)
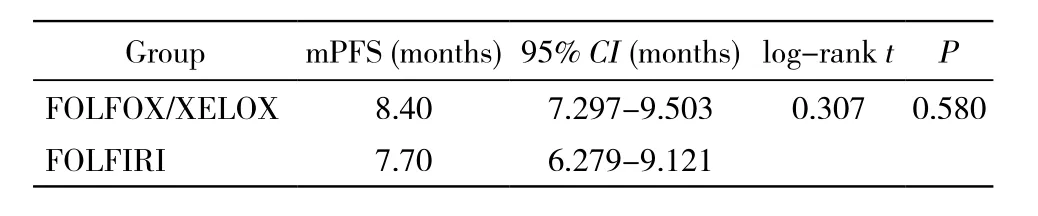
表3 两组结直肠癌患者中位无进展生存期比较Tab. 3 Comparison of mPFS of colorectal cancer patients in two groups

表4 两组结直肠癌患者不良反应比较Tab. 4 Comparison of adverse reactions in colorectal cancer patients in two groups (n, %)
讨 论
表皮生长因子受体(epidermal growth factor receptor,EGFR)在许多实体肿瘤中均高表达,其在结直肠癌中的表达为60% ~ 80%[5-6]。研究发现,EGFR的高表达提示肿瘤的预后较差[7]。西妥昔单抗是重组人鼠嵌合的lgG1单克隆抗体,与EGFR特异性结合抑制EGFR介导的细胞内信号转导,从而抑制细胞增殖、肿瘤血管生长、诱导肿瘤细胞凋亡、抑制肿瘤浸润和转移,同时还可以通过诱发抗体依赖细胞介导的细胞毒作用(antibodydependent cell-mediated cytotoxicity,ADCC)进一步杀死肿瘤细胞。
K-RAS基因是转移性结直肠癌EGFR单抗靶向治疗疗效预测的重要分子标记物,2008年美国临床肿瘤学会会议上,Van Cutsem等[8]报道在CRYSTAL试验中,检测分析540例肿瘤组织标本K-RAS基因突变状态与临床疗效的相关性,540例的临床特点和治疗结果与意向治疗(ITT)人群相似,其中348例(64.4%)为K-RAS基因野生型,192例(35.6%)为突变型,野生型患者接受西妥昔单抗联合FOLFIRI治疗效果明显优于单独FOLFIRI组:RR 59% vs 43%,mPFS 9.9个月vs 8.7个月,中位总生存期显著优于单纯化疗组(23.5个月vs 20.0个月,P=0.009 4)[8]。另一项OPUS研究结果显示,在K-RAS野生型患者中,联合西妥昔单抗组与单纯化疗组相比,RR明显提高(61% vs 37%),mPFS 8.3个月vs 7.2个月,总生存期有延长的趋势(22.8个月vs 18.5个月,P=0.39)[9]。以上试验证明,C225联合伊立替康、奥沙利铂等一线常用化疗药物的疗效均优于单纯化疗。

表2 两组结直肠癌患者疗效评价Tab. 2 Comparison of efficacy of colorectal cancer patients in two groups
COIN研究发现,西妥昔单抗联合FOLFOX或XELOX一线治疗K-RAS野生型晚期结直肠癌患者,与单纯化疗相比,联合西妥昔单抗未带来OS(17.0个月vs 17.9个月,P=0.67)或PFS(两组均为8.6个月,P=0.60)获益[10]。2010年的亚组分析发现,转移瘤数目<2的亚组和化疗使用FOLFOX的亚组,西妥昔单抗联合化疗能显著获益,HR分别为0.73和0.72;而XELOX化疗组不能获益的原因可能是卡培他滨导致了3、4级的腹泻明显增加(17% vs 30%),大部分患者需减量而影响了疗效[11]。另一项来自北欧的大型Ⅲ期随机对照研究NORDIC Ⅶ发现,西妥昔单抗联合Nordic FLOX方案(静脉推注5-FU/LV/奥沙利铂)一线治疗K-RAS野生型结直肠癌,不但PFS没获益,反而缩短(7.9个月vs 单纯化疗8.7个月,P=0.66)[12]。因此2012年结直肠癌美国国立综合癌症网络指南将转移性结直肠癌的靶向治疗和FOLFOX方案与西妥昔单抗联合的方案删除。Vale等[13]荟萃分析了7个有K-RAS状态分析的化疗联合抗表皮细胞生长因子受体单克隆抗体的临床研究数据,发现影响西妥昔单抗与奥沙利铂疗效的可能是方案中5-FU的给药方式,即西妥昔单抗只适合与静脉输注的5-FU联合(FOLFOX),而不适合与推注(FLOX)或口服(XELOX)给药的氟尿嘧啶联合。
2014年ASCO大会公布的CALGB80405研究显示,西妥昔单抗联合FOLFOX与联合FOLFIRI方案的ORR分别为67%和62%,OS分别为30.1个月和28.9个月[14]。该研究提示,西妥昔单抗联合FOLFOX较联合FOLFIRI无论是ORR还是OS均略显优势。我院回顾性分析的数据同样提示,西妥昔单抗联合以奥沙利铂为主的方案客观缓解率优于与FOLFIRI联合的方案(65.91% vs 40.74%, P=0.013),差异有统计学意义。中位PFS与奥沙利铂联合治疗组较FOLFIRI方案治疗组延长了0.7个月,但差异无统计学意义。CALGB80405研究及本研究提示,西妥昔单抗联合以奥沙利铂为基础的化疗方案一线治疗K-RAS野生型晚期结直肠癌患者,其疗效不劣于联合FOLFIRI的方案,虽然目前西妥昔单抗联合FOLFOX方案尚未重新列入NCCN指南,但上述研究结果为我们临床应用西妥昔单抗与以奥沙利铂为主的方案联合提供了依据。
PIessevaux等[15]研究表明,以西妥昔单抗为基础的联合方案治疗转移性结直肠癌,早期肿瘤缩小-即第一次CT扫描时(第8周)肿瘤缩小≥20%与是否可行R0切除、疾病进展时间和总生存期密切相关[15-17]。本研究中西妥昔单抗联合以奥沙利铂为主的方案客观缓解率为65.91%,其中绝大部分患者是在第6周或第12周疗效评价时即达到CR或PR,且该方案不良反应可耐受。因此可以推测,其对于转移性结直肠癌患者的转移灶较局限,特别是仅局限于肝或肺部,经过内科治疗肿瘤缩小后,可以使转移灶从不可切除转化成可切除。该类患者的新辅助化疗可首选西妥昔单抗联合FOLFOX方案,使更多的患者达到早期肿瘤缩小,争取更高的手术根治的机会,从而延长患者的生存期。但本研究为回顾性研究,病例范围选择有限,病例数较少且部分患者PFS未达到观察终点,所以无论是西妥昔单抗联合奥沙利铂组还是联合伊立替康方案组PFS均低于上述临床研究,仍需继续进行随访及大样本的随机前瞻性研究进一步证实。
此外西妥昔单抗安全性较好,不良反应轻微,主要不良反应为痤疮样皮疹、皮肤干燥、皲裂、乏力、恶心、呕吐、腹泻、荨麻疹及低血压等[18]。临床研究证实,痤疮样皮疹可以作为西妥昔单抗治疗效果的一个预测指标,其严重程度与疗效呈正相关[19]。本研究中两组患者均出现不同程度的痤疮样皮疹(75% vs 81.48%),当患者停用西妥昔单抗后,皮疹症状均可好转。
综上所述,西妥昔单抗联合以奥沙利铂为基础的化疗方案一线治疗K-RAS野生型晚期结直肠癌,其疗效不劣于西妥昔单抗联合FOLFIRI方案。两组不良反应无明显差异,值得临床推广。
1 Roh SA, Choi EY, Cho DH, et al. Characterization of biological responses of colorectal cancer cells to anticancer regimens[J]. J Korean Surg Soc, 2012, 83(1): 21-29.
2 Bardelli A, Siena S. Molecular mechanisms of resistance to cetuximab and panitumumab in colorectal cancer[J]. J Clin Oncol, 2010, 28(7): 1254-1261.
3 孙燕,沈琳,叶颖江.大肠癌靶向治疗进入个体化时代[J].医学研究杂志,2009,38(6):1-2.
4 Heinemann V, Von Weikersthal LF, Decker T, et al. Randomized comparison of FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment of KRAS wild-type metastatic colorectal cancer: German AIO study KRK-0306 (FIRE-3)[J]. Journal of Clinical Oncology, 2013, 31S: abstr LBA3506.
5 Messa C, Russo F, Caruso MG, et al. EGF, TGF-alpha, and EGF-R in human colorectal adenocarcinoma[J]. Acta Oncol (Madr),1998, 37(3): 285-289.
6 Porebska I, Harlozińska A, Bojarowski T. Expression of the tyrosine kinase activity growth factor receptors (EGFR, ERB B2, ERB B3) in colorectal adenocarcinomas and adenomas[J]. Tumour Biol, 2000,21(2):105-115.
7 Tsuchihashi Z, Khambata-Ford S, Hanna N, et al. Responsiveness to cetuximab without mutations in EGFR[J]. N Engl J Med, 2005,353(2):208-209.
8 Van Cutsem E, Köhne CH, Hitre E, et al. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer[J]. N Engl J Med, 2009, 360(14):1408-1417.
9 Bokemeyer C, Bondarenko I, Hartmann JT, et al. Efficacy according to biomarker status of cetuximab plus FOLFOX-4 as first-line treatment for metastatic colorectal cancer: the OPUS study[J]. Ann Oncol, 2011, 22(7):1535-1546.
10 Maughan TS, Adams RA, Smith CG, et al. Addition of cetuximab to oxaliplatin-based first-line combination chemotherapy for treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial[J]. Lancet, 2011, 377(9783): 2103-2114.
11 Maughan TS, Adams R, Smith CG, et al. Identification of potentially responsive subsets when cetuximab is added to oxaliplatinfluoropyrimidine chemotherapy in first-line advanced colorectal cancer: mature results of the MRC COIN trial[J]. J Clin Oncol,2010, 28(S15):S261.
12 Tveit KM, Guren T, Glimelius B, et al. Phase III trial of cetuximab with continuous or intermittent fluorouracil, leucovorin, and oxaliplatin (Nordic FLOX) versus FLOX alone in First-Line treatment of metastatic colorectal cancer: the NORDIC-VII study[J]. J Clin Oncol, 2012, 30(15): 1755-1762.
13 Vale CL,Tierney JF, Meade AM,et al. A systematic review of randomized controlled trials(RCTs) of EGFR-targeted monoclonal antibody(MAb) therapy in advanced colorectal cancer(ACRC):Impact of K-RAS status[J]. J Clin Oncol,2010,28:abstract e14001.
14 Venook AP, Niedzwiecki D, Lenz HJ, et al. CALGB/SWOG 80405: Phase III trial of irinotecan/5-FU/leucovorin (FOLFIRI) or oxaliplatin/5-FU/leucovorin (mFOLFOX6) with bevacizumab (BV)or cetuximab (CET) for patients (pts) with KRAS wild-type (wt)untreated metastatic adenocarcinoma of the colon or rectum (MCRC)[A]. Program and abstracts of the American Society of Clinical Oncology Annual Meeting[C]. 2014.
15 Piessevaux H, Buyse M, De Roock W, et al. Radiological tumor size decrease at week 6 is a potent predictor of outcome in chemorefractory metastatic colorectal cancer treated with cetuximab (BOND trial)[J]. Ann Oncol, 2009, 20(8): 1375-1382.
16 De Roock W, Piessevaux H, De Schutter J, et al. KRAS wild-type state predicts survival and is associated to early radiological response in metastatic colorectal cancer treated with cetuximab[J]. Ann Oncol, 2008, 19(3): 508-515.
17 Mansmann UR,Sartorius U,Laubender RP,et al. Deepness of response:A quantitative analysis of its impact on post-progres-sion survival time after first-line treatment in patients with mCRC[J]. J Clin Oncol, 2012, 30(34):427.
18 O’connell MJ, Laurie JA, Kahn M, et al. Prospectively randomized trial of postoperative adjuvant chemotherapy in patients with high-risk colon cancer[J]. J Clin Oncol, 1998, 16(1): 295-300.
19 Stintzing S, Fischer von Weikersthal L, Vehling-Kaiser U, et al. Correlation of capecitabine-induced skin toxicity with treatment efficacy in patients with metastatic colorectal cancer: results from the German AIO KRK-0104 trial[J]. Br J Cancer, 2011, 105(2):206-211.
Efficacy observation of cetuximab combined with chemotherapy for patients with K-RAS wild-type advanced colorectal cancer
LI Juan, ZHANG Tingting, WANG Yishang, HAN Chun, BAI Li
No.1 Department of Oncology, Chinese PLA General Hospital, Beijing 100853, China
BAI Li. Email: libai1959@163.com
ObjectiveTo investigate the efficacy and safety of cetuximab with FOLFIRI or FOLFOX/XELOX as first-line chemotherapy for patients with K-RAS wild-type advanced colorectal cancer.MethodsClinical data about 98 histopathology confirmed patients with KRAS wild-type advanced colorectal cancer admitted to our hospital from February 2008 to July 2014 were collected and analyzed. Forty-four patients received cetuximab plus FOLFOX/XELOX, 54 patients received cetuximab plus FOLFIRI. Each patient received at least two cycles of chemotherapy, every 6 weeks for evaluation. The efficacy was evaluated according to RECIST 1.1.ResultsNinety-eight patients were available for evaluation. In cetuximab plus FOLFOX/XELOX group, the complete response (CR) was 2.27%, partial response (PR) was 63.64%, stable disease (SD) was 25%, and progressive disease (PD) was 9.09%. In cetuximab plus FOLFIRI group, CR was 0%, PR was 40.74%, SD was 44.45%, PD was 14.81%. The objective response rate (ORR) of these two groups were 65.91% and 40.74%, respectively, which was of statistically significant difference (P=0.013). The disease control rate (DCR) were 90.91% and 85.19% respectively, which showed statistically significant difference (P=0.390). The median progression-free survival (PFS) was 8.4 months and 7.7 months respectively, with no statistically significant differences (P=0.580).ConclusionThe efficacy of addition of cetuximab to oxaliplatin-based chemotherapy in first-line treatment for K-RAS wild-type advanced colorectal cancer is not inferior to cetuximab combined with FOLFIRI regimen. Adverse reactions show no significant difference between the two groups, which suggests that it is worthy of promotion.
colorectal neoplasms; cetuximab; chemotherapy
R 735.3
A
2095-5227(2015)06-0590-05
10.3969/j.issn.2095-5227.2015.06.019
时间:2015-03-31 10:03
http://www.cnki.net/kcms/detail/11.3275.R.20150331.1003.001.html
2015-01-04
李娟,女,在职硕士,医师。研究方向:消化系统肿瘤。Email: juanli_301@163.com
白莉,女,博士,主任医师,教授,硕士生导师,出站博士后。Email: libai1959@163.com
