23例原发性肺黏液表皮样癌外科诊疗及预后分析
2015-03-21初向阳张连斌马克峰
王 辉,初向阳,张连斌,马克峰
解放军总医院 胸外科,北京 100853
23例原发性肺黏液表皮样癌外科诊疗及预后分析
王 辉,初向阳,张连斌,马克峰
解放军总医院 胸外科,北京 100853
目的讨论原发性肺黏液表皮样癌(pulmonary mucoepidermoid carcinoma,PMEC)的临床特点、外科诊疗方法及预后。方法回顾性分析2005年7月- 2014年7月23例在我院接受手术的PMEC患者的临床资料,对临床特征、诊断方法、治疗措施及预后进行分析。结果23例中,高度恶性7例,低度恶性16例,均接受手术治疗,全肺切除4例,肺叶切除17例,开胸活检术2例。高度恶性组中位生存时间10个月,明显短于低度恶性组的44个月(P<0.01);高度恶性组淋巴结转移率明显高于低度恶性组的(71.4% vs 6.3%,P<0.01)。术后6例接受化疗。结论手术是治愈PMEC的唯一方法,其预后主要取决于恶性程度,高度恶性者预后差。
肺黏液表皮样癌;外科治疗;预后
黏液表皮样癌起源于腺管上皮,主要发生于涎腺,原发于支气管腺体的情况少见,临床特征及检查结果常缺乏特异性,易造成误诊、误治[1]。本文对23例在我院手术并经病理确诊的原发性肺黏液表皮样癌(pulmonary mucoepidermoid carcinoma,PMEC)患者临床资料进行回顾性分析,旨在提高对本病临床特征、诊疗方法以及预后的认识。
资料和方法
1 一般资料 2005年7月- 2014年7月在我院手术并经病理确诊的23例PMEC患者,病理结果以我院病理科出具的病理报告为准,按2009年国际肺癌研究学会TNM分期标准进行临床分期[2],排除身体其他部位肿瘤。
2 研究方法 依据分化程度分组,7例低分化者为高度恶性组,16例中分化和高分化者为低度恶性组。采用电话或门诊随访,回顾性分析临床特征、诊断方法、治疗措施及预后。随访时间从病例确诊至2014年12月。
3 统计学方法 以SPSS22.0统计学软件进行分析。符合正态分布的计量资料采用t检验,计数资料采用χ2检验,等级资料采用秩和检验,生存时间采用Kaplan-Meier法并进行Log-rank检验,P<0.05为差异有统计学意义。
结 果
1 一般特征及临床表现 本组男性12例,女性11例;确诊年龄19 ~ 67(49.9±12.2)岁;有吸烟史9例。主要临床症状为咳嗽11例,痰中带血4例,咯血3例,胸闷4例,6例无明显症状。高度恶性组(n=7)与低度恶性组(n=16)在一般特征和临床表现方面差异无统计学意义(P>0.05)。见表1。
2 影像学表现 胸部X线片有异常表现19例。胸部CT均可见软组织密度影,多为结节或团块状影,直径1.1 ~ 4.6(3.0±1.1) cm,密度较均匀,平扫平均CT值(34.9±6.2) Hu,强化后平均CT值(87.8±30.7) Hu,可见分叶、毛刺,常可见支气管狭窄、远端黏液栓,其中单侧多发病灶1例,伴纵隔淋巴结肿大1例。见表2。
3 支气管镜检查 18例行术前支气管镜活检,病理确诊8例,误诊为鳞癌5例,腺癌5例;1例行CT引导下经皮肺穿刺,误诊为腺癌。结合相关检查,病变位于左侧9例,右侧14例,位于主支气管1例,叶、段支气管18例,段以下支气管4例。见表2。
4 治疗方法 23例均接受手术治疗,全肺切除术4例,肺叶切除术17例(包含左肺上叶袖式切除1例),开胸活检术2例(因病变侵犯肺动脉主干、胸膜转移各1例)。6例术后行化疗(包括5例高度恶性及1例低度恶性伴淋巴结转移),全部病例均未接受放疗。见表2。
5 病理及分期 PMEC组织镜下可见表皮样细胞、黏液细胞和间质细胞。表皮样细胞形似鳞状细胞,细胞间可见细胞间桥,角化不全;黏液细胞呈多边形或高柱状,胞内可见黏液颗粒,胞外可见大量黏液;间质细胞含量少。本组中高度恶性组7例,占30.4%(7/23),肺门淋巴结转移1例,纵隔淋巴结转移4例;临床分期Ⅰ期、Ⅱ期、Ⅲ期各2例,Ⅳ期1例。低度恶性组16例,占69.6%(16/23),肺门淋巴结转移1例;临床分期Ⅰ期15例,Ⅲ期1例。高度恶性组的淋巴结转移率71.4%(5/7),明显高于低度恶性组的6.3%(1/16)(P<0.01);临床分期晚于低度恶性组(P<0.05)。见表1。
6 预后 23例无失访,随访时间2 ~ 88个月。高度恶性组7例均因转移死亡,生存时间2 ~ 27个月,中位生存时间10个月。低度恶性组生存时间9 ~88个月,中位生存时间44个月。1例于确诊61个月后心源性猝死,余均生存且无疾病进展。低度恶性组生存时间明显长于高度恶性组(P<0.01) (表1),生存曲线见图1。
讨 论
Smetana等[3]于1952年首次报道PMEC。本病发病率低,仅占支气管腺体恶性肿瘤的1%左右[1,4]。文献报道本病可发生于任何年龄,发病率较肺癌稍低,男女发病率相近[1,4-5]。本组发病年龄19 ~67(49.9±12.2)岁,男女比例1.09∶1,高度恶性组与低度恶性组之间性别、年龄无差异,结果与报道基本相符。
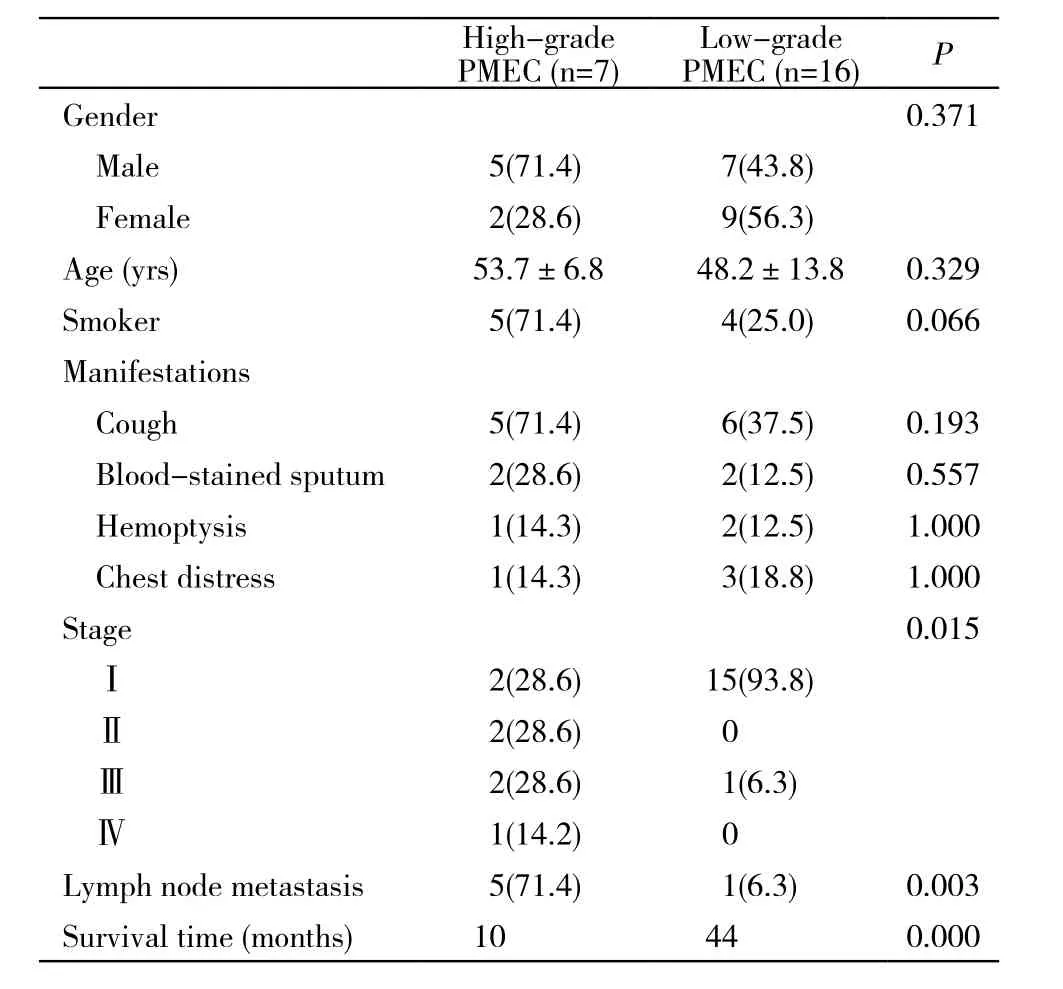
表1 高度恶性与低度恶性PMEC组的临床特征及生存时间比较Tab. 1 Clinical characteristics and survival time of patients with PMEC (n, %)

表2 23例PEMC检查及治疗方法Tab. 2 Examinations and therapies of 23 patients with PMEC (n, %)
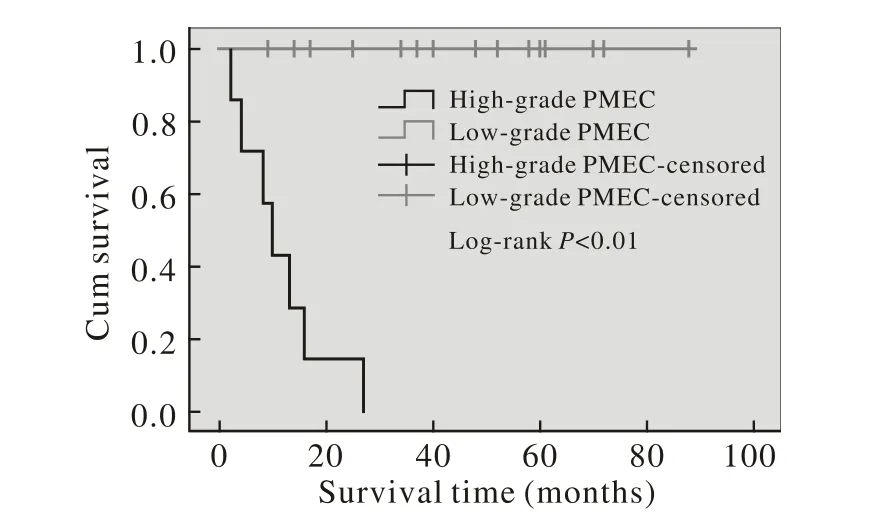
图 1 高度恶性与低度恶性PMEC组的Kaplan-Meier生存率曲线Fig. 1 Kaplan-Meier survival curves of high-grade PMEC group and low-grade PMEC group
通常认为,PMEC按分化程度分为高分化、低分化两类,一般高分化者恶性程度低,低分化者恶性程度高,以低度恶性为主,高度恶性者易出现侵袭、转移[5-6]。本组以低度恶性患者为主,占69.6%(16/23),仅1例发生淋巴结转移,淋巴结转移率及临床分期均明显优于高度恶性组(P<0.05),提示分化程度是决定本病恶性程度和侵袭性的主要因素。
PMEC临床表现取决于肿瘤的大小和部位。肿瘤较小和周围型病例可无任何症状,位于气管、主支气管、叶及段支气管者常见支气管刺激和阻塞症状,包括咳嗽、喘息、咯血,可出现阻塞性肺炎、肺不张,若出现胸膜炎可有持续性胸痛[1,4,7]。本组显示PMEC临床表现并无诊断特异性,高度恶性组与低度恶性组间无明显差异。
本病在胸部X线片上可无明显异常表现,阳性发现多为患侧肺野内孤立性结节或肿块影,部分病例合并或仅有炎症和肺不张征象[1,4,7]。胸部CT可发现肿瘤多位于支气管腔内,椭圆形或分叶状,边缘多光滑、境界清楚,多为中央型,少数为周围型;主要向支气管腔内生长,大多沿支气管方向走行,可见支气管内“气体新月征”;密度比较均匀,多呈轻到中度强化;同时可合并阻塞性肺炎、肺不张、点片状钙化影,少数病例可见纵隔淋巴结肿大[8-10]。
本组结果提示,胸部CT为本病首选的影像学检查方法,尤其是高分辨率CT对于发现及定位病变更具优势,但其表现仍缺乏特异性。临床工作中凡在支气管腔内发现圆形或椭圆形肿块影,尤其是钙化灶、“新月征”,应充分考虑到本病可能。
支气管镜是PMEC术前确诊的主要手段。尤其对于中央型病例,常可于支气管腔内发现病灶,活检成功率高,可明确病变位置及范围,指导手术方式的选择[1,4,11]。文献报道,本病10%发生于主支气管,75%位于叶、段支气管,15%位于周围,右侧略多于左侧[5,7]。本组中18例进行了术前支气管镜检查,均成功明确病变位置并活检,左右比例1:1.56(9/14),位于段及段以上支气管占82.6%(19/23),段以下支气管占17.4%(4/23),提示PMEC以中心型为主。但本组病理误诊率达55.6%(10/18),原因考虑与活检标本组织量少及病理医生经验不足相关。
手术是目前公认的最有效的治疗方法。多数患者尤其是低度恶性病例,在完整切除肿瘤后不再复发,即使姑息切除者也常可带瘤生存多年。手术时应尽可能对肺门及纵隔淋巴结进行活检。放疗和化疗效果不明显,适用于不能手术切除的病例[1,4,7,12]。另有文献报道在支气管镜下行狭窄支气管扩张术或肿物切除术,此术式创伤小,但无法保证切除彻底,缺乏长期生存研究[13]。此外,基因研究和靶向治疗不断进展,为高度恶性患者带来了新的希望[14-16]。
本病预后取决于恶性程度、侵袭范围和手术是否彻底。多数文献认为,低度恶性者预后极佳,经手术彻底切除后不需其他治疗,可获得长期生存;高度恶性者预后很差,往往短期内出现侵袭、转移,甚至死亡,应按肺癌对待[1,7,11]。但Barsky等[17]报道1例高分化病例术中可见卫星灶和心包种植,术后1个月时全身广泛转移,2个月后死亡。
本组全部接受手术治疗,手术过程及术后恢复均顺利,术后6例患者接受了化疗。根据术后病理及随访结果,高度恶性组淋巴结转移率明显高于低度恶性组,临床分期及生存情况较低度恶性组差,提示高度恶性PMEC侵袭性强,即使彻底切除并行淋巴结清扫,预后仍很差。低度恶性PMEC经手术治疗后,可获得长期生存。
综上所述,PMEC在临床工作中少见且缺乏特异性。应当重视体检和及时就诊,当患者影像学检查发现肺部肿块影,尤其胸部CT发现位于近端支气管内、沿管腔生长的病灶时,应考虑到本病可能。如有条件,应积极采用支气管镜活检而确诊,同时明确病变位置,为进一步手术方案的制订提供有力依据。必要时可直接手术。PMEC放化疗效果欠佳,手术是最主要的治疗方式。本病多为中央型,早期发现、早期手术可尽可能地保护患者肺功能。手术应彻底切除病变,并清扫肺门及纵隔淋巴结。本病预后主要取决于恶性程度,低度恶性者一般预后良好,高度恶性者侵袭性强、预后差。
1 孙玉鹗.胸外科手术学[M]. 2版.北京:人民军医出版社,2004:216-217.
2 Detterbeck FC, Boffa DJ, Tanoue LT. The new lung cancer staging system[J]. Chest, 2009, 136(1):260-271.
3 Smetana HF, Iverson L, Swan LL. Bronchogenic carcinoma; an analysis of 100 autopsy cases[J]. Mil Surg, 1952, 111(5): 335-351.
4 Brassesco MS, Valera ET, Lira RC, et al. Mucoepidermoid carcinoma of the lung arising at the primary site of a bronchogenic cyst: clinical, cytogenetic, and molecular findings[J]. Pediatr Blood Cancer, 2011, 56(2): 311-313.
5 Zhu F, Liu Z, Hou Y, et al. Primary salivary gland-type lung cancer: clinicopathological analysis of 88 cases from China[J]. J Thorac Oncol, 2013, 8(12): 1578-1584.
6 Roden AC, García JJ, Wehrs RN, et al. Histopathologic,immunophenotypic and cytogenetic features of pulmonary mucoepidermoid carcinoma[J]. Mod Pathol, 2014, 27(11):1479-1488.
7 Alsidawi S, Morris JC, Wikenheiser-Brokamp KA, et al. Mucoepidermoid carcinoma of the lung: a case report and literature review[J/OL]. http://www.hindawi.com/journals/ crionm/2013/625243.
8 Elnayal A, Moran CA, Fox PS, et al. Primary salivary gland-type lung cancer: imaging and clinical predictors of outcome[J]. AJR Am J Roentgenol, 2013, 201(1): W57-W63.
9 Wu J, Zhao SH, Guo AT, et al. CT characteristics of primary salivary gland-type lung cancer[J]. Zhonghua Zhong Liu Za Zhi, 2011, 33(4): 313-315.
10 Li X, Zhang W, Wu X, et al. Mucoepidermoid carcinoma of the lung: common findings and unusual appearances on CT[J]. Clin Imaging, 2012, 36(1): 8-13.
11 Dyhdalo KS, Chen L. Endobronchial ultrasound-guided fineneedle aspiration cytology of bronchial low-grade mucoepidermoid carcinoma: Rapid on-site evaluation of cytopathologic findings[J]. Diagn Cytopathol, 2013, 41(12): 1096-1099.
12 Jiang L, Li P, Xiao Z, et al. Prognostic factors of primary pulmonary mucoepidermoid carcinoma: a clinical and pathological analysis of 34 cases[J]. Int J Clin Exp Pathol, 2014, 7(10): 6792-6799.
13 Miller RJ, Murgu SD. Bronchoscopic resection of an exophytic endoluminal tracheal mass[J]. Ann Am Thorac Soc, 2013, 10(6):697-700.
14 宋丽,范理宏.非小细胞肺癌综合治疗现状[J].临床肺科杂志,2009,14(1):83-84.
15 Lee KW, Chan AB, Lo AW, et al. Erlotinib in metastatic bronchopulmonary mucoepidermoid carcinoma[J]. J Thorac Oncol,2011, 6(12): 2140-2141.
16 Jhuang JY, Chou YH, Hua SF, et al. Mixed lung mucoepidermoid carcinoma and adenocarcinoma with identical mutations in an epidermal growth factor receptor gene[J]. Ann Thorac Surg, 2014,98(2): 695-697.
17 Barsky SH, Martin SE, Matthews M, et al. “Low grade”mucoepidermoid carcinoma of the bronchus with “high grade”biological behavior[J]. Cancer, 1983, 51(8): 1505-1509.
Diagnosis, surgical therapy and prognosis in patients with pulmonary mucoepidermoid carcinoma: An analysis of 23 cases
WANG Hui, CHU Xiangyang, ZHANG Lianbin, MA Kefeng
Department of Thoracic Surgery, Chinese PLA General Hospital, Beijing 100853, China
CHU Xiangyang. Email: drchu301@aliyun.com
ObjectiveTo discuss the clinical characteristic, diagnosis, surgical therapy and prognosis of primary pulmonary mucoepidermoid carcinoma (PMEC).MethodsClinical data about 23 patients with PMEC who underwent surgery in our hospital from July 2005 to July 2014 were retrospectively analyzed.ResultsAll 23 patients with PMEC had accepted surgery, including 4 cases with pneumonectomies, 17 cases with lobectomies and 2 cases with exploratory thoracotomies. There were 7 patients with high-grade PMEC and 16 patients with low-grade PMEC. The median survival time of patients with high-grade PMEC (10 months) was shorter than patients with low-grade PMEC (44 months) (P<0.01), and the constituent ratio of lymph node metastasis of patients with high-grade PMEC (71.4%) was higher than patients with low-grade PMEC (6.3%) (P<0.01). Six patients with PMEC received postoperative chemotherapy.ConclusionSurgery is the only way to cure PEMC. The prognosis of PMEC depends largely on the degree of malignancy, patients with high-grade PMEC have poor prognosis.
pulmonary mucoepidermoid carcinoma; surgical therapy; prognosis
R 734.2
A
2095-5227(2015)06-0586-04
10.3969/j.issn.2095-5227.2015.06.018
时间:2015-04-10 17:09
http://www.cnki.net/kcms/detail/11.3275.R.20150410.1709.003.html
2015-03-17
王辉,男,在读硕士。研究方向:胸外科。Email: wh ophone@163.com
初向阳,男,硕士,主任医师,教授,博士生导师。Email: drchu301@aliyun.com
