瘦素在海人酸诱导小鼠颞叶癫痫海马损伤中的作用
2015-03-21邓子辉张金英李建华颜光涛
冯 杰,邓子辉,张金英,薛 辉,梁 辰,李建华,颜光涛
解放军总医院,北京 1008531基础所生化研究室;2生化科
瘦素在海人酸诱导小鼠颞叶癫痫海马损伤中的作用
冯 杰1,邓子辉1,张金英1,薛 辉1,梁 辰1,李建华1,颜光涛2
解放军总医院,北京 1008531基础所生化研究室;2生化科
目的探讨瘦素(Leptin)与颞叶癫痫发生、发展过程的关系。方法外源Leptin注射C57BL/6J小鼠后,右侧海马微量注射200 ng海人酸(kainic acid,KA)诱导颞叶癫痫,记录小鼠癫痫评分,1周后观察小鼠海马病理变化,包括Western blot检测Bax的表达水平,尼式染色(Nissl staining)观察海马Hilus区神经元丢失,免疫荧光检测Hilus区星形胶质细胞活化与增殖。结果在200 ng KA诱导的颞叶癫痫模型基础上,10 mg/kg外源Leptin预处理后,癫痫评分增加约52%,Bax表达水平升高约75%(P<0.05),海马Hilus区神经元丢失严重,星形胶质细胞过度活化。结论Leptin增加了KA诱导的神经元凋亡,加重KA诱导的神经病理过程。
瘦素;海人酸;颞叶癫痫;星形胶质细胞;神经元;海马Hilus
颞叶癫痫(temporal lobe epilepsy,TLE)占难治性癫痫60%以上,异常同步放电起源于颞叶,其中内侧颞叶癫痫是颞叶癫痫的主要类型,内侧颞叶癫痫的病灶位于颞叶内侧结构,包括海马、海马旁回及杏仁核,是最常见的一种局部型癫痫综合征[1]。颞叶癫痫主要的病理表现是海马硬化和异常的海马形态,并且常发生特征性的病理改变,包括神经元的丢失和星形胶质细胞活化。星形胶质细胞活化聚集形成瘢痕,神经元丢失最终导致海马萎缩硬化[2]。颞叶癫痫的早期损伤主要包括海马Hilus、CA1和CA3区神经元的丢失,导致异常的突触间的连接,在外界刺激下神经元异常同步放电从而诱发癫痫。瘦素(Leptin)是由肥胖基因(obese gene,OB)编码的16 kU的蛋白,包含167个氨基酸,血液中是去除21个氨基酸信号肽的多肽[3]。瘦素主要由脂肪细胞分泌的,具有调节能量代谢等生物学功能。研究发现,瘦素受体(ObR)在脑内很多部位表达[4],包括下丘脑、海马等,瘦素通过其受体可影响大脑神经元和胶质细胞凋亡或增殖。本研究探讨瘦素和神经元丢失、星形胶质细胞活化的关系,从而认识瘦素对颞叶癫痫的病理发展的作用。
材料和方法
1材料 C57BL/6J小鼠(SPF级,60只),8周龄,雄性,体质量20 ~ 22 g,购自解放军总医院医学实验动物中心;标准饲料(10% KJ%fat,北京中兴饲料);海人酸(kainic acid,KA)(Sigma Chemical Co. St Louis,MO,USA);人重组Leptin(Peprotech公司);三羟甲基氨基甲烷(Tris碱)(北京益利精细化学品公司);脑立体定位仪(ZS-B/C,北京众实迪创科技发展有限责任公司);5μl微量进样器Microliter Syringes(上海高鸽工贸有限公司);乙醚(北京益利精细化学品公司);甲苯胺蓝(Sigma Chemical Co. St Louis,MO,USA);RIPA裂解液、BCA蛋白定量试剂盒、Western Blot超敏发光液(北京普利莱基因技术公司);一抗:Bax(Epitomics公司),β-actin(Santa Cruz)胶质纤维酸性蛋白(GFAP,Cell Signaling Technology Inc. #3670)、瘦素受体(ObR,Santa Cruz Biotechnology);二抗:山羊抗鼠Alexa Fluor(R)488,山羊抗兔Alexa Fluor(R) 555(1∶400,Cell Signaling Technology Inc.)、山羊抗兔IgG/辣根酶标记(北京中衫金桥公司);Hochest33342(Sigma);柠檬酸盐缓冲液(北京普利莱基因技术公司)。
2颞叶癫痫小鼠模型的建立[5]将C57BL/6J小鼠分为0.9%氯化钠注射组(对照组,10只),Leptin注射组(Leptin,10只),海人酸注射组(KA组,20只),Leptin + KA注射组(LepKA组,20只)。将小鼠乙醚麻醉后,置于脑立体定位仪上,以大脑bregma为原点的海马定位注射坐标:-2.0、-1.8、-2.3 (右侧海马),进行单侧注射海人酸200 ng(100 ng/ μl,2 μl)后,速度2 μl/5 min,注射结束留注射器5 min,缝合头皮,碘伏消毒,放入笼中饲养1周。对照组以0.9%氯化钠注射液代替海人酸,其余步骤和注射方式同海人酸;Leptin组以(10 mg/ kg)代替海人酸,其余步骤和注射方式同海人酸;LepKA组,在注射海人酸30 min前,小鼠腹腔注射Leptin(10 mg/kg),然后进行右侧海马微量注射海人酸。
3行为学评分 0.9%氯化钠注射液、Leptin、海人酸注射后4 h,根据Racine分级标准[6]进行痫性评分:0分:无惊厥;1分:咀嚼运动、眨眼、胡须颤抖等面部肌肉抽搐;2分:颈部肌肉抽搐,节律点头;3分:单侧前肢震颤,颈部肌肉痉挛;4分:双前肢阵挛,后肢站立;5分:身体持续性强直,跌倒伴阵挛。记录小鼠癫痫评分,作平均值。
4Western blot检测Bax 小鼠处死后,取脑剥离右侧海马,放入RIPA蛋白裂解液,匀质离心提取总蛋白,BCA法蛋白定量。蛋白上样量为50 μg,在质量分数为10%的SDS-PAGE上进行垂直电泳,然后电转移到硝酸纤维素膜上(100 V,100 min),将硝酸纤维素膜放入含5%脱脂奶粉(TBST溶解)塑料袋中,放入摇床37℃封闭1 h,将稀释好的一抗,Bax(1∶1 000)、β-actin(1∶500),4℃封闭过夜。取出后放室温30 min,TBS/T漂洗膜3次× 10 min,加入稀释好的二抗(1∶3 000),37℃孵育30 min,TBS/T漂洗硝酸纤维素膜3次×10 min,加入发光液,暗室曝光。扫描后,使用Image Plus 6.0软件,分析其灰度值,3次独立实验求平均值。
5尼式染色(Nissl staining) 4 μm石蜡切片脱蜡至水,用磷酸盐缓冲溶液洗2 min,放1%甲苯胺蓝溶液中室温20 min,用梯度酒精依次脱水,结果尼式小体呈深蓝色颗粒,细胞核呈淡蓝色,背景基本无色。
6免疫荧光双染法观察ObR和GFAP共表达注射海人酸后的小鼠冠状面石蜡切片(4 μm)脱蜡至水,柠檬酸盐缓冲溶液高压修复5 min,5%山羊血清封闭,加入一抗瘦素受体(ObR)和胶质纤维酸性蛋白4℃过夜,漂洗后,加二抗Alexa Fluor (R) 488,Alexa Fluor (R) 555,37℃孵育40 min,Hochest 33342染核,置于激光共聚焦显微镜下观察拍照,ObR显红色荧光,GFAP显绿色荧光,细胞核显淡蓝色。
7免疫荧光法观察海马Hilus区GFAP的表达和形态变化 4 μm石蜡切片脱蜡至水,柠檬酸盐缓冲溶液高压修复5 min,5%的山羊血清封闭,GFAP(1∶400) 4℃过夜,漂洗后,山羊抗鼠Alexa Fluor (R)488二抗37℃孵育40 min,Hochest33342染核,置于显微镜下观察并拍照,GFAP显绿色,细胞核显淡蓝色。
8统计学方法 采用GraphPad Prism软件进行统计分析,数据以表示,组间比较用t检验, P<0.05为差异有统计学意义。
结 果
1颞叶癫痫肥胖小鼠行为学评分 对照组和Leptin组小鼠行为评分为0,无癫痫样发作,LepKA组Racine行为学评分为4.1分,显著高于KA组2.7分,癫痫加约52%。见图1。
2Leptin降低了颞小鼠海马的抗凋亡能力对照组与Leptin组间Bax表达水平无差异,KA诱导模型后,Bax表达水平明显增加(aP<0.01),在进行KA诱导前,外源给予Leptin预处理组(LepKA组)Bax表达水平相对于模型组升高了约75%(P<0.01)。见图2。
3光镜下观察神经元丢失情况 Leptin加重颞叶癫痫小鼠模型海马Hilus区神经元丢失,小鼠冠状面切片(4 μm)尼式染色显示KA组海马Hilus区神经元发生丢失,与KA组相比,Leptin预处理明显加重海马Hilus区神经元的丢失(LepKA组),同时可观察到Hilus区变得弥散。见图3。
4KA处理后海马Hilus区瘦素受体与星形胶质细胞共定位 激光共聚焦镜下观察模型组小鼠海马免疫荧光染色显示ObR与GFAP共定位,星形胶质细胞表达ObR,Leptin可通过ObR作用于星形胶质细胞,影响了星形胶质细胞的形态。见图4。
5Leptin处理后星形胶质细胞变化 免疫荧光显示,对照组与Leptin组间无差异,与KA组相比,Leptin预处加重了星形胶质细胞的活化和形态的改变,LepKA组中海马Hilus区活化的星形胶质细胞变长加粗,Leptin预处理加重了颞叶癫痫的病理特征。见图5。

图 1 瘦素预处理后对海人酸诱导颞叶癫痫小鼠抽搐评分的影响(aP<0.05, vs Saline组;bP<0.05, vs KA组,每组n=8)Fig. 1 Effect of leptin pretreatment on seizure scores of mice after KA-induced TLE (aP<0.05, vs Saline group, n=8;bP<0.05, vs KA group, n=8)
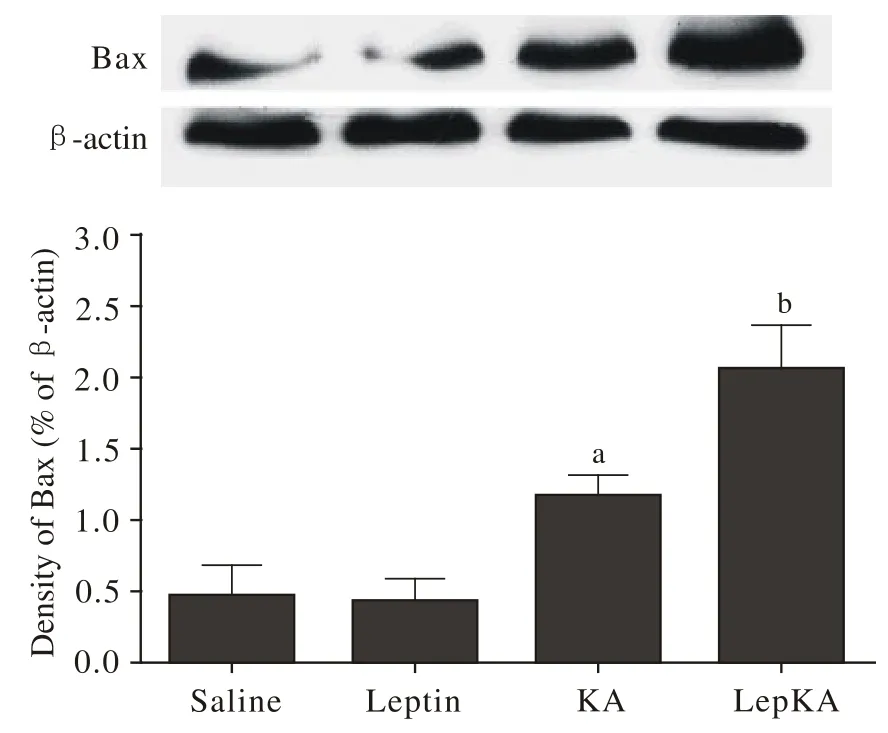
图 2 瘦素预处理后对海人酸诱导海马凋亡蛋白Bax表达的影响(aP<0.05, vs Saline组;bP<0.05, vs KA组,每组n=4)Fig. 2 Effect of leptin pretreatment on KA-induced expression of hippocampal apoptosis protein Bax (aP<0.05, vs Saline group, n=4;bP<0.05, vs KA group, n=4)
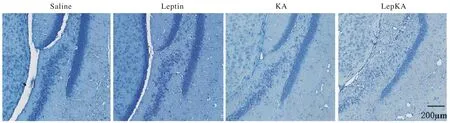
图 3 瘦素预处理后对海人酸诱导的海马Hilus区神经元丢失的影响Fig. 3 Effect of leptin pretreatment on KA-induced neuron loss of hippocampal Hilus region

图 4 瘦素受体和活化的星形胶质细胞共表达Fig. 4 Coexpression of ObRs and reactive astrocytes
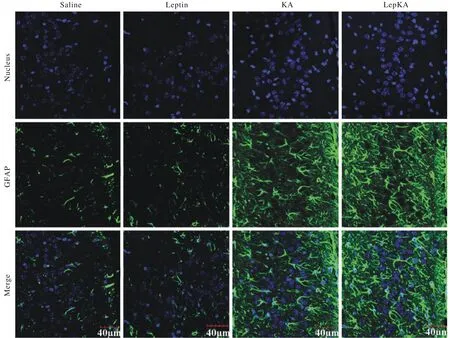
图 5 瘦素预处理后对海人酸诱导的海马Hilus区星形胶质细胞活化的影响Fig. 5 Effect of leptin pretreatment on KA-induced astrocyte activation of hippocampal Hilus region
讨 论
癫痫是神经系统中仅次于脑血管疾病的第二大病种,大部分可以用药物控制,30%癫痫患者会发展为难治性癫痫,其中颞叶癫痫占很大部分。颞叶癫痫常见的病理学改变是海马硬化、萎缩、海马特定部位神经元丢失,胶质细胞增生[7]。苔藓纤维出芽是人类颞叶癫痫的典型病理特征,苔藓纤维是齿状回颗粒细胞的轴突,正常情况下苔藓纤维是同海马Hilus区和CA3区锥体细胞的树突建立联系,在海人酸诱导损伤的情况下,Hilus区神经元和CA3区神经元显著丢失,苔藓纤维与靶细胞失去联系,触发苔藓纤维异常出芽与自身胞体和树突形成自身反馈的兴奋性突触,另外内分子层的传入纤维起始于Hilus区神经元,Hilus区神经元的丢失使苔藓状纤维发芽构成新的传入通路,形成异常的自反馈,在癫痫反复发作中起到重要作用[8-10],海马Hilus区在癫痫的发作中也起着重要作用。本研究采用海人酸诱导的颞叶癫痫小鼠模型,重点观察小鼠海马Hilus区的病理变化。
瘦素是一种主要由脂肪细胞分泌并释放入血的多肽类激素,其可通过血脑屏障作用于中枢神经系统调节能量代谢[11]。近年绝大部分研究表明,瘦素具有减轻神经损伤的作用,如在脑缺血、阿尔茨海默病、帕金森病,谷氨酸诱导的癫痫中均有保护作用[12-14]。少量研究表明,高瘦素水平对癫痫的发生具有促进作用[15],但是具体原因还不清楚。根据Lynch等[15]的研究,本文章探讨腹腔注射(10mg/kg)瘦素在海人酸诱导的颞叶癫痫模型中的作用以及可能的潜在机制。
本研究观察了Hilus区的神经元及星形胶质细胞在颞叶癫痫小鼠海马损伤中的变化。在海人酸诱导颞叶癫痫基础上,瘦素预处理后小鼠的癫痫行为评分增加,病理显示海马Hilus区神经元丢失加重,可能是由于小鼠海马内凋亡蛋白Bax表达显著升高,导致神经元抗凋亡能力下降。神经元和胶质细胞是人脑的主要构成组分,胶质细胞数量是神经元的5 ~ 10倍,其中数量最多的是星形胶质细胞,星形胶质细胞平铺并紧紧包裹着神经元和血管,长期以来星形胶质细胞被认为主要对神经元起营养和支持作用,对维持神经元外的微环境起着至关作用[16]。星形胶质细胞的活化与病理刺激的严重程度相关,神经胶质酸性蛋白是星形胶质细胞的特异性标记物,在活化的星形胶质细胞中显著增加,常用来鉴别大脑损伤区与非损伤区的星形胶质细胞[17]。在神经元丢失后,星形胶质细胞增殖活化既可以起到填充的作用,也可将损失部位隔离,但过度活化的星形胶质细胞形成的瘢痕、星形胶质细胞内谷氨酸合成酶含量降低也是癫痫反复发作及难以治愈的重要因素[18-19]。本研究发现,瘦素预处理后,颞叶癫痫小鼠海马Hilus区GFAP表达增加,星形胶质细胞过度活化,呈现反应性星形胶质细胞形态主要表现为细胞增生和细胞形态发生改变,包括胞体肥大变粗、突起增加、延长、聚集成簇。外源性给予一定量的瘦素会加重海人酸诱导的病理损伤,其可能原因是降低神经元的抗凋亡能力,过度激活星形胶质细胞。瘦素可能作为研究颞叶癫痫的新的切入点。
1 Arabadzisz D, Antal K, Parpan F, et al. Epileptogenesis and chronic seizures in a mouse model of temporal lobe epilepsy are associated with distinct EEG patterns and selective neurochemical alterations in the contralateral hippocampus[J]. Exp Neurol, 2005, 194(1):76-90.
2 Tang YY, Yu XF, Zhou B, et al. Short-term cognitive changes after surgery in patients with unilateral mesial temporal lobe epilepsy associated with hippocampal sclerosis[J]. J Clin Neurosci, 2014,21(8): 1413-1418.
3 Malendowicz LK, Rucinski M, Belloni AS, et al. Leptin and the regulation of the hypothalamic-pituitary-adrenal axis[J]. Int Rev Cytol, 2007, 263:63-102.
4 Marwarha G, Ghribi O. Leptin signaling and Alzheimer's disease[J]. Am J Neurodegener Dis, 2012, 1(3):245-265.
5 Sha LZ, Xing XL, Zhang D, et al. Mapping the Spatio-Temporal pattern of the mammalian target of rapamycin (mTOR) activation in temporal lobe epilepsy[J]. PLoS One, 2012, 7(6): e39152.
6 Racine RJ, Gartner JG, Burnham WM. Epileptiform activity and neural plasticity in limbic structures[J]. Brain Res, 1972, 47(1):262-268.
7 Howe KL, Dimitri D, Heyn C, et al. Histologically confirmed hippocampal structural features revealed by 3T Mr imaging: potential to increase diagnostic specificity of mesial temporal sclerosis[J]. AJNR Am J Neuroradiol, 2010, 31(9): 1682-1689.
8 Mathern GW, Pretorius JK, Babb TL. Quantified patterns of mossy fiber sprouting and neuron densities in hippocampal and lesional seizures[J]. J Neurosurg, 1995, 82(2): 211-219.
9 Wuarin JP, Dudek FE. Excitatory synaptic input to granule cells increases with time after kainate treatment[J]. J Neurophysiol,2001, 85(3): 1067-1077.
10 Barres BA, Barde Y. Neuronal and glial cell biology[J]. Curr Opin Neurobiol, 1995, 5 (5): 675-694.
11 Banks WA, Kastin AJ, Huang WT, et al. Leptin enters the brain by a saturable system Independent of insulin[J]. Peptides, 1996, 17(2):305-311.
12 梁辰,邓子辉,张金英,等.瘦素降低全反式维甲酸诱导的SH-SY5Y细胞tau蛋白过度磷酸化[J].军医进修学院学报,2013,34(5):495-497.
13 Ghanizadeh A. Leptin as a new approach for treatment for autism and epilepsy, a hypothesis with clinical implications[J]. Brain Dev,2011, 33(1): 92.
14 韩铭,张金英,宋翠红,等.瘦素减轻鱼藤酮诱导的SH-SY5Y细胞损伤[J].解放军医学院学报,2014,35(2):170-173.
15 Lynch JJ, Shek EW, Castagné V, et al. The proconvulsant effects of leptin on glutamate receptor-mediated seizures in mice[J]. Brain Res Bull, 2010, 82(1/2): 99-103.
16 Vallon M, Chang J, Zhang H, et al. Developmental and pathological angiogenesis in the central nervous system[J]. Cell Mol Life Sci,2014, 71(18):3489-3506.
17 Zoltewicz JS, Scharf D, Yang B, et al. Characterization of Antibodies that Detect Human GFAP after Traumatic Brain Injury[J]. Biomark Insights, 2012, 7:71-79.
18 Sosunov AA, Wu X, Mcgovern RA, et al. The mTOR pathway is activated in glial cells in mesial temporal sclerosis[J]. Epilepsia,2012, 53(Suppl 1): 78-86.
19 Eid T, Tu N, Lee T, et al. Regulation of astrocyte glutamine synthetase in epilepsy[J]. Neurochem Int, 2013, 63(7): 670-681.
Role of leptin in kainic acid-induced hippocampal injury of temporal lobe epilepsy in mice
FENG Jie1, DENG Zihui1, ZHANG Jinying1, XUE Hui1, LIANG Chen1, LI Jianhua1, YAN Guangtao21
Research Laboratory of Biochemistry, Basic Medical Institute;2Department of Clinic Biochemistry Chinese PLA General Hospital, Beijing 100853, China
YAN Guangtao. Email: yan301@263.net
ObjectiveTo study the association of leptin with the occurrence and development of temporal lobe epilepsy.MethodsAfter injection of exogenous leptin, a normal dose of kainic acid (KA, 200 ng per mouse) were microinjected into the right hippocampus of C57BL/6J mice to induce temporal lobe epilepsy. Then, seizures were scored with the Racine scores,the hippocampal pathogenesis of mice on day 7 after the KA injection were observed, the expression level of Bax was measured by Western blot, the neuron loss of hippocampal Hilus was detected by Nissl staining, and the astrocyte activation and proliferation of hippocampal Hilus were tested by immunofluorescence method.ResultsCompared with KA-induced model, seizure scores increased by about 52%, the expression of Bax significantly increased by about 75%, the neuron loss significantly accelerated, and astrocyte was over activated in the KA-induced model combined with the exogenous leptin (10 mg/kg) pretreatment.ConclusionLeptin pretreatment aggravates the neuron apoptosis and pathogenesis induced by KA.
leptin; kainic acid; temporal lobe epilepsy; astrocyte; neurons; hippocampal Hilus
R 742.1
A
2095-5227(2015)04-0388-05
10.3969/j.issn.2095-5227.2015.04.023
时间:2015-02-10 10:51
http://www.cnki.net/kcms/detail/11.3275.R.20150210.1051.002.html
2014-11-17
科技基础性工作专项项目(2011FY130100);国家科技支撑计划项目(2012BAK25B01)
Supported by the National Key Technology R&D Program(2012BAK25B01)
冯杰,男,2012级在读硕士。研究方向:神经退行性疾病的机制。Email: fengjie654321@126.com
颜光涛,男,主任,研究员,博士生导师。Email: yan301 @263.net
