松针对呼吸道合胞病毒感染小鼠肺组织TLR3、TLR4表达的影响
2015-03-21张文斌雷文汇
王 杰 张文斌 牟 界 雷文汇 李 芹
(重庆市中医院呼吸内科,重庆,400010)
松针对呼吸道合胞病毒感染小鼠肺组织TLR3、TLR4表达的影响
王 杰 张文斌 牟 界 雷文汇 李 芹
(重庆市中医院呼吸内科,重庆,400010)
目的:通过观察松针对呼吸道合胞病毒感染小鼠肺组织Toll样受体3(TLR3)及Toll样受体4(TLR4)蛋白表达的影响,探讨其治疗呼吸道合胞病毒感染的可能免疫调节机制。方法:采用美国癌症研究所(Institute of Cancer Research)培育的ICR小鼠60只随机分为6组:正常对照组、模型组、利巴韦林组、松针高剂量组、中剂量组呼、低剂量组,呼吸道合胞病毒滴鼻后给药,观察肺组织TLR3及TLR4蛋白的表达。结果:松针高剂量组可降低小鼠肺组织TLR3及TLR4蛋白的表达,与模型组比较差异有统计学意义(P<0.05)。结论:松针可抑制呼吸道合胞病毒感染小鼠肺组织中TLR3及TLR4蛋白的表达,可能为其免疫调节作用的机制之一。
松针;呼吸道合胞病毒感染;TLR3;TLR4
呼吸道合胞病毒(Respiratory Syncytial Viral,RSV)是副黏病毒科肺炎病毒属,有包膜非片段性的单股负链RNA病毒,是导致婴幼儿呼吸道感染最重要的病毒病源。目前医学尚无特效的抗RSV药物,相关疫苗开发也尚未成熟[1]。Toll样受体(Toll Like Receptors,TLRs)是近年来发现在抗病原微生物免疫防御反应中起重要作用的蛋白,通过识别病原微生物的病原相关分子模式(Pathogen-associated Molecular Patterns,PAMPs),从而启动天然免疫调节性免疫反应[2],是机体天然免疫的重要组成部分。中医药具有一定的免疫调节机制被人们广泛认可,在临床中我们观察到松针治疗本病有明显优势,具有清肺、化痰、止咳等一系列抗RSV感染的治疗方法,并取得良好的临床疗效[3],为治疗婴幼儿RSV肺炎提供了新的思路。本实验旨在探讨松针在治疗该病上的免疫调节作用可能的机制。
1 材料和方法
1.1 药物和试剂 ICR小鼠60只,体重13~16 g,雌雄各半,由重庆医科大学动物实验中心提供,利巴韦林(四川美大康药业股份有限公司提供,批号:091139);TLR3及TLR4单克隆抗体(Santa Cruz公司,美国);呼吸道合胞病毒A亚型Long株(国家典型培养物保藏中心)。松针的制备:采用2010年版中华人民共和国药典附录制备方法,采摘3~5年以上树龄的松针,每次选取50支鲜松针洗干净,切成长度1 cm左右,加水2小杯由榨汁机进行鲜窄,研磨成汁液,以大火煎开,文火水煎2次过滤去渣,合并水煎液后在中药液体包装机中浓缩成含生药3 g/mL溶液作为灌胃剂量,4 ℃冰箱保存备用。
1.2 方法
1.2.1 实验动物分组及上呼吸道感染模型制备[4]ICR
小鼠50只,随机等分成5组:正常对照组、模型组、抗病毒口服液组、利巴韦林组、松针组,每组10只。给药当日,乙醚的轻度麻醉下,正常对照组小鼠以生理盐水滴鼻,每鼠30 μL。其余各组以呼吸道合胞病毒滴鼻感染,每鼠30 μL。
1.2.2 治疗给药 感染0.5 h后,给药情况:正常组(等量生理盐水)、模型组(等量生理盐水)、抗病毒口服液组(10 mL/kg)、利巴韦林组(150 mg/kg)、松针(37.66 g/kg),各组给药的体积均为0.2 mL/10 g,给予灌胃给药,1次/d,连续7 d。
1.2.3 观察指标 各组小鼠于末次给药后,冰浴条件下无菌迅速摘取小鼠肺脏,置于无RNase EP管中,立即投入液氮中冷冻。每组取6个肺组织。用western blot法检测肺组织中TLR3及TLR4蛋白的表达水平。
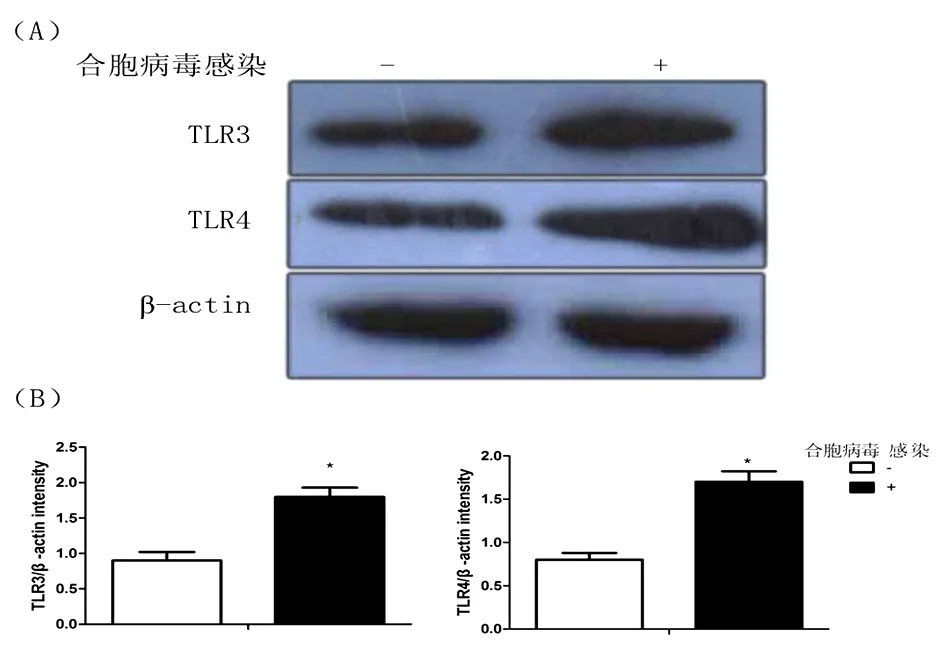
图1 模型组与对照组比较

图2 松针各剂量组与模型组、对照组比较
1.3 统计学方法 使用SPSS 20.0软件进行统计处理,所有western blot实验数据至少进行3次独立实验,通过检测基因与内参β-actin的比值,采用单因素方差分析,LSD法进行两两比较,以P<0.05为差异有统计学意义。
2 结果
松针对上呼吸道感染小鼠肺组织TLR3及TLR4蛋白的表达水平的影响:呼吸道合胞病毒模型组小鼠与正常对照组比较,肺组织中的TLR3及TLR4蛋白的表达水平表达显著增强,二者比较差异具有统计学意义(P<0.05)(图1A、B)。经药物治疗后,松针高剂量组的TLR3及TLR4蛋白的表达降低,与模型组比较差异具有统计学意义(P<0.05)。表明松针对呼吸道合胞病毒引起的上呼吸道感染的免疫调节作用可能与降低肺组织中TLR3及TLR4蛋白的表达有关(图2A、B)。
3 讨论
呼吸道合胞病毒(RSV)是世界范围内婴幼儿病毒性下呼吸道感染最重要的病毒病原,目前现代医学尚无特效的抗RSV药物,相关疫苗的开发也尚未成熟[5]。Delgado M F等提出,灭活的RSV疫苗是确保婴幼儿接种疫苗安全性的关键因素,因其通过Toll样受体(Toll-like Receptors,TLR)的刺激可增强保护性抗原表位的抗体亲和力[6]。而中医药以天然药物的抗病毒优势,提出清肺、化痰、止咳等一系列抗RSV感染的治疗方法,并取得良好的临床疗效,为治疗婴幼儿RSV肺炎提供了新的思路[7]。研究表明,RSV可能激活TLR4受体,然而没有明确的证据表明RSV F蛋白可以单独刺激TLR4依赖的NF-κB通路的激活。近年来有研究发现RSV型肺炎的免疫反应依赖完整的TLR4或MyD88信号通路。认为在RSV感染细胞中,通过LPS激活的人TLR4是不受影响的[8]。因此,RSV颗粒和人类TLR4受体之间复合物的直接相互作用似乎在RSV肺炎的发病机制中不发挥生物学作用。研究表明TLR4信号通路需要通过IFN-β调节IL-4,IL-13,IL-4Rα和IL-10的表达,使PPARγ诱导巨噬细胞,从而回应RSV[9]。RSV识别潜在的TLR3、TLR4通路从而激活人类骨髓树突状细胞,进而影响免疫。通过激活TLR3,影响病毒的发病机制和肺TLR的表达,证实了毒干扰素和肺部炎性反应的关联,并表明IFN的动物模型与肺炎的病因病理变化有着潜在的联系[10]。TLRs中TLR3是在人支气管上皮细胞和单核细胞中参与干扰素反应的主要受体。证实TLR3通过检测病毒RNA参与RSV引起的肺部炎性反应,这可能导致病毒感染,并参与多种TLRs的炎性反应[11]。
TLR是参与非特异性免疫(天然免疫)的一类重要蛋白质分子,也是连接非特异性免疫和特异性免疫的桥梁。在TLRs中,Toll样受体3(TLR3)和Toll样受体4(TLR4)与RSV关系最为密切。当RSV病毒入侵时,TLR3可识别RSV复制过程中双链RNA(dsRNA),通过非依赖的信号通路途径,结合到TRIF介导下游信号转导,激活IRF-3和(或)核因子κB(nuclearfactor kappa-B,NF-κB),刺激诱导大量IFN-α/β及其他细胞因子表达,大量IFN的分泌激活有利于局部抗病毒状态的建立,从而限制病毒在感染部位的复制,研究表明,在RSV感染上皮细胞过程中,TLR4通过引起LPS介导的IL-6反应起作用,且可能是影响上皮细胞趋化因子与病毒和内毒素相互作用的一个重要因素[12]。通过信号通路下游的接头蛋白如NF-κB、AP-1等引起炎性因子或抗炎因子如白介素-6、-8、-12(interleukin-6、-8、-12,IL-6、IL-8、IL-12)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、干扰素-α(interferon-α,IFN-α)等的表达而发挥作用,除此之外,TLR4也可通过TRIF/TRAM依赖性信号通路,激活由脂多糖(LPS)介导所致的各种细胞炎性反应[13]。
近年来中药治疗该病有了一定的进展。同时在临床中,我们运用松针治疗该病,取得了良好的临床疗效,松针在历代本草中均有记载,《别录》谓:其“主风湿疮,生毛发,安五脏”。《本草纲目》记载:“松柏为百木之长”,服之“令人不老,轻身益气,不饥延年”。现代研究表明松针具有镇静、镇痛、抗炎、延缓衰老、降血脂、降胆固醇等作用[14-15]。本研究结果显示,模型组小鼠与正常对照组比较,肺组织中的显著增强,二者比较差异具有统计学意义(P<0.05)。表明感染后,激活机体免疫系统,使得TLR3及TLR4蛋白表达增强。经药物治疗后,松针高剂量组的TLR3及TLR4蛋白表达降低,与模型组比较差异具有统计学意义。表明松针对呼吸道合胞病毒感染的免疫调节作用可能与降低肺组织中TLR3及TLR4蛋白的表达有关,推测其机制可能是通过抑制RSV感染后肺部病毒滴度,减少RSV在体内的复制。
研究表明中药松针在抑制RSV有其独有的优势,然而松针在病毒基因学、免疫学的有机结合尚待研究,我们仍需要深入探讨其抗RSV的作用途径及其作用机制。中药松针对RSV抑制作用的实验研究为松针治疗RSV感染型肺炎提供了技术支撑,由此可见,中医药治疗RSV肺炎疗效明显,具有一定的开发运用前景。
[1]徐文,刘恩梅.中性粒细胞中Toll样受体的表达功能[J].现代免疫学,2007,27:426-429.
[2]M R Gupta,D Kolli,R P Garofalo,et al.Cytokine profiles of human myeloid dendritic cell subsets in response to RSV and TLR agonists[J].Journal of Allergy and Clinical Immunology,2012,129(2):AB161.
[3]杨燕,汪受传,李瑞丽,等.清开灵注射液治疗小儿RSV肺炎痰热闭肺证主症不同时点的疗效[J].中国中西医结合杂志,2010,30(9):908-911.
[4]廉国利,俞海国,赵晓东,等.小鼠呼吸道合胞病毒感染模型的建立[J].西安交通大学学报:医学版,2003,24(4):329.
[5]Boukhvalova,Marina S,Sotomayor,et al.Activation of interferon response through Toll-like receptor 3 impacts viral pathogenesis and pulmonary Toll-like receptor expression during respiratory syncytial virus and influenza infections in the cotton rat[J].Sigmodon HispidusModel,2010,30(4):229-242.
[6]A Sykes,M R Edwards,J Macintyre,et al.Roles of TLR3,TLR4-and TLRS7-9 in interferon induction in bronchial epithelial cells and peripheral blood mononuclear cells from asthmatic and non-asthmaticsubjects[J].Thorax,2012,67(Suppl2):A1-A204.
[7]李佳曦,汪受传,徐建亚,等.白藜芦醇对RSV感染 BALB/c小鼠肺泡灌洗液TNF-α,IL-1β,IL-6表达的调控趋势[J].中国中药杂志,2012,10(37):1451-1453.
[8]Kari Ann Shirey,Lioubov M Pletneva,Adam C Puche,et al.Control of RSV-induced lung injury by alternatively activated macrophages is IL-4Rα-,TLR4-,and IFN-β-dependent[J].Mucosal Immunol,2010,3(3):291-300.
[9]Janssen R,Pennings J,Hodemaekers H,et al.Hosttranscription profilesupon primary respiratory syncytial virus infection[J].J Virol,2007,81(11):5958-5967.
[10]Liu P,Jamaluddin M,Li K,et al.Retinoic acid-inducible gene I mediates early antiviral response and Toll-like receptor 3 expression in respiratory syncytial virus-infected airway epithelial cells[J].JVirol,2007,81(3):1401-1411.
[11]Vercammen E,Staal J,Beyaert R,et al.Sensing of viral infection and activation of innate immunity by Toll-like receptor 3[J].Clin Microbiol Rev,2008,21(1):13-25.
[12]Xie X H,Law H K,Wang L J,et al.Lipopolysaccharide induces IL-6 production in respiratory syncytial virus-infected airway epithelial cells through the Toll-like receptor 4 signaling pathway[J].Pediatr Res,2009,65(2):156-162.
[13]Huang S,Wei W,Yun Y,et al.Upregulation of TLR7 and TLR3 gene expression in the lung of respiratory syncytial virus infected mice[J].WeiShengWuXueBao,2009,49(2):239-245.
[14]郑晓珂,王小兰,冯卫生,等.松针提取物降血脂作用研究[J].中药药理与临床,2008,24(3):81-82.
[15]黄晓峰,刘红煜.松针提取物的药理研究进展[J].生物技术世界,2012,10(3):18-20.
(2014-11-14收稿 责任编辑:王明)
The Effective of Pine on the Expression of TLR3,TLR4 of Respiratory Syncytial Virus Infection in Mice
Wang Jie,Zhang Wenbin,Mu Jie,Lei Wenhui,Li Qin
(RespiratoryDepartmentofInternalMedicine,ChongqingHospitalofTraditionalChineseMedicine,ChongqingYuzhongDistrict,400010)
Objective: To observe the effect of pine in respiratory syncytial virus infection in the expression of TLR3 lung tissue and TLR4 protein in mice,and explore the immune regulation mechanism of the treatment of respiratory syncytial virus infection.Methods: 60 ICR mice were randomly divided into 5 groups: normal control group,model group,the antiviral oral liquid group,ribavirin,and pine needles.After intranasal administration of respiratory syncytial virus,observe TLR3 lung tissue and the expression of TLR4 protein.Results: The antiviral oral liquid,ribavirin,pine needles can reduce the TLR3 and the expression of TLR4 protein of lung tissue in mice,compared with model group with significant difference (P<0.05).Conclusion: Pine needles can inhibit the respiratory syncytial virus infection in the lung tissue of mice TLR3 and the expression of TLR4 protein,and may be one of the mechanisms of immune regulation.
Pine needles; Respiratory syncytial virus infection; TLR3; TLR4; Protein
国家中医临床研究基地业务建设科研专项(编号:JDZX2012062)
王杰(1977.9—),男,硕士研究生,主治医师,E-mail:why9955@126.com
R285.5
A
10.3969/j.issn.1673-7202.2015.01.023
