西太平洋富钴结壳中钙质超微化石和分子化石研究
2015-03-21陈荣华赵庆英张海生卢冰Pulyaeva
陈荣华,赵庆英,张海生,卢冰,Pulyaeva I A
(1.国家海洋局 第二海洋研究所,浙江 杭州 310012; 2.Federal State Unitary Geological Enterprise “Kavkazgeolsyomka” Pyatigorsk,Russia)
西太平洋富钴结壳中钙质超微化石和分子化石研究
陈荣华1,赵庆英1,张海生1,卢冰1,Pulyaeva I A2
(1.国家海洋局 第二海洋研究所,浙江 杭州 310012; 2.Federal State Unitary Geological Enterprise “Kavkazgeolsyomka” Pyatigorsk,Russia)
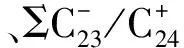
晚白垩纪;西太平洋;富钴结壳;钙质超微化石;分子化石;碳同位素
1 引言
洋底海山富钴结壳中储存有大量海洋环境信息,它记录了过去60~100 Ma以来的海洋和气候历史。一个近10 cm厚的富钴结壳蕴藏的古海洋信息几乎与几千米沉积岩心相当[1],这为研究晚白垩纪以来的异常事件(包括海底火山事件、大洋缺氧事件、生物异常更替与绝灭、沉积记录转变、南极底层流变化等)所引起的全球变化提供了绝佳材料。也使揭示白垩纪晚期以来全球面貌与异常事件之间的关联和反馈机制成为可能。研究表明富钴结壳与大洋深海沉积地层一样能够记录全球气候的变化规律,是全球变化研究中又一值得注意的研究载体。
钙质超微化石(Calcareous nannofossils)数量丰富、演化迅速,许多属种具有全球分布特点。目前,可供全球对比研究的钙质超微化石序列已经建立,它与判断结壳沉积间断的地质学方法联用[2],可使钙质超微化石的生物地球化学成功应用于结壳内部不同层位的生长速率估算和年代厘定[3—4]。
分子化石(生物标志化合物),是以弥散状保存在地层中的生物有机分子。它们分布广泛(能保存在2 700 Ma以来所有的沉积物和沉积岩中[5])、含量丰富(在沉积地层中,2%的平均含量相当于现今世界生物总量的1 000倍[6])、种类多且具有较高的抗生物和非生物分解蚀变性,某些分子化石的特殊结构包含了丰富而形式多样的与古生产力,古环境和古气候等相关信息。分子化石的诸上特点使其在全球变化研究中有着广泛的应用前景[7—8]。
本文通过中太平洋海山富钴结壳中钙质超微化石进行生物地层学年代划分,同时利用分子化石(正构烷烃、类异戊二烯)结合痕量有机碳及其碳同位素组成研究,了解富钴结壳物源及其结壳生长与海洋沉积环境(氧化或还原)、古大洋环流(南极底层流)、古海洋生产力以及古气候变迁之间的联系。
2 样品与分析方法
本次研究的样品由“大洋一号”科考船DYI05-12航次在西太平洋CM3(麦哲伦)海山的斜坡上利用拖网所得,CM3D06结壳样品位置为20.42°N,153.1°E,水深2 490 m。CM3D06富钴结壳具有典型的3层构造,总厚度为10.2 cm。
2.1 结壳分层、超微结构构造描述
CM3D06富钴结壳下伏基底岩石为磷块岩,结壳表面为粗糙型,结壳厚度为10.2 cm,宏观上大致可分为3个生长阶段,不同生长阶段有明显分界,色调和结构差异特征分明:自下而上呈现出色泽的深—浅—深、及结构上的致密—疏松—致密变化,呈韵律性变化特征。将结壳内层分为6层:Ⅰ层、Ⅱ层(68~98 mm)质地致密(亮煤层),电子显微镜下以纹层-柱状结构(微层间平行状),含脉石矿物很少,磷酸盐细脉穿切底部多层结壳(含有磷酸质浮游有孔虫化石),基岩为磷块岩;Ⅲ层(68~58 mm,孔隙发育)和Ⅳ层(28~58 mm),质地疏松,显微结构主要呈叠层状构造,也存在斑杂状构造、树枝状构造和指纹构造等(说明水动力环境变化频繁),层间夹杂脉石矿物和黄色碎屑物质(可能代表了风尘作用的影响),与上下层界限分明;Ⅴ层(28~13 mm)和Ⅳ层(13~5 mm)亦较致密,呈暗黑色,镜下为柱状构造、树枝状构造等,夹杂一定量的脉石矿物(图1)。

图1 麦哲伦海山区CM3D06结壳分层Fig.1 Dividing layers in crust sample CM3D06 from the Magellan Seamount CM3
2.2 古生物分析方法
依照岩石学标准,选择富钴结壳堆积的垂直方向面和水平方向面的合适剖面位置取样,样品断面新鲜,2~5 mm大小,鉴定的每一层面都要涂黄金薄膜,样品经过涂黄金薄膜后,安放在扫描电子显微镜(Scanning electron microscope,SEM)的载物台上,选择具有钙质微浮游生物样品位置,据需要放大2 000~7 000倍或放更大倍数,直接鉴定颗石藻壳体、盘星石碎片以及它们在铁锰物质碳酸盐-磷酸盐脉中的原生印模,该工作由俄罗斯专家Pulyaeva I A教授完成。
2.3 分子化石的提取和仪器条件
富钴结壳样品在温度低于50℃条件下烘干,样品粉碎至100目(粉末状)。样品用二氯甲烷和甲醇(分析纯、全玻璃系统二次蒸馏、体积之比3∶1)提取72 h,加入标准样品。总抽提物旋转蒸发至干,即得到样品中的可溶有机质(通常称氯仿沥青“A”)。然后将上述浓缩液用正己烷沉淀脱去沥青质,再硅胶柱层析分离,分别用正已烷、苯和二氯甲烷/甲醇(1∶1)淋洗分离出饱和烃、芳烃、醇/甾烷和极性组分。
气相色谱(GC)分析条件:采用HP5890气相色谱仪,弹性石英毛细管柱(DB-5,30 m×0.25 mm内径、0.17 μm涂层厚度)。升温程序:初始温度80℃,升温速率5℃/min,终至温度280℃,保持30 min;气相色谱-质谱仪(GC-MS)分析条件:采用美国Finnigan公司的TSQ7000色质联用仪,HP-5MS石英毛细管柱(60 m×0.25 mm内径、0.25 μm)。程序升温:初始温度80℃,恒温2 min—升温速率8℃/min至220℃—升温速率2℃/min至300℃,恒温保持25 min。载气He,气化室温度为3 002℃,质谱仪电离方式EI;电离能量:70 eV;离化电流:400 μA;离子源温度:185℃;扫描速度:1次/s,采集方式为全扫描检测。空白试验均未检出分析物质。
2.4 有机碳(TOC)及有机碳同位素测定
对样品进行预处理,将粉末状的结壳放入玻璃烧杯中,加入2N HCl溶液,不断搅拌,浸泡24 h,离心分离,并用去离子水洗至中性,以除去无机碳酸盐,分析样品经40℃烘干,保存在硅胶干燥器中;有机碳同位素测定使用Thermo NE1112型CN元素分析仪,经Conflo Ⅲ与Delta Plus AD同位素质谱分析仪连接,在线进行样品分析。元素分析仪氧化炉温度1 020℃,还原炉温度650℃,填充柱温度40℃,分别用USGS-24,GBW4408和IAEA-NI标准物质对实验室钢瓶CO2、、N2气进行标定,碳同位素用PDB国际标准为参考标准。实验室的测定精确度为±0.2‰。样品测试在国家海洋局海底科学重点实验室完成。
3 结果与讨论
3.1 富钴结壳生物地层
富钴结壳中钙质超微化石的识别参考已发表的电子显微镜照片[9—11]。结壳壳层的定年根据每个被鉴定层位中钙质超微化石的年代交集来确定,特别是关注其中是否存在标志种(时标),基于它们在生物地层学时标中的出现和未现带或亚带来确定[12—14]。本文中的每个钙质超微化石的时带分布均参考沉积物岩心钙质超微化石分析的文献资料[15—19]。
麦哲伦海山CM3D06富钴结壳层位(老壳层)98~85 mm,化石群Zigodicusspiralis(见图2a)、Watznaneriabarnesae(见图2b)、Broisoniaparka,钙质超微化石-颗石藻(Watznaueriabarnesae)是白垩纪远洋沉积中最为常见暖水种之一[20],抗溶性最强,一般不会因为成岩作用而消失[21],因此时代划分为晚白垩纪~70 Ma BP(或许更古老地层?)。结壳层位85~78 mm化石群组合有相当大的层间变化,总体上对应于Okada和Bukry划分的化石带CP8-CP9(对应于55 Ma BP),由Coccolthusformosus、Discoastermultiradiatus(见图2c)、Discoastermohleri、Discoastersp.(见图2d)组成,时代划分为早始新世-晚始新世。结壳层位58~68 mm化石群组合为Coccolithusformosus、Reticulofenestracoentura、Chiasmolithusconsuetus、Sphenolithusmoriformis、Transversopontispulcher、Ericsoniafenestrata,结壳地层形成时代对应于NP14-NP20或CP12-15 (中始新世-晚始新世)。结壳层位(48~58 mm)Coccolithuspelagicus、Trochoasterduplex(见图2e)、Pontosphaeradistincta,结壳形成时代对应于NP14-NP20或CP12-15(中始新世-晚始新世)。结壳层位(38~48 mm)化石群组合为Ericsoniaobruta、Umbilicosphaerasibogae,结壳形成时代对应于CN3—CN5a(中新世-晚中新世);结壳层位(5~28 mm)化石群组合为Cyclococcolithinaleptopora、Umbilicosphaerasibogae(见图2f)、Oolithussp.、Neosphaeracoccolithomorpha、Ericsoniapauciperforata,结壳形成时代划分为上新世-更新世。由图3可知,麦哲伦海山区结壳底层98~85 mm超微化石组合代表年代为晚白垩系,层位85~78 mm超微化石组合代表年代为晚古新世-早始新世,层位78~68 mm为早始新世,层位68~58 mm为始新世(中期、晚期),层位58~28 mm为中新世(晚期、中期),结壳最外层位28~0 mm为上新世-更新世;从麦哲伦海山区结壳超微化石的组合面貌来看,较好的反映了从更新世到晚白垩纪时期的沉积序列。
3.2 生物先质追索及其古生态意义
3.2.1 正构烷烃分子组合特征
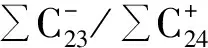
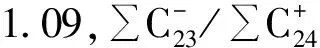
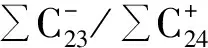

图2 CM3D06结壳钙质超微化石的电子显微镜扫描图片Fig.2 SEM photos of calcareous nannofossils from curst CM3D06
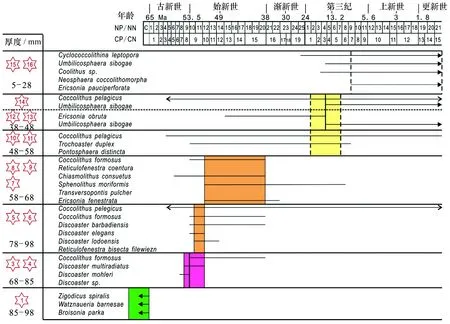
图3 CM3D06结壳生物鉴定结果与年代Fig.3 Calcareous nannofossils stratigraphy for crust CM3D06
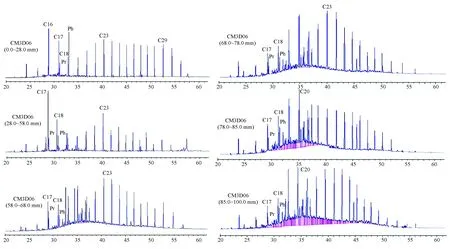
图4 CM3D06 结壳地层中正构烷烃气相色谱图Fig.4 Gas chromatography of n-alkane in the layers of crust CM3D06
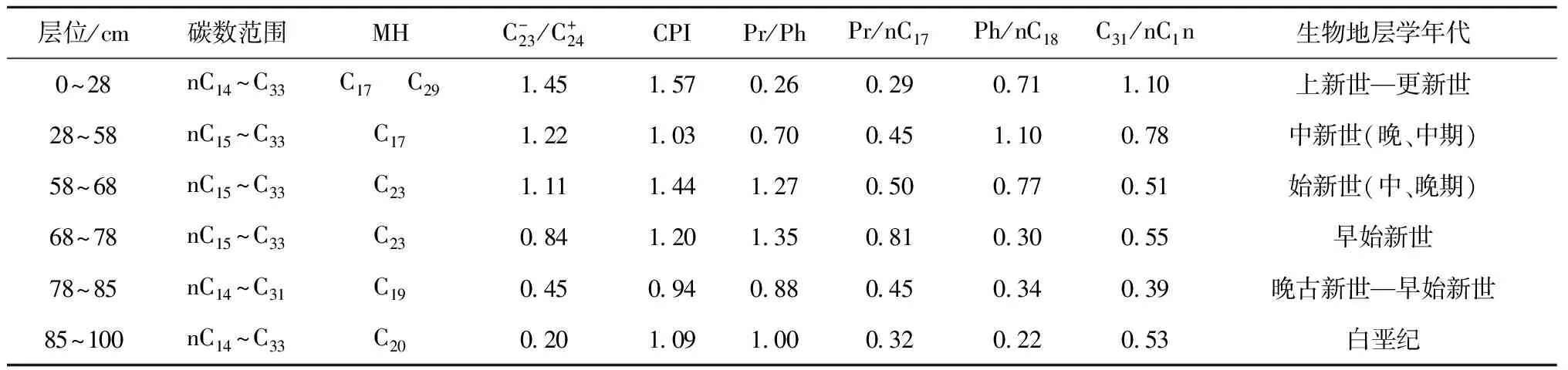
层位/cm碳数范围MHC-23/C+24CPIPr/PhPr/nC17Ph/nC18C31/nC1n生物地层学年代0~28nC14~C33C17 C29145157026029071110上新世—更新世28~58nC15~C33C17122103070045110078中新世(晚、中期)58~68nC15~C33C23111144127050077051始新世(中、晚期)68~78nC15~C33C23084120135081030055早始新世78~85nC14~C31C19045094088045034039晚古新世—早始新世85~100nC14~C33C20020109100032022053白垩纪
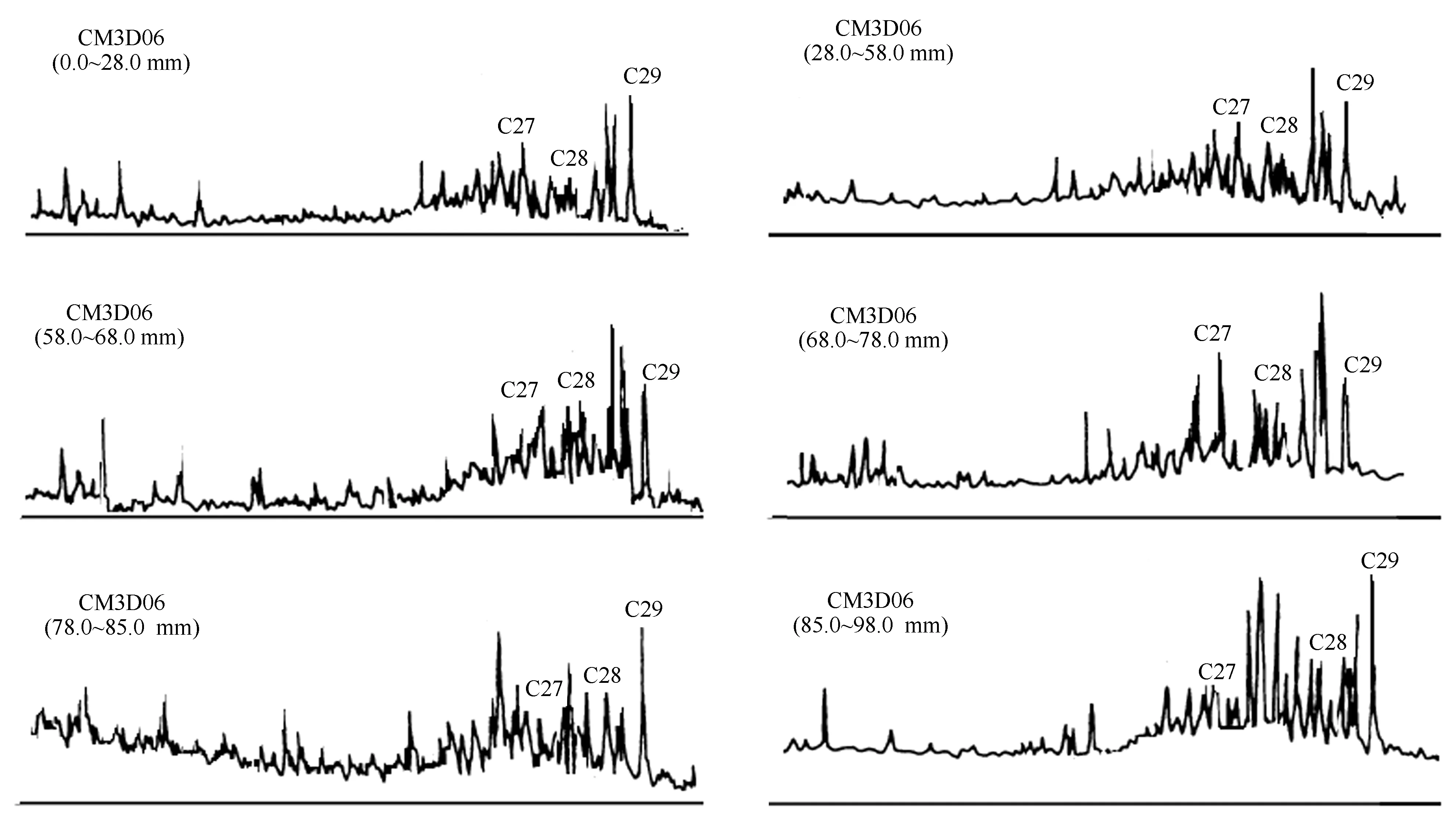
图5 CM3D06结壳地层甾烷m/z 217质量色谱图Fig.5 Mass chromatogram of sterane m/z 217 in the layers of crust CM3D06
3.2.2 甾烷类分布类型
本文将规则甾烷C27作为大洋浮游动物源[22,25],将C28甾烷作为大洋浮游植物源[26],而C29甾烷在古老地层中具有双重来源,既可能是陆地高等植物输入,也可能是蓝藻之类的输入[27—28]。根据分子化石精细结构的鉴定和质谱图显示(见图5),C29甾烷来自于海洋藻类的可能性远大于陆地高等植物源,这种异常分布暗示着不同寻常的生物源的存在,在晚白垩纪时代可能有特殊生物发育,C29甾烷优势很可能是来源于与现代的浮游蓝藻有亲缘关系的远海分布的光球疑源类[29]。
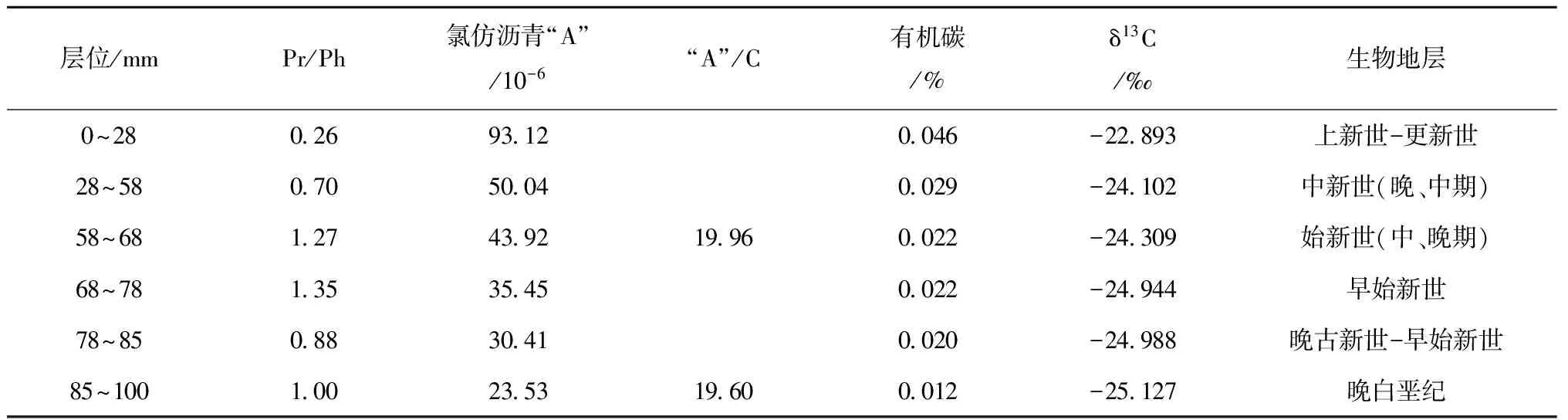
CM3D06结壳底层78~100 mm(晚白垩纪),正常甾烷分布为C29>C28>C27,呈反“L”型分布。从表2可见,中太平洋CM3D06结壳从底部—中间层—外层的规则甾烷C27、C28和C29含量分布特征完全不同,甾烷类这种分布不同型,即分子化石这种变化不但可能与浮游生物属种的相互取代有关,也与海洋环境全球气候变化有关,尤其是C27甾烷减少,可能暗示晚白垩纪部分生物由于环境改变而绝灭。在富钴结壳层58~78 mm,甾烷分布为C29>C28 上述甾烷含量分布的变化,说明生物在晚白垩纪到更新世进化过程中,生物有机质的来源及化学结构发生了改变,生物更替速率较快。晚白垩纪到更新世生物更替速率的加快从钙质超微化石的快速演化中可见一斑。钙质超微化石的某些属种在地质时期中延续短,演化快。以盘星石为例,它们在全球第三纪的地层中广泛分布,在全球范围内具有同时性,到上新世末该属种灭绝,因而作为深海沉积地层划分的世 界性对比标志种。David等[29]研究发现,盘星石类的演化特点就是随着地质时代由老到新,从中新世开始骨骼退化,辐射枝数目由多变少。例如Discoastermultiradiatus为35枝,始新世的Discoasterbaebadiensis为18枝,渐新世的Discoasterdeflandrei为6枝。生物种类的改变,形成独特的群落结构,无疑反映了大洋生态环境的演变[30]。 表2 CM3D06富钴结壳甾烷分布特征 3.3 晚白垩纪以来海洋氧化—还原环境演化 结壳中Pr/Ph比值、有机碳含量以及可溶有机质与大洋氧化还原环境的波动相对应(见表3)。在CM3D06结壳生长初期(壳层85~100 mm处),即白垩纪晚期,Pr/Ph比值平均为1.00,表明当时以弱氧化环境为主。CM3D06结壳层68.0~85.0 mm对应时代为晚古新世-早始新世。在古新世-始新世之交,结壳Pr/Ph比值为0.88,为弱还原沉积环境。结壳层58.0~68.0 mm对应时代为始新世(早、中、晚期),Pr/Ph比值为1.35和1.27,为氧化环境。CM3D06结壳层28.0~58.0 mm对应时代为中新世(晚、中期),Pr/Ph比值为0.70,为弱还原环境,有机碳为0.029%。CM3D06结壳生长后期(壳层0~28 mm处),跨上新世到更新世,Pr/Ph比值为0.26,为强还原沉积环境,同时结壳层内有机碳和可溶有机质含量增高,δ13C发生正值偏移(为-22.893‰)。综上所述,CM3D06结壳的分子化石类异戊二烯烃的姥鲛烷(Pr)/植烷(Ph)比值(0.26~1.35)的变化表明结壳生长经历了氧化—弱还原—氧化—弱还原—强还原的沉积环境。 现有研究一般认为,晚白垩纪末气候变冷,可能有深层水形成,致深海呈氧化环境[31];另一方面,晚白垩纪环特提斯海流的可能存在[32-33],或导致大洋不同海山的氧化还原条件有所不同。已有研究表明富钴结壳是富氧沉积产物,但反过来讲,富氧的沉积环境虽有利于富钴结壳生长,但并不利于有机质的保存,因此晚白垩纪壳层有机碳含量极低,仅为0.012%。在古新世-始新世之交,距今约55 Ma,气温上升,发生极热PETM (Paleocene-Eocene Thermal Maximum)事件,海洋生物大量死亡[34],并在全球范围内形成缺氧沉积,与结壳Pr/Ph比值指示的弱还原沉积环境相吻合。始新世末与渐新世之交为急速度冷期,底层水温骤降4~5℃,南极底层水(Antarctic bottom water,AABW)形成。在渐新世时(距今23~24 Ma)德雷克海峡开放,完整的南极环流形成,气候进一步变冷,AABW加强,AABW流经区域形成一定的氧化环境,这在结壳的Pr/Ph比值记录中得以很好的体现。早中新世末期(16~15 Ma)气温有短暂回升,底层水温增加了3.8℃,并伴随一次海平面的快速升降[35],这可能导致深海转为弱还原环境。 表3 西太平洋富钴结壳CM3D06中有机碳和同位素组成、氯仿沥青“A”和“A”/C比值 3.4 有机质δ13C组成特征及其影响因素 在地质历史时期,气候变化可引起海洋生物繁盛或衰退,同时伴随大气二氧化碳浓度和海水碳同位素的显著改变,这些变化能够被沉积有机质的碳同位素所记录。沉积物中有机质主要来源于海洋生物分解后残存的有机体,其TOC含量仅为0.01%~0.02%,δ13C组成偏负,一般为-19‰~-23‰[35]。与此相对,陆源有机质δ13C值变化区间为-26.3‰~-29.0‰[36]。本研究CM3D06富钴结壳有机碳(TOC)含量0.012%~0.046%,有机碳δ13C变化范围在-22.893‰~-25.127‰,具有明显的海洋生物源碳同位素特征[37—38]。值得注意的是,样品中的δ13C组成并不完全反映有机质来源,随着成岩作用增强,富13C的醣类(-19‰)和蛋白质(-18‰)的分解,也能够引起有机质碳同位素的负偏[39]。因此,如果考虑到δ13C组成的时间效应,更加表明海洋生物来源占绝对优势。 总体上,晚白垩纪以来CM3D06富钴结壳有机质δ13C呈现逐渐正偏的变化。富钴结壳有机质δ13C的这种变化与底栖有孔虫壳体δ13C新生代以来总体趋势[1]并不符合,很有可能说明富钴结壳有机质δ13C的影响因素更为复杂,难去代表大洋碳储库的变化。同时,很显然,新生代以来富钴结壳有机质δ13C正移的趋势既不能用陆源物质输入增加来解释,也不能用陆源碳库δ13C的变化(C3和C4植物的演化)来解释,因为,陆源有机碳δ13C要比大洋生物来源有机碳δ13C偏负,且陆源碳库δ13C的演化方式也与富钴结壳有机质δ13C的演化模式相反。基于以上分析,我们认为成岩作用影响下的碳同位素漂移可能是富钴结壳有机质δ13C组成演化的主要因素,即随着成岩作用增强,有机质δ13C正偏。 (1)对西太平洋麦哲伦海山CM3D06富钴结壳进行了钙质超微化石生物地层学研究,发现了生长于白垩纪(晚期),古新世(晚期),始新世(早、中、晚期),中新世(中期),上新世(晚期)和更新世时期的钙质超微化石标志性种群,并根据鉴定的钙质超微化石标志种确定了CM3D06富钴结壳不同层位的生长年代。 (3)Pr/Ph比值、有机碳含量以及可溶有机质综合反映CM3D06富钴结壳的生长经历了氧化—弱还原—氧化—弱还原—强还原的沉积环境。深层海水的氧化所反映出来的通风状况的变化与全球气候演化密切相关。 (4)CM3D06结壳中有机碳同位素组成呈现逐渐正偏的演化特征,与全球海洋碳库的碳同位素演化特征并不符合,推测可能受到成岩作用的影响,具体原因有待进一步深入研究。 [1] James Z,MarkP,Lisa S,et al. Trend,rhythms,and aberrations in global climate 65 Ma to present[J]. Science,2001,292: 686-693. [2] Summons R E,Jahnke L L,Hope J M,et al. 2-Methylhopanoids as biomarkers for cyanobacterial oxygenic photosynthesis[J]. Nature,1999,400:554-557. [3] 武光海. 中太平洋海山富钴结壳的特征及其形成环境[D].杭州: 浙江大学,2001. Wu Guanghai. Formation and characteristics for cobalt-rich ferromanganese crusts from the central Pacific seamounts[D]. Hangzhou: Zhejiang University,2001. [4] 苏新,马维林,程振波.中太平洋海山区富钴结壳的钙质超微化石地层学研究[J]. 地球科学:中国地质大学学报,2004,29(2):141-147. Su Xin,Ma Weilin,Cheng Zhenbo. Calcareous nannofossil biostratigaphy for Co-rich ferromanganese crusts from the central Pacific seamounts[J]. Earth Science: Journal of China University of Geosciences,2004,29(2):141-147. [5] 张静,于涛,潘家华,等. 西北太平洋中部海山区富钴结壳中的钙质超微化石[J]. 微体古生物学报,2007,24(1): 61-75. Zhang Jing,Yu Tao,Pan Jiahua,et al. Calcareous nannofossil from Cobalt-rich crust in middle Pacific seamount[J]. Acta Micropalaeontologica Sinica,2007,24(1): 61-75. [6] 潘家华,张静,刘淑琴,等. 西北太平洋富钴结壳的钙质超微化石地层学研究及意义[J]. 地球学报,2007,28(5): 411-417. Pan Jiahua,Zhang Jing,Liu Shuqin,et al. Calcareous nannofossil biostratigraphy of Co-rich crust from northwestern Pacific and its significance[J]. Acta Geoscientica Sinica,2007,28(5): 411-417. [7] 谢树成,梁斌,郭建秋,等. 生物标志化合物与相关的全球变化[J].第四纪研究,2003,23(5):521-528. Xie Shucheng,Liang Bin,Guo Jianqiu,et al. Biomarkers and the related global change[J].Quaternary Sciences,2003,23(5):521-528. [8] 谢树成,王志远,王红梅,等. 末次间冰期以来黄土高原的草原植被景观:来自分子化石的证据[J].中国科学(D辑),2002,32(1):28-35. Xie Shucheng,Wang Zhiyuan,Wang Hongmei,et al.Plateau grassland vegetation landscape since the last interglacial loess : evidence from molecular fossils[J].Science in China(Series D),2002,32(1):28-35. [9] Roth P H. Calcareousnannofossils-Leg17,Deep Sea Drilling Project[R]//Initial Reports of the Deep Sea Drilling Project.Vol.17. Washington: U S GovtPrinting Office,1973:695-795. [10] Edwards A R,Perch-Nielsen K. Calcareous nannofossils from the southwest Pacific,Deep Sea Drilling Project,Leg 29[R]//InitialReports of the Deep Sea Drilling Project,1975. [11] Perclr-Nielsen K.Mesozoic calcareous nannofossils[M]//Plankton Stratigraphy.Cambridge:Cambridge University Press,1985:329-426. [12] Martini E. Standard Tertiary and Quaternary calcareous nannoplanktonzonation[G]//Farinacct A. Proc 2nd Planktonic Conf. Planktonic MicrofassilsRoma:EdTecnosci.1971: 739-785. [13] Okada H,Bukry D. Supplementary modification and introduction of code numbers to the low latitude coccolithbiostratigraphic zonation[J]. Marine Micropaleotology,1980,5:321-325. [14] Gartner S. Nannofossils and biostraphy: an overview[J]. Earth-Science Reviews,1977,13:227-250. [15] Martini E,Worsley T. Standard Neogene calcareous nannoplankton zonation[J]. Nature,1970,225:289-290. [16] Martini E,Worsley T. Tertiary calcareous nannoplankton from the western equatorial Pacific[R]// Init Rep DSDP,Vol.7. Washington:USGoct Printing Office,1971:1471-1507. [17] Bukry D. Coocolith stratigraphy,eastern equatorial Pacific,Leg.16,Deep Sea Drilling Project[R]//Init Rep DSSP,Vol.16.Washinggton:USGovt Printing Office,1973:653-711. [18] Bukry D.Pytoplankton stratigraphy,Deep Sea Drilling Project,Leg 20,western Pacific Ocean[R]//Init Rep DSDP,Vol.16.Washington:USGovt Printing Office,1973:307-317. [19] Bukry D. Biostratigraphy of Cenozoic marine sediment by calcareous nannofossils[J]. Micropaleontology,1978,24:44-60. [20] Shumenko S I. Ecology[M]//Proctical Guide to Microfauna of the UUSSR,Vol. 1: CalcareousNannofossils (Nedra,leningrad).1987:11-15. [21] 刘怀宝,Watkins D K.北美西部内陆海盆Niobrara 组的钙质超微化石及其环境意义Ⅱ[J].高校地质学报,2004,10(1):26-38. Liu Huaibao,Watkins D K. Calcareous Nannofossils from the Niobrara Formation (Upper Cretaceous) and Paleoenvironments of the North American Western Interior Basin Part Ⅱ:Paleoenvironment Study[J]. Geological Journal of China Universities,2004,10(1): 26-38. [22] C巴克. 石油勘探中的有机地球化学[M].北京: 石油工业出版社,1982. Barker C. Organic Geochemistry in Petroleum Exploration[M]. Beijing: China Petroleum Industry Press,1982. [23] 杨群.古生物学领域的新辟园地——分子古生物研究[J]. 古生物学报,1995,34(3): 265-276. Yang Qun. A frontal area in paleonotology: Molecular fossil studies[J]. Acta Paleontologica Sinica,1995,34(3):265-276. [24] Shaw P M,Johns R B. The identification of organic input sources of sediments from the Santa Catalina Basin using factor analysis[J]. Organic Geochemistry,1986,10: 951-958. [25] Volkman J K,Farrington J W,Gagosian R B. Marine and terrigenous lipids in coastal sediments from the Peru upwelling region at 15°S: sterols and triterpene alcohols[J]. Organic Geochemistry,1987,11:463-477. [26] Volkman J K. A review of sterol markers for marme and temgenous matter[J].Organic Geochemisty,1986,9:83-99. [27] Goad L J,Goodwin T W. The biosynthesis of plant sterols[J].Progress in Phytochemistry,1972,3: 113-198. [28] Rieley G,Collier R J,Jones D M,et al. The biogeochemistry of Ellesmere Lake,U. K. -I:source correlation of leaf wax inputs to sedimentary lipid record[J].Organic Geochemistry,1991,17:901-912. [29] David K R,James C Z,Robert M O,et al. Global change at the Paleocene-Eocene boundary: climates and evolutionary consequences of tectonic events[J]. Palaegeography,Palaegeography,Palaegeography,1990(79): 117-128. [30] Wang C S,Hu X M,Janasa L,et al. Upper Cretaceous oceanic red beds in southern Tibet: Amajor change from anoxic to oxic condition[J]. Cretaceous Research,2005,26:21-32. [31] Bush A B G. Numerical simulation of the Gretaceous Tethys circumglobal current[J]. Science,1997,271:807-810. [32] Hotinski R M,Toggweiler J R. Impact of a Tethyancircumglobal passage on ocean heat transport and “equable” climates[J].Paleoceanography,2003,18:1007. [33] Zachos J C,Lohmann K C,Walker J C G,et al. Abrupt climate change and transient climates during the Paleogene: Amarinepespective[J]. Journal of Geology,1993,101:191-213. [34] Douglas R G,SavinM. Oxygen and carbonisotope analysis of Cretaceous and Tertiaryforaminiferafrom the central north Pacific[R]//Initial Reports of the Deep Sea Drilling Project,Volume 17: Washington (U.S. Government Printing Office).1973:591-605. [35] Grantham P J,Wakefiled I I. Variations in the sterane carbon number distributiona of marine source rock derived crude oils through geologicaltime[J]. Organic Geochemistry,1988,12(2):61-73. [36] Deines P. The isotopic composition of reduced organic carbon[C]//Handbook of Environmental Isotopic Geochemistry. Amsterdam:Elsevier,1980:320-406. [37] Salomons W,Mook W G. Field observationa of the isotopic composition of particulate organic carbon in the Southern North Sea and adjacent estuaries[J]. Marine Geology,1981,41:11-20. [38] Fry B,Sherr E B. δ13C measurements as indicators of carbon flow in marine and freshwater ecosystems[J]. Contributions to Marine Science,1984,27:13-47. [39] Hunt J M. The significance of carbon isotope variations in marine sediments[M]//Advances in Organic Geochemistry. Oxford: Pergamon,1970:27-35. Calcareous nannofossil stratigraphy and molecular fossils in the Co-rich ferromanganese crust from the Western Pacific Chen Ronghua1,Zhao Qingying1,Zhang Haisheng1,Lu Bing1,Pulyaeva I A2 (1.SecondInstituteofOceanography,StateOceanicAdministration,Hangzhou310012,China;2.FederalStateUnitaryGeologicalEnterprise“Kavkazgeolsyomka”Pyatigorsk,Russia) Late Cretaceous;Western Pacific;Co-rich ferromanganese crust;molecular fossils;carbon isotope 10.3969/j.issn.0253-4193.2015.07.013 2014-06-25; 2015-02-10。 国家自然科学基金(41076072);国家自然科学基金重点基金项目(91128212)。 陈荣华(1955—),男,浙江省杭州市人,研究员,主要从事海洋沉积学与古海洋学研究。E-mail:chrhhz@163.com P736.3 A 0253-4193(2015)07-0132-10 陈荣华,赵庆英,张海生,等. 西太平洋富钴结壳中钙质超微化石和分子化石研究[J]. 海洋学报,2015,37(7): 132-141, Chen Ronghua,Zhao Qingying,Zhang Haisheng,et al. Calcareous nannofossil stratigraphy and molecular fossils in the Co-rich ferromanganese crust from the Western Pacific[J]. Haiyang Xuebao,2015,37(7): 132-141,doi:10.3969/j.issn.0253-4193.2015.07.013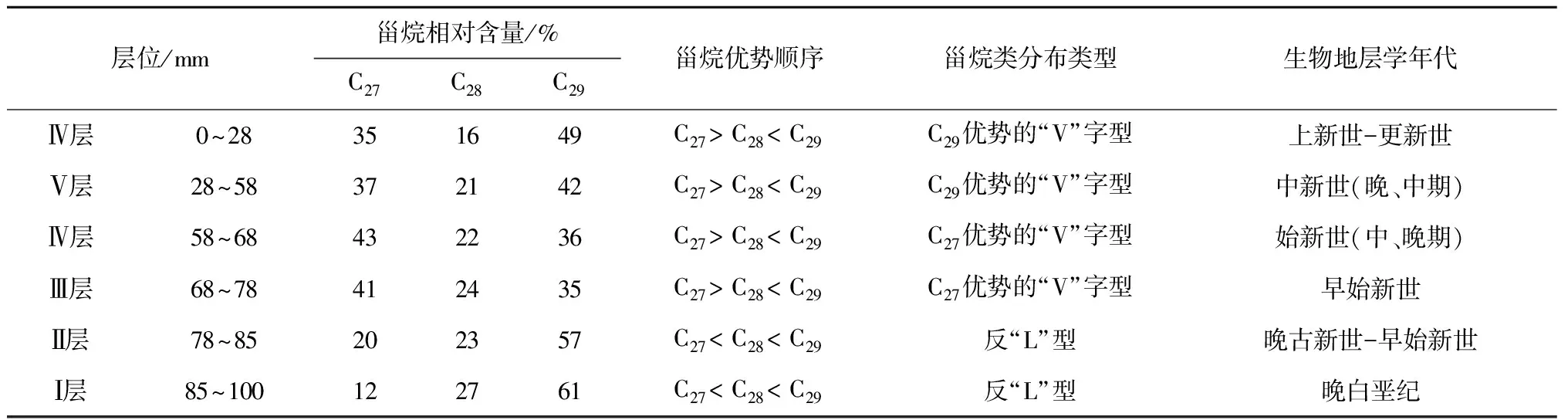
4 结论