一类多氟负介电液晶单体的合成及性能研究
2015-03-21吕文海孟劲松高红茹贠国良华瑞茂
吕文海,孟劲松,高红茹,贠国良,华瑞茂
(1.石家庄诚志永华显示材料有限公司,河北 石家庄050091;2.河北省平板显示材料工程技术研究中心,河北 石家庄050091;3.清华大学 化学系,北京100084)
1 引 言
随着液晶显示技术的不断发展,人们对液晶材料的性能提出了新的要求。任何单组份液晶都不能满足显示的全部要求,因此需要开发各种性能各异的单体液晶,然后将多种单体液晶按照适当的比例进行调配,得到各种参数的最佳配比来满足不同显示的要求[1-2]。
各种中、大尺寸的液晶显示模式中,共面转变液晶显示(IPS)所用液晶材料的介电各向异性(Δε)既可以是正性的,也可以是负性的;垂直取向模式(VA)中,液晶分子在零场时与玻璃基板方向垂直,与垂直入射光线平行。当偏振片正交时,会显示良好的暗态,所以该类器件有着良好的对比度,而其应用的液晶是负性的。这两种显示模式中IPS模式显示具有宽视角、快相应速度等优点,VA 模式器件响应速度较快,两种显示模式都着极好的发展前途[3-4]。
随着两种显示模式的发展,对负性液晶单体的需求也是越来越强烈,作者的目的就是发明一类具有高光学各向异性(Δn)、高负介电各向异性(Δε)、化学性质稳定的液晶单体[5-6]。
具有2,3-二氟苯基的液晶单体一般都具有着负的介电各向异性(Δε)[7],为了得到具有高负介电各向异性的液晶单体,作者设计了具有2个或3个2,3-二氟苯基的分子,因为液晶分子中存在3个苯环,所以目标液晶单体也有着较大的光学各向异性(Δn)[8]。为了改善低温互溶性,选用了酯基作为连接基团。在端基选用了应用最为广泛的丙基和乙氧基。
作者设计了6 种有着高负介电各向异性的液晶单体的合成方法,使用了核磁共振和质谱等方法确定了分子结构,利用示差扫描量热仪、阿贝折射仪和电容电抗测试仪等测试手段对其参数进行了测定。试验表明,该类型的多氟负介电各向异性化合物具有的性能,可以用于液晶母体的调配并且改善其部分性能。该类多氟化合物原料易得、收率较高,对设备要求不高,极易实现工业量产。
2 实 验
2.1 实验原料和测试仪器
实验中采用的原料主要有以下几种:
所用中间体:2,3-二氟-丙基苯、2,3-二氟苯乙醚、4-丙基-2,3-二氟苯硼酸、4-乙氧基-2,3-二氟苯硼酸、2,3-二氟碘代苯均为本公司自产;
所用试剂:正丁基锂、硼酸三甲酯、二氧化碳、4-二甲氨基吡啶(DMAP)、N,N’-二环己基碳二亚胺(DCC)、双氧水(30%)、无水碳酸钠、叔丁醇钾、浓盐酸及各种使用到的相关溶剂等均为市售试剂,化学纯。
测试仪器主要有:
DSC822e型差热分析扫描仪(瑞士Mettler-Toledo公司)
HP6820型气相色谱仪(美国Agilent公司)
岛津LC-20A 型液相色谱仪(日本岛津公司)
HP5890-5972型 气 质 谱 联 用 仪(GC-MS)(美国Agilent公司)
布鲁克AVANCE ⅢHD 核磁(NMR)核磁共振波普仪300M Hz(美国布鲁克公司)
Vario ELⅢ元素分析仪(德国elementar公司)
2WAJ型阿贝折射仪(上海)
HP-4284A 型电容电抗测试仪(美国Agilent公司)
测定单体液晶化合物光学各向异性(Δn)和介电各向异性(Δε)参数所用的母体液晶是FMTA,其 主 要 参 数 为:Cp(清 亮 点)=64.3 ℃,Δn=0.103 1,Δε=-2.54,γ1=125.4 mPa·s。
由石家庄诚志永华显示材料有限公司提供。
具体合成化合物如表1所示。
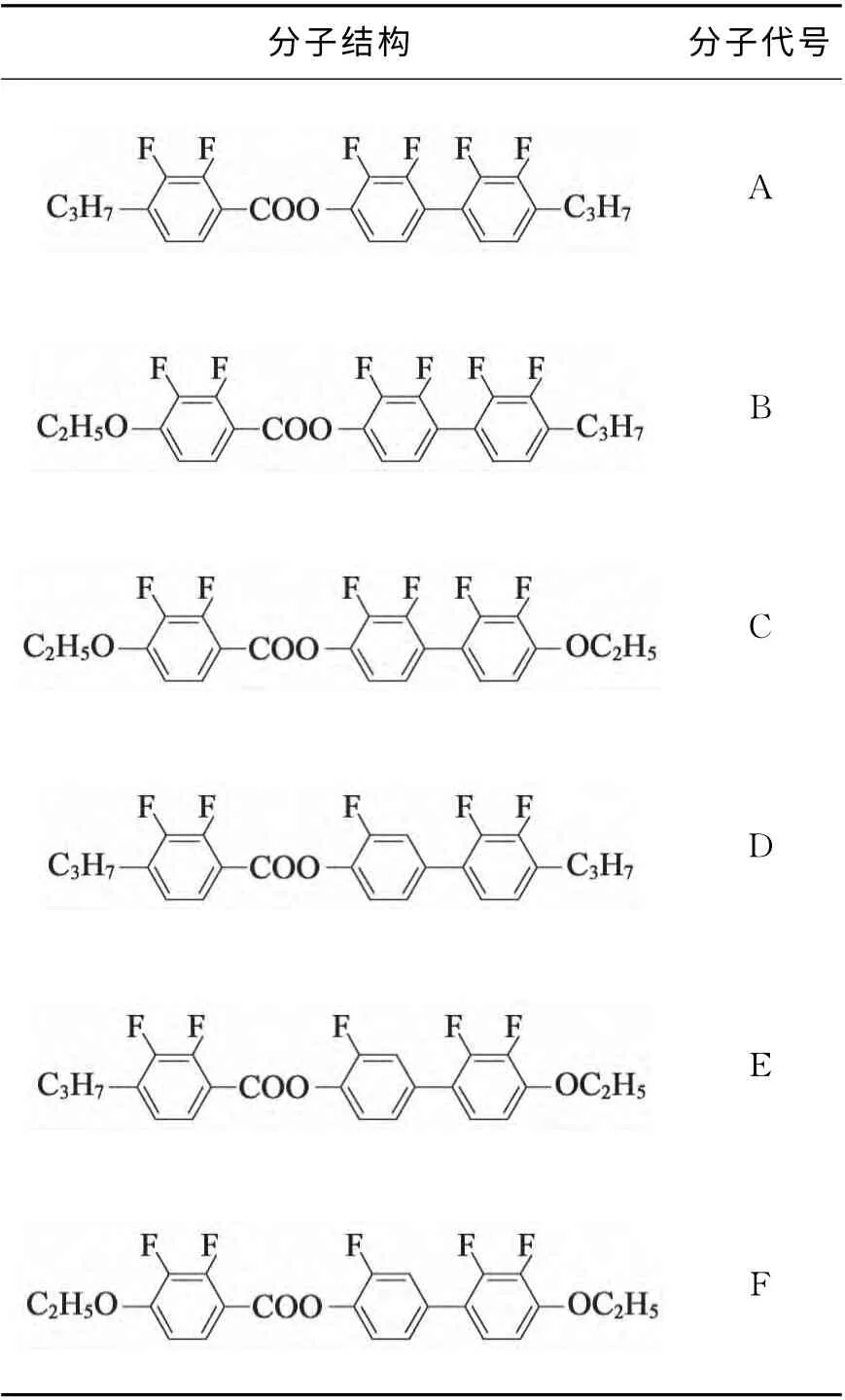
表1 合成化合物结构Tab.1 Compound structure formula
2.2 4-丙基-2,3-二氟苯甲酸-4-(4-丙基-2,3-二氟苯基)-2,3-二氟苯酚酯(化合物A)的合成
2.2.1 合成路线
化合物A 的合成路线如图1 所示。以4-丙基-2,3-二氟苯硼酸为原料,与2,3-二氟碘代苯进行suzuki偶联,得到化合物A-1,之后低温锂代后与硼酸三甲酯反应合成相应的硼酸(化合物A-2),然后使用双氧水进行氧化得到酚(化合物A-3)备用。另一端以4-丙基-2,3-二氟苯为原料,经过低温锂代后与二氧化碳反应得到相应的酸(化合物A-4),最后与备用的酚(化合物A-3)进行酯化反应得到目标产物化合物A。该方法有着简便、产物纯度高、成本低廉等优点。
2.2.2 4-丙基-2,3,2′,3′-四氟联苯的合成(化合物A-1)
在1L三口瓶中加入40g(0.2mol)的4-丙基-2,3-二氟苯、48g(0.2mol)2,3-二氟-碘代苯、31.8g(0.3 mol)无水碳酸钠、160 mL 甲苯、160 mL无水乙醇、160 mL 水,氮气保护下,加入1g Pd(PPh3)4,之后加热至回流,回流反应6h,反应完毕。降至室温后分液,取上层有机相,300 mL水洗涤有机相,减压下蒸除溶剂,残留物加入200 mL石油醚,加热后进行柱层析,200 mL 热石油醚(90~120 ℃)洗脱,得到的产物再次减压下蒸除溶剂,残留物加入150 mL 无水乙醇和50 mL甲苯进行重结晶,得到47g白色晶体化合物A-1,产率87.7%,GC浓度为99.2%。
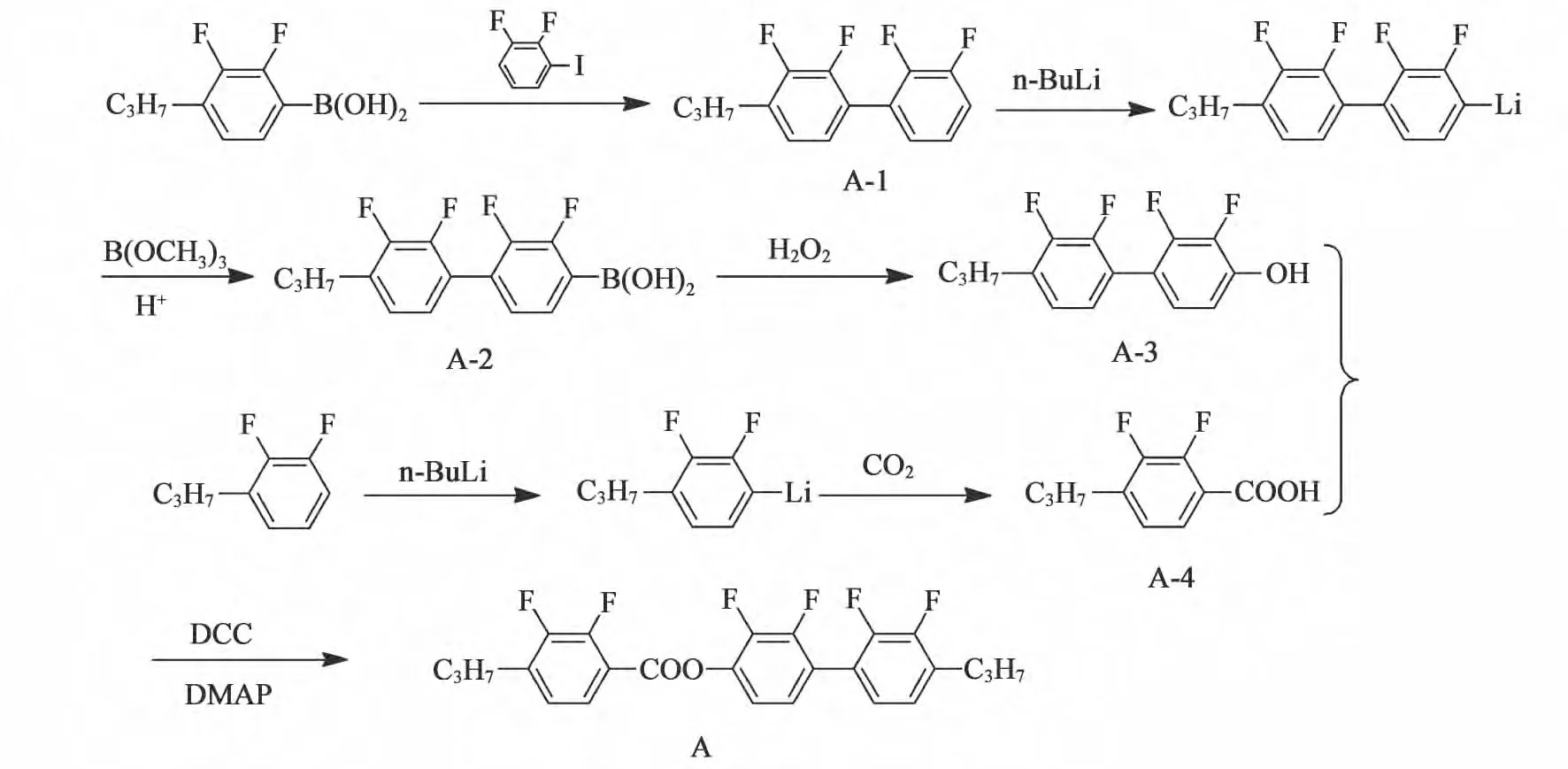
图1 化合物A 的合成路线Fig.1 Sysnthesis of compound A
2.2.3 4-(4-丙基-2,3-二氟苯基)-2,3-二氟-苯硼酸的合成(化合物A-2)
在1L三口瓶中加入47g(0.175mol)化合物A-1、250mL干燥四氢呋喃,使用氮气置换空气,搅拌下将反应液降温至-78℃,滴加0.193mol正丁基锂(2.5mol/L,77mL),滴加过程中控温-85~-75℃,滴加完毕后在此温度下搅拌1h。然后再滴加27g(0.26mol)硼酸三甲酯,滴加过程中控温-85~-75 ℃,滴加完毕后自然升至室温。将反应液倒入盛有200g冰水和30mL浓盐酸的烧杯中,搅拌10min后分液,取上层有机相,200mL甲苯提取水相,合并有机相,300mL水洗涤有机相,加入10g无水硫酸钠干燥30min,滤去催化剂减压下蒸除溶剂,加入300mL石油醚(90~120 ℃)煮沸后自然降至室温,然后放入-20 ℃冰箱中冷冻4h,过滤得到49g白色固体化合物A-2,产率:89.7%,HPLC浓度为98.7%。
2.2.4 4-(4-丙基-2,3-二氟苯基)-2,3-二氟-苯酚的合成(化合物A-3)
在500 mL 三口瓶中加入49g(0.157 mol)化合 物A-2、200 mL 四 氢 呋 喃,滴 加106 mL(0.47mol)15%的双氧水,30min滴加完毕后加热至回流,回流反应3h,反应结束。加入200mL乙酸乙酯,搅拌10min后分液,取上层有机相,有机相用300mL×2水洗涤。加入10g无水硫酸钠干燥30 min,滤去催化剂减压下蒸除溶剂,加入300mL 石油醚(90~120 ℃)和100 mL 乙酸乙酯溶解产物后进行柱层析,800 mL 3∶1的石油醚(90~120 ℃):乙酸乙酯溶液洗脱,流出液减压下蒸除溶剂,残留物用200 mL 石油醚(90~120 ℃)和40mL乙酸乙酯重结晶,得到35g白色晶体A-3,产率:78.3%,GC浓度为99.8%。
2.2.5 4-丙基-2,3-二氟苯甲酸的合成(化合物A-4)
在1L三口瓶中加入31.2g(0.2 mol)4-丙基-2,3-二氟苯、150mL 干燥四氢呋喃,使用氮气置换空气,搅拌下将反应液降温至-78 ℃,滴加0.22mol正丁基锂(2.5mol/L,88mL),滴加过程中控温-85~-75 ℃,滴加完毕后在此温度下搅拌1h。然后再通入二氧化碳气体,通气过程中控温-85~-75 ℃,通气至温度无明显变化后,保持低温正压继续搅拌2h,之后自然升至室温,将反应液倒入盛有200g冰水和30mL 浓盐酸的烧杯中,搅拌10min后分液,取上层有机相,200mL甲苯提取水相,合并有机相,300mL水洗涤有机相,加入10g无水硫酸钠干燥30min,滤去催化剂后减压下蒸除溶剂,残留物用120 mL无水乙醇和40mL甲苯重结晶,得到31g白色晶体A-4,产率:77.5%,GC浓度为97.8%。
2.2.6 4-丙基-2,3-二氟苯甲酸-4-(4-丙基-2,3-二氟苯基)-2,3-二氟苯酚酯(化合物A)的合成
在250mL三口瓶中加入5g(0.025mol)化合物A-4、7.1g(0.025mol)化合物A-3、、0.125 g(0.001 mol)4-二甲氨基吡啶(DMAP)、40 mL二氯甲烷,冰盐浴降温至0℃,滴加5.6g(0.027 mol)N,N′-二环己基碳二亚胺(DCC)和15mL二氯甲烷的溶液,滴加过程中控温-5~5 ℃,滴加完毕后升至室温,室温搅拌8h,反应完毕,过滤,15mL二氯甲烷洗涤滤饼,减压下蒸除溶剂,残留物用40mL甲苯溶解,柱层析提纯,50 mL 甲苯洗脱,减压下蒸除溶剂后,30mL 甲苯重结晶,得到9.6g白色晶体A,产率:82.4%,GC 浓度为99.7%。
1HNMR(300 M Hz CDCl3):δ0.970~1.024(m,6H),1.640~1.759(m,4H),2.675~2.766(m,4H),7.002~7.257(m,5H),7.784~7.838(m,1H)。
MS:m/z(%),466(M+4.3),183(100),154(11.7),126(11.2)
元素分析结果:
C25H20F6O2理 论 值(%):C:64.38%,H:4.29%,O:6.86%;实 测 值(%):C:64.54%,H:4.41%,O:6.67%。
上述检测数据表明,所得化合物A 结构正确。
化合物B、化合物C 的合成方法和过程参考化合物A 的合成。
化合物B:
1HNMR(300 M Hz CDCl3):δ0.999 (t,J=7.0Hz,3H),1.518(t,J=7.0Hz,3H),1.495~1.757(m,2H),4.238(q,J=7.0Hz,2H),6.823~6.876(m,1H),7.000~7.213(m,4H),7.850~7.912(m,1H)。
MS:m/z(%),468(M+0.9),283(3.9),185(100),157(58.3)
元素分析结果:
C24H18F6O3理 论 值(%):C:61.54%,H:3.84%,O:10.26%;实测值(%):C:61.64%,H:3.89%,O:10.40%。
化合物C:
1HNMR(300 M Hz CDCl3):δ1.469~1.546(m,6H),4.146~4.273(m,4H),6.796~6.876(m,2H),7.028~7.199(m,3H),7.849~7.912(m,1H)。
MS:m/z(%),470(M+4.9),257(7.6),185(100),157(65.5)
元素分析结果:
C23H16F6O4理 论 值(%):C:58.72%,H:3.40%,O:13.62%;实 测 值(%):C:58.81%,H:3.49%,O:13.58%。
2.3 4-丙基-2,3-二氟苯甲酸-4-(4-丙基-2,3-二氟苯基)-2-氟-苯酚酯(化合物D)的合成
2.3.1合成路线
化合物D 的合成路线如图2 所示。以4-丙基-2,3-二氟苯硼酸为原料,与间氟溴苯进行suzuki偶联,得到化合物D-1,之后用叔丁醇钾和正丁基锂低温锂代后与硼酸三甲酯反应合成相应的硼酸(化合物D-2),然后使用双氧水进行氧化得到酚(化合物D-3),最后与酸(化合物A-4)进行酯化反应得到目标产物化合物D。
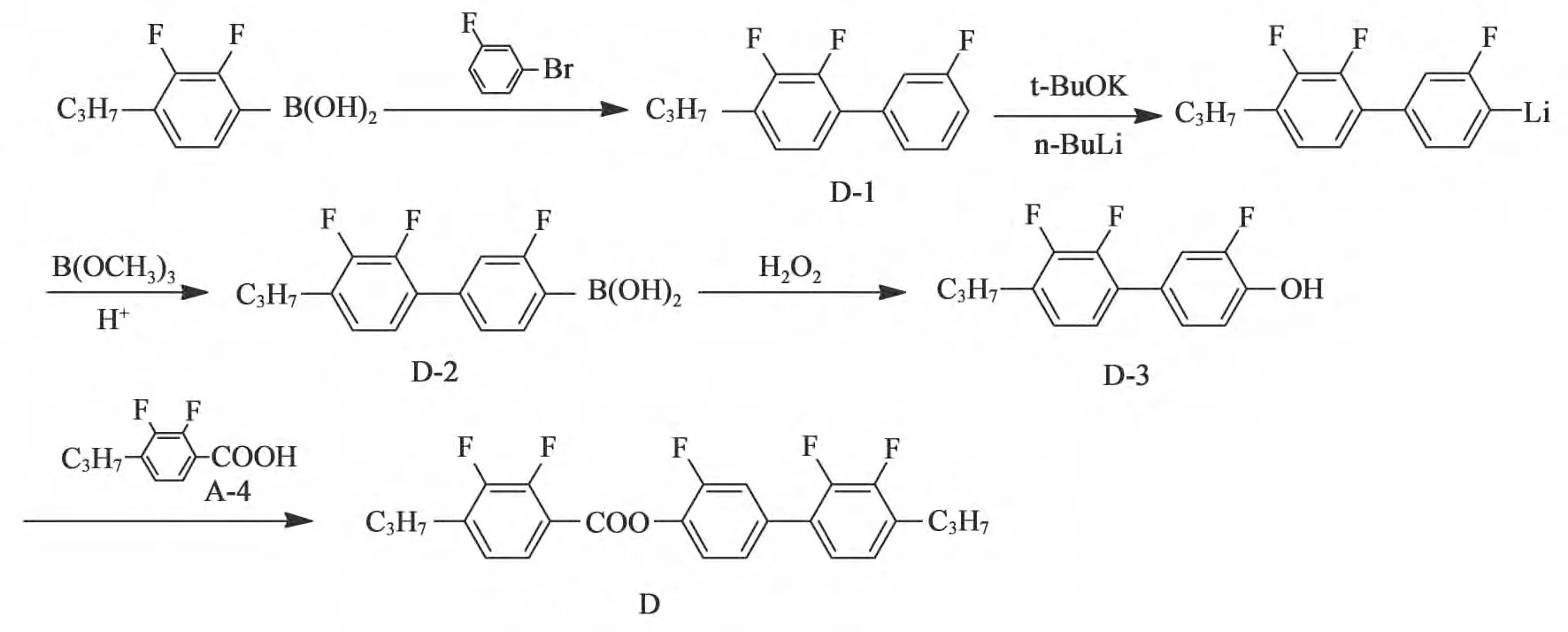
图2 化合物D 的合成路线Fig.2 Sysnthesis of compound D
2.3.2 4-丙基-2,3,3′-三氟联苯的合成(化合物D-1)
参考化合物A-1的合成过程,将2,3-二氟-碘代苯替换为邻氟溴苯,得到43g白色晶体化合物D-1,产率86%,GC浓度为99.4%。
2.3.3 4-(4-丙基-2,3-二氟苯基)-2-氟-苯硼酸的合成(化合物D-2)
在1L三口瓶中加入43g(0.172mol)化合物D-1、21.2g(0.189mol)叔丁醇钾、250mL 干燥四氢呋喃,使用氮气置换空气,搅拌下将反应液降温至-78 ℃,滴加0.189 mol正丁基锂(2.5 mol/L,76 mL),滴加过程中控温-85~-75℃,滴加完毕后在此温度下搅拌1h。然后再滴加27g(0.26mol)硼酸三甲酯,滴加过程中控温-85~-75 ℃,滴加完毕后自然升至室温。将反应液倒入盛有200g冰水和30mL浓盐酸的烧杯中,搅拌10 min后分液,取上层有机相,200 mL甲苯提取水相,合并有机相,300mL 水洗涤有机相,加入10g无水硫酸钠干燥30min,滤去催化剂减压下蒸除溶剂,加入300 mL 石油醚(90~120 ℃)煮沸后自然降至室温,然后放入-20 ℃冰箱中冷冻4h,过滤得到42g白色固体化合物D-2,产率:83%,HPLC浓度为99.1%。
2.3.4 4-(4-丙基-2,3-二氟苯基)-2-氟-苯酚(化合物D-3)及4-丙基-2,3-二氟苯甲酸-4-(4-丙基-2,3-二氟苯基)-2-氟-苯酚酯(化合物-D)的合成
参考化合物A-3的合成过程,将4-(4-丙基-2,3-二氟苯基)-2,3-二氟-苯硼酸(化合物A-2)替换为4-(4-丙基-2,3-二氟苯基)-2-氟-苯硼酸(化合物D-2),得到31g白色晶体化合物D-3,产率81.5%,GC浓度为99.7%。
参考化合物A 的合成过程,将4-(4-丙基-2,3-二氟苯基)-2,3-二氟-苯酚(化合物A-3)替换为4-(4-丙基-2,3-二氟苯基)-2-氟-苯酚(化合物D-3),得到7.8g白色晶体化合物D,产率69.6%,GC浓度为99.7%。
1HNMR(300 M Hz CDCl3):δ 0.982~1.036(m,6H),1.653~1.772 (m,4H),2.687~2.778 (m,4H),7.014~7.262 (m,6H),7.800~7.858(m,1H)。
MS:m/z(%),448(M+4.5),183(100),154(10.8),126(9.9)
元素分析结果:
C25H21F5O2理 论 值(%):C:66.96%,H:4.69%,O:7.14%;实测 值(%):C:66.99%,H:4.78%,O:7.00%。
上述检测数据表明,所得化合物D结构正确。
化合物E、化合物F 的合成方法和过程参考化合物D 的合成。
化合物E:
1HNMR(300 M Hz CDCl3):δ0.992 (t,J=7.0Hz,3H),1.491(t,J=7.0Hz,3H),1.638~1.762(m,2H),2.736(t,J=7.0Hz,2H),4.180(q,J=7.0 Hz,2H),6.797~6.857(m,1H),7.028~7.200 (m,5H),7.780~7.835(m,1H)。
MS:m/z(%),450(M+11.1),183(100),154(10.7),126(10.3)
元素分析结果:
C24H19F5O3理 论 值(%):C:64.00%,H:4.22%,O:10.67%;实测值(%):C:64.11%,H:4.31%,O:10.54%。
化合物F:
1HNMR(300 M Hz CDCl3):δ1.460~1.537(m,6H),4.138~4.265 (m,4H),6.787~6.867 (m,2H),7.020~7.195 (m,4H),7.838~7.901(m,1H)。
MS:m/z(%),452(M+5.2),239(6.4),185(100),157(62.3)
元素分析结果:
C23H17F5O4理 论 值(%):C:61.06%,H:3.76%,O:14.16%;实测值(%):C:61.00%,H:3.67%,O:14.22%。
3 结果与讨论
3.1 相关液晶参数的测量方法
将合成的6种化合物以5%的质量分数加入到FMTA 母体液晶中,测试所得混合液晶电矢量分别平行(ne)、垂直(no)于液晶分子的光轴折射率(25 ℃,589nm),再计算光学各向异性(Δn)(Δn=ne-no);测试外加电场分别与液晶分子长轴平 行(ε∥)、垂 直(ε⊥)的 介 电 常 数(25 ℃,1kHz),计算介电各向异性(Δε)(Δε=ε∥-ε⊥),以及化合物的相变DSC 测试升温速度为5 ℃/min,氮气保护[9-11]。
6种化合物的性能参数以与其在混合物中的浓度呈线性关系计算得出。
3.2 相关液晶参数的测定结果
采用了上述的测试方法,得到的液晶参数如表2所示。
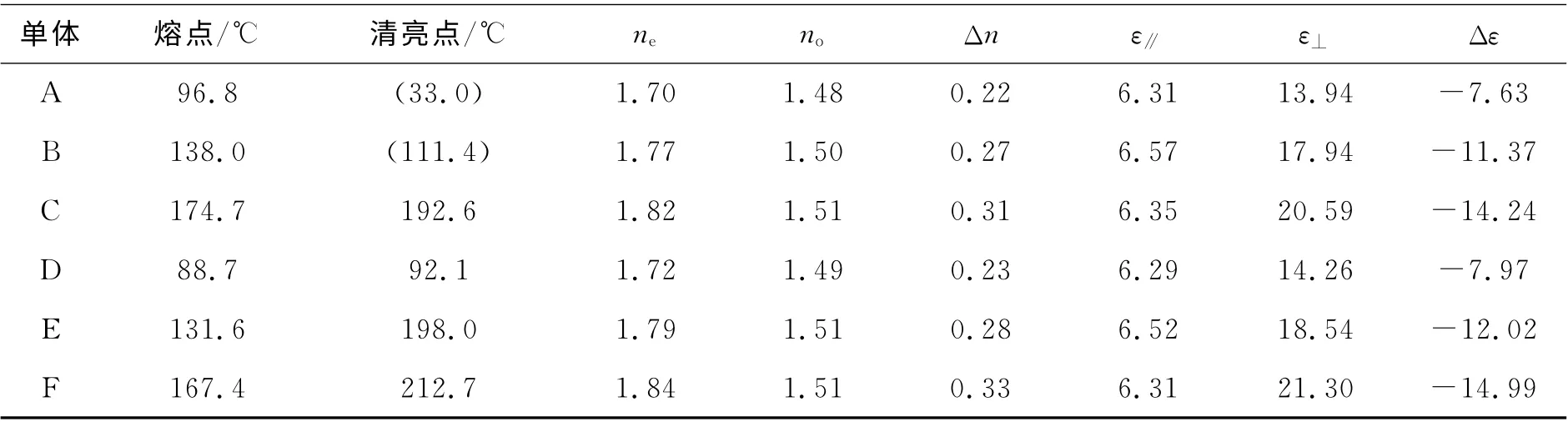
表2 化合物的液晶性能参数Tab.2 Performance characteristics of liquid crystals
3.3 讨 论
(1)作者合成的6种多氟负介电各向异性液晶单体,其中合成的中间体结构单元,可以广泛地应用于其他液晶单体的合成,并得到其他种类含有多氟的负介电各向异性液晶单体。
(2)由于共轭的原因,分子中端基为乙氧基的单体液晶熔点及清亮点要明显高于端基为丙基的液晶单体,极大地增强了液晶向列相的温宽。
(3)虽然侧位氟的存在,会降低苯环分子的电子云密度,极化度变弱,使得液晶分子的光学各向异性有着部分的减弱,但由于分子中存在着3个苯环及乙氧基,使得液晶分子依旧有着较大光学各向异性(0.22~0.33)。
(4)分子中引入多个2,3-二氟苯基基团,确实可以使液晶分子呈现出更强的负介电各向异性(-7.63~-12.02),但是一味的增加2,3-二氟苯基基团并不一定会增加负介电各向异性,目标单体D、E、F的负介电各向异性略大于有着类似结构的目标单体A、B、C,其原因就在于由于相邻的2个2,3-二氟苯基由于相对的氟存在位阻,使得2个2,3-二氟苯基进行了轻微的偏转,致使ε⊥减少,因此存在相邻2个2,3-二氟苯基反而降低了负介电各向异性。
综上所述,作者合成的6种多氟类负介电各向异性的液晶化合物具有着较大的光学各向异性(Δn)和负值很大的介电各向异性(Δε)。多个2,3-二氟苯基基团的引入可以极大的增强负介电各向异性,但是相邻的2,3-二氟苯基却因为位阻的原因进行偏转,比起相邻只有1个侧位氟基团的液晶单体,降低了负介电各向异性。
4 结 论
作者合成了6种新型的具有2个或2个以上的2,3-二氟苯基的有较大负介电各向异性至的化合物。以2,3-二氟丙基苯或2,3-二氟苯乙醚为原料,通过一系列反应合成了目标液晶单体。经过核磁共振、元素分析及质谱等方法确定了分子结构;利用示差扫描量热仪、阿贝折射仪和电容电抗测试仪等测试手段对其进行测定。实验表明,这类多氟化合物有着较大的光学各向异性(Δn=0.22~0.33)和较大负值的介电各向异性(Δε=-7.63~-12.02)。该类型的多氟化合物可以用于液晶母体的调配并且改善其部分性能。该类多氟化合物原料易得、收率较高,对设备要求不高,极易实现工业量产。
[1] 武乃福,赵静,王晓燕,等.负性液晶垂直排列(VA)盒中壁的研究[J].现代显示,2011(120-121):32-36.Wu N F,Zhao J,Wang X Y,et al.Study in the wall in vertical alignment(VA)cell of negative liquid crystal[J].Advanced Disolay,2011(120-121):32-36.(in Chinese)
[2] 王协友.利用负性双折射补偿膜改善LCD 视角[J].现代显示,1998(2):41-45.Wang X Y.Improvement of LCD viewing angles by negativebirefringence compessation films[J].Advanced Disolay,1998(2):41-45.(in Chinese)
[3] 胡朋刚,李建,安忠维.VA-TFT 用负介电各向异性液晶材料研究进展[J].化工新型材料,2007,35(5):5-6,12.Hu P G,Li J,An Z W.Progress of liquid crystal materials for VA-TFT[J].New Chemical Materials,2007,35(5):5-6,12.(in Chinese)
[4] 郭剑,隋岩,曹建华,等.多氟多氰基负性液晶化合物的合成[J].液晶与显示,2014,29(1):15-21.Guo J,Sui Y,Cao J H,et al.Synthesis of polyfluorinated polycyano negative dielectric anisotropy liquid crystalline compounds[J].Chinese Journal of Liquid Crystals and Displays,2014,29(1):15-21.(in Chinese)
[5] 员国良,郑成武,华瑞茂.含链端烯基负性液晶单体的合成及其性能研究[J].液晶与显示,2013,28(4):510-515.Yuan G L,Zheng C W,Hua R M.Preparation andcharacteristics of terminal alkeny-bearing lateral fluoro-benzene negative liquid crystals[J].Chinese Journal of Liquid Crystals and Display,2013,28(4):510-515.(in Chinese)
[6] 尚洪勇,张建立,刘鑫勤,等.多氟二苯乙炔类负性液晶化合物的合成[J].液晶与显示,2009,24(5):650-655.Shang H Y,Zhang J L,Liu X Q,et al.Synthesis of multifluorotolane negative dielectric anisotropy liquid crystals[J].Chinese Journal of Liquid Crystals and Displays,2009,24(5):650-655.(in Chinese)
[7] 戴修文,蔡良珍,闻建勋.含有2,3,4,5-四氟亚苯基的负性液晶合成及液晶性研究[J].液晶与显示,2013,28(3):464-466.Dai X W,Cai L Z,Wen J X.Synthesis and application of negative liquid crystals containing 2,3,5,6-tetrafluorophenylene[J].Chinese Journal of Liquid Crystals and Display,2013,28(3):464-466.(in Chinese)
[8] 史子谦,丰景义,贵丽红,等.高折射率液晶化合物与液晶混合物[J].液晶与显示,2013,28(3):310-314.Shi Z Q,Feng J Y,Gui L H,et al.High birefringence LC compounds and LC mixture[J].Chinese Journal of Liquid Crystals and Displays,2013,28(3):310-314.(in Chinese)
[9] Greenfield S,Coates D,Goulding M,et al.Nematogenic later ally fluorinated biphenyls with polar terminal groups[J].Liq.Cryst.,1995,18(4):665-672.
[10] Peer K,Matthias B.Nematic liquid crystals for active matrix displays:molecular design and synthesis[J].Angew.Chem.Int.Ed.,2000,39(23):4216-4235.
[11] 闫凌,杨增家,唐洪.负性含氟液晶材料的电子轰击质谱分析[J].液晶与显示,2007,22(2):146-150.Yan L,Yang Z J,Tang H.EI mass spectra of negative fluorinated liquid crystal compounds[J].Chinese Journal of Liquid Crystals and Display,2007,22(2):146-150.(in Chinese)
