周围型小肺癌的MSCT诊断及与局灶性机化性肺炎鉴别
2015-03-20李兆勇朱刚明梁俊生王玉恒胡芳辉李志娟王青云李扬彬
李兆勇,朱刚明,梁俊生,王玉恒,胡芳辉,李志娟,王青云,李扬彬
周围型小肺癌(small peripheral lung cancer,SPLC)通常是指肿瘤直径≤3cm且原发于肺段支气管以下的肺癌,早期一般无症状,痰细胞学检查往往为阴性,其检出及诊断主要依靠影像学检查,首选CT检查[1-2]。临床工作中笔者发现SPLC的CT影像学表现与局灶性机化性肺炎(focal organizing pneumonia,FOP)有着诸多相似之处,而能否正确区分这两类病灶成为临床治疗和患者预后的关键。本文通过总结分析SPLC与FOP的影像学表现有无差异,旨在提高对SPLC的定性诊断符合率。
材料与方法
1.一般资料
搜集本院2009年10月-2014年10月入院的106例诊断为经穿刺、手术病理证实的周围型肺癌患者的临床及CT资料,选取其中满足以下条件的58例SPLC患者建立研究组:①首诊发现病灶,未经过治疗;②表现为周围型肺内孤立性结节,肿瘤直径≤3cm。58例SPLC患者中男40例,女18例,年龄30~84岁,中位年龄52岁。临床表现无明显特异性,其中18例因咳嗽、发热、胸部不适就诊,28例无症状体检发现,12例以其它疾患入院行胸部CT检查时发现。58例患者中长期吸烟者30例。23例依靠穿刺病理证实,其余35例均行手术切除。
搜集同期入院的86例经穿刺、手术病理证实的机化性肺炎患者的临床及CT资料,选取其中满足以下条件的FOP患者58例作为对照组,入选条件为:①首诊发现病灶,未经过治疗;②表现为周围型肺内孤立性结节,结节直径≤3cm。58例FOP患者男性35例,女性23例,年龄范围25~76岁,中位年龄45岁。临床表现无明显特异性。40例依靠穿刺病理证实,其余18例均行手术切除。
2.CT扫描及图像重建
CT扫描设备Toshiba Aquilion 64层螺旋CT,患者取仰卧位、双臂上举、头先进、吸气后屏气扫描,扫描范围从肺尖向下达肋膈角,两侧包括胸壁、腋窝。CT扫描及重建参数:Volume数据重建层厚0.5mm,重建间隔0.5mm,管电压120kV,管电流125mAs,纵隔窗采用标准算法重建,肺窗采用高分辨率算法重建。纵隔窗窗宽250HU、窗位0HU,肺窗窗宽800HU、窗位-900HU。常规横轴面、冠状面、矢状面采取5mm层厚、5mm层距重建,对病灶再加作1~3mm薄层重建,多平面重组(multi planar reformation,MPR),含纵隔窗及肺窗。增强扫描:采用高压注射器经肘正中静脉或手背浅静脉团注非离子型对比剂碘海醇(300mg I/mL)60~90mL,注射流率为3mL/s,分别在注射对比剂后25~30s、60~70s行动脉期、静脉期双期增强扫描。
3.病灶数据测量方法及影像资料分析
以病灶上下径、前后径及左右径的平均径线作为病灶的直径。当单个分叶的弧弦距/弦长比值≥2/5记为深分叶,<2/5记为浅分叶。选择病变实质区测量增强前后CT值,取双期增强扫描最高CT值减去平扫CT值作为强化差值,同一病灶测量面积及位置尽可能一致。根据强化差值将病灶强化程度分为4级:Ⅰ级强化差值<20HU;Ⅱ级强化差值20~40HU;Ⅲ级强化差值41~60HU;Ⅳ级强化差值>60HU。所有图像均由两位呼吸系统经验丰富的放射科医师采用盲法分析,记录在统一设计的表格内,记录内容包括患者年龄、性别、病灶部位、大小、形态、边缘特征、内部特征、邻近结构改变、增强前后CT值及强化差值,存在分歧时,由两位医师共同讨论后取得一致结果为准。
4.统计学分析
采用SPSS 19.0统计软件进行分析,对研究组、对照组MSCT征象的频次及强化程度分布情况进行卡方检验,P<0.05时具有统计学差异。如果强化程度分布情况有统计学差异,则进一步分析以强化程度为诊断指标鉴别诊断SPLC的诊断效能,应用四格表计算相应的敏感度、特异度、阳性预测值、误诊率、漏诊率、阳性似然比。
结 果
1.病灶部位、大小
58例SPLC中,右肺病灶居多(37/58),上叶22例,中叶7例,下叶8例;左肺21例,其中上叶16例,下叶5例;病灶直径5~30mm。FOP中病灶多位于右肺,其中上叶10例,中叶4例,下叶18例,3例跨叶(图1);左肺上叶8例,下叶15例;病灶直径7~30mm。
2.MSCT征象及统计学分析
58例SPLC中多表现为圆形或类圆形结节(图2),边缘清楚,深分叶,短毛刺,胸膜凹陷(图3)。58例FOP病灶中多表现为不规则形,边缘模糊,长毛刺,邻近胸膜增厚,部分跨叶间裂。各个征象出现频次及统计学分析见表1。
3.增强表现
58例SPLC中36例呈结节状均匀性强化(图4),17例呈不均匀斑片状强化,5例轻度或无强化;其中7例可见无强化坏死区。FOP多数呈不均匀或环状明显强化(图1),其中10例可见无强化坏死区。两者强化程度分布情况及对照分析见表2。
本研究结果表明大多数SPLC强化程度为Ⅱ~Ⅲ级,而在Ⅱ级SPLC出现例数明显多于FOP,且差异有统计学以意义,在Ⅲ级两者差异无统计学意义。因此有必要进一步分析以Ⅱ级、Ⅱ~Ⅲ级为诊断指标鉴别诊断SPLC的诊断效能。以Ⅱ级、Ⅱ~Ⅲ级强化程度作为SPLC的诊断指标,根据四格表计算出相应的敏感度、特异度、阳性预测值、误诊率、漏诊率、阳性似然比,详见表3。
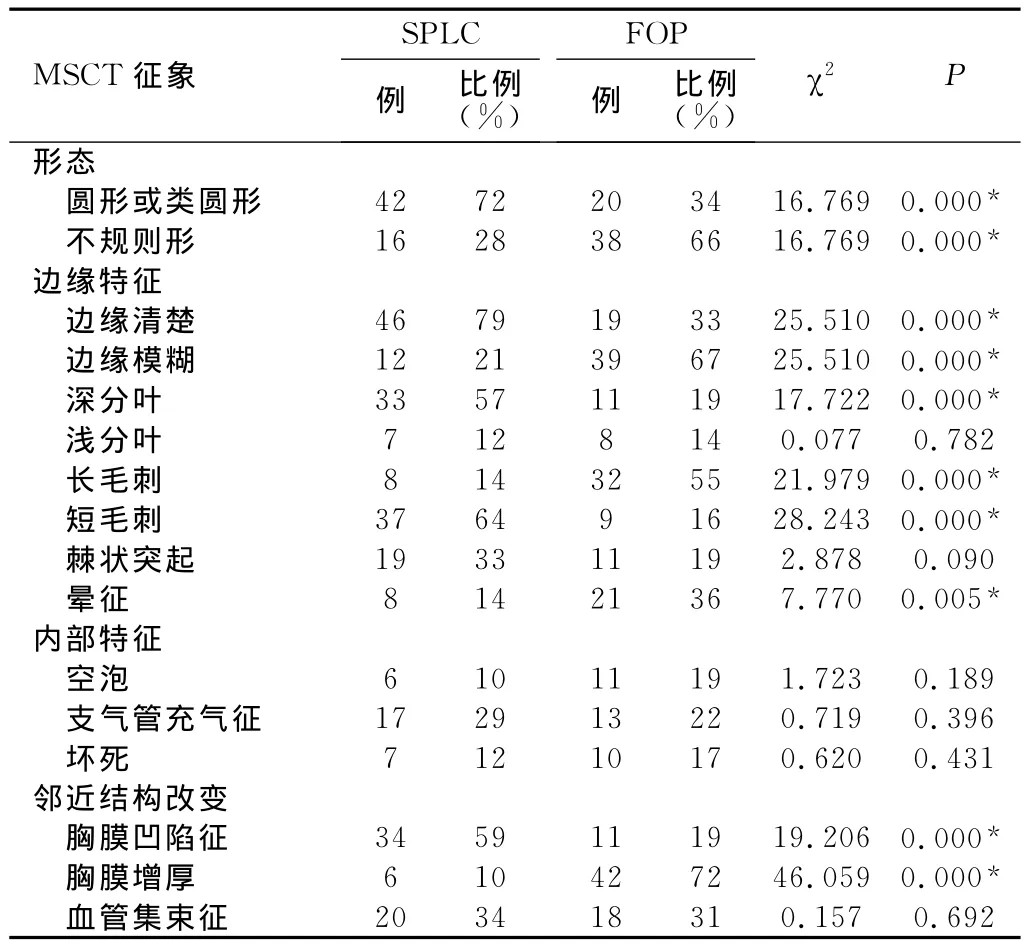
表1 SPLC与FOP的MSCT征象对照分析

表2 SPLC与FOP强化程度分布情况对照分析 (例)
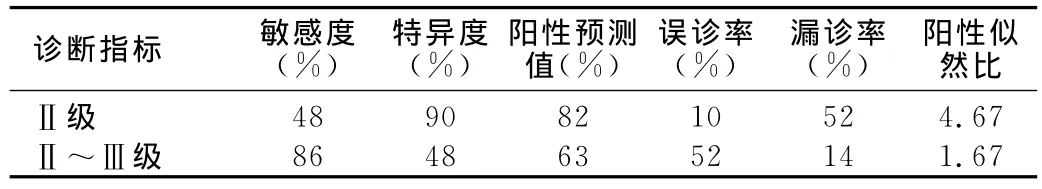
表3 以Ⅱ级、Ⅱ~Ⅲ级为诊断指标诊断SPLC的诊断效能
讨 论
孤立性肺结节(solitary pulmonary nodule,SPN)指肺内直径≤30mm的单发病灶,无肺不张、阻塞性肺炎、卫星病灶,不伴纵隔、肺门淋巴结肿大[3]。SPN的定性诊断是临床工作中的热点和难点,最为重要的任务就是SPLC的检出。其中以周围型SPN为表现的SPLC与FOP在形态特征及强化表现上均存在较多交叉,鉴别诊断较困难。
1.多层螺旋CT容积扫描能够为SPLC的定性诊断提供丰富、可靠的影像信息
SPLC的定性诊断关键是能否真实客观的显示其大体形态及基本征象。MSCT容积扫描实现了各向同性;一次屏气即可完成扫描,避免了由呼吸不均所致的病灶细节显示不清或病灶的遗漏。MPR克服了常规CT横轴面观察角度的限制,从而减少常规横轴面扫描所致的假阳性率,提高了基本征象的显示率。本组3 4例胸膜凹陷中有8例在常规5mm横轴面上未能显示,在MPR图像上得到了很好的显示。部分病例在5mm横轴面显示为空泡征而在MPR图像上显示为充气支气管征,且能较好的显示支气管的截断、管壁增厚等细节,这也可能是本研究组中空泡征显示率(仅10%)较低的原因。MPR能够显示血管束是进入结节内部或是恰好贴结节边缘经过,本组血管集束征显示率约34%,低于黄佐良等[4]报道。
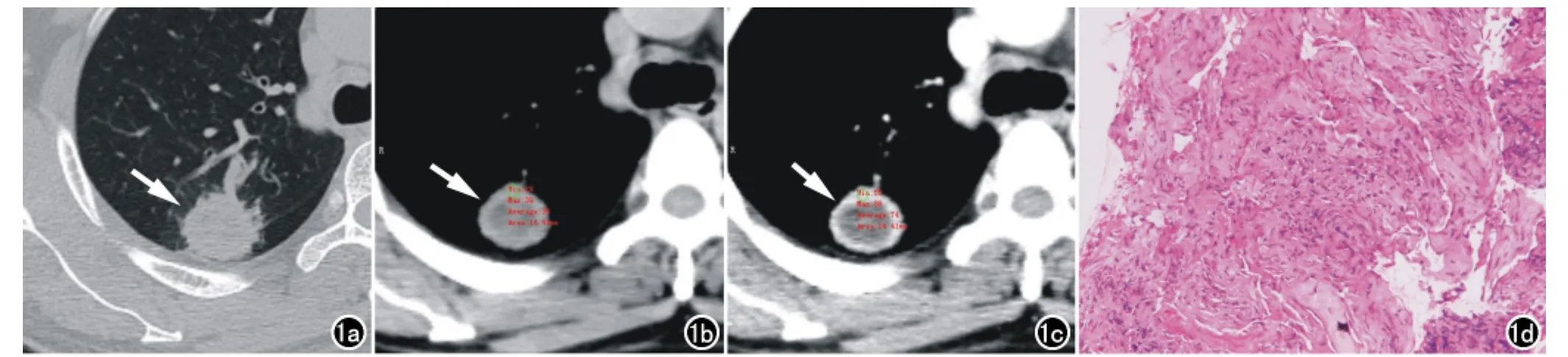
图1 女,44岁,穿刺病理证实为FOP。a)右肺上叶后段与下叶背段交界处一类圆形结节(箭),病灶跨斜裂胸膜,大部分位于右肺上叶后段,边缘稍模糊,可见血管集束征,周围多发短毛刺、棘状突起,邻近背侧胸膜、斜裂胸膜增厚;b)纵隔窗平扫示病灶内密度不均(箭),边缘密度较高,CT值约35HU;c)增强扫描静脉期示病灶呈环状强化(箭),CT值约74HU,其内无强化液化区;d)肺组织结构消失,代之以增生的纤维组织,少至中等量慢性炎细胞浸润(HE,×100)。

图2 男,75岁,左肺上叶尖后段中分化鳞癌。a)患者入院体检时发现左肺上叶病灶(箭),呈类圆形、无分叶、毛刺等,拟诊为增殖灶;b)10个月后患者因咳嗽、发热来诊,发现病灶较前明显增大(箭);c)MPR清楚显示分叶(箭)、短毛刺及棘状突起,周围见片状密度增高模糊影(考虑合并肺部感染所致);d)镜下鳞状细胞癌癌细胞排列呈异型的细胞巢,细胞不同程度异型,核大、深染,易见核分裂(HE,×100)。
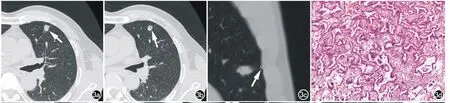
图3 男,45岁,左肺上叶中分化腺癌。a)横轴面薄层肺窗示病灶呈类圆形(箭),边缘清楚,深分叶,长毛刺,血管集束征;b)横轴面薄层肺窗示空泡征、短毛刺、棘状突起(箭);c)MPR能更好显示胸膜凹陷(箭),棘状突起;d)镜下腺癌细胞为柱状或立方状,中度异型,形成腺样结构,结构多样,浸润性生长(HE,×100)。

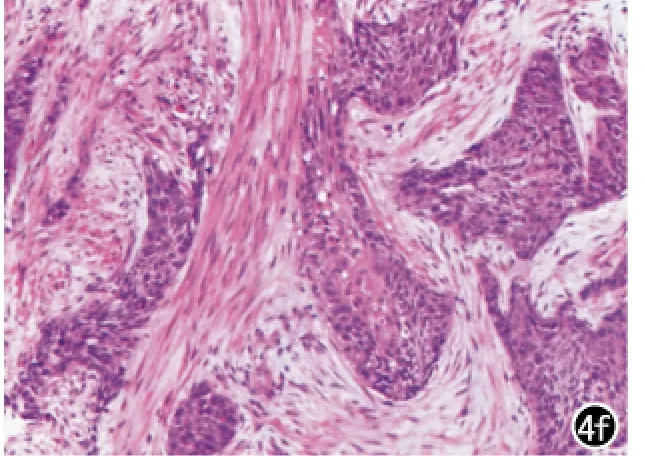
图4 女,68岁,右肺上叶中分化鳞癌。a)横轴面平扫示右肺上叶一不规则小结节(箭),边缘清楚,深分叶;b)MPR示近肺门侧支气管充气征(箭),其进入结节一段后截断,相应支气管壁增厚、局部见小结节;c)纵膈窗平扫示病灶CT值约29HU(箭);d)动脉期增强扫描示结节较均匀强化(箭),病灶实性部分CT值约54HU;e)静脉期病灶强化程度增加(箭),实性部分CT值约76HU;f)癌细胞异型性明显,核大、深染,核分裂象较多,癌细胞形成大小不等巢状结构(HE,× 100)。
2.SPLC的MSCT主要表现及病理基础
SPLC的CT征象反映了肿瘤的生长模式及瘤周的病理改变,正确认识这些征象,可以提高诊断的正确性。①分叶征是指CT图像示肿瘤边缘凹凸不平呈梅花状突出[5],其形成与肿瘤膨胀性或填充性生长、生长速度不均及肺支架结构的制约有关[6]。本组SPLC中深分叶33例,浅分叶7例。②毛刺征表现为自病灶边缘向周围肺野伸展呈放射状排列的无分支的线条影,近瘤体处略粗。毛刺征的形成是因病变的浸润生长,致病灶周围间质对肿瘤反应性改变。毛刺可长可短,本组SPLC显示毛刺征中短毛刺居多(占82%)。③胸膜凹陷表现为瘤灶邻近胸膜间见喇叭口,其与瘤灶线影相连。主要病理基础是胸膜沿肿瘤方向的牵拉和局部胸膜增厚粘连[7]。本组SPLC胸膜凹陷征34例。Saito等[8]研究认为有胸膜凹陷的小肺癌中发生胸膜浸润的可能性很高,应尽早切除。④棘状突起表现为肿瘤边缘一处或多处长2~6mm,宽2.5~6.6mm的棘形突出,其顶端尖锐或钝圆。病理基础肿瘤细胞在血管支气管周围的间质内浸润或沿淋巴管内蔓延。⑤肺癌的支气管充气征由于瘤组织在细支气管和肺泡表面生长,不破坏肺支架结构,其内的支气管结构得以保存,而形成残留含气支气管影。本组SPLC空气支气管征17例,均位于肺门侧,表现为支气管进入结节内一段就发生各种形态的阻断,管壁边缘多不规则。
关于肺癌血供来源意见不一,罗香国等[9]认为肺癌以支气管动脉供血为主兼有肺动脉及其它体循环动脉供血,另一种观点认为肺动脉不参与肺癌供血[10]。CT能够通过检测进入病灶血管及血管外间隙对比剂的量的多少反应出不同的CT值即使得强化程度得以量化。肺癌的强化程度取决于对比剂在血管内和血管外组织内滞留的程度[11]。Yamashita等[12]研究表明周围型肺癌的强化程度与血管的数量及类型有密切关系。张敏鸣等[13]将肺癌的微血管分布分为均匀分布型和周围密集分布为主型。本组SPLC病例有36例呈结节状均匀性强化,17例呈不均匀斑片状强化,在一定程度上说明肺癌的微血管分布是不尽相同的。SPLC中50例强化差值在20~60HU间。增强扫描能够明确病灶有无坏死,本组SPLC病例7例可见无强化坏死区。
3.SPLC与FOP的鉴别诊断
SPLC与FOP两者的MSCT征象虽有重叠,但有些征象出现的频次差异有统计学意义。SPLC多为类圆形、边界清楚,而FOP多为不规则形、边界模糊。FOP周围的炎性渗出致边界模糊[14],而SPLC肿瘤侵犯肺泡壁边界多较清楚。本组病例SPLC多为深分叶,而浅分叶在两组病例中检出率相近,因此将深、浅分叶分别统计对两者的鉴别诊断更有价值。通常认为肺部结节有细毛刺多为恶性,粗大长毛刺常由增生的纤维结缔组织所形成多为良性病变,本组病例表现与之相符。胸膜改变在两者的表现亦有不同,SPLC多为胸膜凹陷,而FOP多为胸膜增厚。可能与FOP多位于肺边缘胸膜下、部分病灶跨叶间裂生长有关。本组SPLC中无1例跨胸膜生长,34例胸膜凹陷中20例与胸壁有一定的距离,6例胸膜增厚的SPLC均紧邻胸膜。本组病例中SPLC出现晕征的几率小于FOP,且差异有统计学意义;两者的晕征表现亦有区别,肺癌结节与晕征交界面及晕征与肺野交界面均境界清楚,而炎性结节与两者的交界面大都模糊[15]。而Furuya等[16]研究认为晕征出现100%为恶性,与本研究不符。两者支气管充气征出现的频次差异虽无统计学意义,但是两者支气管充气征的影像表现有所不同。本组SPLC支气管充气征多表现为支气管阻断,管壁边缘多不规则,而FOP支气管充气征表现为树枝状支气管伸入病灶,管壁边缘多较光整,无明确狭窄及阻塞。因此病灶内出现支气管中断改变时多为恶性肿瘤[17]。空泡征、坏死及血管集束征在本组病例中的频次差异无统计学意义,影像表现无特异性。
SPLC以结节状均匀强化为主,且强化程度多为Ⅱ~Ⅲ级。而FOP以不均匀或环形强化为主,强化程度多为Ⅲ~Ⅳ级。两者强化程度在Ⅱ级、Ⅳ级时差异存在统计学意义,FOP整体强化程度要高于SPLC。在两者的鉴别诊断中以Ⅱ~Ⅲ级为诊断指标诊断SPLC具有较高的敏感度而特异度差,以Ⅱ级为诊断指标诊断SPLC的特异度高而敏感度差。两个诊断指标的阳性似然比均小于10,诊断效能差。因此在鉴别诊断时需要根据临床实际进行分析。笔者的经验是对于肺癌高危人群或平扫征象倾向于肺癌时选择Ⅱ~Ⅲ级作为诊断指标,减少漏诊,以免延误肺癌的早期检出,但建议做穿刺活检,因为该指标误诊率较高;而对于非肺癌高危人群或平扫征象难以与FOP鉴别时选择以Ⅱ级为诊断指标,减少误诊率,避免不必要的手术切除,但是要随访以降低漏诊。
综上所述,MSCT为诊断SPLC提供了丰富的影像信息,熟悉并掌握平扫征象及增强特点可提高SPLC早期诊断率及与FOP鉴别诊断能力。对于不典型病例,鉴别诊断确实困难时,应根据条件建议进一步穿刺活检或6个月内随诊,以免延误肺癌的早期检出。
[1] 李铁一.中华影像医学.呼吸系统卷[M].北京:人民卫生出版社,2002:193-194.
[2] 董志明,韩邦成,刘汝超,等.周围型小肺癌的CT征象分析[J].实用放射学杂志,2013,29(2):205-208.
[3] Hansell DM,Bankier AA,Macmahon H,et al.Fleischner society:glossary of terms for thoracic imaging[J].Radiology,2008,246(3):697-722.
[4] 黄佐良,何望春,周继华.血管集中征对周围型肺癌的诊断价值[J].中华放射学杂志,1999,33(1):48-50.
[5] 刘大亮,马大庆,陈广.CT的分叶征表现在肺内孤立结节影像诊断中的价值[J].中华放射学杂志,2007,41(5):487-489.
[6] 李铁一.肺癌的影像学诊断[J].中华放射学杂志,1997,31(7):441.
[7] 肖湘生,洪应中.胸膜凹陷征形成的病理基础[J].中华放射学杂志,1988,22(1):85.
[8] Saito H,Oshima M,Kiuchi R,et al.Relationship between pleural indentation on computed tomography scans and pleural invasion in small peripheral lung cancer of 2cm in size or less[J].Kyobu Geka,2009,62(9):767-772.
[9] 罗香国,唐肇普,严景恩.CTA与DSA对支气管肺癌的血供研究及其临床意义[J].中国医学影像学杂志,2002,10(2):110-114.
[10] 董伟华,肖湘生,李惠民,等.支气管动脉和肺动脉多层螺旋CT血管造影对肺癌血供的研究[J].中华放射学杂志,2003,37(7):612-614.
[11] 张林,李文峰,王成伟,等.周围型小肺癌的64排螺旋CT表现与病理对照[J].实用放射学杂志,2011,27(10):1483-1487.
[12] Yamashita K,Matsunobe S,Takahashi R,et al.Small peripheral lung carcinoma evaluated with incremental dynamic CT:radiologic-pathologic correlation[J].Radiology,1995,196(2):401-408.
[13] 张敏鸣,周华,邹煜.肺癌肿瘤血管生成CT及MR灌注成像研究[J].放射学实践,2005,20(4):286-290.
[14] 江森,朱晓华,孙兮文,等.直径小于3cm的孤立性局灶性机化性肺炎CT征象分析[J].中国医学影像技术,2006,22(3):417-419.
[15] 吕岩,谢汝明,周新华,等.磨玻璃晕征环绕的周围型肺癌的CT特征及病理对照观察[J].中国医学影像技术,2010,26(6):1096-1099.
[16] Furuya K,Murayama S,Soeda H,et al.New classification of small puImonary nodules by margin characteristics on high-resolution CT[J].Acta Radiol,1999,40(5):496-504.
[17] Kui M,Templeton PA,White CS.Evaluation of the air bronchogram sign on CT in solitary pulmonary lesions[J].J Computer Assisted Tomography,1996,20(6):983-986.
