Dermokine-β mRNA在结肠癌组织中的水平及临床意义*
2015-03-18付汉东张爱华刘汉忠袁岸龙湖北省孝感孝感市中心医院华中科技大学同济医学院附属孝感医院中心实验室普外科病理科消化内科湖北孝感000
付汉东,张爱华,刘汉忠,袁岸龙,魏 威 (湖北省孝感孝感市中心医院/华中科技大学同济医学院附属孝感医院:.中心实验室;.普外科;.病理科;.消化内科,湖北孝感 000)
·论 著·
Dermokine-β mRNA在结肠癌组织中的水平及临床意义*
付汉东1,张爱华2,刘汉忠3,袁岸龙4,魏 威1
(湖北省孝感孝感市中心医院/华中科技大学同济医学院附属孝感医院:1.中心实验室;2.普外科;3.病理科;4.消化内科,湖北孝感 432000)
目的 研究Dermokine(DK)-β mRNA在结肠癌组织中的水平和临床价值。方法 采用RT-PCR法检测DK-β mRNA相对水平,对结肠癌患者、结肠息肉、溃疡性结肠炎患者以及健康对照组DK-β mRNA相对水平进行比较,对结肠癌不同临床参数间DK-β mRNA相对水平进行比较,并进行统计学分析。结果 结肠癌患者DK-β mRNA表达比结肠息肉、溃疡性结肠炎患者以及健康对照组明显升高,差异有统计学意义(P<0.01);但与患者年龄、性别、肿瘤的位置、大小无相关性,在低分化腺癌、Dukes分期B 期、有淋巴结转移的患者中DK-β mRNA表达更明显(P<0.05)。结论 结肠癌DK-β表达与结肠癌患者黏膜上皮细胞受损密切相关,B 期DK-β表达呈显著升高,因此结肠组织DK-β水平检测可作为结肠癌早期诊断的指标,对临床结肠癌早期诊断有一定价值。
结肠癌; DK-β; mRNA
结肠癌是常见的消化道恶性肿瘤,在我国已成为发病率上升最快的恶性肿瘤之一[1],由于目前结肠癌的早期诊断水平较低,约1/3的患者明确诊断时疾病已处于进展期[2],因此结肠癌的延误诊断是影响诊断和预后的重要原因[3]。Dermokine(DK)是结直肠上皮细胞角化后分泌的一种多肽,主要是缩氨酸,目前研究显示DK至少有13种不同的亚型[4],其中DK-β在早期结肠癌患者血清中的水平是呈显著升高的[5]。作者通过检测结肠癌组织中DK-β mRNA的相对水平变化来研究DK-β对国内人群早期结肠癌诊断的价值。现报道如下。
1 资料与方法
1.1 一般资料 选择2013年1~9月在本院住院治疗的结肠癌患者30例,其中男18例,女12例;年龄26~81岁,参照文献[6]按年龄分:≥60岁的老年患者14例,41~59岁的中年患者13例,≤40岁的青年患者3例;以肿瘤大小5 cm为临界值[6](CT或MRI测量直径,多个肿瘤时取直径最大者):≥5 cm 16例,<5 cm 14例;肿瘤部位:升结肠癌11例,横结肠癌2 例,降结肠癌4例,乙状结肠癌13例;淋巴结转移:有13例,无17例;病理组织学分级:高分化腺癌4例,中分化腺癌12例,低分化腺癌11例,黏液腺癌3例,Dukes分期:A期6例,B期12例,C期8例,D期4例;以上病例匀符合病理学结肠癌诊断标准[7]。同期从门诊和住院结肠息肉和溃疡性结肠炎(UC)患者中各随机抽取20例作为对照,每组中男12例、女8例,年龄20~67岁、平均45.6岁。同时从同期健康体检人群中抽取30例作为健康对照组,其中男18例、女12例,年龄18~65岁、平均44岁。
1.2 标本采集 手术取患者肿瘤及周围组织,癌旁正常组织为距肿瘤边缘5 cm以上的肠段组织(病理证实肿瘤标本切缘肿瘤细胞残留均为阴性),对照组在肠镜下取结肠息肉和炎症组织,健康对照组在肠镜下取少许结肠组织,快速切取组织,用预冷的1×PBS 液冲洗。放置于无RNA酶的冻存管中,保存于-86 ℃冰箱中待检。
1.3 试剂与仪器 试剂:反转录试剂盒(美国Sigma公司),总RNA提取试剂盒(美国Sigma公司),β-actin 基因试剂盒(美国Sigma公司),琼脂糖(美国Invitrogen公司),Taq DNA聚合酶(上海华美公司),二乙基焦磷酰胺(DEPC),液氮,无水乙醇、氯仿、溴化乙啶等。引物设计如下,DK-β上游引物:5′-ATGAAGCCGGCCACTGCCTCTG-3′,下游引物:5′-GCAGGCCAGGTTGCACCCGGG-3′,扩增范围379 bp;β-actin上游引物:5′-TCATGAAGTGTGACGTGGACAT-3′,下游引物:5′-CTCAGGAGGAGCAATGATCTTG-3′,扩增范围158 bp(郑州美博公司)。仪器:TC9600-G-230V型MultiGene梯度PCR仪(美国Labnet公司),DYCZ-21型电泳仪(北京六一仪器厂),Tanon-3500凝胶成像分析系统(上海天能公司),TG328型电子天平(上海上天公司),TGL-16M高速低温离心机(湖南湘仪公司),YQ-3型电动匀浆机(华城开元实验仪器厂),移液器(芬兰Biohit公司)等。检测中所有操作严格按试剂和仪器说明书要求进行。
1.4 组织RNA提取 用Trizol法提取组织中的总RNA,RNA的提取、完整性、纯度及浓度检测操作程序严格按试剂盒说明书要求进行,经质量检测RNA的完整性、纯度及浓度均符合要求后方可用扩增。
1.5 扩增和电泳 反应体系Ⅰ:Rnasin 1 μL,RT-PCR缓冲液4 μL,10 mmol/L dNTP 2 μL,反转录酶1 μL,OligodT 1 μL,RNA 4 μL,加无RNase灭菌蒸馏水至20 μL。把反应体系Ⅰ放在PCR仪反应孔中,设置反应模式。循环模式:37 ℃反转录60 min,得到cDNA。反应体系Ⅱ:RT-PCR缓冲液2 μL,dNTPs 1 μL,上游引物1 μL,下游引物1 μL,Taq酶 1.5 U,cDNA 2 μL,PCRTye 2 μL,加无RNase灭菌蒸馏水至20 μL。循环模式:94 ℃预变性5 min,94 ℃ 45 s,60 ℃ 45 s,72 ℃ 30 s,循环40次,72 ℃延伸10 min,4 ℃保存待凝胶电泳检测。电泳:将6 μL扩增产物与2 μL溴酚蓝上样缓冲液混合,在1.5%的琼脂糖凝胶中进行电泳,恒压80 V,30 min后,用凝胶成像系统观察结果。
1.6 结果判断标准 凝胶成像仪观察结果,进行面积灰度扫描,DK-β mRNA相对表达量A值= DK-β mRNA产物的吸光度A值(OD)/β-actin产物的吸光度A值(OD)。

2 结 果
2.1 各组DK-βmRNA相对水平 结肠癌患者DK-βmRNA相对水平为0.82±0.46,比结肠息肉(0.34±0.16)、溃疡性结肠炎(0.29±0.18)、健康对照组(0.14±0.11)均明显升高,差异有统计学意义(P<0.01);结肠息肉与溃疡性结肠炎间DK-βmRNA相对水平无明显差异,但均比健康对照组高(P<0.05)。
2.2DK-βmRNA相对水平与结肠癌患者临床病理参数的关系 见表1。DK-βmRNA的表达与患者年龄、性别、肿瘤的位置与大小无关,在不同组织学分级中低分化腺癌DK-βmRNA表达更明显(P<0.05),不同Dukes分期中B期表达更明显(P<0.05),有淋巴结转移的比无淋巴结转移表达更明显(P<0.01)。
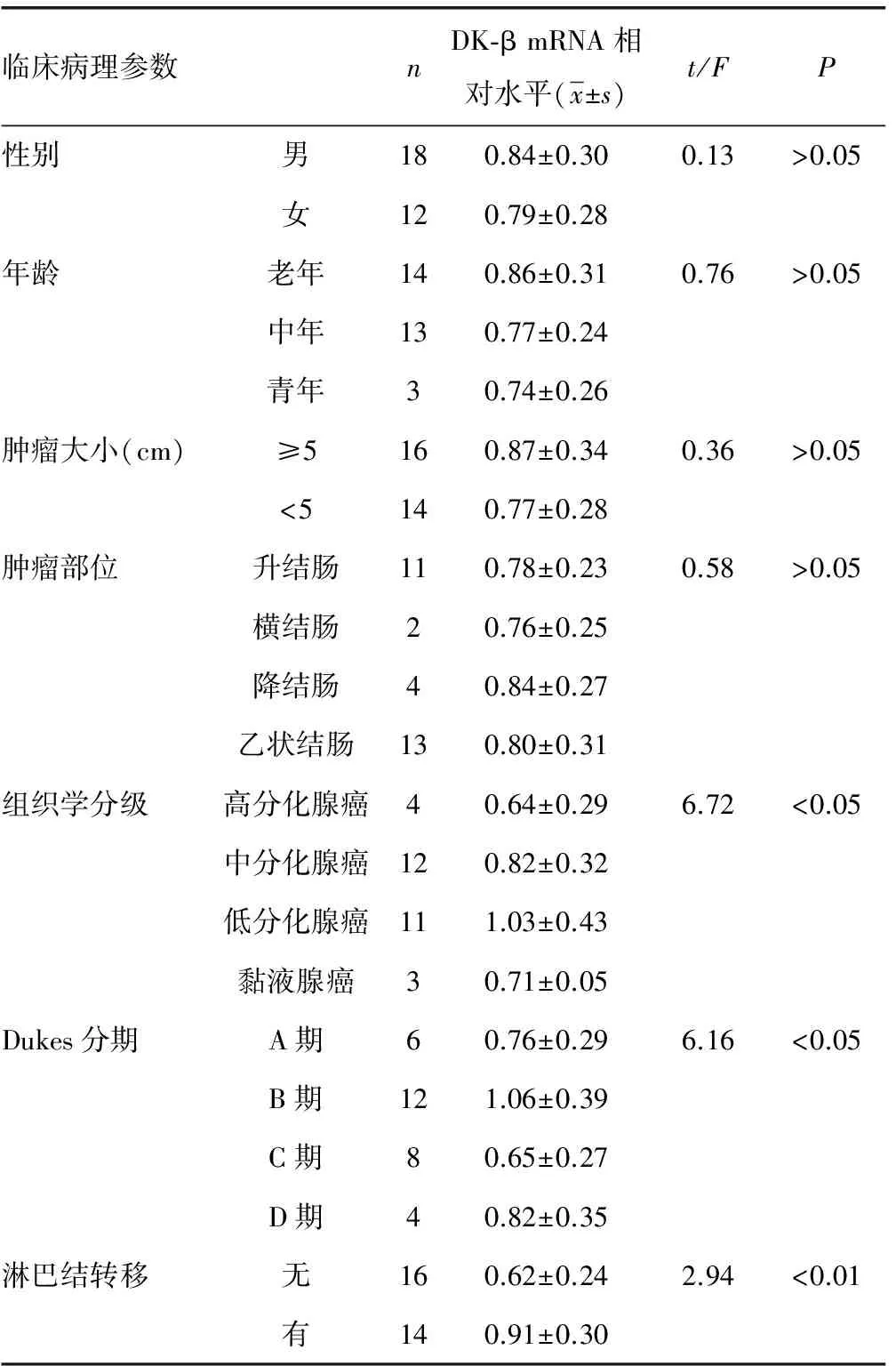
表1 DK-β mRNA相对水平与结肠癌患者临床病理参数的关系
3 讨 论
目前研究显示DK位于人类染色体19q13.12上,是由一定数量的表皮特异基因组成[8]。DK至少有13种亚型,可编码10多种不同的蛋白质,其中β型(相对分子质量45×103)拥有自己的启动子,并在表皮细胞上表达,DK-β是以高度分化的上皮细胞层分层分泌的形式表达的[4]。炎症条件下相关组织的上皮细胞的DK基因表达是有差异的,这种差异性也促进炎症状态的差异性[9]。研究表明在上皮细胞层广泛受损中存在DK-β的高水平表达[10]。
本研究显示结肠癌患者DK-βmRNA相对水平均比结肠息肉、溃疡性结肠炎、健康对照组明显升高(P<0.01)。结肠黏膜上皮细胞是通过细胞桥粒连接呈相互嵌合紧密排列的,其间隙由膜被颗粒排出物充填,使结肠黏膜具有独特的生物学特性[11],结肠黏膜上皮受到损伤可形成溃疡性结肠炎,导致黏膜上皮细胞角化,黏膜组织发生异型增生,同时溃疡性结肠炎中炎症上皮细胞Bcl-2表达增高,炎症细胞凋亡停止或减慢,造成溃疡性结肠炎中大量炎症细胞浸润肠壁和持续活化[12],从结肠息肉、溃疡性结肠炎发展到结肠癌,是一个长期的过程,在早期发生APC基因突变,中期发生ras基因突变,晚期发生p53突变,最终导致癌变[13],在此过程中伴有黏膜组织的异型增生和炎症的长期存在,导致结肠黏膜上皮细胞层长期广泛受损,DK-β表达也逐渐升高。由于NF-κB、肿瘤坏死因子-α(TNF-α)、γ-干扰素(INF-γ)和一氧化氮合酶(iNOS)[14]等在炎性黏膜中表达显著升高,这些导致黏膜上皮细胞角化和增生、异生加剧;角化细胞衰老、凋亡的调控受干扰素、APC基因、ras基因信号通路的调控,当APC基因和(或)ras基因发生突变时APC基因、ras基因信号通路受到影响,这种调控机制可能被打破,从而导致角化的黏膜上皮细胞分泌DK-β增加,这也是结肠癌患者DK-βmRNA相对水平比对照组都要高的原因,在低分化腺癌、Dukes分期B期、有淋巴结转移的患者中表达更明显(P<0.05),同时早期结肠癌患者血清DK-β水平显著升高[15],这由于癌细胞对周围组织浸润,导致结肠局部黏膜上皮细胞层广泛受损,并使淋巴结转移的黏膜上皮细胞层受损,从而引起DK-β表达水平显著升高[5],并大量聚集在病变周围组织,但与患者年龄、性别、肿瘤的位置及大小无关。结肠息肉与溃疡性结肠炎间DK-βmRNA相对水平无明显差异,但它们比健康对照组要高(P<0.05),是由于炎症局部黏膜上皮细胞层受损导致DK-β表达轻度升高,但升高幅度较结肠癌低得多。
DK-βmRNA在结肠癌早期和进展期表达是显著升高的,因此组织中DK-β水平检测对结肠癌的早期诊断和治疗有重要意义。
[1]XuAG,YuZJ,JiangB,etal.ColoreetalcancerinGuangdongPrevinceofChina:ademographicandanatomicsurvey[J].WorldJGastroenterol,2010,16(8):960-965.
[2]OnouchiS,MatsushitaH.NewmethodforcolorectalcancerdiagnosisBasedonSSCPanalysisofDNAfromexfoliatedcolonocytesinnaturallyEvacuatedfeces[J].AnticancerRes,2008,28(1):145-150.
[3]HewitsonP,GlasziouP,IrwigL,etal.Screeningforcolorectalcancerusingthefaecaloccultbloodtest,Hemoccult[J].CochraneDatabaseSystRev,2007,24(1):CD001216.
[4]MoffatP,SaloisP,St-AmantN,etal.Identificationofaconservedclusterofskin-specificgenesencodingsecretedproteins[J].Gene,2004,33(4):123-131.
[5]付汉东,张爱华,刘汉忠,等.Dermokine-β在结肠癌患组织中的表达及临床意义[J].国际检验医学杂志,2013,34(18):2353-2357.
[6]翟志伟,顾晋.肿瘤大小对结肠癌患者预后的影响[J].中华胃肠外科杂志,2012,15(5):495-497.
[7]陆再英,钟南山.内科学[M].7版.北京:人民卫生出版社,2009:420-421.
[8]MatsuiT,Hayashi-KimumiF,KinoshitaY,etal.Identificationofnovelkeratinocyte-secretedpeptidesdermokine-β/γandanewstratifiedepithelium-secretedproteingenecomplexonhumanchromosome19q13.12[J].Genomics,2004,84(1):384-397.
[9]NasoMF,LiangBL.Dermokine:AnExtensivelyDifferentiallySplicedGeneExpressedinEpithelialCells[J].JInvesDermatology,2007,12(7):1622-1631.
[10]ToulzaE,GallianoMF,JoncaN,etal.Thehumandermokinegene:descriptionofnovelisoformswithdifferenttissue-specificexpressionandsubcellularlocation[J].JInvesDermatology,2006,126(2):503-506.
[11]NagtegaalID,vandeVeldeCJ,vanderWorpE,etal.Macroscopicevaluationofrectalcancerresectionspecimen:clinicalsignificanceofthepathologistinqualitycontrol[J].JClinOncol,2002,20(7):1729-1734.
[12]LealRF,AyrizonoMdeL,MilanskiM,etal.Detectionofepithelialapoptosisinpelvicilealpouchesforulcerativecolitisandfamilialadenomatouspolyposis[J].JTranslMed,2010,8(11):8-11.
[13]KumarA,TakadaY,BoriekAM,etal.Nuclearfactor-kappaB:Itsroleinhealthanddisease[J].JMolMed,2004,82(4):434-448.
[14]StallmachA,GieseT,SchmidtC,etal.Cyokine/chemokinetranscriptprofilesreflectmucosalinflammationinCrohn§disease[J].IntJColorectalDis,2004,19(3):308-315.
[15]付汉东,张爱华,袁岸龙,等.结肠癌患者血清Dermokine-β检测方法的建立及临床意义[J].国际检验医学杂志,2012,33(2):307-312.
Level of Dermokine-β mRNA in colon cancer tissue and its clinical significance*
FUHan-dong1,ZHANGAi-hua2,LIUHan-zhong3,YUANAn-long4,WEIWei1
(1.CentralLaboratory;2.DepartmentofGeneralSurgery;3.DepartmentofPathology;4.DepartmentofGastroenterology,XiaoganMunicipalCentralHospital/AffiliatedXiaoganHospital,TongjiMedicalCollege,HuazhongUniversityofSciencesandTechnology,Xiaogan,Hubei432000,China)
Objective To investigate the level of dermokine-β(DK-β) mRNA in colon cancer tissue and its clinical value.Methods The RT-PCR method was used to detect DK-β mRNA relative level.The DK-β mRNA relative levels were compared among the patients with colon cancer,colonic polyps and ulcerative colitis and normal control group.The DK-β mRNA relative levels were compared among different clinical parameters in colon carcinoma.The statistical awalysis was performed.Results The expression of DK-β mRNA in the patients with colon cancer was significantly higher than that in the patients with colon polyps,ulcerative colitis and normal control group,the difference was statistically significant(P<0.01).But the DK-β mRNA expression had no correlation with age,gender,tumor location and size.The DK-β mRNA expression in the low differentiation adenocarcinoma,Dukes B stage and lymph node metastasis was more significant (P<0.05).Conclusion The DK-β expression in colon cancer is closely associated with mucosal epithelial cell damage.The DK-β expression in the stage B is significantly increased.Therefore,the DK-β level detection in colon tissue may be used as an index of early diagnosis of colon cancer,which has a certain value for early diagnosis of colon cancer.
colon cancer; dermokine-β; mRNA
湖北省自然科学基金项目(2013CFB486);湖北省孝感市科技局基金支持项目(2011XXF042)。
付汉东,男,在职研究生,医学硕士,副主任技师,主要从事肿瘤早期诊断和肿瘤标志物研究。
10.3969/j.issn.1672-9455.2015.21.003
A
1672-9455(2015)21-3137-03
2015-01-02
2015-08-31)
