温度和盐度对华贵栉孔扇贝免疫相关酶的联合效应
2015-03-18栗志民钱佳慧劳翠英刘志刚
栗志民,钱佳慧,劳翠英,刘志刚
(广东海洋大学 水产学院,广东 湛江 524088)
温度和盐度对华贵栉孔扇贝免疫相关酶的联合效应
栗志民,钱佳慧,劳翠英,刘志刚*
(广东海洋大学 水产学院,广东 湛江 524088)
为研究温度和盐度对华贵栉孔扇贝免疫相关酶活力的联合效应,采用中心复合设计(CCD)和响应曲面分析法(RSM)进行试验,在实验室条件下研究了温度(19~31 ℃),盐度(22~38)对华贵栉孔扇贝酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、谷胱甘肽还原酶(GR) 三种免疫相关酶活性的联合效应,旨在考察温度与盐度对ACP,AKP和GR活性的影响及华贵栉孔扇贝免疫水平较高时的最佳温度和盐度组合,为华贵栉孔扇贝人工养殖所需条件提供理论基础。结果表明:温度的一次效应和二次效应对ACP,AKP和GR活力影响显著(P<0.05);盐度的一次效应和二次效应对ACP,AKP和GR的活力影响显著(P<0.05);温度和盐度的交互作用对ACP,AKP和GR活力的影响显著(P<0.05)。采用响应曲面法,建立了温度和盐度对华贵栉孔扇贝ACP,AKP和GR活性影响的模型方程,该模型方程决定系数分别为0.986 6,0.981 3和0.957 6(P<0.01),预测系数分别为0.934 5,0.888 0和0.738 4,表明该模型可以用于预测华贵栉孔扇贝ACP,AKP和GR活力变化。通过模型优化和验证实验,得到在温度24.30 ℃、盐度30.55时,ACP和AKP活力达到最小值,分别为170.43,181.74 U/mg,而GR活力最大为0.34 U/mg,满意度达0.95。
华贵栉孔扇贝;响应曲面;碱性磷酸酶(AKP);酸性磷酸酶(ACP);谷胱甘肽还原酶(GR)
温度和盐度作为水产养殖中两个重要的环境因子,通常对水生动物的生长、存活以及生理、免疫造成直接或间接的影响。近年来,海区温度、盐度等环境因子不断改变,导致贝类病害频繁发生,造成海水贝类大面积死亡,给养殖区带来严重的经济损失[1-3]。因此,越来越多的学者开始关注温度和盐度对贝类免疫的影响。已有研究表明,温度和盐度的变化对菲律宾蛤仔(Ruditapesphilippinarum)[4]、鸡帘蛤(Chameleagallina)[5]、中国血蛤(HiatulaChinese)[6]等贝类血淋巴中各免疫指标造成显著影响。
华贵栉孔扇贝(Chlamysnobilis)广泛分布于我国南海、日本、印度尼西亚等地区,是一种暖水性经济贝类[7]。因其肉质鲜美,生长速度较快,现已经成为我国重要的海产经济贝类[8]。目前,国内学者先后研究了不同壳色和性腺成熟期华贵栉孔扇贝类胡萝卜素的含量[9-10];克隆了冷休克蛋白基因[11];分析了在重金属胁迫下华贵栉孔扇贝类金属硫蛋白的周转[12];考察了环境因子对华贵栉孔扇贝呼吸、排泄生理、生长和存活[13-14]的影响;并研究了壳色与闭壳肌颜色遗传规律[15]等内容。但环境因子对华贵栉孔扇贝免疫相关酶活力的影响研究较少,因此本文以华贵栉孔扇贝为材料,采用响应曲面法研究了温度和盐度的变化以及两者间的联合效应对华贵栉孔扇贝血淋巴中酸性磷酸酶(ACP)、碱性磷酸酶(AKP)和谷胱甘肽还原酶(GR)活力的影响,探索华贵栉孔扇贝生存环境适宜、用于免疫调节的能量较少、生长能力比较旺盛的温度和盐度组合,为华贵栉孔扇贝的人工养殖条件的选择提供免疫学方面的理论依据。
1 材料与方法
1.1 材 料
试验所用华贵栉孔扇贝取自海南三亚养殖场,随机抽取一定数量的健康、活力较好的扇贝,平均壳长为(62.33±4.48) mm,平均壳高为(67.74±3.80) mm。去除贝壳表面附着物,暂养于广东海洋大学水产学院无脊椎动物养殖实验室。暂养7 d后用于试验,暂养期间温度为23.60~24.30 ℃,盐度为26.20~27.10,投喂亚心型扁藻(Platymonassubcordiformis),投饵密度(1~2)×104cell/mL。静水条件下连续充气,每2 d100%换水1次。
1.2 试验设计
采用中心复合法和响应曲面法研究温度和盐度对华贵栉孔扇贝3种免疫相关酶活性的联合效应。根据预试验的结果得出华贵栉孔扇贝适宜生存的温、盐度范围,本试验中温度范围为19~31 ℃,盐度范围为22~38。温度和盐度在上述范围内各取3个水平,各因子水平的编码值分别为-1.414,-1,0,1,1.414。整个试验共计13个温度和盐度交叉组合(表1),中心点重复5次,星号臂α=±1.414。试验重复3次。为消除系统误差,所有因子组合均随机安排。
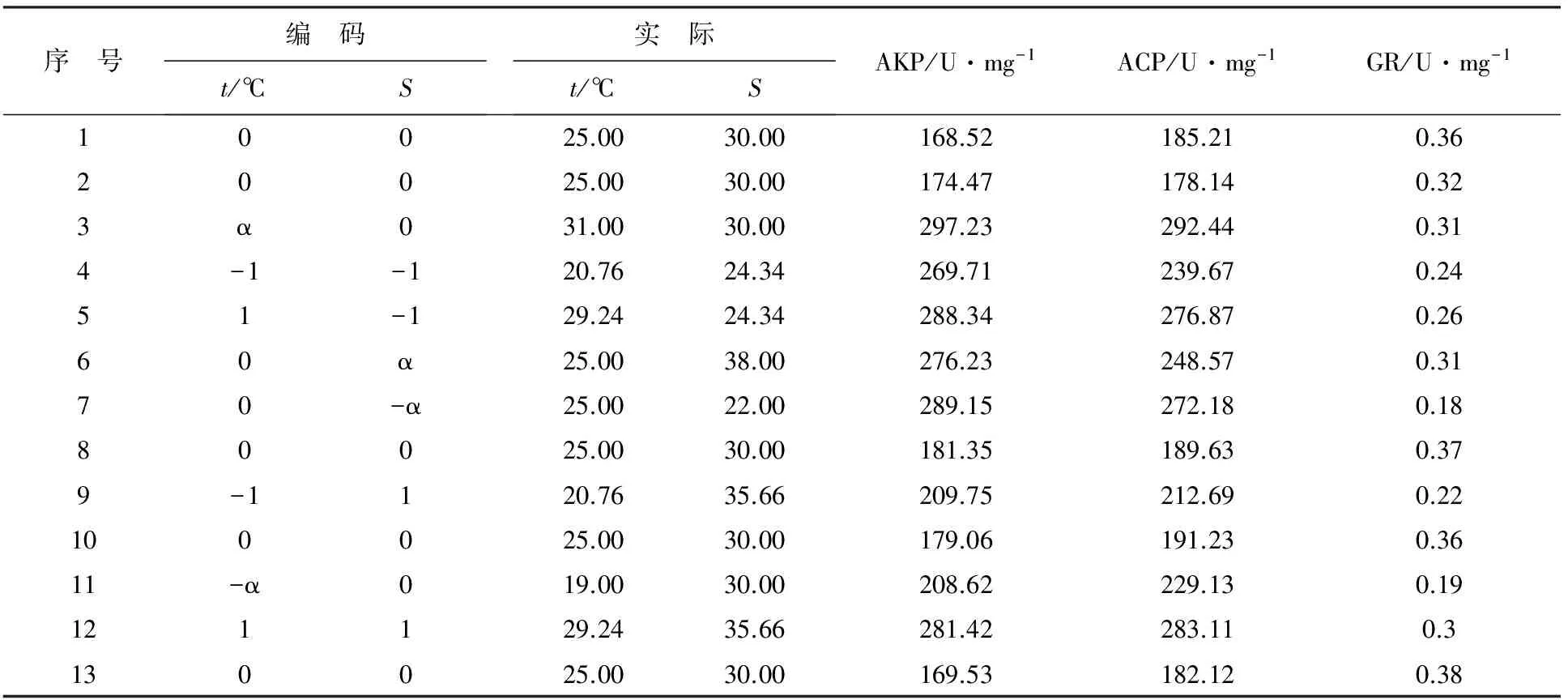
表1 实验设计及结果
1.3 试验方法
1.3.1 华贵栉孔扇贝血淋巴的采集
将暂养7 d后的华贵栉孔扇贝按照表1组合,放入13个水桶中,每桶放入20只健康贝。按照表1组合将各桶扇贝的水温和盐度调节至相应的温度和盐度组合,实验温度控制按照栗志民等[16]的方法进行,每天上调幅度或下调幅度为2 ℃;实验盐度用经曝气的淡水和海水晶进行调节,每天上调或下调幅度为2。温度测定采用水银温度计测定,盐度则采用盐度计测定。
调节至相应温度和盐度组合后继续培养7 d,随机抽取5只华贵栉孔扇贝,用灭菌后的1 mL注射器在闭壳肌处抽取血淋巴,置于含有750 μL抗凝剂的1.5 mL离心管中,4 ℃下静置1 h后,以4 500 r/min离心30 min,取上清液,即为血淋巴样品,用于酶活力测定。
1.3.2 酶活的测定
酶活力测定采用南京建成生物工程研究所的试剂盒。酸性磷酸酶活力单位定义为:100 mL血清在37 ℃与基质作用30 min产生1 mg酚为1个活力单位。碱性磷酸酶活力单位定义为:100 mL血清在37 ℃与基质作用15 min产生1 mg酚为1活力单位。谷胱甘肽还原酶活力单位的定义为:在25 ℃,pH=7.5条件下,在1 min内可以还原1 μmol氧化型谷胱甘肽时所用的酶量为1个活力单位。
1.4 数据处理
以温度和盐度两因子为自变量,以ACP,AKP,GR活力为因变量,建立酶活力和温度、盐度之间的回归方程模型为:
(1)
式中,Y为响应变量(ACP,AKP,GR活力);t为温度一次效应;S为盐度一次效应;t2为温度二次效应;S2为盐度二次效应;b0为常数项;b1、b2为温度和盐度的一次效应系数;b3为温度和盐度的交互作用;b4、b5为温度和盐度的二次效应系数;ε为残差,并假定其服从均值为0的正态分布。
采用SPSS软件对实验数据进行统计分析,由此建立影响因子与酶活力的回归方程,并给出相应的拟合度。对所建立的回归方程进行分析,可得到最优的温度和盐度组合,其结果可通过响应曲面来清晰展示。采用显著性标准为P<0.05。
2 结果与分析
2.1 温度和盐度对华贵栉孔扇贝ACP活力影响的方差分析
表2为温度和盐度对华贵栉孔扇贝ACP活力影响的方差分析表,由表可知,所建立的回归方程模型极显著(P<0.01),表明所建立的模型有效。失拟项F=2.00,P>0.05表明拟合的方程有效。回归方程的决定系数为98.66%、校正系数为97.70%、预测决定系数为93.45%,表明所拟合的方程拟合度极高,模型选择恰当。
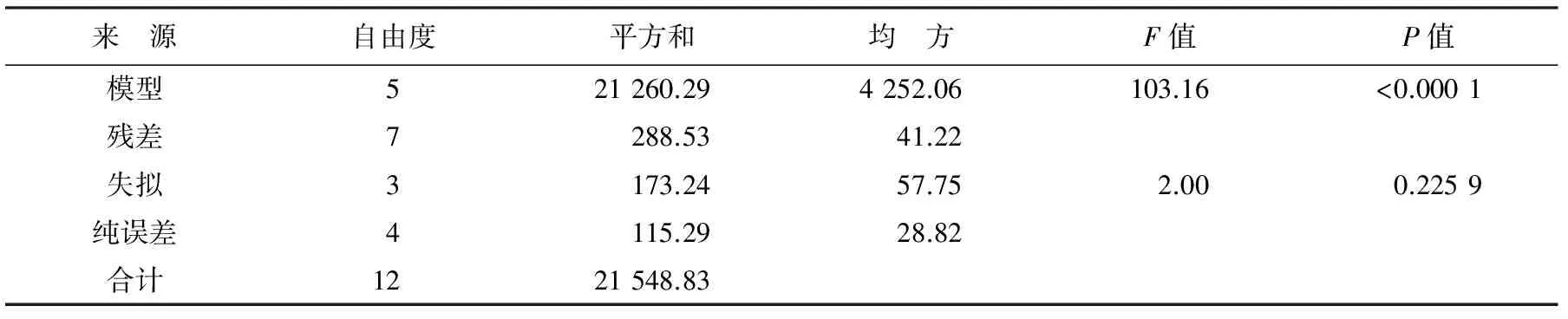
表2 温度和盐度对华贵栉孔扇贝ACP活力影响的方差分析
注:决定系数R2=98.66%;校正系数Adj.R2=97.70%;预测决定系数Pred.R2=93.45%;空白处无数据
由表3可知,回归模型95%置信区间内预测的最低值为178.48,最高值为192.06。系数估计是根据方差分析表中的编码值得到的值,回归方程中系数是非编码值。表中影响因子温度的一次效应和二次效应对ACP活力的影响极显著(P<0.01);盐度的一次效应对酶活力的影响显著(P<0.05),而二次效应的影响极显著(P<0.01);温度和盐度的互作效应对ACP活力的影响显著(P<0.05)。
对试验数据进行二次多元回归拟合,根据实际得到的ACP活力对温度、盐度的二次多项回归方程为:
YACP=185.27+24.64t-6.77S+8.30t×S+35.89t2+35.68S2
(2)
式中,Y为ACP活力;t为温度一次效应;S为盐度一次效应;t2为温度二次效应;S2为盐度二次效应;t×S为温度和盐度互作效应。
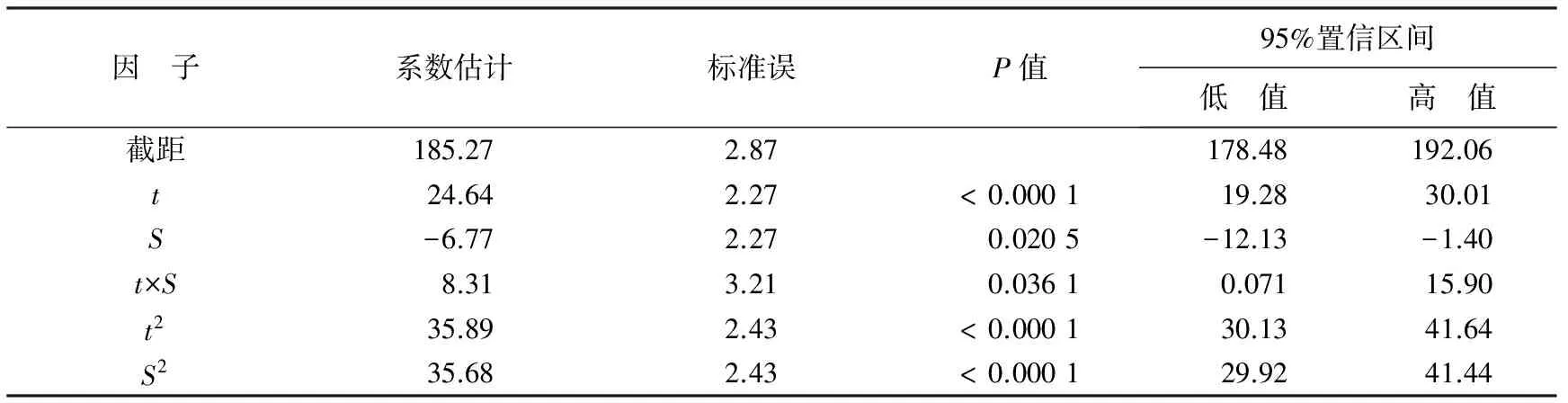
表3 温度和盐度对ACP活性影响回归系数的显著性检验
注:空白处无数据
2.2 温度和盐度对华贵栉孔扇贝AKP活力影响的方差分析
利用SPSS统计软件对表1的数据进行多元回归拟合,得到AKP活力对温度和盐度的二次多项回归方程为:
YAKP=174.59+26.95t-10.64S+13.26t×S+37.79t2+52.68S2
(3)
式中,Y为AKP活力;其他各参数含义同式(2)。
对该方程进行方程分析和回归系数显著性检验,由表4可知,温度和盐度对华贵栉孔扇贝AKP活力影响所建立的回归模型极显著(P<0.01)。失拟项F=5.30,显著性检验结果不显著(P>0.05),表明拟合方程有效。回归方程的决定系数为98.13%、校正决定系数为96.80%、预测决定系数为88.80%,说明所建立的方程与实际数据拟合良好,因此可用该回归方程进行下一步的优化分析。
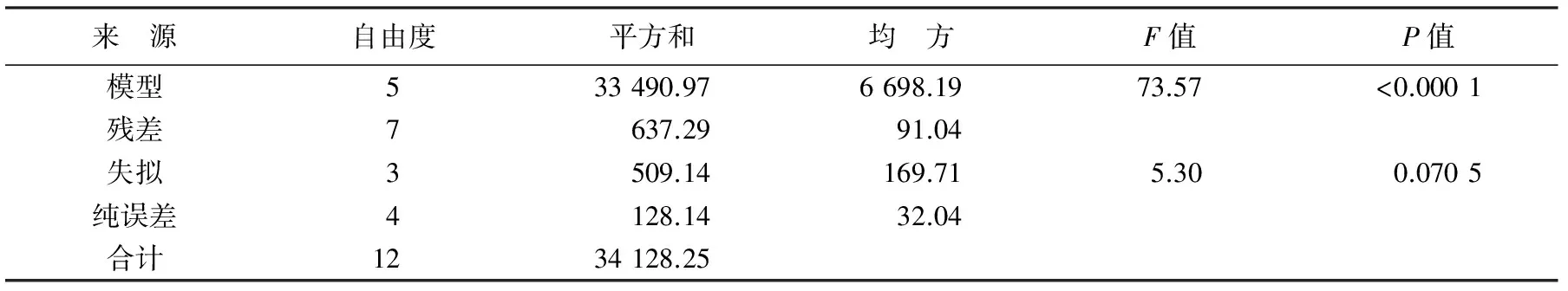
表4 温度和盐度对华贵栉孔扇贝AKP活力影响的方差分析
注:决定系数R2=98.13%;校正系数Adj.R2=96.80%;预测决定系数Pred.R2=88.80%;空白处无数据
由表5可知,回归模型95%置信区间内预测最低值为164.50,最高值为184.68,表明建立的模型可靠性较高。系数估计是根据方差分析表中的编码值得到的值,回归方程中的系数是非编码值。表中影响因子温度和盐度的一次效应、二次效应以及互作效应对华贵栉孔扇贝AKP活力影响均显著(P<0.05)。
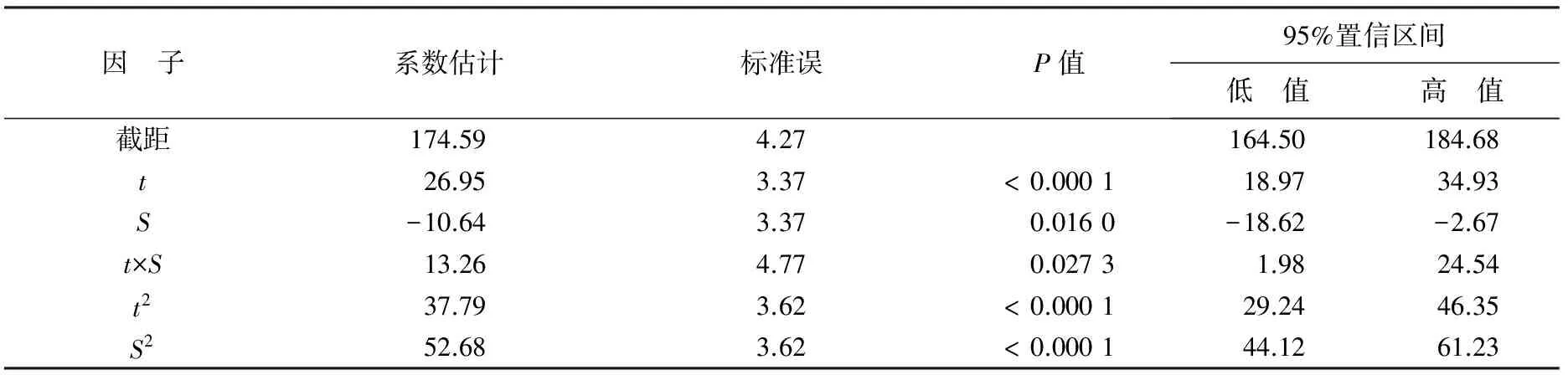
表5 温度和盐度对AKP活性影响回归系数的显著性检验
注:空白处无数据
2.3 温度和盐度对华贵栉孔扇贝GR活力影响的方差分析
表6为温度和盐度对华贵栉孔扇贝GR活力影响的方差分析表,由表可知,所建立的方程模型显著性检验P<0.05,表明模型拟合度极高。失拟项F=6.57,P>0.05,表明拟合方程有效,回归方程的决定系数为95.76%,校正系数为92.74%,预测决定系数为73.84%,这表明所拟合的二次方程合适。根据所得的试验数据进行拟合,得到的二次方程为:
YGR=0.35+0.02t+0.015S+0.063t×S-0.067t2-0.059S2
(4)
式中,Y为GR活力;其他各参数含义同式(2)。
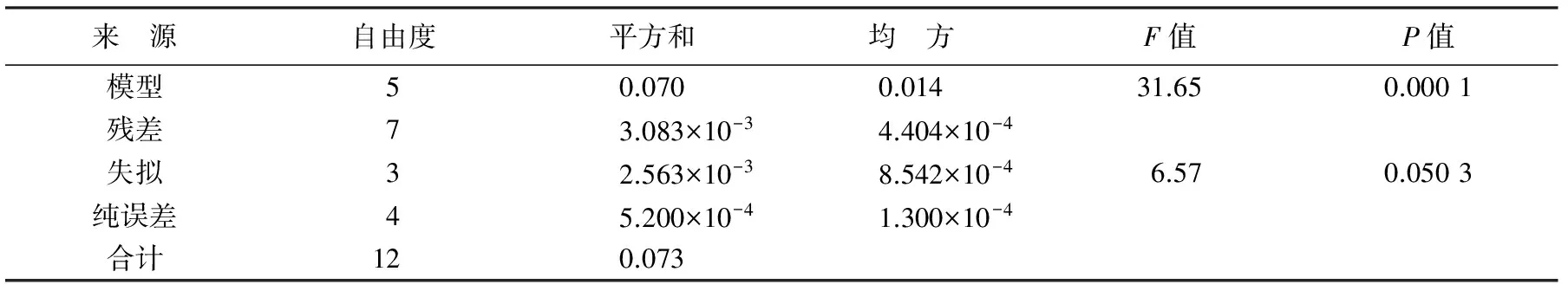
表6 温度和盐度对华贵栉孔扇贝GR活力影响的方差分析
注:决定系数R2=95.76%;校正系数Adj.R2=92.74%;预测决定系数Pred.R2=73.84%;空白处无数据
由表7可知,回归模型系数的显著性检验结果可知,温度和盐度的一次效应和二次效应对华贵栉孔扇贝GR活力的影响显著(P<0.05);温度和盐度的交互作用对酶活力的影响显著(P<0.05)。且试验因子与响应变量间都不存在简单的线性关系。
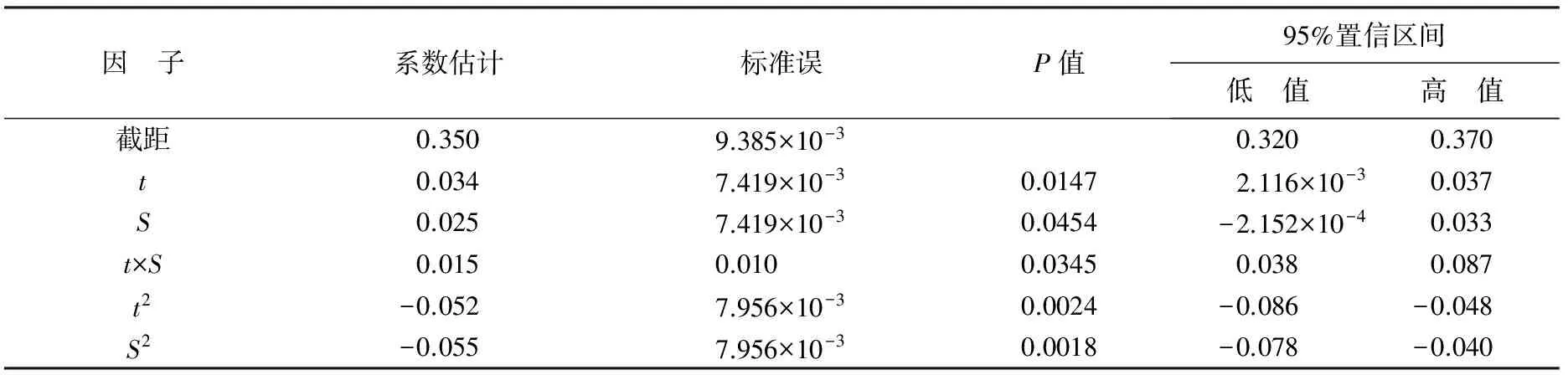
表7 温度和盐度对GR活性影响回归系数的显著性检验
注:空白处无数据
2.4 温度和盐度对华贵栉孔扇贝ACP活力影响的响应曲面分析
为了直观考察温度和盐度两因子及其交互作用对3种免疫相关酶活力的影响,实验建立了温度和盐度对响应值影响的二次方程,并得到一组响应曲面及其等高线,从而确定影响因子最佳水平范围。曲面的形状可反映出影响因素的显著水平,曲面较陡说明影响显著,曲面平缓则说明影响不显著;等高线的形状可反映出交互作用的强弱趋势,椭圆表示两因素交互作用显著,而圆形则与之相反[17]。
由图1可知,温度和盐度对ACP活力影响的响应曲面图较陡,说明两因子对ACP活力影响显著。当温度一定时,随着盐度的变化,ACP活力呈现先下降后上升的峰值变化;当盐度一定时,随着温度的升高,ACP活力先下降后上升。温度为23.47 ℃、盐度为30.77时,ACP活力最低为180.37 U/mg,其可靠性为0.98。由图2可知,温度和盐度对ACP活力影响的等高线图近似椭圆形,因此两因子交互作用对华贵栉孔扇贝ACP活力的影响显著(P<0.05)。温度趋于24.15 ℃、盐度趋于30时,ACP活力逐渐降低。
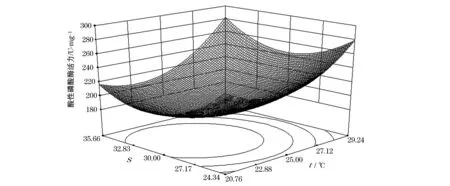
图1 温度和盐度对华贵栉孔扇贝ACP活力影响的响应曲面图Fig.1 Response surface of temperature and salinity on the activity of ACP of Chlamys nobilis
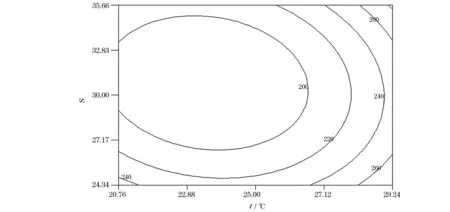
图2 温度和盐度对华贵栉孔扇贝ACP活力影响的等高线图Fig.2 Contour plot of effects of temperature and salinity on the activity of ACP of Chlamys nobilis
2.5 温度和盐度对华贵栉孔扇贝AKP活力影响的响应曲面分析
由图3可知,温度和盐度对AKP活性影响的响应曲面图形较陡,说明温度和盐度两个因子对AKP活力影响显著。当温度一定时,AKP活力随着盐度的升高呈现先下降、后上升的趋势;当盐度一定时,AKP活力随着温度的变化呈现出先下降、后上升的趋势。温度为23.38 ℃,盐度为30.84时,AKP活力最低为168.63 U/mg,其可靠性为 0.99。由图4可知,等高线图近似椭圆形,因此温度和盐度的交互作用显著(P<0.05),且当温度趋于25 ℃、盐度趋于30时,AKP活力最低。
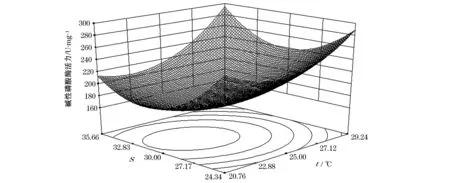
图3 温度和盐度对华贵栉孔扇贝AKP活力影响的响应曲面图Fig.3 Response surface of effects of temperature and salinity on the activity of AKP of Chlamys nobilis
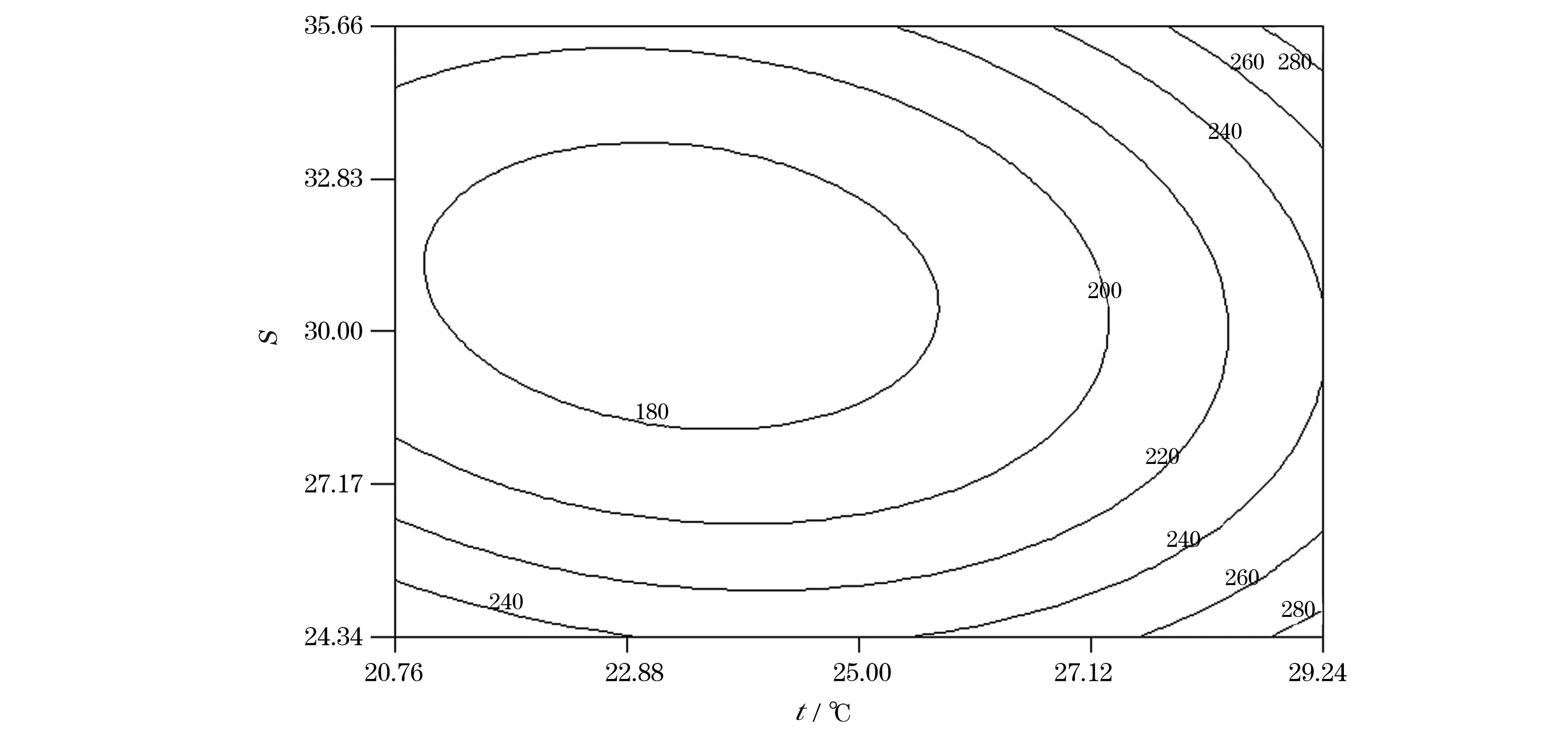
图4 温度和盐度对华贵栉孔扇贝AKP活力影响的等高线图Fig.4 Contour plot of effects of temperature and salinity on the activity of AKP of Chlamys nobilis
2.6 温度和盐度对华贵栉孔扇贝GR活力影响的响应曲面分析
从图5可知,温度和盐度对ACP活力影响的响应曲面较陡,说明温度和盐度分别对ACP活力影响显著。当温度一定时,随着盐度升高,GR的活性先升高后下降;当盐度一定时,随着温度的升高,GR的活性呈现先升高后下降的峰值变化。温度和盐度分别为26.17 ℃,31.56时,GR的活性最高0.35 U/mg,其可靠性为0.96。由图6可知,温度和盐度对华贵栉孔扇贝GR活力影响等高线图为椭圆形,因此温度和盐度的交互作用对华贵栉孔扇贝GR活力影响显著(P<0.05),温度趋于24.15 ℃、盐度趋于30时,GR的活性逐渐升高。
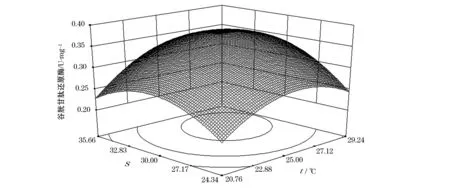
图5 温度和盐度对华贵栉孔扇贝GR活力影响的响应曲面图Fig.5 Response surface of effects of temperature and salinity on the activity of GR of Chlamys nobilis
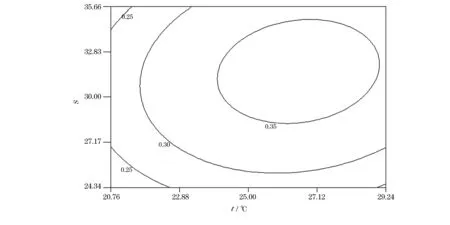
图6 温度和盐度对华贵栉孔扇贝GR活力影响的等高线图Fig.6 Contour plot of effects of temperature and salinity on the activity of GR of Chlamys nobilis
2.7 优 化
以3种免疫相关酶的活力为因变量,通过中心组合设计试验考察了温度和盐度两个因子对ACP,AKP,GR活力的影响,并对结果进行优化,结果表明温度为24.30 ℃、盐度为30.55时,ACP和AKP活力最低,分别为170.44,181.74 U/mg;而GR活力达到最大值0.34 U/mg,满意度为0.95。为了进一步验证响应曲面优化条件的可靠性,按所得最优条件重新设计一组实验作为验证试验,所得的ACP,AKP和GR活力分别为168.79,180.99和0.32 U/mg,与理论预测值基本相符,说明模型优化条件合理有效。
3 讨 论
3.1 温度对华贵栉孔扇贝ACP,AKP和GR活性的影响
随着季节的变化,水温常常会发生改变。与其他水生动物一样,双壳贝类对水温的改变比较敏感,因此贝类的免疫也易随之发生变化[18]。本试验结果显示,温度的一次效应和二次效应对ACP,AKP和GR活力影响显著(P<0.05),表明3种酶的活性均易受温度的影响。ACP和AKP活力随着温度的升高呈现出先下降、后上升的变化趋势。与ACP和AKP活力变化相反,GR活力随温度升高呈现出先升高、后下降的峰值变化。ACP和AKP改变的原因可能是低温或高温威胁到贝类的正常生存,且高温会导致大量病原体出现,从而华贵栉孔扇贝需通过增强自身的免疫来抵御不良环境,保证机体正常的生理活动,因此在温度和盐度改变一段时间后ACP和AKP的值有所升高[19]。GR活性变化的原因是高温使得华贵栉孔扇贝呼吸作用增强,产生大量的氧自由基将谷胱甘肽氧化,因此GR的活性增强以维持机体内的氧自由基平衡[20]。李晓英等[21]对青蛤(Cyclinasinensis)的研究中发现,温度骤升引起青蛤肝胰脏中ACP活性显著升高; Chen等[22]报道了在一定温度范围内,随着温度的升高,栉孔扇贝(ChlamysFarreri)中ACP活性呈现上升的变化趋势;Liu[23]对海湾扇贝(Argopectensirradias)和栉孔扇贝两种扇贝研究发现,AKP活性受温度影响显著(P<0.05),且当温度达到31 ℃时,两种扇贝中AKP活性均达到最大。以上研究与本文研究结论一致,表明ACP和AKP受温度影响显著,且温度高于最适存活温度的一段范围内,ACP和AKP活力会显著增加。温度对GR活力影响在贝类中研究较少,但在其他水生动物中得到了广泛研究。尹晓燕等[24]对草鱼(Ctenopharyngodonidellus)的研究发现,温度对草鱼肾细胞中GR活具有显著影响(P<0.05),随着温度的升高活性增强;Dorts等[25]报道了杜父鱼(Cottusgobio)在热应激的情况下肝脏中GR活力显著下降。本文研究也得出了类似的结论,即在高温刺激下,GR活力明显下降,且显著低于正常温度条件下GR的活力。因此控制温度对于华贵栉孔扇贝的养殖以及病害的控制具有重要意义。
3.2 盐度对华贵栉孔扇贝ACP,AKP和GR活性的影响
在贝类养殖过程中,水体盐度的改变能够对机体的渗透压产生影响,从而影响生物体内离子水平、能量代谢以及电解质平衡,最终改变生物体内与免疫相关的酶活性[26]。本研究结果显示,盐度的一次效应和二次效应对华贵栉孔扇贝ACP,AKP和GR活性影响显著(P<0.05),这表明3种酶活性易受到盐度的影响,且存在最大或最小峰值。ACP和AKP活性随着盐度的升高呈现出先下降、后上升的峰值变化。与之相反,GR活性随着盐度的升高呈现出先升高、后下降的变化趋势。ACP和AKP活性变化原因可能是由于低盐和高盐造成贝类渗透压严重的改变,贝类为了调节渗透压的平衡,需要大量的能量,而免疫水平也因此增强,所以ACP和AKP两种酶的活性会升高[27]。当盐度适宜时,ACP和AKP活力较低的原因可能是由于环境条件适宜,贝类免疫所需的能量较少,大部分能量用于贝类的生长,因此与免疫相关的酶活力相对较低[19]。GR呈现出与ACP和AKP变化趋势相反的原因是盐度逐渐升高时,贝类的耗氧率呈现先升高、后下降的变化[27],因此机体内氧自由基的含量也呈现出相同的变化趋势,为了调节体内氧自由基的平衡,GR的活性也相应呈现出先升高后下降的变化趋势。马洪明等[28]研究发现盐度突降能够增强栉孔扇贝血淋巴中ACP酶活性;时少坤等[29]研究表明,低盐和高盐胁迫下,近江牡蛎(OstrearivularisGould)AKP活性呈现出先降后升的变化。在对其他水生动物的研究中也同样发现[30-32]了与本研究类似的结论,即AKP和ACP活性在适宜盐度条件下,活力较低。目前,研究盐度对贝类血淋巴中GR活性影响的成果较少,而在其他水生动物中有相关报道。尹飞等[33]认为低盐度胁迫下银鲳幼鱼(Pampusargenteus)肝脏中GR活性得到增强;Rodrigues等[34]研究发现盐度对青蟹(Carcinusmaenas)GR活性影响显著(P<0.05),随盐度升高GR活性增强,当盐度为25时,GR活性最高。与本文研究GR活性受盐度影响的变化趋势一致,表明低盐或高盐都不利于GR发挥作用。
3.3 温度和盐度对华贵栉孔扇贝ACP,AKP和GR活性的互作效应
以往的研究多集中于单因子对水生动物中ACP,AKP和GR的独立影响,因而这些研究不能考察温度和盐度两者间的交互作用对3种酶活性的影响。本试验采用复合设计,对温度和盐度的互作效应进行显著性检验,结果表明,温度和盐度的交互作用对华贵栉孔扇贝血淋巴中ACP,AKP和GR活性影响显著(P<0.05)。原因可能是温度能够改变3种酶的空间构象,而盐度则提供酶激活所需的金属离子,因此两者能够共同促进酶活性的调节。据报道,马氏珠母贝(Pinctadamartensi)稚贝中ACP和AKP活力受温度和盐度交互作用影响显著[19];军曹鱼(Rachycentridae)幼鱼肌肉中GR活性受到温盐联合效应的影响显著[35]。以上报道与本文试验结果相一致,表明温度和盐度对3种酶均存在互作效应。
目前,有关ACP和AKP的研究已经建立了相应的模型,但对于GR并未建立相应模型。本试验通过建立可靠的模型,可以实现对响应的连续预测,这对贝类生理和免疫的研究提供了可靠的因子条件支撑。方差分析结果显示(表2,4,6)显示,所建立的温度和盐度对华贵栉孔扇贝ACP,AKP和GR活力影响的模型极显著(P<0.01),说明模型建立恰当,可以预测华贵栉孔扇贝血淋巴中ACP,AKP和GR活力。
通过优化得出,在温度24.30 ℃、盐度30.55时,ACP和AKP活力最低,而GR活力最大,反应了此时华贵栉孔扇贝生存环境适宜,用于免疫调节的能量较少,生长能力比较旺盛,说明在实际生产中,控制温度24 ℃、盐度31,华贵栉孔扇贝生长良好。
[1] MALHAM S K, COTTER E, O′KEEFFE S, et al. Summer mortality of the Pacific oyster,Crassostreagigas, in the Irish Sea: The influence of temperature and nutrients on health and survival[J].Aquaculture, 2009, 287(1-2):128-138.
[2] COTTER E, MALHAM S K, O′KEEFFE S, et al. Summer mortality of the Pacific oyster,Crassostreagigas, in the Irish Sea: The influence of growth, biochemistry and gametogenesis[J].Aquaculture, 2010,303(1-4):8-21.
[3] LI W J, TAN K F. Enlightenment to solve the mass death ofPectenyessoensisin Japan[J].Fisheries Science, 2009, 28(10):609-612.李文姬,谭克非. 日本解决虾夷扇贝大规模死亡的启示[J].水产科学,2009,28(10):609-612.
[4] MUNARI M, MATOZZO V, MARIN M G. Combined effects of temperature and salinity on functional responses of haemocytes and survival in air of the clamRuditapesphilippinarum[J].Fist and Shellfish Immunology, 2011, 30(4): 1024-1030.
[5] MONARI M, MATOZZO V, FOSCHI J, et al. Effects of high temperatures on functional responses of haemo-cytes in the clamChameleagallina[J].Fist and Shellfish Immunology, 2007, 22(1): 98-114.
[6] WANG S, GAO R C, WEN Y M, et al. Effect of abrupt decline in salinity on nonspecific immune enzme activities ofHiatulachinensis[J].Jiang Su Agriculture Sciences, 2008, 5:213-215.王帅,高如承,温扬敏,等. 盐度突变对中国血蛤非特异性免疫酶活性的影响[J].江苏农业科学, 2008, 5:213-215.
[7] CAI Y Y, XIE S H. Seashell of Guangdong[M].Shan Tou:Shantou University Press,2006. 蔡英亚, 谢绍河.广东的海贝[M].汕头:汕头大学出版社, 2006.
[8] WANG Q, YUAN T, HE M Q. Rearch progress of culture and genetic breeding of noble scallopChlamysnobilis[J].South China Fisheries Science, 2011,7(5):73-80.王琦,袁涛,何毛贤.华贵栉孔扇贝养殖及遗传育种研究进展[J].南方水产科学, 2011, 7(5):73-80.
[9] ZHENG H, LIU H, ZHANG T, et al.Total carotenoid differences in scallop tissues ofChlamysnobilis(Bivalve: Pectinidae) with regard to gender and shell colour[J].Food chemistry, 2010, 122(4): 1164-1167.
[10] ZHENG H, LIU H, LIU W, et al. Changes of total carotenoid and lipid content in scallop tissues ofChlamysnobilisBivalve: Pectinidae) during gonad maturation[J].Aquaculture, 2012, 342: 7-12.
[11] WANG Y J, ZHENG H P, ZHANG B, et al. Cloning and respond of a cold shock domain protein (CnCSDP) gene to cold stress in noble scallopChlamysnobilis(Bivalve: Pectinidae)[J].Molecular Biology Reports, 2014, 41(12): 1-10.
[12] LIU F, WANG W X. Metallothionein-like proteins turnover, Cd and Zn biokinetics in the dietary Cd-exposed scallopChlamysnobilis[J].Aquatic Toxicology, 2011, 105(3): 361-368.
[13] LI Z M, LIU Z G, XIE L, et al. Effect of body weight and temperature on oxygen consumption and ammonia-N excretion rates ofChlamysnobilis[J].Oceanologla et Limnologia Sinica, 2010,41(1):99-105.栗志民,刘志刚,谢丽,等. 体重和温度对华贵栉孔扇贝耗氧率和排氨率的影响[J].海洋与湖沼, 2010,41(1):99-105.
[14] LIU Z G, LIU J Y, YANG B. Interactions of temperature and salinity to the survival and growth ofChlamysnobilis[J].Marine Sciences,2011,35(10):75-80.刘志刚,刘建勇,杨博. 温度与盐度对华贵栉孔扇贝幼贝存活与生长的互作效应研究[J].海洋科学, 2011,35(10):75-80.
[15] LIU Z G, WANG H, LÜ W G, et al. Inheritance of shell color and adductor muscle color inChlamysnobilis[J].Oceanologla et Limnologia Sinica,2012,43(2):237-243.刘志刚,王辉,吕文刚,等.华贵栉孔扇贝(Chlamysnobilis)壳色与闭壳肌颜色遗传规律的研究[J].海洋与湖沼,2012,43(2):237-243.
[16] LI Z M, LIU Z G, YANG R, et al. Effect of temperature and salinity on the survival and growth ofMeretrixlyratajuveniles[J].Acta ecologica Sinica,2010,30(13):3406-3413.栗志民,刘志刚,姚茹,等.温度和盐度对皱肋文蛤幼贝存活与生长的影响[J].生态学报, 2010, 30(13):3406-3413.
[17] PENG J, WANG H, QIANG J, et al. Combined effect of temperature and salinity on the fertilization and hatching rate in the GIFI strain of Nile tilapia,Oreochrominiloticus[J].Journal of Fishery Sciences of China,2011,18(4):847-856.彭俊,王辉,强俊,等.温度和盐度对吉富品系尼罗罗非鱼受精率和孵化率的联合影响[J].中国水产科学, 2011,18(4):847-856.
[18] EKANAYAKE P M, De Z M, KANG H S, et al. Cloning, characterization and tissue expression of disk abalone (Haliotisdiscusdiscus) catalase[J].Fist and Shellfish Immunology, 2008, 24(3): 267-278.
[19] ZHU X W. Combined effects of temperature, salinity and pH on the physiological features of the juveniles ofPinctadamartensii[D].Zhanjiang: Guangdong Ocean University. 2012:54-57.朱晓闻. 温度、盐度、pH对马氏珠母贝稚贝生理学特征的联合效应研究[D].湛江:广东海洋大学. 2012:54-57.
[20] LIU W C, LI M Y, HUANG F Y, et al. Effects of cadmium stress on xanthine oxidase and antioxidant enzyme activities inBoleophthalmuspectinirostrisliver[J].Chinese Journal of Applied Ecology,2006,17(7):1310-1314.刘伟成, 李明云, 黄福勇, 等. 镉胁迫对大弹涂鱼肝脏黄嘌呤氧化酶和抗氧化酶活性的影响[J].应用生态学报, 2006, 17(7): 1310-1314.
[21] LI X Y, DONG Z G, XUE Y, et al. The impact of sharp increase in water temperature and hypoxia on activities of acid phosphatase and lysozyme in clamCyclinasinensis[J].Fisheries Science,2009,28(6):321-324.李晓英, 董志国, 薛洋, 等. 温度骤升和窒息条件对青蛤酸性磷酸酶和溶菌酶的影响[J].水产科学, 2009, 28(6): 321-324.
[22] CHEN M, YANG H, DELAPORTE M, et al. Immune condition ofChlamysfarreriin response to acute temperature challenge[J].Aquaculture, 2007, 271(1): 479-487.
[23] LIU S, JIANG X, HU X, et al. Effects of temperature on non-specific immune parameters in two scallop species:Argopectenirradians(Lamarck 1819) andChlamysfarreri(Jones & Preston 1904)[J].Aquaculture Research, 2004, 35(7): 678-682.
[24] YIN X Y. The effects of temperature and nitrite on antioxidative system in kindey cell, erythrocyte, and hepatocyte in vitro of grass carpctenopharyngodonidellus[D].Wuhan:Huazhong Agriculture University,2014,6:1-46.尹晓燕.温度和亚硝酸盐对草鱼肾细胞、血细胞及肝细胞抗氧化体系的影响[D].武汉:华中农业大学, 2014,6:1-46.
[25] DORTS J, BAUWIN A, KESTEMONT P, et al. Proteasome and antioxidant responses inCottusgobioduring a combined exposure to heat stress and cadmium[J].Toxico Pharma, 2012,155(2): 318-324.
[26] PILLAI B R, DIWAN A D. Effects of acute salinity stress on oxygen consumption and ammonia excretion rates of the marine shrimpMetapenaeusmonoceros[J].Journal of Crustacean Biology, 2002, 22(1): 45-52.
[27] FAIRCHILD C R, MOSCOW J A, O'BRIEN E E, et al. Multidrug resistance in cells transfected with human genes encoding a variant P-glycoprotein and glutathione S-transferase-pi[J].Molec pharma, 1990, 37(6):801-809.
[28] MA H M, LIU X W, MAI K S,et al.Effects of abrupt salinity decline on anti-disease ability of scallopChlamysfarreri[J].High Technology Letters, 2006,16(7):746-751. 马洪明, 刘晓伟, 麦康森, 等. 盐度突降对栉孔扇贝抗病力指标的影响[J].高技术通讯, 2006, 16(7): 746-751.
[29] SHI S K, WANG R X, WANG J Y, et al. Effects of salinity stress on immune factors ofCrassostreahongkongensis[J].South China Fisheries Science,2013,9(3):26-30.时少坤, 王瑞璇, 王江勇, 等. 盐度胁迫对近江牡蛎几种免疫因子的影响[J].南方水产科学, 2013,9(3): 26-30.
[30] JOSEPH A, PHILIP R. Acute salinity stress alters the haemolymph metabolic profile ofPenaeusmonodonand reduces immunocompetence to white spot syndrome virus infection[J].Aquaculture, 2007, 272(1): 87-97.
[31] CHENG W, JUANG F M, CHEN J C. The immune response of Taiwan abaloneHaliotisdiversi-colorsupertextaand its susceptibility toVibrioparahaemolyticusat different salinity levels[J].Fish and Shellfish Immunology, 2004, 16(3): 295-306.
[32] SHEN L Q, CHEN Z Q, CHEN C S, et al. Growth and immunities of the shrimp,Litopenaeusvanameiexposed'to different salinity levels[J].Journal of Jimei University:Natural Science,2008,12(2):108-113.沈丽琼, 陈政强, 陈昌生,等. 盐度对凡纳滨对虾生长与免疫功能的影响[J].集美大学学报:自然科学版,2008,12(2): 108-113.
[33] YIN F, SUN P, PENG S M, et al. Effects of low salinity stress on the antioxidant enzyme activities in juvenilePampusargenteusliver and the ATPase activities in its gill and kidne[J].Chinese Journal of Applied Ecology,2011,22(4):1059-1066.尹飞, 孙鹏, 彭士明, 等. 低盐度胁迫对银鲳幼鱼肝脏抗氧化酶, 鳃和肾脏 ATP 酶活力的影响[J].应用生态学报,2011,22(4): 1059-1066.
[34] RODRIDUES A P, OLIVEIRA P C, GUILHERMINO L, et al. Effects of salinity stress on neurotransmission, energy metabolism, and anti-oxidant biomarkers ofCarcinusmaenasfrom two estuaries of the NW Iberian Peninsula[J].Marine Biology, 2012, 159(9): 2061-2074.
[35] YANG J, CHEN G, HUANG J S, et al. Effects of temperature and salinity on the growth and activities of antioxidant enzymes of Cobia(Rachycentroncanadum) juveniles[J].Journal of Guangdong Ocean University,2007,27(4):25-29.杨健, 陈刚, 黄建盛, 等. 温度和盐度对军曹鱼幼鱼生长与抗氧化酶活性的影响[J].广东海洋大学学报,2007,27(4):25-29.
Received: January 21, 2015
Synergistic Effects of Temperature and Salinity on the Activities of Immune-Related Enzymes ofChlamysnobilis(Reeve)
LI Zhi-min, QIAN Jia-hui, LAO Cui-ying, LIU Zhi-gang
(FisheriesCollege,GuangdongOceanUniversity, Zhanjiang 524025, China)
In order to provide a reference for disease control, culture and spreading ofChlamysnobilis,the synergistic effects of temperature (19~31 ℃) and salinity (22~38) on the activities of immune related enzymes of ACP, AKP and GR were studied using the central composite design (CCD) and response surface methodology (RSM). The results showed that the linear effects of temperature on the activities of ACP, AKP and GR were significant (P<0.05). And quadratic effects of temperature on the activities of three enzymes were also significant (P<0.05), which suggested that the activities of ACP, AKP and GR were easily be impacted by the temperature conditions. While the linear effects of salinity on the activities of ACP, AKP, GR were significant (P<0.05), and the quadratic effects of salinity on the ACP, AKP and GR were also significant (P<0.01). There existed significant synergistic effects between temperature and salinity on the activities of ACP, AKP and GR (P<0.05). Through response surface methodology, a model equation about the relationship of the activities of ACP, AKP and GR to the two factors was established, with theR2as high as 0.986 6, 0.981 3 and 0.957 6 (P<0.05)respectively, and the Pred.R2reached to 0.934 5,0.888 0 and 0.738 4, suggesting that the fitting capability of the model was practicably applied for prediction. Through the optimization of the reliable model, the activities of ACP, AKP reached their minimum(170.43, 181.74 U/mg) and the activity of GR reached the maximum (0.34 U/mg) when the 2-factor combination was 24.30 ℃/30.55, with the desirability value being 0.95.
Chlamysnobilis; response surface method; Alkaline Phosphatase(AKP); Acid Phosphatase(ACP); Glutathione Reductase(GR)
2015-01-21
广东省教育厅项目——热带海产无脊椎动物养殖工程研究中心建设项目(GCZX-A0909)
栗志民(1972-),男,辽宁兴城人,博士,副教授,主要从事经济无脊椎动物生物学和增养殖方面研究. E-mail:lizhimin811@163.com
*通讯作者:刘志刚(1963-),男,广东潮州人,教授,硕士生导师,主要从事经济无脊椎动物增养殖方面研究.E-mail:lzg919@126.com
(王佳实 编辑)
S917.4
A
1671-6647(2015)02-0227-12
