外周血滤泡辅助性T 细胞与B 细胞在酒精性股骨头坏死患者中的作用
2015-03-18丁福鹏戚长林刘易军单玉兴吉林大学第一医院分院骨科长春130021
丁福鹏 戚长林 高 辉 刘易军 王 井 单玉兴 (吉林大学第一医院分院骨科,长春 130021)
非创伤性股骨头坏死是以渐进性股骨头塌陷为特征的严重的慢性疾病[1],疾病早期进展隐匿没有明显的临床症状,后期只能通过人工髋关节置换手术治疗来缓解症状和恢复功能,但是该手术给家庭和社会带来了沉重的经济负担并带有长期的并发症。非创伤性股骨头坏死的发病机制并不明确,但饮酒是公认的非创伤性股骨头坏死的主要病因之一,酒精可能通过加重血管内凝血进而导致骨质缺血和坏死,但其具体机制并不明确[2,3]。滤泡辅助性T 细胞(Tfh)是最近发现的对B 细胞的分化、抗体生产和体液免疫具有重要调节作用的细胞,Tfh细胞表面表达趋化因子受体5(CXCR5),可诱导辅助刺激因子(ICOS)和程序性死亡因子(PD)-1 并以分泌IL-21 为特征[4],本研究通过分析酒精性股骨头坏死患者外周血中Tfh 细胞和B 细胞的变化情况,来探究Tfh-B 细胞间相互作用在酒精性股骨头坏死的发病机制中的作用。
1 对象与方法
1.1 研究对象 26 例酒精性股骨头坏死患者来自吉林大学第一医院住院部及门诊,其中男性24 例,女性2 例,年龄49(40~70)岁;选取15 名健康者作为健康对照组,男性12 名,女性3 名,年龄48(36~68)岁。病例组和健康对照组之间性别、年龄差异无统计学意义。诊断均符合Mont 提议的诊断标准[5],患者酗酒超过十年,每日饮白酒量大于0.25 kg/dof,病人的疾病等级分期参照FICAT 分期标准[6],股骨头塌陷指数参照Deng JC 提出的标准评价[7]。排除创伤性股骨头坏死、骨肿瘤、强直性脊柱炎、先天髋关节发育不良、髋关节骨性关节炎、慢性炎症、自身免疫性疾病及近期感染的患者。本研究符合中国医学伦理委员会制定的伦理标准,并获得伦理委员会的批准。标本采集均取得受试者的知情同意。
1.2 外周血单核细胞(PBMC)分离 治疗前静脉抽取新鲜全血(枸橼酸钠抗凝)6 ml,通过梯度离心法获得外周血单个核细胞(PBMCs),在含10%小牛血清的RPMI1640 培养液(Hyclone,Waltham,MA,USA)中培养PBMCs,加入50 ng/ml phorbol myristate acetate(PMA)和2 g/ml 离子霉素(Sigma,St.Louis,MO,USA)刺激1 h,加入布雷菲德菌素A(10 g/ml,GolgiStop,BD Sciences,San Jose,CA,USA)培养5 h,收集调成细胞数约为1 ×107ml-1的悬液备用。
1.3 流式细胞术检测Tfh 细胞 分离后PBMCs 加入Alexa Fluor 647 抗CXCR5 抗体,藻红蛋白(PE)/CY7 抗CD4 抗体,PE 抗CD278 抗体,和异硫氰酸荧光素(FITC)抗CD279 抗体(BD PharMingen,San Diego,CA,USA)在室温下避光染色30 min。同型对照组加入FITC 抗IgG1 抗体,PE 抗IgG1 抗体,PE/CY7 抗IgG1 抗体和Alexa Fluor 647 抗IgG1 抗体(BD PharMingen)。收集刺激后的PBMCs,加入Alexa Fluor 647 抗CXCR5 抗体,PE/CY7 抗CD4 抗体在室温下避光染色30 min,固定破膜后PE 抗IL-21抗体胞内染色。流式细胞检测分析IL-21+Tfh 细胞比率。
1.4 流式细胞术检测B 细胞 分离后PBMCs 加入多甲藻叶绿素蛋白(PerCP)抗CD19 抗体,FITC-抗CD86 抗体,PE-抗CD27 抗体,别藻蓝蛋白(APC)抗CD95 抗体(BD PharMingen)在室温下避光染色30 min,同型对照组加入FITC-IgG1 抗体,PE 抗Ig2a 抗体,PerCP 抗IgG1 抗体,和APC 抗IgG1 抗体(BD PharMingen)染色。选取CD4+细胞设门,FlowJo 软件(v7.6.2)分析样本中不同亚群CD19+B 细胞的数量。
1.5 细胞因子测定 严格按照人IL-21 ELISA 试剂盒(Roche Diagnostics,Lewes,UK)说明书检测外周血中IL-21 浓度。
1.6 统计学处理 采用SPSS13.0 软件包进行统计分析,数据采用中值及其范围表示,进行独立样本t检验和秩和检验。相关性分析采用Spearman 秩和相关分析,以P <0.05 为差异具有统计学意义。
2 结果
2.1 酒精性股骨头坏死中不同B 细胞亚群的变化情况及其与疾病进展的相关性 酒精性股骨头坏死患者外周血CD19+B 细胞百分率显著高于健康对照组(图1B;t=3.765,P=0.000 5),分析B 细胞不同亚群在酒精性股骨头坏死中的变化情况,发现CD27+CD19+B 细胞相对于健康对照组明显减少(图1C;t=3.027,P=0.004),CD86+CD19+B 细胞和CD96+CD19+B 细胞百分率显著高于健康对照组(图1D、E;t=5.506,P <0.000 1;t=4.152,P=0.000 2),相关性分析显示CD86+CD19+B 细胞百分率与股骨头坏死评分呈正相关(图1F;P <0.000 1,r=0.536)。
2.2 酒精性股骨头坏死中不同Tfh 细胞亚群和血清IL-21 水平的变化情况 酒精性股骨头坏死患者外周血Tfh 细胞百分率显著高于健康对照组(图2B;t=7.611,P <0.000 1),同时PD-1+Tfh 细胞和IL-21+Tfh 细胞百分率显著高于健康对照组(图2C、E;t=4.369,P <0.000 1;t=0.989,P <0.000 1),然而患者及健康对照组间比较ICOS+Tfh 细胞百分率并无显著变化(图2D;t=0.989,P=0.328),患者血清IL-21 水平明显高于健康人(图2F;t=23.03,P <0.000 1)。
2.3 酒精性股骨头坏死中不同Tfh 细胞亚群的变化情况与不同B 细胞亚群的变化情况的相关性相关性分析显示,酒精性股骨头坏死患者外周血Tfh 细胞百分率与CD19+B 细胞百分率呈正相关(图3A;P=0.000 2,r=0.455),外周血IL-21+Tfh细胞百分率与CD86+CD19+B 细胞百分率呈正相关(图3B;P=0.000 2,r=0.447)。

图1 酒精性股骨头坏死中不同B 细胞亚群的变化情况及其与疾病进展的相关性分析Fig.1 Analysis of different subsets of B cells between NONFH patients and HC,and correlation between B cells and indices of femoral head collapse

图2 酒精性股骨头坏死中不同Tfh 细胞亚群和血清IL-21 水平的分析Fig.2 Analysis of different subsets of Tfh cells and serum IL-21 levels between NONFH patients and HC
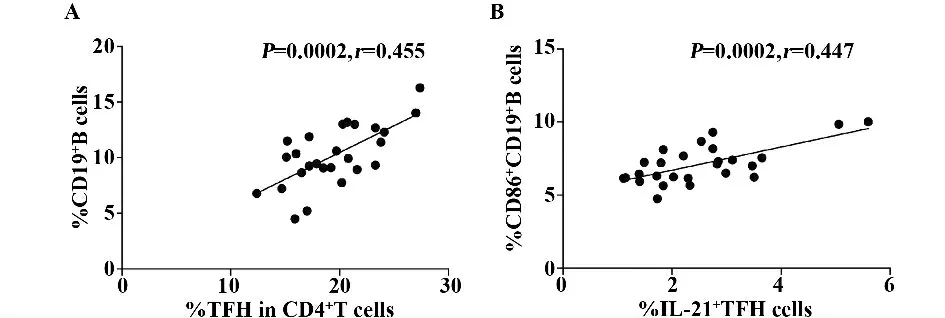
图3 酒精性股骨头坏死中不同Tfh 细胞亚群与不同B 细胞亚群的相关性分析Fig.3 Correlations between different subsets of Tfh cells and CD19 +B cells
3 讨论
非创伤性股骨头坏死是临床上常见的慢性疾病,发病机制不清且致病因素复杂。众多学者发现非创伤性股骨头坏死患者中存在免疫失衡的现象,免疫性疾病如系统性红斑狼疮、类风湿性关节炎等易并发股骨头坏死[8,9],外周血升高的细胞因子被证明与股骨头的破坏有关,抗磷脂抗体和抗心脂抗体也被发现参与股骨头坏死的发病及进展。饮酒是非创伤性股骨头坏死的主要病因之一,Okazak 等[10]在研究酒精性骨坏死时发现酒精滥用通过LPS 相关通路诱导IL-1、IL-2、IL-4、IL-6、IL-10、GM-CSF、IFN-γ 和TNF-α 的分泌,从而导致股骨头的破坏,同样有研究证明酒精滥用可通过Toll 样受体4(TLR4)通路引起系统性的炎症[11]。众所周知,LPS 通过TLR4 对B 细胞具有激活作用[12]。可见B 细胞可能参与酒精性非创伤性股骨头坏死的发病及进展。
我们的研究发现酒精性非创伤性股骨头坏死患者外周血CD19+B 细胞显著高于健康对照组,进一步分析发现患者外周血CD95+CD19+B 细胞和CD86+CD19+B 细胞百分率相对于健康对照组显著增高,然而患者外周血CD27+CD19+记忆性B 细胞显著减少。有研究者证明CD27+B 细胞易在活化B细胞的刺激下分化为浆细胞[13],这与我们的发现相符,在酒精性股骨头坏死的病理状态下,记忆性B细胞可能再次活化分化为浆细胞,导致体内CD27+CD19+记忆性B 细胞的减少。同时我们发现在酒精性股骨头坏死患者中CD86+CD19+B 细胞与股骨头塌陷指数呈正相关,这说明B 细胞在酒精性股骨头坏死发病及发展中具有重要的作用。
Tfh 细胞是最近发现的对B 细胞的分化、抗体生产和体液免疫具有重要调节作用的CD4+T 细胞,Tfh 细胞通过表面表达的CXCR5、PD-1 和ICOS 调节生发中心中B 细胞的活化[14],同时Tfh 细胞可分泌IL-21。IL-21 参与Tfh 细胞的产生分化和细胞增殖,并在生发中心形成及免疫球蛋白的类别转换过程中发挥着重要作用[15]。有研究者发现Tfh 细胞和IL-21 在类风湿关节炎的关节炎症和骨质破坏中发挥着重要的作用[16,17]。本研究发现酒精性非创伤性股骨头坏死患者外周血Tfh 细胞显著高于健康对照组,且PD-1+Tfh 细胞和IL-21+Tfh 细胞百分率显著高于健康对照组,然而患者及健康对照组间比较ICOS+Tfh 细胞百分率并无显著变化。过去的研究证明免疫的失衡在NONFH 的疾病进展中发挥着重要的角色,升高的Tfh 细胞可能也参与酒精性股头坏死进展。为了更好地探究Tfh 细胞在酒精性股骨头坏死发病机制中发挥的作用,我们进一步分析了酒精性股骨头坏死中不同Tfh 细胞亚群的变化情况与不同B 细胞亚群的变化情况的相关性,发现酒精性股骨头坏死患者外周血Tfh 细胞百分率与CD19+B 细胞百分率呈正相关,IL-21+Tfh 细胞百分率与CD86+CD19+B 细胞百分率呈正相关,这提示Tfh 细胞通过诱导细胞因子的分泌和B 细胞的活化参与酒精性股骨头坏死的发病及进展。
过量的酒精摄入造成体外循环的炎症状态[10],Tfh 细胞数目增高并分泌大量IL-21,诱导B 细胞的活化,Tfh-B 细胞相互作用导致患者体内免疫失衡。Kwok[18]发现IL-21 不仅上调RANKL(核因子κ B受体活化因子配体)的表达,而且可以在缺乏RANKL 的情况下诱导破骨细胞的分化,B 细胞也表达RANKL[19]。众所周知,体内升高的RANKL,会导致破骨细胞的激活,从而引发骨坏死,从而加重股骨头坏死。Tfh-B 细胞可能在酒精性股骨头坏死的发病和发展过程中具有重要的作用。
综上所述,酒精性股骨头坏死患者体内Tfh 细胞和B 细胞均高于健康对照组,并且Tfh 细胞与B细胞在疾病的发展过程中相互作用,可能在酒精性股骨头坏死的发病过程中发挥着重要的作用,然而Tfh-B 细胞在酒精性股骨头坏死疾病中的具体机制仍需进一步研究。因此,对Tfh-B 细胞的相互作用进一步的研究对控制和治疗酒精性股骨头坏死具有重要意义。
[1]Malizos KN,Karantanas AH,Varitimidis SE,et al.Osteonecrosis of the femoral head:Etiology,imaging and treatment[J].Eur J Radiol,2007,63:16.
[2]Zalavras CG,Lieberman JR.Osteonecrosis of the femoral head:evaluation and treatment[J].J Am Acad Orthop Surg,2014,22(7):455-64.
[3]Lykissas MG,Gelalis ID,Kostas-Agnantis IP,et al.The role of hypercoagulability in the development of osteonecrosis of the femoral head[J].Orthop Rev(Pavia),2012,4(2):e17.
[4]Qi H,Chen X,Chu C,et al.Tfh cell differentiation and their function in promoting B-cell responses[J].Adv Exp Med Biol,2014,841:153-80.
[5]Mont MA,Jones LC,Hungerford DS.Nontraumatic osteonecrosis of the femoral head:ten years later[J].J Bone Joint Surg Am,2006,88:1117.
[6]Ficat RP.Idiopathic bone necrosis of the femoral head.Early diagnosis and treatment[J].J Bone Joint Surg Br,1985:67:3.
[7]Deng JC,Wang Y,Lv B,et al.Evaluation Guidelines for femoral head collapse severity[J].J Chin J Clinicians,2012,6:1570.
[8]Kim HS,Bae SC,Kim TH,et al.Endothelial nitric oxide synthase gene polymorphisms and the risk of osteonecrosis of the femoral head in systemic lupus erythematosus[J].Int Orthop,2013,37(11):2289-2296.
[9]Van Vugt RM,Sijbrandij ES,Bijlsma JW.Magnetic resonance imaging of the femoral head to detect avascularnecrosis in active rheumatoid arthritis treated with methylprednisolone pulse therapy[J].JRheumatol,1996,25:74.
[10]Okazaki S,Nishitani Y,Nagoya S,et al.Femoral head osteonecrosis can be caused by disruption of the systemic immune response via the toll-like receptor 4 signalling pathway[J].Rheumatology,2009,48:227.
[11]Agematsu K.Memory B-cells and CD27[J].Histol Histopathol,2000,15:573-576.
[12]Godowski PJ.A smooth operator for LPS responses[J].Nat Immunol,2005,6:544.
[13]Dang LV,Nilsson A,Ingelman-Sundberg H,et al.Soluble CD27 induces IgG production through activation of antigen-primed B cells[J].J Intern Med,2012,271(3):282-293.
[14]Linterman MA,Liston A,Vinuesa CG.T-follicular helper cell differentiation and the co-option of this pathway by non-helper cells[J].Immunol Rev,2012,247(1):143-159.
[15]雷玲彦,郭惠芳,张明峰,等.Tfh 细胞在原发性干燥综合征中的致病作用[J].中国免疫学杂志,2014,30(3):392-396.
[16]Kwok SK,Cho ml,Park MK,et al.Interleukin-21 promotes osteoclastogenesis in humans with rheumatoid arthritis and in mice with collagen-induced arthritis [J].Arthritis Rheum,2012,64(3):740-751.
[17]Wang J,Shan Y,Jiang Z,et al.High frequencies of activated B cells and T follicular helper cells are correlated with disease activity in patients with new-onset rheumatoid arthritis[J].Clin Exp Immunol,2013,174(2):212-220.
[18]Kotake S,Udagawa N,Hakoda M,et al.Activated human T cells directly induce osteoclastogenesis from human monocytes:possible role of T cells in bone destruction in rheumatoid arthritis patients[J].Arthritis Rheum,2001,44(5):1003-1012.
[19]张立智,蒋 垚.骨的免疫学研究进展[J].中国际骨科学杂志,2009,30(4):218-221.
