有机酸对纤维素酶解和纤维乙醇发酵的影响
2015-03-18韩秀丽赵浩浩何玉远
韩秀丽,赵浩浩,鲁 峰,常 春,何玉远
(1.郑州大学 化工与能源学院,河南 郑州450001;2.河南省周口市环境监测站,河南 周口466002)
0 引言
随着各国对能源需求的增加,利用纤维原料生产纤维乙醇成为国内外学者的研究热点[1]. 目前,纤维乙醇项目存在的技术瓶颈主要有:废水处理问题;纤维原料的预处理能耗较大[2-3];秸秆运输储存困难;生产所需纤维素酶的成本高[4-5],这些因素导致纤维乙醇生产成本居高难下,每生产1 t 纤维乙醇约产生20 t 废水.而随着纤维乙醇生产规模的扩大,需要处理的废水量巨大[6];同时,纤维乙醇废水污染负荷高、组分复杂,具有色度高和COD(化学需氧量,Chemical Oxyen Demand)高的特点,是一种难处理的工业废水.目前,蒸馏废液以采用“厌氧-好氧法”生物处理工艺为主,最终的废水(COD 约300 ~400 mg/L)还需排放进入城市污水处理系统,加大了城市污水处理负荷.废水好氧处理法投入大、难达标[7],好氧处理成本达10 元/t,并且好氧污泥造成的污染隐患也依然存在.因此,要发展纤维乙醇工业,必须解决其高浓度废水污染问题.
纤维乙醇废水首先经厌氧发酵生产沼气处理,然后将沼液作为工艺配料用水回用于纤维乙醇生产过程,这是解决纤维乙醇废水污染最有效的途径[8].废水的回用[9]不仅可以节约水资源,而且可减少废水排放对环境的污染[10],从而降低纤维乙醇生产成本.
厌氧发酵生产沼气过程主要包括3 个阶段:①水解液化阶段,发酵性细菌所分泌的胞外酶将沼气原料中的非水溶性有机物转化为可溶性的有机酸和醇类等;②产酸阶段,主要是把第一阶段的产物丙酸、丁酸、乳酸和醇类等在产氢产乙酸菌的作用下转化为乙酸,同时产生H2和CO2;③产甲烷阶段,是利用产甲烷菌将乙酸和H2、CO2等转化为沼气.厌氧产沼气后的沼液中含有少量甲酸、乙酸和丙酸等小分子有机酸,这些物质累积到一定程度就会对酵母生长和乙醇发酵产生抑制. 笔者主要研究了甲酸、乙酸和丙酸等小分子有机酸对纤维素酶解和乙醇发酵的影响,旨在为纤维乙醇废水回用提供理论支撑.
1 实验部分
1.1 实验材料和仪器
材料:汽爆玉米秸秆,河南天冠企业集团有限公司;纤维素酶,诺维信(中国)生物技术有限公司,酶活为1 381 U/mL(滤纸酶活法);安琪耐高温型酿酒高活性干酵母,湖北安琪酵母股份有限公司;所用试剂均为分析纯.
仪器:UV-2102 PC 型紫外可见分光光度计,尤尼柯上海仪器有限公司;FIWE3/6 纤维素测定仪,北京盈盛恒泰科技有限责任公司;PHS -3S型精密酸度计,上海大普仪器有限公司;HZ -9311K 恒温振荡器,太仓市科教器材厂;数显恒温水浴锅,郑州长城科工贸有限公司;电热手提压力蒸汽消毒器,上海医用核子仪器厂.
1.2 酵母的活化
用5 mol/L 的H2SO4将2%葡萄糖水溶液的pH 值调到4.5 ~5.0,于121 ℃的灭菌锅中灭菌20 min,冷却至40 ℃,向50 mL 的上述灭菌后的葡萄糖水溶液中加入3 g 干酵母,在38 ℃的恒温水浴中保温30 min,即可做酒母使用.
1.3 实验方法
酶解:按照底物浓度15%的比例,称取一定量的汽爆玉米秸秆置于三口烧瓶中,然后分别加入一定量pH 4.8 的柠檬酸缓冲溶液、纤维素酶和聚乙二醇,摇匀,将三口烧瓶放入到50 ℃恒温水浴,以200 r/min 搅拌速度酶解48 h,酶解液经离心机离心后,取上清液,适当稀释后测其还原糖浓度.
发酵:取150 mL 酶解液,酵母接种量1%(体积分数),摇匀后封口,放入34 ℃恒温摇床中震荡,摇床转速为160 r/min,发酵一定时间后,取样测定其乙醇含量和残余还原糖浓度.
1.4 分析方法
1.4.1 玉米秸秆成分分析
蒸汽爆破后的玉米秸秆成分采用纤维素测定仪测定. 其主要成分为:纤维素31.68%;半纤维素17.62%;木质素22.11%;灰分10.64%;其他17.95%(均为质量分数).
1.4.2 还原糖浓度的测定
采用3,5-二硝基水杨酸(DNS 试剂)法测定[11].取0.5 mL 稀释至一定倍数的酶解液于25 mL 比色管中,加入pH 4.8 的柠檬酸缓冲液1.5 mL 和DNS 3 mL,混匀,将比色管置于沸水浴中反应10 min,取出迅速冷却至室温,用蒸馏水定容至25 mL,混匀,用1 cm 比色皿在波长540 nm 处测量吸光度,用标准曲线法求出还原糖葡萄糖的含量.
1.4.3 乙醇含量(体积分数)的测定
取100 mL 发酵液和等体积的蒸馏水于三口烧瓶中进行蒸馏,用容量瓶收集100 mL 馏出液,然后用重铬酸钾比色法[11],在波长610 nm 处测定吸光度,求出乙醇含量.
2 结果与讨论
2.1 甲酸、乙酸和丙酸对酶解的影响
纤维乙醇废水经厌氧发酵生产沼气处理后的沼液废水中含有甲酸、乙酸和丙酸等小分子有机酸,这些有机酸影响纤维素酶的糖化效率.酶解试验的条件为:pH 4.8;底物浓度15%(质量分数);聚乙二醇0.15%(质量分数);纤维素酶用量50 U/g(纤维素量);酶解时间48 h.为考察小分子有机酸对酶解的影响,向酶解液中加入不同浓度的甲酸、乙酸和丙酸,按照1.3 中的实验方法进行酶解,酶解48 h 后,测定酶解液的还原糖浓度和pH值,结果见图1.
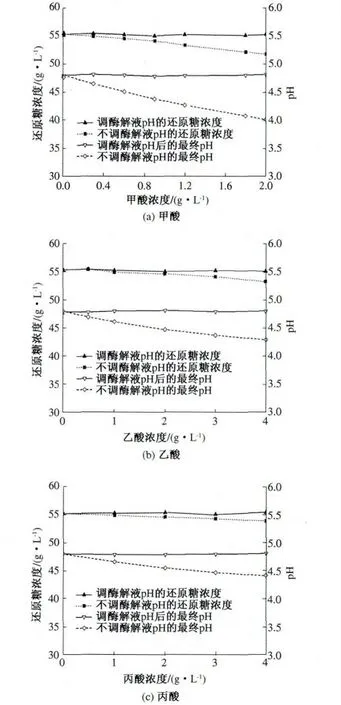
图1 不同浓度的有机酸对还原糖浓度和酶解液最终pH 的影响Fig.1 Effect of organic acid on reducing sugar concentrations and final pH values of enzymatic solution
按照上述方法加入有机酸后,再用5 mol/L氢氧化钠溶液分别调节酶解液的初始pH 值为4.8,然后进行酶解48 h,考察调节酶解液的pH 值后3种酸对酶解糖化效率的影响,结果如图1 所示.
由图1 可以看出,甲酸、乙酸和丙酸对酶解的影响表现出相似的规律.随着酸浓度的增加,酶解液的pH 值逐渐降低,酶解48 h 后所得的还原糖浓度也呈下降趋势.当加入甲酸、乙酸,丙酸的浓度均为2 g/L 时,酶解液的pH 值分别为4. 01,4.47和4.55,所对应的还原糖浓度分别为51.7,54.6,54.6 g/L.可以看出,添加甲酸的酶解液pH值降低较明显,强于乙酸和丙酸,而且所对应的还原糖浓度降低也比较显著,这主要是由于甲酸的酸性强于乙酸和丙酸,pH 值的改变影响了纤维素酶的活性,降低了纤维素酶的反应速率,从而使最终的还原糖浓度降低.
从图1 还可以看出,加不同量的有机酸,再将酶解液的pH 值调节为4.8 后进行酶解,得到的最终还原糖浓度与不加有机酸相比没有明显差别.因此,一定浓度的甲酸、乙酸和丙酸对酶解的影响主要是由酸度引起的,可通过调节酶解液的pH值来消除小分子有机酸对酶解糖化效率的影响.
2.2 甲酸、乙酸和丙酸对乙醇发酵的影响
经厌氧沼气发酵可去除纤维乙醇废水中80%以上的COD,但出水的COD 仍然可达3 000 mg/L 以上,其中含有未转化成沼气的甲酸、乙酸、丙酸等小分子有机酸. 废水回用过程中含有的这些有机酸会对乙醇发酵造成影响. 不同的有机酸对乙醇发酵和耗糖率的抑制作用差别很大,这是由于细胞膜具有选择性,对于不同的有机酸,其通透性是不同的.不同的酸根离子在细胞内的存在形式也有差异,对细胞内外的浓度影响也不相同.
2.2.1 甲酸对乙醇发酵的影响
按照试验方法进行发酵,发酵前向醪液中添加不同量的甲酸,使浓度分别为0,0.6,1.2,1.6,2.0,2.5,3.0 g/L,酵母接种量1%(体积分数),发酵12,24,36,48,60 h 后取样,分别测其乙醇含量和还原糖浓度,结果见图2 和图3.
甲酸是沼气发酵的一种前驱体物质,在厌氧过程中,甲酸可直接被甲烷菌利用转化成沼气.当发酵醪液中的甲酸达到一定浓度时,会对乙醇发酵产生抑制作用.从图2 和图3 可看出,随着甲酸浓度的增加,乙醇发酵受到抑制,酵母开始发酵的时间延长,与此同时耗糖速率也开始减慢.当甲酸浓度较低时,甲酸并未对乙醇发酵产生明显影响.当甲酸浓度达到1.6 g/L 时,乙醇发酵开始表现出明显的抑制现象,最终发酵液中乙醇含量与对照组相比也明显减少,与之对应的残还原糖量也在增加.当甲酸浓度达到3 g/L 时,乙醇发酵几乎被完全抑制.乙醇发酵的抑制作用主要表现在前期,酵母的数量增加慢,从而使乙醇含量低,耗糖速率慢.由此可知,甲酸对乙醇发酵的抑制浓度为1.6 g/L.
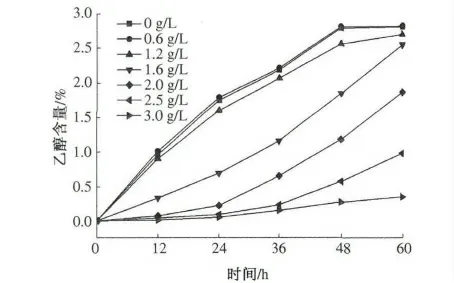
图2 不同浓度的甲酸对发酵液乙醇含量的影响Fig.2 Effect of formic acid on ethanol production at different fermentation times
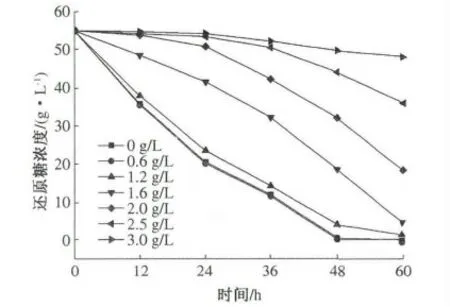
图3 不同浓度的甲酸对耗糖速率的影响Fig.3 Effect of formic acid on reducing sugar consumption
2.2.2 乙酸对乙醇发酵的影响
在发酵液中加不同量的乙酸,使其浓度分别为0,1,2,3,3.5,4,6 g/L,酵母接种量1%(体积分数),按照试验方法进行发酵,发酵12,24,36,48,60 h 后,分别测定发酵液中乙醇含量和还原糖浓度,结果见图4 和图5.
乙酸是沼气发酵中产生甲烷的主要前驱体物质,因此在厌氧发酵沼液中有少量存在.若在发酵过程中污染了乙酸菌,也会产生乙酸.从图4 和图5 可以看出,当乙酸浓度较低时,乙酸不仅不会对酵母发酵产生抑制作用,相反还会促进发酵.在乙酸浓度为1 g/L 时,发酵60 h 后乙醇含量与对照组相比略有提高,这可能是由于乙酸浓度较低时,酵母可以利用低浓度的乙酸作为碳源进行发酵产乙醇. 当乙酸达到3 g/L 时,将会抑制酵母的生长,主要表现在发酵的前期,酵母的数量与对照组相比增加较慢,但酵母仍保持自身的活性,与此同时发酵液中的耗糖速率也较慢,发酵结束后,添加组与对照组相比乙醇含量略有降低. 随着乙酸浓度继续增加,当乙酸浓度达到6 g/L 时,乙醇发酵几乎被完全抑制,糖几乎不被消耗.由此可知,乙酸对乙醇发酵的抑制浓度为3 g/L.
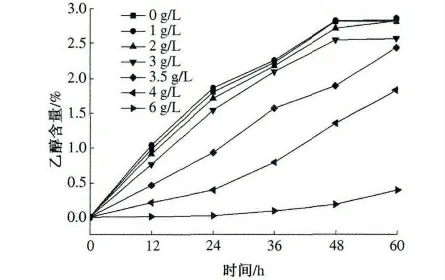
图4 不同浓度的乙酸对发酵液乙醇含量的影响Fig.4 Effect of acetic acid on ethanol production at different fermentation time
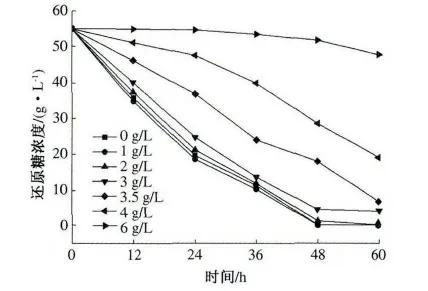
图5 不同浓度的乙酸对耗糖速率的影响Fig.5 Effect of acetic acid on reducing sugar consumption
2.2.3 丙酸对乙醇发酵的影响
在发酵液中加入同量的丙酸,使其浓度分别为0,1,2,3,3.5,4,5 g/L,酵母接种量1%(体积分数),按照试验方法进行发酵,发酵12,24,36,48,60 h 后取样,分别测定其乙醇含量和还原糖浓度,结果见图6 和图7.
丙酸是沼气发酵中一个重要的中间产物,与其他中间产物相比,丙酸转化甲烷的速率是最慢的,而且它也是沼气发酵的限制性物质,若发酵条件的控制不当,易造成丙酸型发酵.从图6 和图7 可以看出,当丙酸浓度低于2 g/L 时,与对照组相比,丙酸对乙醇发酵和耗糖速率没有明显的差别.丙酸浓度高于3 g/L 时,乙醇的发酵开始表现出明显的抑制现象,酵母的生长也受到了抑制,耗糖速率也开始减慢.随着丙酸浓度的增加,丙酸对乙醇发酵的抑制作用越来越强烈,当丙酸浓度为5 g/L 时,乙醇发酵抑制率可达80%. 由此可知,丙酸对乙醇发酵和耗糖的抑制浓度为3 g/L.
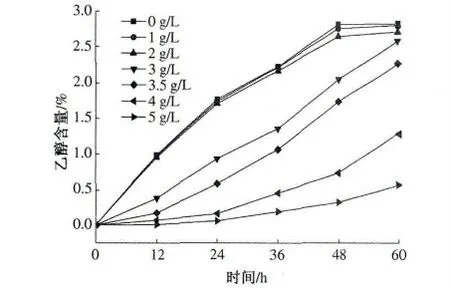
图6 不同浓度的丙酸对乙醇含量的影响Fig.6 Effect of propanoic acid on ethanol production at different fermentation time
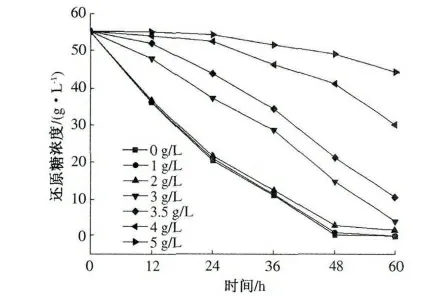
图7 不同浓度的丙酸对耗糖速率的影响Fig.7 Effect of propanoic acid on reducing sugar consumption
2.2.4 有机酸对乙醇发酵的抑制机理[12]
由于酵母细胞内的pH 值接近中性,未解离的有机弱酸通过扩散的方式穿过细胞膜进入细胞质内,在胞内不断地发生解离,造成了胞内质子浓度的不断增加,破坏了胞内质子梯度,使得膜电位降低.为了维持胞内pH 值在最佳的代谢范围,细胞必需依靠ATP 产生能量将质子运出胞外以维持细胞内中性环境.由于细胞内能量的大量消耗,又不能及时得到补充,使得必需的酶、辅酶和营养物质缺乏,就会对细胞代谢速率和原料利用速率产生抑制作用,从而影响了酵母发酵过程.
3 结论
构建纤维乙醇厌氧发酵-沼液资源化处理回用耦联工艺系统为消除纤维乙醇废水污染隐患指明了方向.笔者对纤维乙醇废水回用中的关键问题进行了研究,主要考察了甲酸、乙酸和丙酸对纤维素酶解和乙醇发酵的影响规律. 结果表明:甲酸、乙酸和丙酸对纤维素酶解反应的影响主要是酸度的影响,可以通过调节酶解液的初始pH 值而消除.甲酸对乙醇发酵产生抑制的有效抑制浓度为1.6 g/L,乙酸和丙酸对乙醇发酵产生抑制的有效抑制浓度均为3 g/L.小分子有机酸是厌氧发酵生产沼气的重要底物,也是厌氧发酵的中间产物,因此,控制厌氧沼气发酵的稳定运行以及降低沼液中残留的甲酸、乙酸和丙酸的量,是实现纤维乙醇废水回用的重要前提.
[1] ZHANG Chengming,MAO Zhonggui. Effective ethanol production by reutilizing waste distillage anaerobic digestion effluent in an integrated fermentation process coupled with both ethanol and methane fermentations[J].Bioprocess Biosystem Engineering,2010,33(9):1067 -1075.
[2] TAO L,ADEN A,ELANDER R T,et al. Process and technoeconomic analysis of leading pretreatment technologies for lignocellulosic ethanol production using switchgrass[J]. Bioresource Technology 2011,102(24):11105 -11114.
[3] YU Menghui,LI Jihong,LI Shizhong,et al. A cost-effective integrated process to convert solid-state fermented sweet sorghum bagasse into cellulosic ethanol[J].Applied Energy,2014,115:331 -336.
[4] 方诩,秦玉琪,李雪芝,等. 纤维素酶与木质纤维素生物降解转化的研究进展[J]. 生物工程学报,2010,26(7):864 -869.
[5] ELLISTON A,COLLINS S R A,WILSON D R,et al.High concentrations of cellulosic ethanol achieved by fed batch semi simultaneous saccharification and fermentation of waste-paper[J]. Bioresource Technology,2013,134:117 -126.
[6] RAMCHANDRAN D,RAJAGOPALAN N,STRATHMANN T J,et al.Use of treated effluent water in ethanol production from cellulose[J].Biomass And Bioenergy,2013,56:22 -28.
[7] ZHANG Chengming,DU Fengguang,WANG Xin,et al.Effect of propanoic acid on ethanol fermentation by saccharomyces cerevisiae in an ethanol-methane coupled fermentation process[J].Biotechnology And Bioengineering,2012,20(5):942 -949.
[8] BIALAS W,SZYMANOWSKA D,GRAJEK W. Fuel ethanol production from granular corn starch using Saccharomyces cerevisiae in a long term repeated SSF process with full stillage recycling [J]. Bioresource Technology,2010,101(9):3126 -3131.
[9] 肖冬光,姚文娟,李于. 酒精废液回用理论的探讨[J].酿酒科技,2001(6):76 -78
[10]郑超,马晓建,郜晋楠.纤维乙醇废水处理研究进展[J].湖北农业科学,2013,52(9):1988 -1991.
[11]王福荣.酿酒分析与检测[M].北京:化学工业出版社,2005:213 -249.
[12]OLIVA J M,NERO M J,SAEZ F,et al. Effects of acetic acid,furfural and catechol combinations on ethanol fermentation of kluyv eromyces marxianus[J]. Process Biochemistry,2006,41:1223 -1228.
