四溴双酚A对7种海洋微藻的急性毒性❋
2015-03-18邓结平潘鲁青
邓结平, 李 赟, 潘鲁青
(中国海洋大学海水养殖教育部重点实验室, 山东 青岛 266003)
四溴双酚A对7种海洋微藻的急性毒性❋
邓结平, 李 赟❋❋, 潘鲁青
(中国海洋大学海水养殖教育部重点实验室, 山东 青岛 266003)
本文研究了四溴双酚A(TBBPA)对7种海洋微藻(微拟球藻、塔胞藻、亚心形扁藻、牟氏角毛藻、三角褐指藻、湛江等鞭金藻、等鞭金藻塔溪堤品系)的急性毒性。分析了不同质量浓度TBBPA暴露下7种微藻的相对生长率、抑制率,结果显示,7种海洋微藻对TBBPA的敏感性不同,存在明显的时间—剂量效应。采用概率单位—浓度对数法得到TBBPA对牟氏角毛藻、微拟球藻、等鞭金藻塔溪堤品系、湛江等鞭金藻、塔胞藻的96h半效应浓度分别为2.59、2.64、4.23、4.35和6.71mg·L-1,均属于高毒性。同时发现牟氏角毛藻在2.44mg·L-1的TBBPA作用下96h抑制率为54.72%,微拟球藻在3.456mg·L-1的TBBPA作用下96h抑制率为70.27%,等鞭金藻塔溪堤品系在6mg·L-1的TBBPA作用下96h抑制率为76.64%,湛江等鞭金藻在2.83mg·L-1的TBBPA作用下96h抑制率为39.24%,塔胞藻在9.83mg·L-1的TBBPA作用下96h抑制率为54.21%,三角褐指藻在浓度为9.83mg·L-1的TBBPA作用下96h抑制率为22.84%,亚心形扁藻在浓度14.6mg·L-1的TBBPA作用下96h抑制率仅为14.11%。结果显示,微拟球藻和牟氏角毛藻对TBBPA最敏感,可以作为潜在的生物指示物。
四溴双酚A;海洋微藻;急性毒性;96h半效应浓度
四溴双酚A(Ietrabromobisphenol A,TBBPA)是目前世界上使用最广泛、全球产量最大的溴系阻燃剂之一[1],在四溴双酚A生产、应用过程中,未结合的TBBPA常会释放到环境中并聚集在生态系统中[2-3]。目前,TBBPA在空气、土壤、底泥、水生生物体内,甚至在人体血液及母乳中均已被检测到[3-5]。有关研究表明,TBBPA具有神经毒性[6]、免疫毒性[7]、肾毒性[8]和肝毒性[9-10]。由于它的化学结构与甲状腺激素结构相似,可能是一种潜在的内分泌干扰物。
微藻是水域生态系统中的主要初级生产者,其种类的多样性及初级生产量直接影响水生生态系统的结构、功能以及生态系统的稳定和平衡。目前,有关TBBPA对海洋微藻毒性影响的研究仅涉及小球藻[14]、四尾栅藻[12-13]和中肋骨条藻[11]等少数几种,关于其对微藻的毒性效应和对生态系统的影响的报道还较少。本文研究TBBPA对7种海洋微藻的急性毒性并求得其96h EC50,以期反映不同种类微藻对TBBPA的耐受性,为筛选微藻作为TBBPA生物指示物和开展TBBPA的生态安全评估提供依据。
1 材料与方法
1.1 微藻及其培养
本实验所用藻种分别为微拟球藻(Nannochloropsisoculata)、塔胞藻(Pyramimonassp.)、亚心形扁藻(Platymonassubcordiformis)、牟氏角毛藻(Chaetocerosmuelleri)、三角褐指藻(Phaeodactylumtricornutum)、湛江等鞭金藻(Isochrysiszhanjiangensis)和等鞭金藻塔溪堤品系(TahitianIsochrysisgalbana),这7种微藻均来自中国海洋大学微藻种质库。
将生长至指数生长期的微藻用于实验。7种微藻均采用常规f/2培养基[15]培养(硅藻培养时需加入硅酸盐),实验海水为青岛近海自然海水。250mL培养瓶中培养体积为100mL,置于光照培养箱,温度为(24±2)℃,光照强度为50μmol/(m2·s),明暗周期为12h∶12h。实验期间保持所有实验瓶受光均匀,并每天定时摇瓶3次。
1.2 TBBPA浓度设置
实验所用TBBPA购于Sigma公司,纯品为白色粉末。首先将TBBPA溶于二甲基亚砜(Dimethyl sulfoxide,DMSO)配成TBBPA母液,随后根据实验需要配制成不同浓度的工作液。在微藻培养液中加入一定体积的工作液用于实验,基于预实验结果和《新化学物质危害评估导则》(HJ/T 154-2004),并根据程树培[16]的等对数间距法分别设置7种海洋微藻的5个梯度的TBBPA实验浓度(见表1),实验组培养液中的DMSO浓度均小于0.01%,每组设3个平行。同时设置一组只含有DMSO无TBBPA的助溶剂对照组和一组既无DMSO也无TBBPA的空白对照组。

表1 TBBPA浓度设置Table 1 Concentration set of TBBPA
1.3 藻细胞计数及TBBPA毒性分析
在培养基中接种微藻后,在0、24、48、72和96h取样,在光学显微镜下用血球计数板统计藻细胞的数目。根据各处理组不同培养时间的细胞密度,按照国际经合组织(OECD)规定的藻类生长阻抑制标准方法计算藻类细胞生长速率μ,
μt=(lnNn-lnN1)/(tn-t1),
式中:μt为t时间(d)的生长速率;N1为t1时刻的细胞数(细胞起始数量);Nn为tn时刻的细胞数。
TBBPA对微藻的毒性通过计算生长抑制率I(%)和96h的EC50来反映。生长抑制率I(%)计算参照美国材料与实验协会(American Society for Testing and Materials)[17]推荐的方法。计算公式为:
I=(μc-μt)/μc×100%,
式中:μc为对照组的生长速率;μt为处理组t时间的比生长速率。96h EC50计算采用概率单位-浓度对数法,通过直线回归得到浓度效应方程;当概率单位为5时,计算96hEC50。
1.4 数据处理
处理组与对照组间各指标的差异显著性采用SPSS17.0软件进行单因素方差分析(ANOVA),显著性水平为P<0.05。
2 结果与分析
2.1 不同浓度TBBPA对7种微藻相对生长率的影响
在实验的96h内,7种海洋微藻的DMSO对照组与空白对照组之间均无显著差异(P>0.05),表明DMSO浓度小于0.01%对实验结果无影响。相比于DMSO对照组,随着处理时间的延长,不同浓度TBBPA处理组海洋微藻表现不同的生长抑制效应,如高浓度处理组,海洋微藻在48h后均受到明显抑制,并随处理时间的延长和处理浓度的加大抑制作用逐渐增强(见图1)。如微拟球藻,藻细胞数在处理24h时所有浓度组与对照组均无显著差异(P>0.05);在48h时,低浓度组(1.67和2.00mg·L-1)与DMSO对照组之间仍无显著差异(P>0.05),而高浓度组(2.40、2.88和3.46mg·L-1)与DMSO对照组均存在极显著性差异(P<0.01);到了72h后,所有TBBPA处理组与DMSO对照组均存在极显著性差异(P<0.01),结果表现出TBBPA对微藻生长存在明显的时间—剂量效应。
在实验中还发现在高浓度TBBPA处理下,微拟球藻、塔胞藻、等鞭金藻塔溪堤品系的细胞增殖被明显抑制,此时可以在三角瓶瓶底观察到白色沉淀。镜检显示高浓度处理组塔胞藻细胞膨胀、颜色暗淡,视野中存在大量的细胞破碎物,这可能是高浓度的TBBPA造成细胞过氧化程度严重,从而导致细胞膜溶解。
对7种海洋微藻的相对生长率的分析可知(见表2),在低浓度TBBPA处理下,7种微藻96h相对生长率下降均不明显,如牟氏角毛藻在1.0mg·L-1的TBBPA作用下,其相对生长率甚至略高于DMSO对照组,但无显著差异(P>0.05)。而高浓度TBBPA处理,7种海洋微藻相对生长率均比各自的DMSO对照组有不同程度的下降,如塔胞藻、等鞭金藻塔溪堤品系、微拟球藻和牟氏角毛藻处理组依次为相应对照的0.75、0.65、0.53和0.47,下降幅度较大。湛江等鞭金藻仅下降了0.29,三角褐指藻和亚心形扁藻仅下降0.17和0.07,但本实验用于处理三角褐指藻和亚心形扁藻的TBBPA处理浓度并不低,这说明TBBPA对不同种微藻生长的影响存在显著不同。

(A、B、C、D、E、F、G分别为TBBPA对微拟球藻、塔胞藻、亚心形扁藻、牟氏角毛藻、三角褐指藻、湛江等鞭金藻、等鞭金藻塔溪堤品系生长的影响。A、B、C、D、E、F、G representN.oculata、Pyramimonassp.、P.subcordiformis、C.muelleri、P.tricornutum、I.zhanjiangensisandTahitianI.galbana,respectively.)
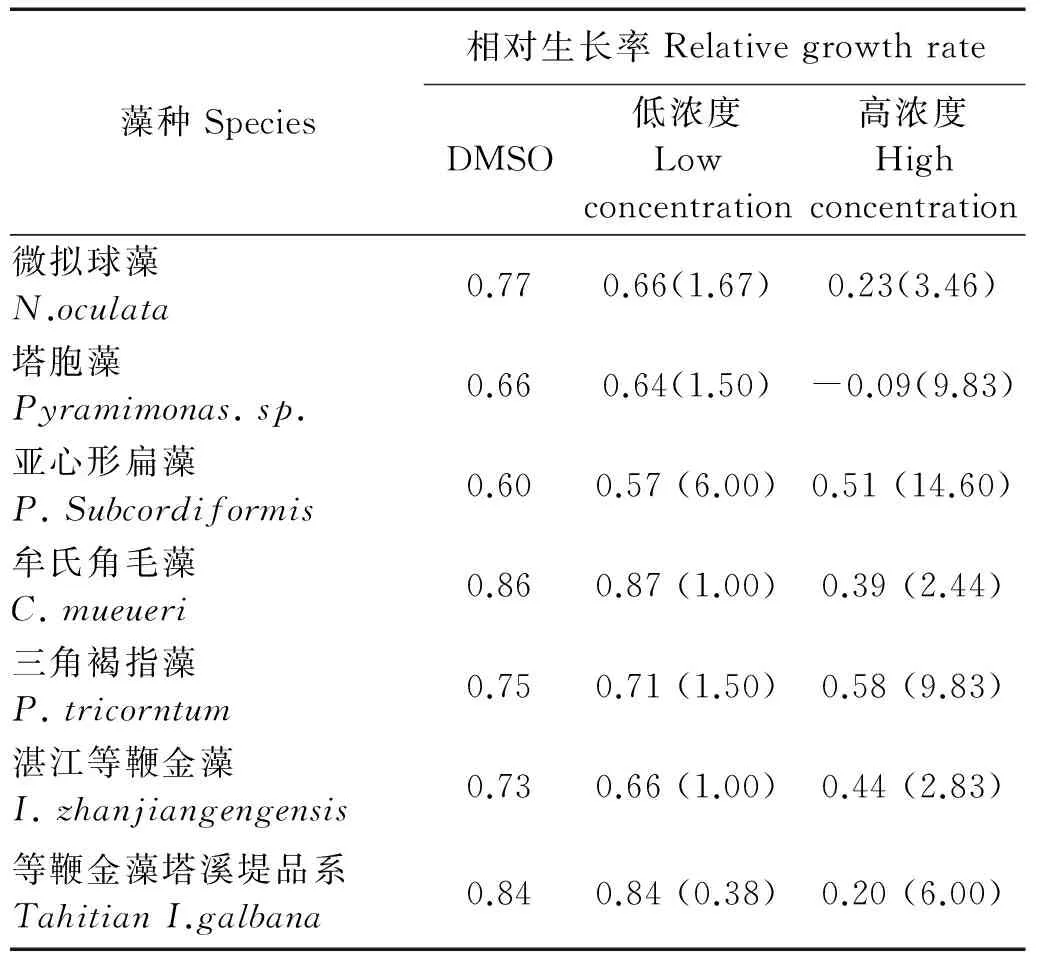
图1 TBBPA对7种海洋微藻生长的影响Fig.1 The effect of different concentrations of TBBPA on the growth of seven marine microalgae
注:括号内数字代表TBBPA浓度(mg·L-1)。
Note: stand for TBBPA concentration (mg·L-1).
2.2 不同浓度TBBPA对7种微藻抑制率的影响
进一步比较不同浓度TBBPA对7种微藻96h的抑制率,结果见表3。在低浓度TBBPA处理下,TBBPA对微拟球藻的抑制率为14.01%,对湛江等鞭金藻为10.23%,对三角褐指藻为5.08%,对亚心形扁藻为4.52%,对塔胞藻为3.69%,对等鞭金藻塔溪堤品系为0.75%,低浓度TBBPA对牟氏角毛藻有一定的刺激作用,抑制率为-1.67%。但随着处理浓度的增加,TBBPA对7种海洋微藻的抑制率逐渐增加,对塔胞藻的抑制率最高,为114.00%,表明这一处理浓度已造成部分藻细胞的死亡。对塔溪堤等鞭金藻为76.64%,对微绿球藻为70.27%,对牟氏角毛藻为54.72%,对湛江等鞭金藻为39.24%,对三角褐指藻和亚心形扁藻的抑制率仍不高,仅为22.84%和14.11%。
2.3 TBBPA对海洋微藻的96h EC50
基于7种微藻在不同浓度TBBPA处理的生长情况,计算各自的96h EC50,结果显示(见表4)。在相同的光照强度、温度、pH等条件下,TBBPA对牟氏角毛藻、微拟球藻、等鞭金藻塔溪堤品系、湛江等鞭金藻、塔胞藻的96h EC50分别为2.59、2.64、4.23、4.35和6.71mg·L-1。三角褐指藻因在TBBPA处理的最高浓度9.83mg·L-1作用下96h时抑制率仅为22.84%,亚心形扁藻在TBBPA处理的最高浓度14.6mg/L作用下96h的抑制率仅为14.11%,未计算出其96h EC50。但显然这2种微藻的96h EC50要远高于以上5种海洋微藻。

表3 7种海洋微藻抑制率Table 3 Inhibition rate of seven marine microalgae
注:括号内数字代表TBBPA浓度(mg·L-1)。
Note: stand for TBBPA concentration (mg·L-1).

表4 TBBPA对5种海洋微藻的96h EC50Table 4 96h EC50 values of TBBPA for five kinds of marine microalgae
注:x为TBBPA浓度的对数;y为抑制率的概率单位。
Note:xstand for Logarithin of TBBPA concentration;ystand for Probability unite of inhibition rate.
基于《新化学物质危害评估导则(HJ/T154-2004)》[18]中的评判标准(极高毒性:≤1mg/L,高毒性:1~10mg/L,中毒性:10~100mg/L,低毒性:≥100mg/L),TBBPA对微拟球藻、塔胞藻、牟氏角毛藻、湛江等鞭金藻、等鞭金藻塔溪堤品系均为高毒性,而对三角褐指藻和亚心形扁藻的毒性可能为中毒性。
3 讨论
据报道TBBPA对哺乳动物的毒性较低[19-20],但对藻类、软体动物、甲壳类和鱼类有很高的急性毒性[21-23]。尽管目前有关TBBPA对生物毒性方面的研究涉及到不少生物种类,但在微藻上的研究仅有四尾栅藻、小球藻和中肋骨条藻等少数几种。Walsh等[12]研究表明,TBBPA对四尾栅藻的96h EC50为1.5mg·L-1,也有研究[13]显示TBBPA对四尾栅藻的96h EC50为1.202mg·L-1。那广水等[14]研究表明,TBBPA对小球藻的96h EC50为0.0455mg·L-1。TBBPA对海洋微藻中肋骨条藻的96h EC50为0.09~0.89mg·L-1[11]。本文同时研究了TBBPA对7种海洋微藻的急性毒性,结果表明,高浓度TBBPA处理对7种微藻的生长均有一定的抑制作用,且存在明显的时间—剂量效应关系。7种海洋微藻中,牟氏角毛藻的96h EC50最小,为2.59mg·L-1,96h EC50最高的可能为亚心形扁藻,其在浓度高达14.6mg·L-1的TBBPA处理96h下,抑制率仅为14.11%。
QSAR方法研究表明,有机化合物对水生生物的毒性大小主要由两个环节所决定:一是化合物在生物体内的富集能力;二是毒性物质与受体物质发生相互作用的能力[24]。已有研究显示,绿藻门的亚心形扁藻和塔胞藻以及硅藻门的三角褐指藻和小新月菱形藻对苯并芘的耐受性较高,其96h EC50均大于1mg·L-1,而硅藻门的牟氏角毛藻及金藻门的塔溪堤等鞭金藻和湛江等鞭金藻对苯并芘非常敏感,96h EC50分别为83.06、25.18和17.00μg·L-1[25]。多氯联苯对锥状斯氏藻的96h EC50为0.103mg·L-1,而对热带骨条藻的96h EC50只有0.009mg·L-1,两者相差10倍[26]。多溴联苯醚(BDE-47)对海水小球藻的96h EC50为0.79μg·L-1,对牟氏角毛藻、中肋骨条藻和赤潮异弯藻的96h EC50分别为1.52、1.95和2.25μg·L-1[27]。相比这些污染物,本研究TBBPA对7种海洋微藻的96h EC50均在mg级,其毒性相对来说比苯并芘、多氯联苯和多溴联苯醚要低。
Kuch等[28]研究表明,德国巴登-符腾堡州某污水处理厂表层水体中TBBPA含量为0.2~20.4ng·L-1。Yang等[29]研究了巢湖水环境及沉积物中TBBPA的时空分布,发现TBBPA在湖水中的含量在7月达到最大值4.87μg·L-1,2008年3月巢湖沉积物中TBBPA含量达到最大值为518ng/g。张普青等[30]测定了巢湖中TBBPA的水平,在已监测到环境沉积物、水体样品中TBBPA含量分别为21.96~481.80ng/g和0~4.77μg·L-1,并且TBBPA含量随着水华爆发而增大。张琳等[31]在环渤海区域20个采样点水体中均检测到TBBPA存在,其含量为38.97~672.64ng·L-1。不借助DMSO等助溶剂,TBBPA在水中的溶解度大约为4.16mg·L-1(25℃)。基于已有的研究结果,目前水体中TBBPA污染水平还不足以对微藻产生明显的毒害。然而,由于低剂量TBBPA对微藻可能存在一定的刺激作用,海洋微藻长期暴露于低剂量的TBBPA是否会对海洋微藻种群结构产生影响,以及TBBPA通过食物链由微藻向高营养级传递而造成的生物放大效应、TBBPA与其他海洋污染物的联合作用效应尚不清楚。
相对于其它高等生物,单细胞微藻作为海洋生态系统初级生产者,对海洋生态环境的变化更为敏感。而微拟球藻和牟氏角毛藻是本实验中对TBBPA最敏感的2种海洋微藻,可以作为海洋环境中TBBPA检测的潜在生物指示物。但传统的急性毒性实验的96h EC50只能在细胞层面上对TBBPA毒性进行评价,有必要在生理生化和基因表达层面对TBBPA毒性进一步评价。
[1] Alaee M, Arias P, Sjödin A, et al. An overview of commercially used brominated flame retardants, their applications, their use patterns in different countries/regions and possible modes of release [J]. Environment International, 2003, 29(6): 683-689.
[2] Sjödin A, Patterson Jr D G, Bergman Å. A review on human exposure to brominated flame retardants—particularly polybrominated diphenyl ethers [J]. Environment International, 2003, 29(6): 829-839.
[3] Morris S, Allchin C R, Zegers B N, et al. Distribution and fate of HBCD and TBBPA brominated flame retardants in North Sea estuaries and aquatic food webs [J]. Environmental Science & Technology, 2004, 38(21): 5497-5504.
[4] Jakobsson K, Thuresson K, Rylander L, et al. Exposure to polybrominated diphenyl ethers and tetrabromobisphenol A among computer technicians [J]. Chemosphere, 2002, 46(5): 709-716.
[5] 薛银刚, 王晓蓉, 顾雪元, 等. 四溴双酚A对赤子爱胜蚓的急性毒性及抗氧化防御系统酶的影响 [J]. 生态毒理学报, 2009, 4(1): 93-100.
[6] Mariussen E, Fonnum F. The effect of brominated flame retardants on neurotransmitter uptake into rat brain synaptosomes and vesicles [J]. Neurochemistry International, 2003, 43(4): 533-542.
[7] Pullen S, Boecker R, Tiegs G. The flame retardants tetrabromobisphenol A and tetrabromobisphenol A-bisallylether suppress the induction of interleukin-2 receptor α chain (CD25) in murine splenocytes [J]. Toxicology, 2003, 184(1): 11-22.
[8] Fukuda N, Ito Y, Yamaguchi M, et al. Unexpected nephrotoxicity induced by tetrabromobisphenol A in newborn rats [J]. Toxicology Letters, 2004, 150(2): 145-155.
[9] Szymańska J A, Piotrowski J K, Frydrych B. Hepatotoxicity of tetrabromobisphenol-A: effects of repeated dosage in rats [J]. Toxicology, 1999, 142(2): 87-95.
[10] Ronisz D, Farmen Finne E, Karlsson H, et al. Effects of the brominated flame retardants hexabromocyclododecane (HBCDD), and tetrabromobisphenol A (TBBPA), on hepatic enzymes and other biomarkers in juvenile rainbow trout and feral eelpout [J]. Aquatic Toxicology, 2004, 69(3): 229-245.
[11] WHO/IPCS. Environmental Health Criteria 172. Tetrabromobisphenol A and Derivatives [M]. Geneva, Switzerland: World Health Organization, 1995.
[12] Walsh G E, Yoder M J, McLaughlin L L, et al. Responses of marine unicellular algae to brominated organic compounds in six growth media [J]. Ecotoxicology and Environmental Safety, 1987, 14(3): 215-222.
[13] Yang S, Yan Z, Xu F, et al. Development of freshwater aquatic life criteria for Tetrabromobisphenol A in China [J]. Environmental Pollution, 2012, 169: 59-63.
[14] 那广水, 陈彤, 张月梅, 等. 己烯雌酚与四溴双酚A对小球藻生长效应的影响 [J]. 生态毒理学报, 2010, 5(3): 375-381.
[15] Guillard R R L, Ryther J H. Studies of marine planktonic diatoms. I. Cyclotella nana Hustedt and Detonula confervacea Cleve [J]. Can J Microbiol, 1962, 8: 229-239.
[16] 程树培. 环境生物技术实验指南 [M]. 南京: 南京大学出版社, 1995: 212-213.
[17] ASTM. Standard guide for conducting static toxicity tests with microalgae ASTM E 1218-04el [S]. USA: ASTM, 2004.
[18] 国家环境保护总局. 新化学物质危害评估导测, 中华人民共和国环境保护行业标准HJ/154-2004 [S]. 北京: 中国环境科学出版社, 2004.
[19] Darnerud P O. Toxic effects of brominated flame retardants in man and in wildlife [J]. Environment International, 2003, 29(6): 841-853.
[20] Wit C A. An overview of brominated flame retardants in the environment [J]. Chemosphere, 2002, 46(5): 583-624.
[21] 薛银刚, 王晓蓉, 顾雪元, 等. 四溴双酚A对赤子爱胜蚓的急性毒性及抗氧化防御系统酶的影响 [J]. 生态毒理学报, 2009, 4(1): 93-100.
[22] 彭浩, 金军, 王英, 等. 四溴双酚A及其环境问题 [J]. 环境与健康杂志, 2006, 23(6): 571-573.
[23] Laura Canesi, Lucia Cecilia Lorusso, Caterina Ciacci, et al. Effects of the brominated flame retardant tetrabromobisphenol A ( TBBPA ) on cell signaling and function of Mytilus hemocytes: Involvement of MAP kinases and protein kinase C [J]. Aquatic Toxicology, 2005, 75(3): 277-287.
[24] Lu G H, Yuan X, Zhao Y H. QSAR study on the toxicity of substituted benzenes to the algae [J]. Chemosphere, 2001, 44(3): 437-440.
[25] 沈忱, 李赟, 潘鲁青. 苯并[α]芘对海洋微藻生长及细胞特征的影响 [J]. 海洋环境科学, 2012, 31(4): 510-514.
[26] 方浩, 吕颂辉, 马方方, 等. 多氯联苯对2种微藻的急性毒性研究 [J]. 安徽农业科学, 2011, 38(15): 9147-9150.
[27] 李卓娜, 孟范平, 赵顺顺, 等. 2, 2′, 4, 4′-四溴联苯醚(BDE-47)对4种海洋微藻的急性毒性 [J]. 生态毒理学报, 2009, 4(3): 435-439.
[28] Kuch B, Hagenmaier H, Korner W. Determination of brominated flame retardants in sewage sludges and sediments in South-West Germany [C].//BERTRAM K. 11th Annual European Society of Environmental Toxicology and Chemistry Meeting, 2001. Madrid: ISWA
[29] Yang Y S, Wang S, Liu H, et al. Tetrabromobisphenol A: tissue distribution in fish, and seasonal variation in water and sediment of Lake Chaohu, China [J]. Environmental Science and Pollution Research, 2012, 19(9): 4090-4096.
[30] 张普青, 李玉文, 李敬瑶, 等. 巢湖沉积物及水体中四溴双酚 A 浓度分布及时空分布特征 [J]. 内蒙古科技与经济, 2011, 5(31): 51-55.
[31] 张琳, 云霞, 那广水, 等. 环境水体中四溴双酚A的HPLC-MS/MS分析方法的建立与应用 [J]. 环境工程学报, 2011, 5(5): 1077-1080.
责任编辑 朱宝象
The Acute Toxicity of TBBPA on Seven Marine Microalgae
DENG Jie-Ping, LI Yun, PAN Lu-Qing
(The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China)
The acute toxicity of TBBPA on seven marine microalgae (Nannochloropsisoculata,Pyramimonassp. ,Platymonassubcordiformis,Chaetocerosmuelleri,Phaeodactylumtricornutum,IsochrysiszhanjiangensisandTahitianIsochrysisgalbana) was determined in this study. The results showed that the sensitivity of seven marine microalgae to TBBPA was different. An obvious time-dose effect was documented. The 96h EC50ofC.muelleri,N.oculata,TahitianI.galbana,I.zhanjiangensis,Pyramimonassp. was 2.59mg·L-1, 2.64mg·L-1, 4.23mg·L-1, 4.35mg·L-1, 6.71mg·L-1, respectively, indicating that TBBPA was highly toxic to microalgae. The 96 h inhibition rate ofP.tricornutumwas 22.84% when the concentration of TBBPA was 9.83mg·L-1. The 96h inhibition rate ofP.subcordiformiswas only 14.11% when the concentration of TBBPA was 14.6 mg/L.C.muelleriandN.oculatawere the most sensitive microalgae to TBBPA, which promised to be the biological indicators of TBBPA.
tetrabromobispherol A; marine microalgae; acute toxicity; 96h EC50
国家海洋局海洋公益项目(201105013-3)资助
2013-10-15;
2014-05-14
邓结平(1989-),男,硕士生,主要从事微藻毒理学研究。E-mail:djp81312982@163.com
❋❋ 通讯作者: E-mail: sxsdlwl@ouc.edu.cn
S917
A
1672-5174(2015)02-054-06
10.16441/j.cnki.hdxb.20130377
