BMSCs在功能化自组装多肽水凝胶中定向分化神经细胞研究*
2015-03-17李鹏斌张振兴
李鹏斌, 车 彪, 张振兴, 王 凯
(长江航运总医院骨科, 湖北 武汉 430010)
BMSCs在功能化自组装多肽水凝胶中定向分化神经细胞研究*
李鹏斌, 车 彪, 张振兴, 王 凯**
(长江航运总医院骨科, 湖北 武汉 430010)
目的:探讨骨髓基质干细胞(BMSCs)在功能化自组装多肽水凝胶中定向分化为神经细胞及分化后细胞的功能特征。方法:制备功能化自组装多肽水凝胶,分别将BMSCs接种于RADA16自组装多肽水凝胶(对照组)与功能化自组装多肽水凝胶(实验组)表面,观察细胞迁移情况。用预诱导剂bFGF和EGF及定向诱导剂(SHH+RA)时序诱导,应用Nestin、MAP2、GFAP、ChAT和VAT染色,比较分化后神经样细胞的形态和功能标志的差异。结果:BMSCs在功能化自组装多肽水凝胶中共培养及诱导剂的特定组合和时序的诱导下增殖分化呈现神经元细胞样改变,MAP2阳性细胞百分率较对照组显著提高(P<0.05),GFAP阳性细胞百分率较对照组显著降低(P<0.05),且功能标志ChAT和VAT只在实验组表达。结论:BMSCs在功能化自组装多肽水凝胶中能定向诱导分化为具有功能的神经细胞。
水凝胶; 骨髓基质干细胞; 自组装多肽; 神经细胞
IKVAV(异亮氨酸-赖氨酸-缬氨酸-丙氨酸-缬氨酸)是层粘连蛋白的核心五肽活性片段,能促进神经元分化、黏附和轴突生长,抑制胶质细胞分化和黏附[1~3]。RADAl6(精氨酸-丙氨酸-天冬氨酸-丙氨酸-16)是自我互补的两亲性多肽,在水溶液中能自组装成含水量超过99%的水纳米凝胶纤维,可运输营养物质和氧气至其定植的细胞内。本研究在RADAl6的羧基末端链接 IKVAV模体合成 RADAl6-IKVAV,将RADAl6与多肽RADAl6-IKVAV混合制备自组装多肽水凝胶,并检测骨髓基质干细胞(BMSCs)在自组装多肽水凝胶中定向分化为神经细胞的潜能及功能特征。
1 材料与方法
1.1 动物与主要试剂:4周龄SD大鼠,体重约100g; BMSCs购自Cyagen公司;BMSCs培养试剂购于Gibco公司;碱性成纤维细胞生长因子(bFGF)、表皮生长因子(EGF)、维甲酸(RA)、SHH购自Sigma公司;兔抗大鼠nestin抗体、兔抗大鼠ChAT抗体、AT抗体、GFAP抗体、MAP-2抗体购自武汉博士德公司。
1.2 材料:多肽RADA16的序列为:AcN-RADARADARADARADA-CONH2,多肽RADA16-IKVAV的序列为:can-RADARADARADARADA-GG-IKVAVCONH2。将0.5%RADA16溶液与0.5%RADA16-IKVAV溶液以4∶1的体积比混合制备功能化自组装多肽溶液。
1.3 原子力显微镜检测:将0.5%功能化自组装多肽溶液超声波破碎30min,然后稀释到0.01%的工作浓度,吸取溶液10μL滴到新剥离的云母片表面,置于室温下自然干燥,用NanoscopeIV原子力显微镜进行检测。
1.4 BMSCs与水凝胶复合培养:将0.5%RADA16溶液与0.5%功能化自组装多肽溶液超声波破碎30min,然后将浓度稀释为0.25%,100uL/孔加至Transwell小室上室的聚碳酸脂膜,加入BMSCs培养基触发多肽溶液自组装,37℃孵育30min产生水凝胶。取第六代BMSCs,以200uL/孔种植于RADA16自组装多肽水凝胶(对照组)与功能化自组装多肽水凝胶(实验组)表面。(预诱导剂)各5ng/mL的bFGF和EGF、(谱系定向诱导剂)2μmoL/mL RA和15ng/mL Shh。开始每组加预诱导液,6d后改为混合诱导,每3d换一次液,18d停止诱导。
1.5 诱导细胞鉴定:不定期对诱导后的细胞分别进行神经干细胞标志物nestin和神经细胞标志物GFAP、MAP2、ChAT和 VAT的免疫组化鉴定。用 Hoechst33342对细胞核进行染色,用激光共聚焦扫描显微镜进行观察,计数抗原阳性细胞数和Hoechst33342染色阳性的正常细胞的胞核数,计算阳性细胞在总细胞数中所占的比例。
1.6 统计学方法:采用SigmaPlot12.0软件进行统计学分析。实验组和对照组间比较采用t检验。P<0.05认为差异具有统计学意义。
2 结果
2.1 功能化纳米水凝胶纤维原子力显微镜检测结果:多肽RADA16与多肽RADA16-IKVAV混合自组装形成多肽水凝胶(图1A),通过原子力显微镜下观察功能化自组装多肽水凝胶由纳米纤维交织形成立体网状结构,纤维直径为20~30nm,长度可达数百纳米(图1B)。
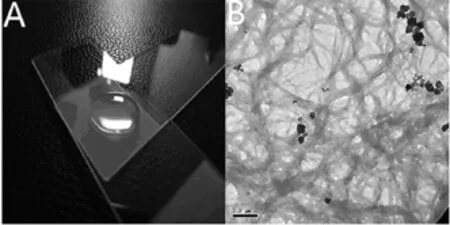
图1 多肽水凝胶和功能化纳米水凝胶纤维结构
2.2 BMSCs分化为神经元的形态变化:接种后细胞数量较多,突起较长,并交织成网状结构,加预诱导液6d细胞增值迅速,6d后加入诱导剂后细胞间隙增宽,可见细胞突起伸长,细胞间可形成连接,10d后实验组可见神经干细胞球状形态减少,出现花瓣状形态(图2A),神经细胞数量逐渐增多,细胞的多个突起发出分支,实验组细胞的变化明显高于对照组(图2B),16d后细胞转化达到峰值,形态稳定,呈典型的神经细胞形态,对照组表现不明显。
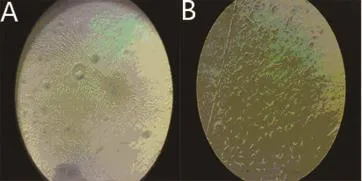
图2 神经干细胞和神经细胞形态
2.3 神经元细胞免疫组化鉴定:预诱导4d开始出现nestin表达阳性,中期6~12d加诱导剂后nestin阳性细胞开始减少,实验组明显多于对照组,发绿色荧光(13.014±3.124)%(图3A),神经细胞标志在实验组与对照组增多,实验组为MAP2(59.171±1.839)%(图3B)和GFAP(22.103±1.034)%(图3C),对照组为MAP2(29.354±4.845)%和GFAP(36.354±4.846)%,表明BMSCs向神经细胞分化,ChAT只在实验组绿色荧光分布以胞核核膜为主的阳性细胞出现,比例为(42.356±3.741)%(图 3D)。12~18d后,实验组MAP2(72.536±1.018)%、GFAP(21.536±1.018)%,明显高于对照组MAP2(31.016±2.371)%和GFAP(23.451±3.735)%,ChAT开始分布在胞核周围,随细胞突起增长,向突起中延伸,并实验组出现VAT红色荧光的阳性细胞,且细胞阳性率为 ChAT(45.112±3.044)%、VAT(28.223±1.716)%(图3E),对照组为阴性。

图3 神经元细胞免疫荧光
3 讨 论
多肽分子源于自然界,其结构简单、无毒副反应及免疫反应,具有好的生物相容性,张曙光等[4]首次从酵母蛋白中发现了一组可自组装的离子互补型多肽,开拓了分子自组装技术的新领域,随后设计合成了可支持多种细胞三维生长的RADA16自组装多肽水凝胶[5],近几年来许多研究者通过改变多肽的氨基酸序列,已设计出了众多具有特殊功能的纳米自组装材料应用于不同的科研领域[6,7],这种多肽可根据细胞的特征改变自身序列和电荷,为细胞量身打造专用生存环境,可以模拟充盈水性液体的机体组织,为细胞的生长提供一个理想的生活环境,在调控细胞行为和功能研究方面取得了令人瞩目的研究进展。RADA16是自我互补的两亲性多肽,单元序列为([COCH3]-RADARADARADARADA-[COCH2]),由极性氨基酸(精氨酸和天冬氨酸)与非极性氨基酸(丙氨酸)交替排列,分子之间间隔的A形成疏水面,R和D形成亲水面。自组装成纳米纤维的过程成形成β折叠结构,在亲水面往复形成且补离子键组装为纳米纤维,这种多肽水凝胶支架材料在体内不会引起明显的免疫反应和炎症反应[8]。
来自层粘连蛋白的IKVAV序列具有促进神经细胞的粘附、生长及分化等功能[9],可以与神经干细胞表面的IKVAV受体LBP110发挥作用,本实验通过直接固相法在RADA16的羧基末端修饰IKVAV模体合成RADA16-IKVAV,将自组装多肽RADA16与多肽RADA16-IKVAV混合制备功能化自组装多肽水凝胶,根据各种因子在干细胞定向分化过程中的不同作用,选择了预诱导剂(bFGF和EGF)及定向诱导剂(SHH+ RA),将BMSCs与水凝胶混合培养,结果发现功能化自组装多肽水凝胶能促进BMSCs迁移,提高其向神经元分化的比例,MAP2阳性细胞百分率、功能标志ChAT和VAT阳性表达实验组明显优于对照组,表明我们设计构建的自组装多肽凝胶对骨髓基质干细胞有良好细胞相容性,特定因子合适的配伍及时序应用可以使骨髓基质干细胞在体外向胆碱能神经元分化,为临床中脊髓损伤的神经修复提供客观理论依据。
[1]阚瑞,涂来勇,杨明坤,等.神经干细胞联合体外自组装IKVAV纳米纤维凝胶移植治疗大鼠脊髓损伤[J].中华医学杂志,2013,93(21):1669~1673.
[2]Cheng TY,Chen MH,Chang WH,et al.Neural stem cells encapsulated in a functionalized self-assembling peptide hydrogel for brain tissue engineering[J].Biomaterials,2013,34 (8):2005~2016.
[3]王天瑞,马学晓,于腾波,等.人工合成IKVAV多肽对星形胶质细胞增殖和Neurocan基因表达的影响[J].脊柱外科杂志,2012,10(2):109~112.
[4]Zhang S,Holmes T,Lockshin C,et al.Spontaneous assembly of a self-complementary oligopeptide to form a stable macroscopic membrane[J].Natl Acad Sci USA,1993,90 (8):3334~3338.
[5]Zhang S.Designer self-assembling peptide nanofiber scaffolds for study of 3-D cell biology and beyond[J].Adv Cancer Res,2008,99:335~362.
[6]刘茜,王秀梅.自组装多肽纳米纤维水凝胶在细胞三维培养中的应用及特征[J].中国组织工程研究,2014,(12): 1907~1913.
[7]赵刚,李京玲,王丹等.新型自组装水凝胶NBD/RADA16可促进前成骨细胞的分化[J].中国组织工程研究,2014,(21):3329~3333.
[8]郝少飞.新型多肽RADA16-P24-PLGA共聚物体内诱导成骨的研究[D].华中科技大学,2013.
[9]刘宁,郭海龙,盛伟斌,等.神经干细胞-多肽自组装凝胶复合体移植治疗脊髓损伤[J].中华实验外科杂志,2011,28(11):1961~1963.
Directed Differentiation of Bone Marrow Stromal Cells in the Functional Differentiation of Self-assembling Peptide Hydrogel
LI Pengbin, CHE Biao, ZHANG Zhenxing, et al
(General Hospital of the Yangtze River Shipping,Hubei Wuhan430010,China)
Objective:To investigate the potential and differentiation of bone marrow stromal cells which in functional self-assembling peptide hydrogel after directed differentiation for neural cells functional characteristics.Method:The functionalized self-assembling peptide was produced by mixing the self-assembling peptide RADA16 and peptide RADA16-IKVAV.BMSCs were seeded into RADA16 self-assembling peptide hydrogel(control group)and functionalized self-assembling peptide hydrogel(experimental group)surface.Pre-inducing agents with bFGF and EGF and directed inducers(SHH+RA)induced timing,application Nestin,after MAP2,GFAP,ChAT,VAT immunofluorescence staining to detect morphological and functional differentiation of neural-like cells mark.Result:By inducing BMSCs in functional self-assembling peptide hydrogel culture and inducers communist specific combination and timing of the proliferation and differentiation of neuronal cells exhibit like change,MAP2-positive cells was significantly increased compared with the control group(P<0.05),GFAP-positive cells the percentage was significantly lower than the control group(P<0.05),and the feature flag ChAT,VAT expressed only in the experimental group.Conclusion:BMSCs in the function of self-assembling peptide hydrogels can be induced into neural cells have certain features.
Hydrogel; Bone marrow stromal cells; Self-assembling peptide; Neural cell
A
10.3969/j.issn.1006-6233.2015.04.004
1006-6233(2015)04-0539-04
交通运输部长江航务管理局科技项目基金,(编号:201210010)
** 通讯作者
