HSP70在先天性白内障小鼠晶状体上皮细胞中的表达及意义
2015-03-17蔡小军李朝辉余爱华
王 萍,蔡小军,朱 怡,熊 期,张 菁,李朝辉,余爱华
(武汉大学中南医院,湖北 武汉 430071)
论 著
HSP70在先天性白内障小鼠晶状体上皮细胞中的表达及意义
王 萍,蔡小军,朱 怡,熊 期,张 菁,李朝辉,余爱华
(武汉大学中南医院,湖北 武汉 430071)

目的 探讨热休克蛋白(heat shock protein, HSP)70在先天性白内障小鼠模型晶状体上皮细胞中的表达及意义。方法 先天性白内障BALB/c-Cat小鼠为实验组,正常BALB/c小鼠为对照组,每组16只。将实验组与对照组均各取8只分别进行Western blot蛋白印迹法和逆转录聚合酶链反应(RT-PCR)法检测小鼠眼睛晶状体上皮细胞中HSP70及HSP70基因的表达水平,以β-actin作为内参校正,比较2组间HSP70表达的差异。结果 HSP70在小鼠晶状体上皮细胞的相对表达值实验组为0.105 0±0.041 4,对照组为0.188 7±0.023 6,2组比较差异有统计学意义(t=4.972 0,P<0.01);小鼠晶状体上皮细胞HSP70基因的相对表达值实验组为0.131 3±0.003 5,对照组为0.334 0±0.004 2,2组比较差异有统计学意义(t=37.026,P<0.01)。结论 HSP70在先天性白内障小鼠病情的发生、发展中能起一定的细胞保护作用。
先天性白内障;晶状体上皮细胞;热休克蛋白HSP70;BALB/c小鼠
先天性白内障是导致儿童失明的主要原因之一,在发达国家其发病率为1~4/10 000万,在发展中国家其发病率为5~215/10 000万,全世界有13万~20万双侧先天性白内障患者致盲,并正以每年2万~4万/年的速度递增[1]。先天性白内障能导致婴幼儿失明或弱视,其中失明儿童中有22%~30%为先天性白内障所致,已成为儿童失明的第二位原因[2]。先天性白内障是由于胚胎时期晶状体代谢发生异常而导致其自身透明度下降的疾病[3]。染色体异常为先天性白内障主要致病原因,已经发现多种基因的突变体与临床及动物实验性先天性白内障发生有关。由于蛋白质才是各种生命活动真正的执行者,基因是不能解释一切的,随着蛋白质检测技术的发展,先天性白内障的研究也将进入蛋白质的研究阶段。热休克蛋白70(heat shock protein 70,HSP70)是生物体(或离体培养细胞)在不良环境因素作用下所产生的一组具有高度保守性的应激蛋白[4],其作为ATP依赖的分子伴侣可以辅助新合成的多肽进行正确的折叠、多蛋白复合物的聚合以及蛋白质通过膜的转运,同时HSP70通过抑制应激时蛋白质分子的错误折叠,修复或降解损伤的蛋白,从而协助组织细胞的恢复,维持内环境稳定,促进细胞的生存[5]。本研究以Crygc基因突变的先天性白内障小鼠为模型,探讨HSP70在先天性白内障小鼠模型晶状体上皮细胞中的表达及其意义。
1 实验资料
1.1材料
1.1.1实验动物 先天性白内障BALB/c-Cat小鼠16只,鼠龄2~3周,雌雄不限,体质量50~100 g,购自上海斯莱克实验动物有限责任公司。正常BALB/c小鼠16只,鼠龄2~3周,雌雄不限,体质量50~100 g,购自武汉大学动物实验中心。实验前2组小鼠均进行散瞳,并进行裂隙灯检查排除角膜病及葡萄膜、玻璃体疾病。
1.1.2主要试剂及仪器 鼠抗人单克隆单体HSP70和Actin (深圳晶美生物制品公司),Westem blot检测试剂盒(美国cellsignaling公司),Trizol试剂(Invitrogen 公司),HSP70及β-actin基因引物(Invitrogen Biotechnology Co., LTD中国公司合成);PCR仪(美国PE公司),离心机(Heal Force公司 ), PCR检测系统(上海宏石医疗科技有限公司),超净工作台(苏净安泰),电泳仪(北京六一仪器厂),Tanon-1600R型凝胶成像系统(上海天能科技有限公司),裂隙灯,显微镜,显微器械。
1.2方法 购买后的小鼠环境适应时间为1周。 给予10%水合氯醛腹腔内注射(3 mg/kg),麻醉后,将小鼠颈椎脱臼致死,在显微镜下摘除双侧眼球,并用生理盐水进行冲洗;置于冰浴中,剪除角膜、虹膜,摘出完整之晶状体,生理盐水冲洗;分离出晶状体囊膜,因单个晶状体囊膜HSP70表达含量较少且不稳定,所以将2个晶状体囊膜合并放入1.5 mL Ep冷冻管,于液氮瓶下保存。采用Western-blot蛋白印迹法检测2组小鼠眼睛晶状体囊膜上皮细胞中HSP70蛋白的表达,按照常规方法完成SDS-PAGE凝胶的灌制和分离蛋白的电转移,印迹膜片与上述的一抗及HRP标记的二抗相继孵育后,经过反复漂洗,与化学发光试剂温育,经X射线片曝光显现特异的蛋白信号,将胶片进行扫描存档,Alpha软件处理系统分析目标带的光密度值,以β-actin作为内参校正,行半定量分析。采用RT-PCR法检测2组小鼠服睛晶状体囊膜上皮细胞HSP70基因的表达,RT-PCR条件:55 ℃逆转录30 min,94 ℃预变性3 min,94 ℃持续30 s,55 ℃退火1 min,72 ℃延伸1 min,进行30个PCR循环后72 ℃ 7 min。取5 μL PCR产物进行0.8%琼脂糖电泳,以Kodak 2 000凝胶成像系统对扩增条带进行密度扫描和分析。以151 bp β-actin作为内参照,并按照下列公式计算HSP70的相对表达值:被检测基因表达值=被检测基因光密度/β-actin光密度。
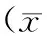
2 结 果
2.12组小鼠晶状体囊膜上皮细胞中HSP70蛋白表达情况 2组小鼠晶状体囊膜上皮细胞上HSP70蛋白均有表达,见图1。其中实验组小鼠晶状体囊膜上皮细胞中HSP70蛋白的相对表达值明显低于对照组(t=4.972 0,P<0.01),见表1。

E为实验组,C为对照组。
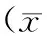
表1 2组小鼠晶状体囊膜上皮细胞中HSP70蛋白表达情况±s)
注:①与对照组比较,P<0.01。
2.22组小鼠晶状体囊膜上皮细胞中HSP70基因表达情况 HSP70基因在2组小鼠晶状体囊膜上皮细胞上的表达情况见图2,HSP70基因和内参β-actin分别扩展基因片段,1~2为对照组小鼠晶状体囊膜上皮细胞上HSP70基因的扩展产物,3~8为实验组小鼠晶状体囊膜上皮细胞上HSP70基因的扩展产物,2组小鼠晶状体囊膜上皮细胞上HSP70基因的扩展产物约为255 bp。图像分析仪测量琼脂糖凝胶上HSP70/β-actin的平均灰度,结果实验组HSP70基因相对表达值明显低于对照组(t=37.026,P<0.01),见表2。
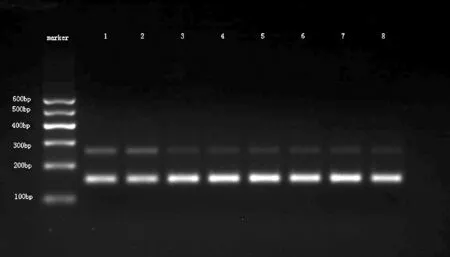
图2 2组小鼠晶状体囊膜上皮细胞中HSP70的表达情况
表2 2组小鼠晶状体囊膜上皮细胞中HSP70基因表达情况
注:①与对照组比较,P<0.01。
3 讨 论
机体在正常生理应激和病理状态下,都可激活一组基因——热休克基因,产生具有高度保守性的氨基酸序列及其编码基因所表达的蛋白质,即HSPs,以增强保护机体自身细胞免受应激因子的损伤的作用,其在原核细胞及真核细胞中均广泛存在。HSPs对生物体在严酷环境下的生存起重要作用,又名应激蛋白[6]。HSPs种类繁多,现已发现10多种,目前尚无明确的分类标准,主要的HSPs可分为4个家族,即HSP90家族(分子量为83~90 kD)、HSP70家族(分子量为66~78 kD)、HSP60以及小分子量HSP家族(分子量为12~43 kD)[7]。其中HSP70是HSP大家族中的重要成员,它在正常细胞中有基础性表达,表达水平比较低,而在应激后表达显著增高。HSP70作为主要的分子伴侣之一,在维持机体正常的生理活动中起了重要的作用。由于晶状体无血管供给营养,也没有神经支配,各种应激因子均可对其造成损害,并影响晶状体的正常代谢。当晶状体蛋白质发生变性或其结构出现异常,不溶性蛋白质或异常蛋白质会增加,透明晶状体发生混浊,导致白内障。在混浊晶状体中不可溶性蛋白质增加,可能是由于HSP70的缺乏或缺陷造成,缺氧及渗透性应激可导致晶状体蛋白的展开和分解并导致晶状体混浊,ATP和HSP帮助展开的蛋白质重新折叠,但如果这一层防御措施失效,则变性蛋白将被消化或细胞进入凋亡途径,在此过程中HSP促进其消化或凋亡[8]。Li 等[9]研究显示,HSP70可以通过抑制线粒体细胞色素C的释放及Caspase-3 的活化而抑制细胞凋亡。目前医学界对HSP70在许多组织及疾病中的作用进行了广泛的研究,国内很多学者都对HSP70在年龄相关性白内障发生发展中的作用进行了研究,结果均提示老年性白内障中HSP70含量明显高于正常对照组,推测在老年性白内障中,细胞发生氧化损伤后,诱导产生更多的HSP70,以此发挥其细胞保护、分子伴侣、调节凋亡及抗氧化等方面的重要作用[7]。最终形成的白内障则可能由于负性影响大于保护因素所致。
本实验以BALB/c-Cat小鼠为先天性白内障模型。BALB/c-Cat小鼠于2006年12月在大规模生产(BALB/C♂×ICR♀)F1代小鼠时发现,经10个世代回交,通过白内障杂合子小鼠自交,培育成先天性白内障近交系小鼠,呈常染色体显性遗传,同时将其命名为BALB/c-Cat小鼠[10]。2009年上海东华大学发现该白内障小鼠是由于Crygc基因发生突变而导致的。Crygc基因是小鼠γ-C晶状体蛋白的编码基因,γ-C晶状体蛋白是晶状体的重要结构蛋白。Crygc基因位于小鼠1号染色体的D1Mit236和D1Mit19之间约11 cM内,BALB/c-Cat小鼠Crygc亚基第3个外显子的209 bp处缺失一个碱基。该突变在Crygc亚基第3外显子的76位引入终止密码子,使正常蛋白质丢失了15个氨基酸,第二结构域中的保守区被破坏、变短,形成截短蛋白,保守序列对维持蛋白质的结构和功能是相当重要的,变短则影响了晶状体蛋白的功能,导致蛋白结构不稳定,突变后缩短的γ-C晶状体蛋白可能失去与其他分子间正常的相互作用,或导致本身的不溶解性[11]。在蛋白质三维结构分析中,突变型蛋白的C-末端缺失一个β-折叠。β-折叠结构也是蛋白质构象中经常存在的一种结构方式,对于晶状体而言,β-折叠有利于其形成球状的结构,因此当其失去时,多肽链空间的伸张失去平衡,正是由于γ-C晶状体蛋白的结构和功能发生了改变,导致晶状体内发生了上述一系列的改变,引发白内障[11]。
本实验结果显示HSP70和HSP70基因在先天性白内障小鼠和正常小鼠的晶状体上皮细胞中均有表达,且先天性白内障小鼠的表达均低于正常小鼠,推测HSP70在先天性白内障小鼠的晶状体上皮细胞中表达减少,可能对白内障的形成起到一定的作用。其机制可能是Crygc基因突变后,机体产生一定的应激反应,HSP70应保护细胞应对这一反应。而缺失的HSP70导致细胞或生物从各种应激中恢复的能力下降,降低了细胞对损害的耐受程度,从而不能有效地保护它们免遭这些应激因素的损害,影响了细胞正常代谢。HSP70不仅可以与新生、未折叠的正常蛋白质结合,辅助新合成的多肽链折叠,还可以与错折叠或聚集的蛋白质相结合,使某些蛋白质解离,减少不溶性聚集物的产生。同时HSP70的缺失导致机体不能将某些变性蛋白及时降解和清除,并且延缓了正常蛋白质合成的恢复。Crygc基因突变后,γ-C晶状体蛋白缩短,HSP70的缺失使其不能帮助γ-C晶状体蛋白进行正确的折叠,影响了γ-C晶状体蛋白肽链的伸展状态,增加了γ-C晶状体蛋白的不溶解性。在这两大方面的因素的综合影响下,小鼠晶状体蛋白质发生变性,不溶性蛋白质增多,透明晶状体出现混浊,从而导致白内障发生。
本实验力求从蛋白质水平对先天性白内障形成原因进行初步探讨,进一步为先天性白内障的防治工作提供新视野。随着对HSP70研究的不断深入,HSP 70在先天白内障上的应用价值也将不断被开发出来。可以把HSP70具有的抗氧化应激、分子伴侣、细胞保护作用应用到先天性白内障的防治上,这是一项值得深入探讨的课题,拥有极为广阔的前景。但本研究对HSP70在先天性白内障小鼠晶状体上皮细胞中降低的分子机制方面还不明了,将在接下来的工作中做进一步的研究与探讨。
[1] Foster A,Gilbert C,Rahi J. Epidemiology of cataract in childhood:a global perspective[J]. J Cataract Ref Surg,1997,23:601-604
[2] Gogate P,Muhit M. Blindness and cataract in children in developing countries[J]. Community Eye Health,2009,22(69):4
[3] Churchill A,Graw J. Clinical and experimental advances in congenital and paediatric cataracts. Philosophical Transactions of the Royal Society B[J]. Biolog Sci,2011,366(1568):1234-1249
[4] Vera M,Singer RH. Gene regulation:The HSP70 gene jumps when shocked[J]. Current Biology,2014,24(10):R396-R398
[5] 王宇萍,蒋建东. 热休克蛋白70的结构和功能[J]. 中国细胞生物学学报,2010,32(2):305-313
[6] Merck K,Groenen P,Voorter C,et al. Structural and functional similarities of bovine alpha-crystallin and mouse small heat-shock protein. A family of chaperones[J]. J Biolog Chemistry,1993,268(2):1046-1052[7] 尚进才,王亚洲,高岩,等. 热休克蛋白的研究进展[J]. 医学理论与实践,2010,23(5):527-529
[8] Heydari AR,Wu B,Takahashi R,et al. Expression of heat shock protein 70 is altered by age and diet at the level of transcription[J]. Molecular Cellular Biology,1993,13(5):2909-2918
[9] Li CY,Lee JS,Ko YG,et al. Heat shock protein 70 inhibits apoptosis downstream of cytochrome c release and upstream of caspase-3 activation[J]. J Biological Chemistry,2000,275(33):25665-25671
[10] 张丽青,刘韬,杨宝田,等. 遗传性 BALB/c Cat/Cat 白内障小鼠胚胎干细胞建系[EB/OL]. 北京:中国科技论文在线[2012-03-05]. http://www.paper.edu.cn/releasepaper/content/201203-165
[11] 金怡萍,燕顺生,金玫蕾,等. Rncat 先天性白内障小鼠的晶状体形态学研究[J]. 眼科新进展,2004,24(5):361-363
Expression and significance of HSP70 in congenital cataract lens epithelial cells of mice
WANG Ping, CAI Xiaojun, ZHU Yi, XIONG Qi, ZHANG Jing, LI Zhaohui, YU Aihua
(Zhongnan Hospital of Wuhan University, Wuhan 430071, Hubei, China)
Objective It is to approach the expression of heat shock protein 70 (HSP70) in lens epithelial cells (LECs) in mice model of congenital cataract and clarify the effect of HSP70 on pathogenesis of congenital cataract. Methods The lens capsule membrane in mice was chose as the research object, there was 16 cases (32 eyes) of normal BALB/c mouse in control group, and 16 cases (32 eyes) of congenital cataract BALB/c-Cat mouse in experimental group. The expression of HSP70 protein and HSP70 gene was assayed using Western blot method of protein imprinting and reverse transcription polymerase chain reaction (RT-PCR) method in the two groups of mice eye lens epithelial cells. Using β-actin as the confidential reference items for correction, the differences of HSP70 expression was compared between the two groups. Results The relative values of HSP70 expression to β-actin is 0.105 0+0.041 4 in congenital cataract LECs, while is 0.188 7+0.023 6 in normal control group, there was significant different in the expression of HSP70 between the two groups (t=4.972 0,P<0.01). The relative expression value of HSP70 gene is 0.131 3±0.003 5 in the experimental group and 0.334 0±0.004 2 in the normal group, there was significant difference between them (t=37.026,P<0.01). Conclusion HSP70 is associated with the occurrence and development of congenital cataract and it plays an important role in the cytoprotection.
congenital cataract; lens epithelial cells; heat shock protein 70, BALB/c mice
王萍,女,硕士,研究方向为白内障发生机制与治疗。
蔡小军,E-mail:xiaojuncai86@yahoo.com.cn
湖北省自然科学基金资助项目(2012FFB04324)
10.3969/j.issn.1008-8849.2015.06.001
R-332
A
1008-8849(2015)06-0571-04
2014-09-10
