氮6-环戊基腺苷对大鼠肾缺血再灌注肾细胞凋亡的影响
2015-03-17马漫漫董振明
马漫漫,王 超,董振明
(1. 河北省邯郸市中心医院,河北 邯郸 056000;2. 河北医科大学第二医院,河北 石家庄 050000)
氮6-环戊基腺苷对大鼠肾缺血再灌注肾细胞凋亡的影响
马漫漫1,王 超1,董振明2
(1. 河北省邯郸市中心医院,河北 邯郸 056000;2. 河北医科大学第二医院,河北 石家庄 050000)

目的 观察氮6-环戊基腺苷(CPA)对大鼠缺血再灌注(I/R)肾细胞凋亡的影响。方法 健康SD大鼠32只随机分成4组,每组8只。假手术组(S)组只进行手术操作,不做其他处理;I/R组肾缺血45 min再灌注24 h;C组给予CPA 1.0 mg/kg夹闭肾动脉前15 min腹腔注射,余操作同I/R组;CD组给予CPA 1.0 mg/kg和8-环戊基-1,3-二丙基黄嘌呤(DPCPX)1.0 mg/kg在夹闭肾蒂前15 min腹腔注射,余操作同I/R组。所有动物于再灌注24 h处死。肾组织制备肾脏单细胞悬液,经碘化丙啶染色后用流式细胞分析法测定肾脏细胞凋亡率。结果 I/R组、C组和CD组肾组织细胞凋亡率明显高于S组(P均<0.05),C组肾组织细胞凋亡率明显低于I/R组及CD组(P均<0.05);I/R组与CD组比较差异无统计学意义(P>0.05)。结论 CPA可抑制细胞凋亡,对大鼠肾I/R损伤有一定的保护作用。
肾;再灌注损伤;氮6-环戊基腺苷;8-环戊基-1,3-二丙基黄嘌呤;细胞凋亡
外科手术中高难度的肾脏手术如肾脏移植术、肾脏切开取石术、肾肿瘤术、肾部分切除术、血管外科的主动脉修补术需要阻断肾脏血流,血流开放时易引起缺血再灌注(I/R)损伤。氮6-环戊基腺苷(CPA)是腺苷A1受体激动剂,其对脑、心脏I/R有一定的保护作用。本实验通过建立大鼠肾I/R损伤模型,探讨CPA对大鼠肾I/R损伤的保护作用,旨在为寻找治疗肾I/R损伤的有效药物提供实验依据。
1 实验资料
1.1主要设备及试剂 流式细胞仪(河北医科大学第四医院科研中心),小动物呼吸机,小动物实验操作台,CPA购自Sigma公司,美国,8-环戊基-1,3-二丙基嘌呤(CDPCPX,Sigma公司,美国),水合氯醛。
1.2实验动物及分组 健康SD雄性大鼠32只,河北医科大学实验中心提供,体质量250~300 g,动物合格证号:1182430。随机分成假手术组(S组)、I/R组、CPA预先给药+I/R组(C组)、CPA+CDPCPX预先给药+I/R组(CD组),每组8只。
1.3实验方法 大鼠术前12 h禁食,自由饮水。腹腔注射10%水合氯醛0.3 g/kg麻醉后,做右颈内静脉穿刺置管用微量泵持续输液用。75%乙醇消毒腹部皮肤,暴露手术区域,用无菌生理盐水浸湿的纱布作为无菌单铺垫术野,沿腹正中线剪开腹部皮肤,钝性分离肌肉,打开腹腔,分离肾包膜,暴露肾脏,轻柔操作,仔细寻找、分离肾蒂,保护输尿管,用无损伤动脉夹同时夹闭两侧肾蒂,开始计时。肉眼观察肾脏的颜色由暗红色变为紫红色即可确认肾血流被阻断,造成肾脏缺血。间断夹闭腹部切口,用盐水纱布覆盖。缺血45 min后,再次打开腹腔,暴露肾脏,显露肾蒂,松开动脉夹,肾由紫红色恢复为暗红色可确认血流恢复,再灌注成功,同时开始记录再灌注时间。逐层缝合腹部正中切口,75%乙醇消毒手术切口。继续观察2 h,如果大鼠能够正常活动说明造模成功。术后大鼠置于鼠笼,保持24~29 ℃的环境,密切观察大鼠生命体征,给予正常饮食,再灌注24 h即为I/R模型。剔除松开动脉夹5 min后肾脏未变为正常红色的大鼠,术中损伤大血管或者周围组织导致造模不成功大鼠,术后观察2 h不能正常活动大鼠。
1.4观察指标 实验结束,处死大鼠,肾组织制备肾脏单细胞悬液,经碘化丙啶(propidine iodide,PI)染色后用流式细胞分析法测定肾脏组织细胞凋亡率。

2 结 果
再灌注24 h时,S组、I/R组、C组和CD组肾组织细胞凋亡率分别为(2.67±0.85)%,(15.12±1.65)%,(9.23±1.98)%和(14.17±1.42)%。肾组织细胞凋亡率I/R组、C组和CD组明显高于S组(P均<0.05),C组明显低于I/R组和CD组(P均<0.05),而I/R组与CD组比较差异无统计学意义(P>0.05)。各组流式细胞分析法测得肾组织细胞凋亡情况见图1~4。

图1 再灌注24 h时S组肾组织细胞凋亡情况
3 讨 论
肾I/R损伤是指肾缺血后,当自主循环功能恢复、组织再灌注后,缺血性损伤仍继续发展,进一步发生组织水肿及持续低灌流状态,结果使细胞继续缺血缺氧导致细胞变性和坏死,甚至发生更为严重的组织损伤或肾衰竭。肾脏为高灌注器官,对缺血及再灌注均敏感。目前一致认为缺血20~40min

图2 再灌注24 h时I/R组肾组织细胞凋亡情况

图3 再灌注24 h时C组肾组织细胞凋亡情况
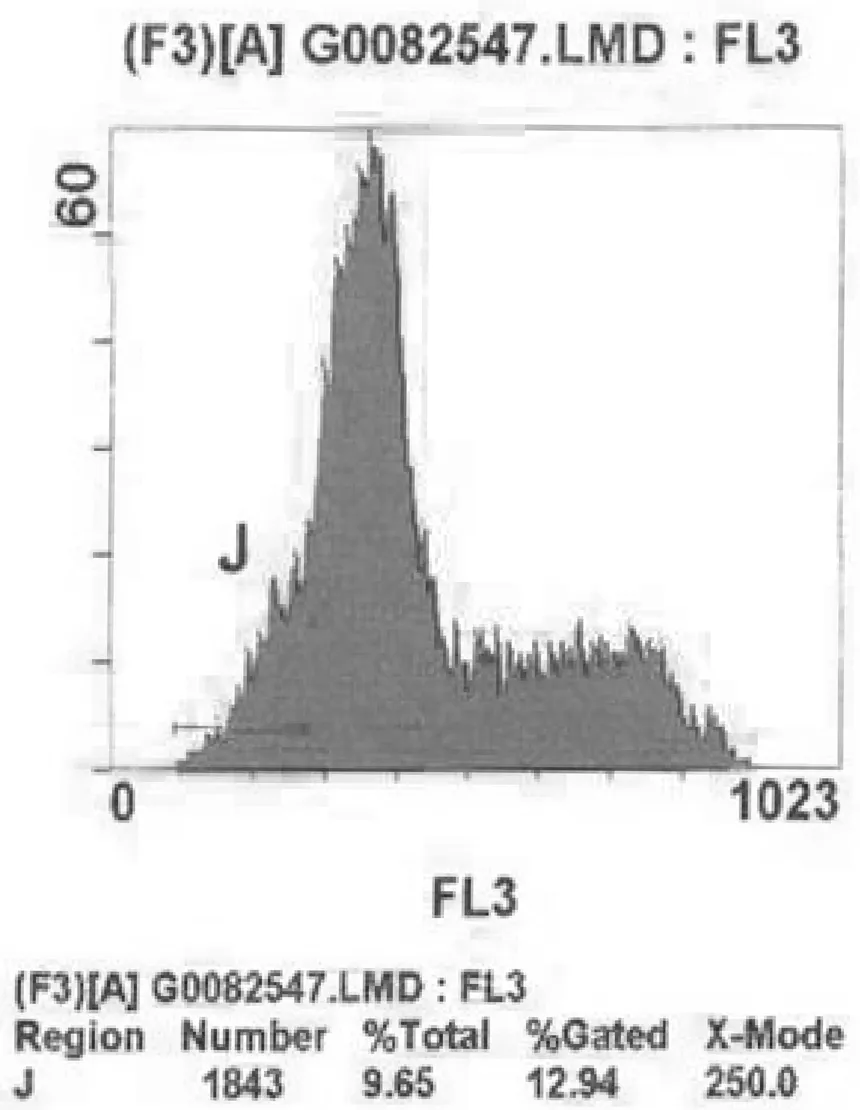
图4 再灌注24 h时CD组肾组织细胞凋亡情况
再灌注,其损伤是可逆转的;缺血40~60 min后再灌注,损伤则不可逆转。故本研究采用夹闭双侧肾蒂45 min再灌注24 h制备肾脏I/R损伤模型。
当肾组织发生急性缺血时,组织细胞的氧化磷酸化过程停止,能量迅速消耗,进一步使肾功能活动发生障碍,Na+、K+、Ca2+等离子跨膜转运受到影响,使细胞内Na+、Ca2+增多,细胞肿胀,功能逐渐丧失。另外肾缺血后ATP降解生成大量次黄嘌呤,再灌注恢复后,次黄嘌呤在黄嘌呤氧化酶的催化作用下生成黄嘌呤,从而产生大量氧自由基和羟自由基。产生的自由基可通过膜的脂质过氧化作用对肾组织造成损害,降解生物膜中的多不饱和脂肪酸,损伤细胞膜和线粒体膜的结构和功能,造成各种细胞功能障碍,这些氧自由基及羟自由基对肾近曲小管损伤最重[1]。
本研究结果显示,C组肾细胞凋亡率明显低于I/R组和CD组,表明CPA可以增加组织的抗氧化能力,降低再灌注肾组织的细胞凋亡率。Saikumar等[2]在肾损伤模型中发现,缺血能够导致以细胞凋亡为主的细胞死亡,再灌注时由于线粒体膜通透性增加,启动了Caspase家族蛋白酶,引起序列DNA酶效应,从而进一步加重细胞凋亡[3]。
近来研究证明在心肌缺血前,应用腺苷可缩小心肌坏死面积,促进再灌注时心脏功能恢复,减少心肌细胞损伤,这种作用可被选择A1受体拮抗剂所阻断[4]。在心肌缺血时,应用腺苷可促进其功能的恢复和减少心肌细胞损伤,减少ATP分解。Zhao等[5]在犬I/R模型中应用腺苷140 mg/(kg·min)治疗,结果显示 ,腺苷在再灌注时通过调节抑制凋亡蛋白Bcl-2,促进凋亡蛋白Bax的表达,同时通过减少中性粒细胞聚集,从而抑制了心肌细胞凋亡。Leesar等[6]将30例择期经皮冠状动脉腔内成形术(PTCA) 患者(不稳定型心绞痛13例,稳定型心绞痛17例,均是左前降支或回旋支的近端狭窄,狭窄>70%)随机分为腺苷组和盐水对照组,腺苷以2 mg/min的速度冠脉内注射10 min,然后行PTCA,共行3次球囊扩张,每次扩张持续2 min,球囊扩张之间间隔5 min,结果表明在冠脉左前降支行PTCA术时,腺苷对抗缺血造成的心肌损害十分有效,有效性甚至强于缺血预适应。Heidland等[7]报道,在为患者行PTCA前冠脉内注入腺苷20 mg,可以增强心肌对缺血的耐受(具体表现为耐受更长时间的球囊扩张、心电图上缺血征象减轻及胸痛减轻),并能预防缺血期间左室功能的减退。Wei等[8]将30例需行搭桥的患者分为腺苷组和对照组,每组各15例。其中腺苷组于冠脉搭桥(CABG)术前经静脉输入腺苷(开始剂量50 μg/kg,在第2分钟加量至100 μg/(kg·min),持续7 min,总量650 μg/kg),输注腺苷结束后3 min开始行体外循环。结果术后腺苷组CK生成较少,心脏指数明显改善,提示在CABG前应用腺苷对心脏有保护作用。王阳等[9]研究表明腺苷能够抑制氧自由基的生成,减轻脂质过氧化,对心肌I/R损伤有保护作用。
目前研究认为iNOS是腺苷受体激动剂预处理产生保护作用的效应酶[10],以腺苷A1受体激动剂2-氯-N6-环戊基腺苷(CCPA)预处理能触发胞内信号传递系统产生与缺血预处理相同的保护效应。Baxter等[11]根据CCPA用量分为25,50,100 μg/kg 3组,自兔耳缘静脉注射,结果对血压及心率影响均较小(P均<0.05),24 h后心肌保护程度随CCPA用量的增加而增强。李小鹰等[12]和戴成等[13]R-苯异丙基腺苷(PIA)预处理大鼠,结果同样产生心肌保护效应,如缩小心肌梗死面积和降低缺血性心律失常的发生率。提示腺苷A1受体是保护作用的腺苷受体亚型。本研究结果表明CPA能够减轻肾组织细胞凋亡,DPCPX可以阻断CPA的保护作用,CPA保护作用可能是通过激动腺苷A1受体来实现的。CPA预先给药可抑制肾组织细胞凋亡,防治肾脏I/R损伤,对大鼠肾I/R损伤有保护作用。
[1] Weight SC,Bell PR,Nicholson ML. Renal ischaemia-reperfusion injury[J]. Br J Surg,1996,83(2):162-170
[2] Saikumar P,Venkatachalam MA. Role of apoptosis in hypoxic/chemic damage in the kidney[J]. Semin Nephrol,2003,23(16):511
[3] 李冬,赵继顺,魏克伦. 胎鼠宫内缺血/再灌注损伤后细胞凋亡的分析[J]. 中国小儿急救医学,2006,13(2):123
[4] Chi HL,Adrian L,Bee CT,et al. Pretreatment with intracoronary adenosine reduces the incidence of myonecrosis after nonurgent percutameous coronary intervention:a prosepective randomized study[J]. Eur Heart J,2007,28(1):19-25
[5] Zhao ZQ,Budde JM,Morris C,et al. Adenosine attenuates reperfusion-induced apoptotic cell death by modulating expression of Bcl-2 and Bax proteins[J]. J Mol Cell Cardiol,2001,33(1):57-68
[6] Leesar MA,Stoddard M,Ahmed M,et al. Preconditioning of human myocardium with adenosine during coronary angioplasty[J]. Circulation,1997,95(11):2500-2507
[7] Heidland UE,Heintzen MP,Schwartzkopff B,et al. BE. Preconditioning during percutaneous transluminal coronary angioplasty by endogenous and exogenous a-denosine[J]. Am Heart J,2000,140(5):813-820
[8] Wei M,Kuukasjarvi P,Laurikka J. Cardioprotective effect of adenosine pretreatment in coronary artery by pass grafting[J]. Chest,2001,120(3):860-865
[9] 王阳,高明宇,李铁铮, 等. 腺苷对大鼠心肌缺血再灌注损伤保护作用的研究[J]. 中国医科大学学报,2007,36(2):145-147
[10] Zhao T,Xi L,Chelliah J,et al. Inducible nitricoxide synthase mediates delayed myocardial protection induced by activation of adenosine A1 receptors:evidence from gene-knockout mice[J]. Circulation,2000,102(8):902-907
[11] Baxter GF,Marber MS,Patel VC,et al. Adenosine receptor involvement in a delayed phase of myocardial protection 24 hours after ischemic preconditioning[J]. Circulation,1994,90(6):2993-3000
[12] 李小鹰,戴成祥,荆忱. R-苯异丙基腺苷预适应抗缺血性心律失常的第二保护窗口[J]. 中国循环杂志,2001,16(5):381
[13] 戴成,李小鹰,荆忱. 腺苷A1受体激动剂R-苯异丙基腺苷介导的大鼠心肌延迟预适应[J]. 中华老年心脑血管病杂志,2001,3(3):187
Effect of N6-cyclopentyl adenosine on the apoptosis of renal cells in rats after kidney ischemia-reperfusion
MA Manman1, WANG Chao1, DONG Zhenming2
(1. The Central Hospital of Handan, Handan 056000, Hebei, China; 2. The Second Hospital of Hebei Medical University, Shijiazhuang 050000, Hebei, China)
Objective It is to observe the effect of N6-cyclopentyl adenosine (CPA) on the apoptosis of renal cells in rats after kidney ischemia-reperfusion(I/R). Methods 32 healthy SD rats were randomly divided into 4 groups, each group had 8 rats. Sham group (S group) was operated only without other treatment, I/R group undergone kidney ischemia for 45 min and reperfusion for 24 h, C group was given CPA 1.0 mg/kg by intraperitoneal injection 15 min before renal artery blocking, and the rest operation was the same as I/R group, CD group was given CPA 1.0 mg/kg and 8-cyclopentyl-1, 3-2-propylxanthine (DPCPX) 1.0 mg/kg by intraperitoneal injection 15 min before renal artery blocking, and the rest operation was the same as I/R group. All the animals was killed in 24 h after reperfusion. Renal tissue was taken to made renal single cell suspension, and the apoptosis rate of renal cells was detected by flow cytometer after staining by propidium iodide. Results The apoptosis rates of renal cells in I/R group, C group and CD group were significantly higher than that in S group (Pall<0.05), and the rate in C group was obviously lower than that in I/R group and CD group (P<0.05). There was no significant difference in the rate between I/R group and CD group (P>0.05). Conclusion CPA can inhibit cell apoptosis, and has some protecting effect on renal I/R injury in the rats.
kidney; reperfusion injury;8-cyclopentyl-1, 3-2-propylxanthine; 8-cyclopentyl-1, 3-2-propylxanthine; cell apoptosis
马漫漫,女,主治医师,硕士研究生,主要从事临床麻醉工作。
10.3969/j.issn.1008-8849.2015.04.005
R-332
A
1008-8849(2015)04-0356-03
2014-08-20
