三七总皂苷调节哮喘小鼠气道炎症的免疫分子机制研究
2015-03-17赵文娟邢海晶袁嘉丽韩妮萍
赵文娟,陈 静,邢海晶,袁嘉丽,韩妮萍
(云南中医学院基础医学院,云南 昆明 650500)
三七总皂苷调节哮喘小鼠气道炎症的免疫分子机制研究
赵文娟,陈 静,邢海晶,袁嘉丽,韩妮萍
(云南中医学院基础医学院,云南 昆明 650500)

目的 观察三七总皂苷(PNS)对哮喘小鼠气道炎症的疗效及对免疫细胞Th1/Th2平衡的调节作用,从免疫平衡的角度寻找其作用靶点,探讨PNS防治支气管哮喘的可能作用机制。方法 将SPF级BALB/c雌性小鼠50只随机分成正常对照组、哮喘模型组及PNS低、中、高剂量组。以卵清白蛋白(OVA)腹腔注射及雾化激发法构建哮喘模型。观察小鼠肺组织病理变化,用酶联免疫吸附法(ELISA)检测各组小鼠血清中IL-4、IFN-γ的变化。结果 PNS低、中、高剂量组哮喘症状有所减轻,肺组织炎性细胞浸润减轻,且小鼠血清中IFN-γ的表达具有升高趋势,以低、中剂量组效果明显(P<0.05和P<0.01),PNS中剂量组和PNS高剂量组血清IL-4浓度明显降低(P<0.01)。结论 PNS可减轻哮喘小鼠肺组织炎性细胞浸润,减少气道上皮黏液分泌,改善气道炎症状态。PNS防治哮喘的机制之一可能是通过上调哮喘小鼠IFN-γ的分泌,抑制IL-4的分泌,进而促进Th0向Th1分化,抑制Th0向Th2分化,恢复Th1/ Th2平衡状态。
三七总皂苷;哮喘小鼠;白细胞介素-4;干扰素-γ
支气管哮喘(简称哮喘)是由多种细胞包括气道的炎性细胞和结构细胞(如嗜酸粒细胞、肥大细胞、T淋巴细胞、中性粒细胞、平滑肌细胞、气道上皮细胞等)和细胞组分(cellular elements)参与的气道慢性炎症性疾病[1]。目前全球哮喘患者约3亿人,中国哮喘患者约3 000万,随着空气污染等环境问题的日益严重以及饮食结构、生活方式的变化,哮喘发病率仍在逐年增高。支气管哮喘的病因和发病机制并未完全阐明,但已证实炎症-免疫反应是哮喘发生的关键机制之一,气道炎症反应、气道高反应性和气道重塑3个基本病变贯穿哮喘整个病变过程。免疫细胞CD4+Th亚群形成的Th1/Th2平衡的失调是哮喘发生发展的关键原因之一,促进Th分化的细胞因子以及Th亚群效应因子在肺组织局部和全身水平的变化,是导致失衡机制的基本因素[2]。具体而言,Th1/Th2 分泌的细胞因子发生失衡是哮喘发病的关键机制,即促进Th1分化的细胞因子IL-12、IFN-γ减少,而抑制Th1分化促进Th2分化的细胞因子IL-4和IL-10的分泌增加[3]。支气管哮喘属中医学“哮证”范畴,近年来认为“瘀血”在哮喘发病中也起着重要作用[4]。近年来的研究证实血液流变性降低、血液凝固性增强、微循环功能障碍等是瘀血致喘的病理基础,故血瘀的存在, 是哮喘缠绵不愈和导致全身疾患如肺心病等的重要病机[5]。三七是临床常用的活血化瘀中药,具有止血、散瘀、消肿、止痛、补虚、抗炎、免疫调节等功效。而哮喘的发病又与气道炎症、免疫失衡和血瘀相关,因此本实验观察了活血化瘀中药三七的主要成分提取物三七总皂苷(PNS)对哮喘小鼠气道炎症及对免疫细胞Th1/Th2平衡的调节作用,旨在从免疫平衡的角度寻找其作用靶点,探讨PNS防治支气管哮喘的可能作用机制。
1 实验资料
1.1实验动物 SPF级BALB/c小鼠,雌性,6~8周龄,体质量18~22 g,由四川省医学实验动物研究所提供,许可证号:SCXK(川)2008-24,合格证号:0012504。根据分组分笼饲养,可以自由进食去卵白蛋白(包括鸡蛋)的饲料,自由饮水,常规饲养于云南中医学院实验动物中心层流架。
1.2实验用药及试剂 三七总皂苷(血塞通软胶囊):100 mg/粒,昆明制药集团有限公司。本实验用剂量以该药品推荐剂量300 mg/d为中剂量。实验的低、中、高剂量比例为1∶2∶4。根据动物体表面积等效剂量计算方法,计算小鼠给药剂量,算出总的用药量。取血塞通软胶囊1粒(100 mg)溶于25 mL生理盐水中,作为高剂量,中、低剂量在高剂量基础上做对倍稀释。所用药品在每次试验前现配现用。卵清白蛋白(Ovalbu-min,OVA,Grade II&V):美国Sigma公司;氢氧化铝凝胶(Al(OH)3):美国Sigma公司;醋酸地塞米松片:0.75 mg/片,重庆青阳药业有限公司;小鼠白细胞介素-4(IL-4)酶联免疫分析试剂盒:美国R&B公司;小鼠干扰素-γ(IFN-γ)酶联免疫分析试剂盒:美国R&B公司;无水乙醇:湖南汇虹试剂有限公司;二甲苯:湖南汇虹试剂有限公司;PBS磷酸盐缓冲液:武汉博士德生物技术有限公司。
1.3主要仪器 医用压缩雾化吸入机:PARI BOYN08,德国百瑞有限公司;雾化箱:规格30 cm×30 cm×20 cm,自制;微量移液器:德国Eppendorf公司;电子天平:AR124CN型,美国奥豪斯;离心机:德国Eppendorf公司;冰箱:美的,广东美的集团;电热恒温水浴箱:HH·W21·420型,天津市泰斯特仪器有限公司;病理切片机:德国LEICA公司;组织烘/摊片机:德国LEICA公司;光学显微镜:日本OLYMPUS;超纯水系统:美国Millipore公司;干燥箱:QIC-3型,上海市实验仪器总厂;SpectraMax 340PC酶标仪:美国分子仪器公司。
1.4实验方法
1.4.1实验分组及哮喘模型的制备 按随机数字表法将50只BALB/c小鼠分为正常对照组、哮喘模型组及PNS低、中、高剂量组,每组10只。哮喘模型组和PNS低、中、高剂量组第1,8,15天各腹腔注射0.2 mL致敏液(含OVA 50 μg)。第22天开始,2%OVA雾化液6 mL雾化激发哮喘,1次/d,45 min/次,雾化7 d。正常对照组以生理盐水代替OVA。实验中观察小鼠反应,出现烦躁不安、呼吸深而快、腹肌抽搐、口唇发绀、头面部瘙痒、前肢抬起挠鼻、大小便失禁、烦躁呛咳及点头运动等症状表明激发成功。结合肺组织病理学切片判断支气管炎症改变情况。
1.4.2药物干预试验 每次激发前30 min对实验小鼠灌胃给药,1次/d,连续7 d:正常对照组和哮喘模型组灌胃生理盐水0.4 mL/只。PNS低、中、高剂量组分别给予19.5 mg/(kg·d)、39 mg/(kg·d)、78 mg/(kg·d)浓度的PNS药液以0.4 mL/只灌胃。
1.4.3标本采集及检测 各实验组于最后1次激发24 h后取材。小鼠摘除眼球采血及分离血清,ELISA法检测血清中细胞因子IL-4、IFN-γ水平。取小鼠右肺组织固定于10%甲醛液中,用于制作石蜡切片和肺组织病理学检查。
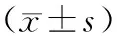
2 结 果
2.1小鼠激发过程中的行为表现 在激发过程中,模型组小鼠激发后精神较差,出现不同程度烦躁不安,呼吸深而快,腹肌抽搐;随着激发时间延长,精神状态渐差,呈弓背呼吸,活动明显减少或俯伏不动,甚至聚集成团,点头运动,呼吸急促深快明显,口唇发绀,头面部瘙痒,前肢抬起挠鼻,毛色暗淡竖起,大小便失禁等。表明哮喘模型制备成功。正常对照组小鼠激发前后活动自如,精神状态可以,毛色光泽度好,几乎没出现以上症状。药物干预组小鼠症状、体征有不同程度减轻。
2.2各组肺组织表现 正常对照组小鼠肺组织气道结构清晰,各级支气管管腔规则,气道内未见黏液分布及黏液栓形成,气道纤毛上皮排列整齐,黏膜皱襞无水肿,无明显的炎症改变,见图1。哮喘模型组小鼠肺内细支气管周围有大量炎性细胞浸润,肺间质及肺泡腔内可见炎性细胞浸润,气道结构紊乱,气道上皮增生、肥大,支气管黏膜皱襞减少,甚至脱落,管腔狭窄,管腔内黏液渗出物明显增多,肺泡腔间隔扩大、增厚,周围组织水肿及炎性细胞浸润。表明小鼠哮喘模型建立成功,见图2。PNS低、中、高剂量组与哮喘模型组相比,肺内细支气管周围炎性细胞有所减少,各级支气管管腔相对规则,气道上皮黏液分泌物减少,气道上皮形态较完整,支气管及血管周围炎症细胞浸润明显减少,见图3~5。
2.3各组小鼠血清中IFN-γ和IL-4浓度比较 PNS低、中剂量组血清IFN-γ浓度均明显高于哮喘模型组(P<0.01和P<0.05),PNS高剂量组与哮喘模型组比较差异无统计学意义(P>0.05)。PNS中剂量组和PNS高剂量组血清IL-4浓度明显低于哮喘模型组(P均<0.01),PNS低剂量组与哮喘模型组比较差异无统计学意义(P>0.05)。见表1。
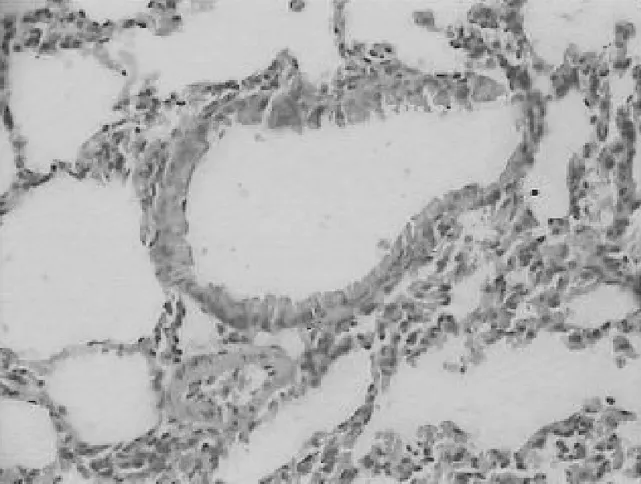
图1 正常对照组肺组织病理表现(HE染色×400)
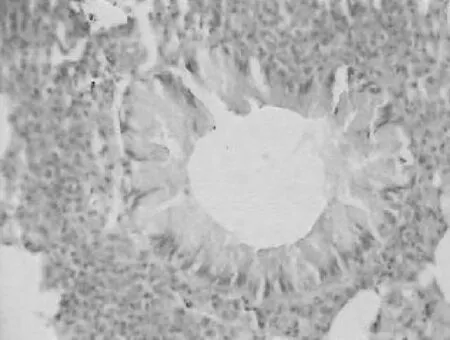
图2 哮喘模型组肺组织病理表现(HE染色×400)

图3 PNS低剂量组肺组织病理表现(HE染色×400)
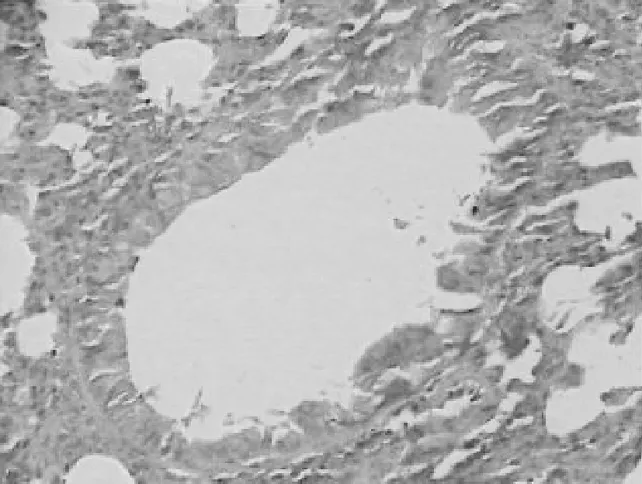
图4 PNS中剂量组肺组织病理表现(HE染色×400)
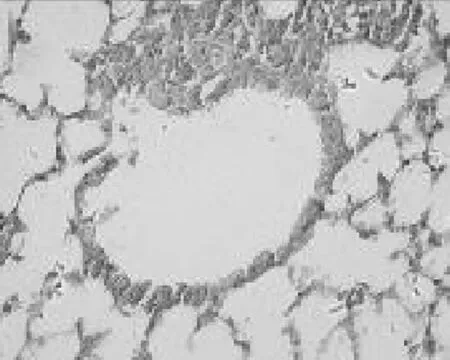
图5 PNS高剂量组肺组织病理表现(HE染色×400)
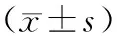
表1 各组小鼠血清中IFN-γ和IL-4的浓度
注:①与哮喘模型组比较,P<0.01;②与哮喘模型组比较,P<0.05;③与正常对照组比较,P<0.01。
3 讨 论
支气管哮喘是一种气道慢性炎症疾病,免疫反应在其发病机制中起重要作用[6]。Th1/Th2失衡与气道炎症过程是支气管哮喘的免疫机制之一,即Th1细胞分化受到抑制,Th1细胞分泌的细胞因子IFN-γ等减少,Th2细胞优势应答在特应性哮喘发病中发挥了重要作用[7]。患者接受变应原后静止Th0细胞活化、增殖,分化为Th2细胞,产生IL-4、IL-5、IL-6、IL-13、TNF-α等细胞因子,促进B细胞增殖,产生IgE,与肥大细胞及嗜酸性粒细胞膜上IgE Fc受体结合使细胞脱颗粒释放组胺、白三烯、前列腺素、血小板活化因子、各种酶类及细胞趋化因子,引起气管收缩,发生速发型哮喘反应[8];同时在白三烯、血小板活化因子、细胞趋化因子作用下使中性粒细胞、嗜酸性粒细胞、单核- 巨噬细胞等炎症细胞向气道壁浸润并被激活,释放出多种炎症递质引起毛细血管渗漏、黏膜水肿、上皮损伤、腺体分泌增加、气管平滑肌收缩,从而维持、扩大哮喘气道炎症反应、气道高反应性、气道损伤[3]。治疗哮喘的药物主要有全身用激素、白三烯调节剂、长效β2受体激动剂、缓释茶碱、色苷酸钠、抗IgE抗体及其他有助于减轻患者症状的药物等,但这些药物都有许多毒副作用。为了寻求更好的治疗方法,人们一直很重视中医对哮喘的防治。
支气管哮喘属中医学“哮证”范畴,唐容川《血证论》中有云:“内存瘀血,气道阻塞,不得升降而喘。”中医认为哮喘的发病过程是由于“宿痰伏肺”遇外感、饮食、情志等诱发,外邪引动伏痰,痰浊壅阻气道,气机阻滞,气滞导致血瘀,瘀血内阻,停于脉络,阻塞气道,使气滞更甚,又加重瘀血,如此反复发作,耗损肺气;肺贯心脉而朝百脉,肺气虚衰,鼓动无力,心脉不畅,瘀血内留,血瘀日久,新血不升,肺失所养,其气更虚,更加重血瘀留滞[4]。现代医学认为哮喘患者长期缺氧,导致微循环障碍,微血管痉挛后肥大细胞缺血、缺氧便分泌组胺,而组胺会引起气管痉挛,进而引发哮喘。现代药理研究表明,活血化瘀药物可通过改善微循环缓解气道瘀血,因此运用中医活血化瘀法治疗哮喘可改善哮喘的症状[9]。
三七是临床常用的活血化瘀中药,主治咯血、衄血、外伤出血及跌打肿痛等。近年对三七的药理作用研究显示三七具有活血化瘀、镇静镇痛、降血脂、抗心律失常、抑制血小板聚集、保护脑缺血损伤、抗炎及免疫调节、抗衰老、提高免疫力等作用[11-14],且其抗炎和免疫调节作用已成为近年的研究热点。
本研究结果表明活血化瘀类中药三七的主要成分PNS对支气管哮喘免疫平衡的恢复及抗气道炎症均有较好作用,可以提高Th1特征性细胞因子IFN-γ的表达,促进Th0向Th1分化;并能降低IL-4的表达,抑制Th0向Th2分化,恢复Th1/Th2平衡状态,从而减轻气道炎症,起到防治哮喘作用。
[1] 中华医学会呼吸病学分会哮喘学组. 支气管哮喘防治指南(支气管哮喘的定义、诊断、治疗和管理方案)[J/CD]. 中华哮喘杂志:电子版, 2008,2(1):3-13
[2] 安霞,龚颖,叶伶,等. 细胞及其相关细胞因子与支气管哮喘[J/CD]. 中华哮喘杂志:电子版,2012,6(1):26-29
[3] 阮氏容,李超乾. Th1/ Th2迁移与支气管哮喘研究进展[J]. 蛇志,2009,21(4):297-298
[4] 张惠勇,段晨霞. 活血化瘀法治疗支气管哮喘[J]. 江西中药,2008,8(39):5-8
[5] 王志英,李向荣. 活血化瘀法治疗哮喘的研究概况[J]. 南京中医学院学报1999,11(1):59
[6] Patrick GH. Key factors in the development of asthma atopy[J]. Am J Respir Crit Care Med,2000,161(3):172-175
[7] Robinson DS,Hamid Q,Ying S,et al. Predominant TH2-like bronchoalveolar T-lymphocytepopulation in atopicasthma[J]. N Engl J Med,1992,326:298-300
[8] Secor ER,Carson WF,Sing A,et al. Oral bromelain attenuates inflammation in an ovalbumin-induced murine model of asthma[J]. Evid Based Complement Alternat Med,2008,5:61-69
[9] 刘其军,牟德英. 活血化瘀法治疗支气管哮喘作用机制的研究概况[J]. 中药与临床,2010,1(2):58-59
[10] 许德金,王琦,许爱兰. 丹参防治支气管哮喘的临床实验研究[J]. 江苏中医,2009,13(9):40-42.
[11] 陈健文,谭敏谊,向秋玲. 三七中人参三醇皂苷活血化瘀作用研究响[J]. 中药药理与临床,2008,24(3):38-41
[12] 宋勇,张琪娟,肖晓秋,等. 三七总皂苷对棕榈酸诱导的HepG2细胞炎症反应的保护作用[J]. 重庆医科大学学报,2012,37(6):535-538
[13] 张捍. 糖皮质激素及三七总皂苷治疗急性重症胰腺炎的临床意义[J]. 中国老年保健医学杂志,2012,10(2):27-29
[14] 姚茹冰,高佩芳,赵智明,等. 三七总皂甘对类风湿关节炎环瓜氨酸肽抗原特异性T细胞分泌干扰素-γ及白细胞介素-4的影响[J]. 医学研究生报,2010,23(11):1148-1150
Research of molecular immune mechanism of PNS in alleviating asthmatic mouse airway inflammation lesions
ZHAO Wenjuan, CHEN Jing, XING Haijing,YUAN Jiali, HAN Niping
(Yunnan University of Traditional Chinese Medicine, Kunming 650500, Yunnan, China)
Objective It is to observe the effects of Panax notoginseng saponin (PNS) on the airway inflammation in asthmatic mice and Th1/Th2 related cytokines, and to fine the target from the point of immunologic balance, thus to explore the possible mechanism of PNS in preventing asthma. Methods 50 SPF level BALB/c female mice were divided into normal control group, asthma model group, PNS low, medium and high dose groups. The asthma models were established by OVA intraperitoneal injection and atomization inspired method. The pathological changes in the lung tissue of mice were observed, and the changes of serum IL-4 and IFN-γ were detected by enzyme-linked immunosorbent assay (ELISA). Results Asthma symptoms and inflammatory cell infiltration were relieved in PNS low, medium and high dose groups, furthermore the expression of IFN-γ in serum of the mice had a increase trend, especially in low and medium dose groups (P<0.05 orP<0.01). The serum concentration of IL-4 decreased significantly in PNS medium and high dose groups (P<0.01). Conclusion PNS can relieve infiltration of inflammatory cells in lung tissue in the mice with asthma, reduce airway epithelial mucus secretion, improve airway inflammation. One of the mechanisms for PNS prevention of asthma in asthmatic mice may be by up-regulating secretion of IFN-γ, inhibiting the secretion of IL-4, thus contributing to Th0 to Th1 differentiation, inhibit Th0 to Th2, restore Th1/Th2 balance.
Panax notoginseng saponin; asthmatic mice; IL-4; IFN-γ
赵文娟,女,硕士,实验师,主要研究方向为中西医结合基础免疫学。
韩妮萍,E-mail: nini577 @126.com
云南省应用基础研究面上项目(2011FZ156);2013年云南省基础研究重点项目(2013FA041)
10.3969/j.issn.1008-8849.2015.04.002
R-332
A
1008-8849(2015)04-0347-04
2014-08-08
